Шендрик А.Н. Химия белка. Структура, свойства, методы исследования
Подождите немного. Документ загружается.

122
ка в 16-членном цикле). Если расположить α-спираль N-концом вверх, то все
С=О группы будут направлены вниз, а NH - вверх.
Другая характерная особенность α-спирали следует непосредственно из
комбинации значений углов ϕ и ψ: шаг спирали (один полный виток) 5.4Å со-
ставляют 3.6 аминокислотных остатка на виток. Угол поворота цепи на один
аминокислотный остаток составляет: 360
о
/3.6 = 100
о
. Диаметр спирали (без уче-
та боковых групп) равен 6Å. Для L-aминокислот правовращающая спираль вы-
годно отличается от левовращающей, тем что R-группы аминокислот направ-
лены наружу от центральной оси, что резко уменьшает стерические напряже-
ния. Кроме того, за счет повернутых вовне R-остатков обеспечивается гидро-
вильность или гидрофобность пептидной -цепи.
Содержание α-спиралей в глобулярных белках сильно варьирует: от пол-
ного отсутствия (нейротоксин змей, например) до 80-90%. Миоглобин и гемо-
глобин содержат 75% спиралевидных участков, альбумин сыворотки - 50%, ри-
бонуклеаза - 17%, химотрипсин - 8%.
Белок не может иметь в цепи 100% α-спиралей и сохранять глобуляр-
ность. Он в этом случае будет фибриллярным. Более того, если имеется α-
спираль, она находится, как правило, в одном, двух или нескольких отдельных
участках цепи. Спиральная структура нарушается многими факторами. Напри-
мер, наличием остатка пролина, циклическая структура которого вносит излом
в пептидную цепь; наличием локального электростатического отталкивания,
обусловленного кластером положительно заряженных R-групп лизина и арги-
нина, либо кластером отрицательно заряженных R-групп глутаминовой и аспа-
рагиновой кислот и др. причинами. Неспиральная часть пептидной цепи может
иметь структуру складчатого листа либо статистического клубка.
Помимо α-спирали, известны и другие виды спиралей. Они различаются
между собой числом аминокислотных остатков на виток. Например, 3
10
-
спираль содержит три остатка в 10-членном цикле, 4.3
16
- или π-спираль (4.3
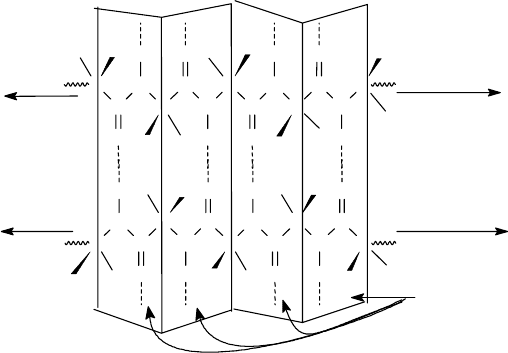
123
аминокислотных остатка в 16-членном цикле. 3
10
- Спираль и π-спираль в ре-
альных белках встречаются крайне редко и только в очень коротких участках
пептидной цепи (например, в миоглобине и лизоциме). Левые 3
10
- и π-спирали в
природных белках пока не обнаружены.
2.2.2.2 Структура складчатого листа
Структура типа складчатого листа также стабилизирована кооператив-
ными водородными связями между теми же диполями. Совершенно новая
структура образуется в этом случае за счет межмолекулярных водородных свя-
зей между двумя или большим числом цепей (в фибриллярных белках) или
внутримолекулярных водородных связей между различными участками одной
цепи (в глобулярных белках). Полинг и Кори постулировали «плоские» парал-
лельный и антипараллельный β-складчатые листы.
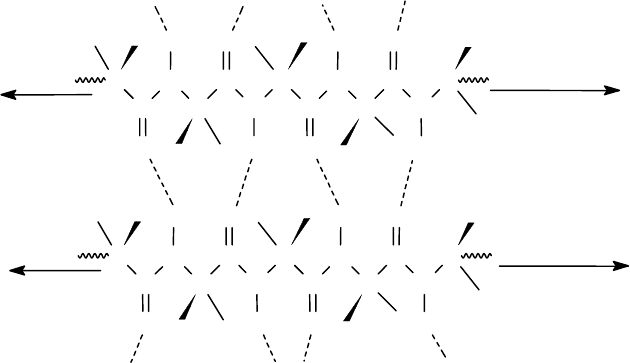
В параллельном складчатом листе обе пептидные цепи или два разных участка
одной и той же пептидной цепи имеют в пространстве одно направление, т.е.
параллельны. В антипараллельном складчатом листе цепи направлены в про-
тивоположные стороны, т.е антипараллельны. В природных белках и пептидах
встречаются обе структуру, но антипараллельная является более стабильной,
поэтому и более распространенной. В ней диполи С=О и N-Н расположены па-
раллельно или соосно.
C
C
N
C
C
N
C
C
N
C
C
N
C
H
H
O
O
O
O
H
H
R
H
R
H
R
C
C
N
C
C
N
C
C
N
C
C
N
C
H
H
O
O
O
O
H
H
R
H
R
H
R
к N-концу
к С-концу
к С-концу
к N-концу
Антипараллельный складчатый лист
Все атомы на
одной стороне
листа копланарны
124
Фрагменты параллельной и антипараллельной структур типа складчатого
листа приведены на рисунках.
к С-концу
к N-концу
C
C
N
C
C
N
C
C
N
C
C
N
C
H
H
O
O
O
O
H
H
R
H
R
H
R
к С-концу
к N-концу
C
C
N
C
C
N
C
C
N
C
C
N
C
H
H
O
O
O
O
H
H
R
H
R
H
R
Па
р
аллельный складчатый лист
Расположение R-групп в складчатых листах следующее. Если смотреть
вдоль полипептидного остова, то R-группы находятся то над плоскостью, то за
плоскостью листа. Складчатые структуры встречаются довольно часто. Наибо-
лее характерный пример - β-фиброин шелка, который имеет структуру антипа-
раллельного складчатого листа. Участки молекулы фиброина имеют повто-
ряющийся структурный фрагмент: Гли-Ала-Гли-Сер-Гли-Ала. При образовании
β-антипараллельной структуры R-группы Ала и Сер располагаются по одну
сторону, а Гли - по другую (получается как бы ворс с одной стороны). Посколь-
ку слои связаны между собой только невалентными взаимодействиями, шелк
очень эластичен.
Большинство складчатых листов не являются плоскими. Они характери-
зуются левой закруткой, если смотреть вдоль плоскости листа перпендикуляр-
но его вытянутым цепям. Фактически можно сказать, что лист - это очень рас-
тянутая левая спираль.

125
Длинна скрученного листа неограниченна. β-Фиброин шелка содержит
очень длинные скрученные ленты складчатого листа.
α-Спираль и β-структура представлены в белках отдельными иногда дос-
таточно короткими отрезками. Значительную часть пептидной цепи составляет
различного рода петли, которые позволяют изменить направление цепи. Наи-
более экономный структурный элемент, позволяющий повернуть пептидную
цепь на 180
0
, назван β-изгибом. β-Изгибы образуются четырьмя последователь-
но расположенными аминокислотными остатками с водородной связью 4→1
(цикл из 10 атомов). Две возможные структуры β-изгибов приведены ниже:
C
C
N
C
H
O
R
R
H
C
C
N
C
H
O
H
C
N
O
H
C
C
N
C
H
O
H
C
N
O
H
C
C
N
C
H
O
R
R
H
Анализ поворотов цепей в глобулярных белках показал, что 65% из них явля-
ются β-изгибами (их называют еще β-шпильками). Третья аминокислота в β-
шпильках - глицин. Другие виды поворотов, как правило, не содержат водород-
ных связей. Иногда такие нестандартные изгибы содержат фрагмент Цис-Про.
Большинство реверсивных поворотов находится на поверхности белка. Они со-
держат в основном гидрофильные остатки.
2.2.3 Третичная структура белков
Пептидная цепь, содержащая участки с определенной вторичной струк-
турой, располагается в пространстве обычно так, чтобы элементы вторичной
структуры, взаимодействуя между собой и с участками с неупорядоченной
126
структурой, образовывали глобулы (глобулярные белки) или вытянутое волок-
но (фибриллярные белки). В этих случаях говорят об образовании третичной
структуры белковой молекулы. Каждый белок обладает своей уникальной про-
странственной структурой.
Фибриллярные белки. В фибриллярных белках пептидные цепи имеют
преимущественно спиральную структуру или структуру складчатого листа. Ин-
тактный белок состоит не из одиночных пептидных цепей, а из их агрегатов.
Фиброин шелка, например, состоит из нескольких цепей со структурой склад-
чатого листа, уложенных стопкой так, что каждая цепь со всех четырех сторон
окружена цепями в антипараллельной ориентации. В то же время, такой белок
как α-кератин (шерсть, волосы, перья, рога, ногти) построен из больших мно-
гоцепочечных структур из скрученных спиральных цепей. Эти цепи связаны в
пучки или взаимоперекручены так, что образуются надструктуры.
Из фибриллярных белков наиболее изучен коллаген. Это основной ком-
понент соединительной ткани и является главным структурным белком всех
живых клеток. Около 30% от массы содержащегося в теле белка приходится на
коллаген. В целом, его содержание в биосфере оценивается в 1млрд.т.
Кон
ф
о
р
мация
левозакрученной
спирали отдельной
цепи
гли
Х
гип
гли
9A
Трехспиральная нить
коллагена, называемая
т
р
опоколлагеном
15A
Каждое макроволокно коллагена соединительной ткани представляет собой аг-
регат молекул коллагена. Длина молекулы коллагена около 3000Å, молекуляр-
ная масса ≅ 300 000. Структура молекулы коллагена - специфичная спираль

127
(иногда ее называют тропоколлаген): три одинаковые левозакрученные цепи
сплетены в одну и образуют вместе правозакрученную тройную спираль. Каж-
дая тройная цепь имеет гораздо более вытянутую форму, чем исходная молеку-
лярная α-спираль.
Почти треть аминокислотных остатков в ней приходится на глицин, чет-
верть составляют пролин и гидроксипролин, остальное - небольшие количества
других аминокислот, включая гидрокислезин. Аминокислотная последователь-
ность довольно регулярно чередуется, причем глицин находится почти в каж-
дом третьем положении. Очень часто встречаются трипептидные фрагменты:
Гли-Х-Про; Гли-Х-Гип (гидроксипролин); Гли-Про-Гип. Считается, что после-
довательность:
- - Гли - - Гли - - Гли - - Гли
1 2 3 1 2 3 1 2 3 1 2 3
совершенно необходима для образования третичной структуры коллагена.
Тройная спираль коллагена стабилизирована невалентными взаимодейст-
виями (водородными связями) и валентными связями между лизином и гидро-
ксилезином. В результате, третичная структура обладает жесткостью и прочно-
стью. Нить коллагена толщиной в 1 мм. способна выдерживать нагрузки до 100
Н (около 10 Кг силы).
Биосинтез коллагена идет в такой последовательности. Вначале форми-
руются две различные пептидные цепи (α1- и α2-цепи) из аминокислот, в т.ч.
пролина и лизина. Далее они агрегируются в спираль состава (α1)
2
(α2). При
образовании тройной спирали некоторые остаткии пролина и лизина в каждой
из цепей гидроксилируются. Гидроксилирование осуществляется разными
ферментами по пролину и по лизину. Оба фермента используют О
2
как источ-
ник -ОН группы. Есть свидетельства, что для максимальной эффективности
ферментов необходима аскорбиновая кислота. Предполагается, что гидрокси-
пролин стабилизирует цепь за счет водородной связи. Некоторые -ОН группы
используются для присоединения углеводов к коллагену. Наследственные на
128
рушения процессов гидроксилирования приводят к серьезным дефектам.
Ухудшаются механические свойства тканей (например кожи или связок).
Глобулярные белки. В 1960 г. Кендрю и Перутц с сотрудниками методом
рентгеноструктурного анализа впервые исследовали полную трехмерную
структуру белковой молекулы. К настоящему времени такие работы выполнены
на достаточно большом числе белков. В результате было установлено, что в от-
личие от фибриллярных белков глобулярные представляют собой плотно упа-
кованные свернутые участки пептидной цепи. Однако нет одной единой формы
для всех глобулярных белков. Некоторые среди них - почти правильные сферы,
другие - вытянутые элипсоиды, большинство же имеет промежуточную и не
всегда правильную форму. В целом же результатом этих исследований явились
следующие обобщения.
1.
Нативная конформация белка - индивидуальное структурное свойство
данного белка, которое определяет и его функциональную индивидуальность,
т.е. пространственная структура белка характеристична.
2.
Нативная структура белка определяется не до конца ясными «инструк-
циями» заложенными в его аминокислотной последовательности, т.е. уже в
первичной структуре.
3.
Всем нативным структурам белков присуще одно общее свойство - это
коформация с минимальной энергией, т.е. максимально стабильная.
Существование большого количества складок, поворотов и изгибов в
пептидных цепях белков поддерживается различными стабилизирующими си-
лами. Наиболее мощные из них - ковалентные связи, примерами которых могут
служить дисульфидные мостики. В некоторых белках они, однако, не обнару-
жены. Принято, поэтому считать, что стабилизация в целом осуществляется не-
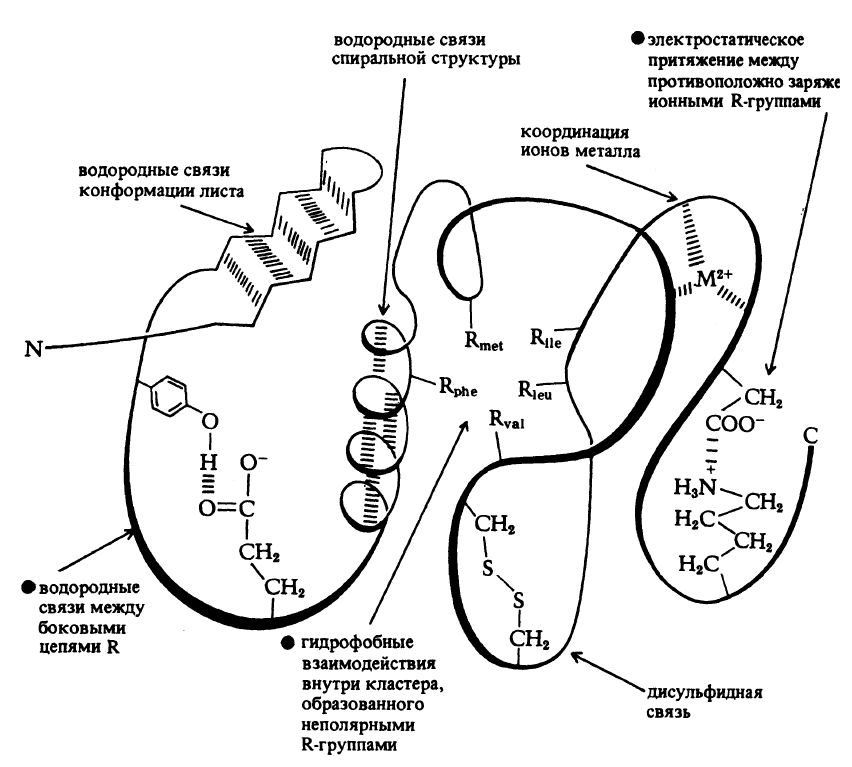
ковалентными взаимодействиями следующих типов:
¾ электростатические силы притяжения между боковыми цепями с проти-
воположно заряженными ионными группами (ион-ионные взаимодействия), ес
129
ли в состав ПП-цепи входят аминокислоты с полярными R-остатками (лизин,
аргинин, аргинин, глутаминовая и аспарагиновая кислоты);
¾ водородные связи между группами, не участвующими в образовании пеп-
тидной связи, например между остатками тирозина и глутаминовой кислоты;
¾ водородные связи пептидных группировок, которые образуются в спи-
ральных структурах и структурах типа складчатого листа;
¾ гидрофобные взаимодействия между неполярными боковыми цепями
лейцина, валина, изолейцина, аланина, фенилаланина и др. неполярных амино-
кислот;
¾ взаимодействия в простетической группе, например между ионом металла
и R-группами.
Схематически, все перечисленные виды невалентных межмолекулярных
взаимодействий, стабилизирующих пространственную структуру белков пред-
ставлены на рис. 2.3.
Условно принято, что при расстояниях между взаимодействующими
группами в 2-3.1Å они участвуют в полярных взаимодействиях, а при расстоя-
ниях 3.1-4.1Å - в неполярных. Неполярные взаимодействия имеют достаточно
сложный механизм и реализуются в основном за счет энтропийного вклада в
свободную энергетию процесса структурирования белка взаимодействий с уча-
стием молекул воды.
Нативная конформация глобулярного белка очень чувствительна к внеш-
ним воздействиям и гораздо менее устойчива, чем у фибриллярного белка.
Для третичной структуры белков выполняются следующие правила.
¾ Пептидные цепи находятся в наиболее устойчивом состоянии (с наимень-
шей энергией).
¾ Все донорные и акцепторные группы, склонные к образованию водород-
ных связей (или любых других донорно-акцепторных комплексов) расположе-
ны в благоприятных для образования таких связей местах и, как правило, на
поверхности.
130
¾ Заряженные остатки располагаются, как правило, на поверхности белка;
погружение зарядов внутрь белковой молекулы невыгодно (повышает энер-
гию). Иногда наличие зарядов обнаруживается и внутри молекулы, но они на-
ходятся в большинстве случаев на остатках непосредственно участвующих в
актах катализа, или выполняющих другие специфические функции.
¾ Гидрофобные неполярные остатки в глобулярных белках располагаются,
как правило, внутри клубка;
Рис. 2.3
Схема межмолекулярных взаимодействий в молекулах белков, стабилизирую-
щих их пространственную (третичную) структуру
(Рисунок позаимствован из книги: Бохински Р. Современные воззрения в биохимии. 1987.-
М.: Мир.- 544 с.)
131
2.2.4 Четвертичная структура белков
Четвертичная структура присуща только белкам, которые существуют в
виде агрегатов из двух и более пептидных цепей, связанных между собой нева-
лентными взаимодействиями. Ковалентные связи, в том числе и дисульфидные
мостики, отсутствуют. Белки такого типа называют олигомерами. Это могут
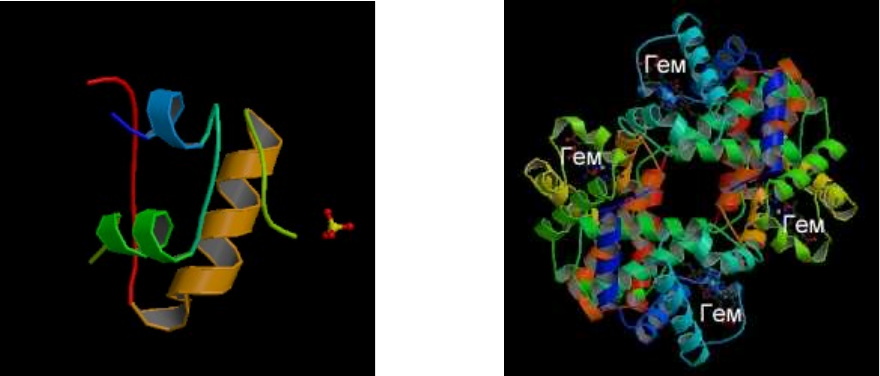
быть ди-, три- и т.д. - меры. Ниже, для примера, на рисунке приведены модели
установленных методом РСА структур инсулина и гемоглобина (рисунки взяты
из банка данных белков по сети "Internet").
Известны олигомерные белки и с большим числом пептидных цепей.
Если входящие в олигомер пептидные цепи идентичны, то он называется
гомогенным. Если цепи не идентичны - гетерогенным. Стабилизация агрегатов
осуществляется в основном за счет электростатических и водородных связей
между боковыми цепями, расположенными на поверхности отдельных пептид-
ных цепей. Гидрофобные взаимодействия могут быть, но их значение невелико,
поскольку большинство неполярных остатков находится внутри каждой глобу-
лярной субъединицы.
Из олигомерных белков наиболее изучен гемоглобин - гетерогенный тет-
рамер. Для него методом РСА установлены третичная и четвертичная структу
