Шендрик А.Н. Химия белка. Структура, свойства, методы исследования
Подождите немного. Документ загружается.

151
¾ Ряд белков плазмы, в том числе фибриноген, основные компоненты сис-
темы свертывания крови.
¾ Белки плазмы определяют вязкость крови. Она, как отмечено выше, в 4-5
раз больше вязкости воды.
¾ Белки плазмы участвуют в поддержании рН крови, (буферная функция).
¾ Транспортная функция.
¾ Поддержание электролитного состава крови. Например, до 50% кальция в
сыворотке крови связано с белками. Большая часть железа, магния меди и др.
элементов также связана с белками плазмы.
¾ Белки плазмы являются резервом аминокислот.
На данный момент исследованы и описаны около 100 различных белко-
вых компонентов плазмы крови.
В сыворотке человека электрофорезом на бумаге отчетливо обнаружива-
ется пять фракций белков: альбумины, α
1
-, α
2
-, β-, и γ-глобулины. Электрофо-
резом в агаровом геле белки сыворотки разделяются на 7-8 фракций, а при
электрофорезе в крахмальном или полиакриламидном геле - на 16-17 фракций.
Еще большее число белковых фракций (свыше 30) получают методом иммуно-
электрофореза.
3.1.2 Характеристика основных белковых фракций плазмы
Альбумины. Альбумины состоят из одной пептидной цепи (≅580 амино-
кислотных остатков, молекулярная масса около 70000 Да). В цепи содержится
17 дисульфидных связей. Из распределения дисульфидных связей и локализа-
ции специфических остатков в пептидной цепи можно предположить, что мо-
лекула альбумина образует три сходных домена.
Пептидная цепь альбуминов свернута в глобулу (элипсоид 30 х 150 Å).
Обладая высокой гидрофильностью, альбумины играют важную роль в под-
держании осмотического давления крови. Транспортируют многие биологиче-
ски активные вещества, в частности, гормоны, свободные жирные кислоты.
152
Связываются с холестерином, желчными пигментами. Значительная часть
кальция в сыворотке также связана с альбуминами. Альбумины сравнительно
быстро обновляются. Период полураспада составляет около 7 суток.
При электрофорезе в крахмальном геле в некоторых случаях наблюдается
разделение альбуминов на две фракции (альбумин "А" и альбумин "В"). Пред-
полагается, что у доноров двойников альбуминов имеется два независимых ге-
нетических локуса, которые контролируют их синтез. Фракция "В" отличается
от обычной "А" наличием в молекуле двух или более остатков дикарбоновых
аминокислот, которыми замещены в альбумине "А" остатки тирозина или цис-
теина. Известны и некоторые другие редкие варианты альбуминов (альбумин
Ридинг, альбумин Джент, альбумин Маки). Наследование полиморфизма аль-
буминов наблюдается, как правило, в нескольких поколениях.
Глобулины. При высаливании нейтральными солями глобулины можно
разделить на две фракции: эуглобулины и псевдоглобулины. Эуглобулины - это,
в основном, γ-глобулины, а фракция псевдоглобулинов включает α-, β-, и час-
тично γ-глобулины.
Фракции α- и β-глобулинов содержат липопротеины и связанные с ме-
таллами белки. В состав γ-глобулинов входит большая часть находящихся в сы-
воротке антител.
Некоторые α-глобулины являются ингибиторами протеиназ. К ним отно-
сятся: антитрипсин, макроглобулин и интер-α
1
-трипсиновый ингибитор. Рети-
нолсвязывающий белок (ММ=21000) переносит ретинол.
Фракция γ-глобулинов содержит 5 основных классов иммуноглобулинов:
A, D, E, G, M. Все иммуноглобулины являются олигомерными белками, для ко-
торых характерно следующее строение: две тяжелые цепи - Н (ММ = 50000-
75000) и две легкие - L (ММ ≅ 23000) соединены между собой тремя дисуль-
фидными мостиками. Известно два типа легких и пять типов тяжелых цепей,
153
которые различаются по своему аминокислотному составу. Каждый тип имму-
ноглобулинов специфичен к своему антигену.
3.1.2.1 Отдельные белки плазмы
Гаптоглобин входит в состав α
2
-глобулиновой фракции. Этот белок спо-
собен соединяться с гемоглобином, образуя комплексы состава 1:1. Образовав-
шийся комплекс может поглощаться системой макрофагов. Это позволяет
уменьшить потери железа при освобождении гемоглобина из эритроцитов.
Электрофорезом выявлены три группы гаптоглобинов, которые обозна-
чают как: Нр 1-1; Нр 2-1 и Нр 2-2. Установлено наличие связи между наследо-
ванием типов гаптоглобина и резус антителами.
Ингибиторы трипсина - обнаруживаются при электрофорезе в составе
α
1
и α
2
-глобулинов. Являются ингибиторами трипсина и других протеаз.
Трансферрин относится к β-глобулинам. ММ≅76000. Способен образо-
вывать окрашенный в оранжевый цвет комплекс с железом. Железо в этом (же-
лезотрансферриновом) комплексе находится в трехвалентном состоянии. В
норме только треть трансферрина насыщена железом. Выявлено 19 типов
трансферрина, которые различаются по величине заряда молекулы, аминокис-
лотному составу и количеству молекул сиаловых кислот, связанных с белком.
Предполагают, что наблюдаемые различия обусловлены наследственным фак-
тором.
Церулоплазмин - медьсодержащий (0.34% меди) белок небесно-голубого
цвета с ММ=150000. Окисляет аскорбиновую кислоту, адреналин, диоксифени-
лаланин и некоторые другие вещества. Обладает слабой каталитической актив-
ностью. Выявлены 4-е изофермента церулоплазмина, два из которых обнару-
живаются в норме.
С-Реактивный белок - назван так из-за способности вступать в реакцию
преципитации с С-полисахаридами пневмококков. В норме отсутствует и обна
154
руживается при наличии в организме воспалительных процессов или некроза
тканей. При электрофорезе этот белок перемещается вместе с α
2
-глобулинами.
Криоглобулин. В норме отсутствует. Появляется при различных патоло-
гиях. Отличительное свойство - выпадает в осадок или желатинизируется при
Т<37
0
С. При электрофорезе чаще всего перемещается вместе с γ-глобулинами.
Обнаруживается при миеломе, нефрозе, циррозе печени, ревматизме, лимфо-
саркоме, лейкозах и некоторых других заболеваний.
Интерферон - специфичный белок. Синтезируется при воздействии на
клетки вирусов. Обладает способностью угнетать размножение вирусов, но не
разрушает уже имеющиеся вирусы. Образовавшись в клетках, интерферон лег-
ко выходит в кровяное русло и разносится по организму. Специфичность ин-
терферона не абсолютна. Интерферон обезьян, например, активен и в клетках
человека.
3.1.3 Транспорт кислорода кровью
В покое ткани человека потребляют около 200 мл. кислорода в минуту.
При физических и умственных нагрузках потребление О
2
увеличивается в 10 и
более раз (2-3 л/мин.). Доставить такое количество кислорода к тканям просто
за счет физического растворения в плазме, невозможно. Растворимость О
2
в
плазме крайне мала (0.023 мл/мл при 40
0
С, Р
О2
= 1 атм.), и позволяет обеспе-
чить только 0.3% от потребности организма в кислороде. Поэтому, практически
весь кислород доставляется к тканям в связанном с гемоглобином виде.
Гемоглобин (Hb) - олигомерный белок. Состоит из 4-х пептидных цепей,
каждая из которых содержит одну гемгруппу. Процентное содержание железа в
гемоглобине составляет 0.335%. Один грамм-атом Fe (55.84г) в Hb связывает 1
моль О
2
(22,4 л). Следовательно, 100г гемоглобина способны связать:
(0.335•22400мл)/55.84 = 134 мл. О
2.

155
Содержание гемоглобина в крови составляет (13-16г)/100мл крови. С уче-
том скорости оборота гемоглобина в кровяном русле его количества вполне
достаточно для полного обеспечения тканей кислородом.
Помимо транспорта кислорода к клеткам, гемоглобин выполняет еще од-
ну весьма важную функцию - переносит углекислый газ в легкие. Механизм
этого переноса следующий. Восстановленная форма гемоглобина (HHb) при-
соединяет СО
2
в форме угольной кислоты с образованием карбгемоглобина:
RNH
2
CO
2
R
NHCOO
-
H
+
Г
е
м
о
гл
об
ин
Ка
р
бгемоглобин
++
Карбгемоглобин - нестойкое соединение и диссоциирует в легочных ка-
пиллярах с выделением СО
2
. В виде карбгемоглобина из тканей к легким пере-
носится от 3 до 10% СО
2
.
3.1.4 Синтез белков плазмы
Альбумин, фибриноген и около 80% всех глобулинов, включая липопро-
теины, синтезируются в печени. Другие основные белки, в том числе и белки
фракции γ-глобулинов синтезируются, в основном, лимфоидальной тканью и
селезенкой.
Скорость синтеза альбумина изолированной печенью крысы составляет
10-20 мг/час. Такая скорость позволяет обновлять в течении суток до 25% на-
ходящихся в плазме белков. У человека альбумины синтезируются с несколько
меньшей скоростью.
3.1.5 Система свертывания крови
Способность крови свертываться с образованием сгустка - один из при-
меров высочайшего уровня биохимической саморегуляции. Впервые теорию
свертывания крови предложил в 1872 г. А. Шмидт - профессор Юрьевского
(ныне Тарту) университета. Суть ее в следующем.
156
Свертывание крови - есть ферментативный процесс. Для его протекания
необходимы три компонента: фибриноген, фибринопластическое вещество и
тромбин. Процесс свертывания крови - реакция образования фибрина из фиб-
риногена и фибринопластического вещества, которую катализирует тромбин.
Дальнейшими исследованиями школы Шмидта, а также Моравица, Гаммар-
стена, Спиро и др. было установлено, что фибрин образуется из одного пред-
шественника - фибриногена. Проферментом тромбина является протромбин, а
для свертывания крови необходимы тромбокиназа тромбоцитов и ионы каль-
ция. Эта теория свертывания крови известна как теория Шмидта-Моравица.
На данный момент установлено, что процесс свертывания крови много
сложнее и в нем участвуют значительно большее число компонентов плазмы и
тромбоцитов, так называемые факторы свертывания крови. Факторы свертыва-
ния, связанные с тромбоцитами, обозначают арабскими цифрами, а факторы
плазмы - римскими.
3.1.5.1 Факторы плазмы
Фактор I - фибриноген. Важнейший компонент системы свертывания.
Фибриноген состоит из трех пар неидентичных пептидных цепей, связанных
дисульфидными мостиками. Каждая цепь имеет олигосахаридную группу. Бел-
ковая и углеводная компоненты соединены через мостик аспарагин-N-
ацетилглюкозамин. Длина молекулы фибриногена 450Å, ММ=330000-340000
Да. При электрофорезе на бумаге фибриноген движется между β- и γ-
глобулинами. Синтезируется в печени.
Фактор II - протромбин. Один из основных белков плазмы, определяю-
щих свертывание крови. При протеолизе протромбина образуется активный
фермент свертывания - тромбин. Содержание протромбина в плазме составляет
1.4-2.1 мкмоль/л. Он является гликопротеидом, содержащим 11-14% углеводов,
включая гексозы, гексозамины и нейраминовую кислоту. По электрофоретиче-
ской подвижности относится к α-глобулинам, иммеет ММ = 68000-70000 Да.
157
Молекула имеет форму элипсоида (119 и 34 Å). Изоэлектрическая точка очи-
щенного протромбина расположена в области рН = 4.2-4.4. Синтезируется в пе-
чени при участии витамина К. Специфическая особенность - одна молекула
протромбина связывает 10-12 ионов кальция, изменяя свою конформацию.
Превращение протромбина в тромбин сопровождается резким уменьшением
ММ с 70000 до ≅35000Да. предполагают, что тромбин - это большой фрагмент
молекулы протромбина.
Фактор III - тканевый фактор или тканевый тромбопластин. Образуется
при повреждении тканей. Является комплексным соединением липопротеино-
вой природы. Имеет очень большую ММ = 167 000 000 Да.
Фактор IV - ионы кальция. Удаление ионов кальция (осаждение оксала-
том или фторидом натрия) останавливает процесс свертывания крови. Опти-
мальная для протекания процесса свертывания концентрация ионов кальция со-
ставляет 1.0-1.2 ммоль/л. Отклонения в большую или меньшую стороны замед-
ляют процесс свертывания. Ионы кальция необходимы почти на всех стадиях
свертывания крови.
Фактор V - проакцелерин. Белок глобулиновой фракции плазмы. Пред-
шественник активного фактора - акцелерина. Синтезируется в печени.
Фактор VII - антифибринолизин или проконвертин. Предшественник
конвертина. Механизм превращения проконвертина в конвертин малоизучен.
Синтезируется проконвертин в печени при участии витамина К.
Фактор VIII - антигемофильный глобулин А. Необходимый компонент
крови для образования фактора X. Очень лабилен. При хранении стабилизиро-
ванной цитратом плазмы активность фактора VIII снижается на 50% за 12 ча-
сов. Врожденный недостаток фактора VIII - причина гемофилии А.
Фактор IX - антигемофильный глобулин В или кристмасфактор. Участ-
вует в образовании активного фактора Х.
Фактор Х - фактор Прауэра-Стюарта. Назван по фамилиям больных, у
которых впервые был обнаружен его недостаток. Относится к α-глобулинам.
158
ММ=87000Да. Участвует в образовании тромбина из протромбина. При недос-
таточности фактора Х увеличивается время свертывания крови. Синтезируется
в печени. Процесс синтеза чувствителен к содержанию витамина К в организ-
ме.
Фактор XI - фактор Розенталя. Антигемофильный фактор белковой при-
роды. Недостаточность этого фактора при гемофилии С впервые открыл Розен-
таль в 1953г. Является плазменным предшественником тромбопластина.
Фактор XII - Фактор Хагемана. Участник пускового механизма сверты-
вания крови. Стимулирует фибринолитическую активность. Активируется фак-
тор XII при контакте с чужеродными внутренней среде организма поверхно-
стями: кожей, стеклом, металлом и т.д. Назван по фамилии больного, у которо-
го впервые были выявлены нарушения свертывания крови, связанные с недос-
татком фактора XII.
Фактор XIII - фибринстабилизирующий фактор. Является белком плаз-
мы, который стабилизирует фибрин, участвуя в образовании прочных межмо-
лекулярных связей в фибрине-полимере. ММ=330000-350000Да. Состоит из
трех пептидных цепей.
3.1.5.2 Факторы тромбоцитов
Наряду с факторами плазмы в свертывании крови участвуют факторы,
связанные с тромбоцитами. Известно около 10 таких факторов. Роль всех их до
конца не ясна. Наиболее важные из них.
Фактор 1 - адсорбированный на поверхности тромбоцитов проакцеле-
рин. С тромбоцитами связано около 5% всего проакцелерина крови.
Фактор 3 - один из важнейших компонентов системы свертывания кро-
ви. Необходим для образования тромбина из протромбина.
Фактор 4 - антигепариновый фактор. Тормозит антитромбопластиновое
и антитромбиновое действие гепарина. Активно участвует в агрегации тромбо-
цитов.
159
Фактор 8 - тромбостенин. Участвует в процессе ретракции тромбина.
Очень лабилен. Обладает АТФ-азной активностью.
3.1.5.3 Схема процесса свертывания крови
Полной, окончательной и общепринятой теории процесса свертывания
крови пока нет, но многие его стадии неплохо изучены.
В самых общих чертах процесс свертывания крови аналогичен цепной ре-
акции, которая завершается образованием сгустка или тромба. Последний явля-
ется основным биохимическим средством предупреждения потери крови орга-
низмом при нарушении целостности кровеносной системы.
В образовании тромба участвует большое число белков, а завершающая
стадия есть превращение растворимого белка плазмы фибриногена в нераство-
римый белок фибрин. Это превращение катализирует тромбин. В нормальных
условиях его в крови нет. В «аварийной» ситуации он образуется из своего не-
активного предшественника протромбина, который содержится в плазме. Весь
этот процесс выглядит примерно так.
При повреждении сосудов, в результате контакта с кожей (или чужерод-
ным телом), активируется фактор XII. Активная форма фактора XII (фактор
XIIa) запускает цепочку последовательных реакций активации других белковых
факторов плазмы крови (VIII, IX, X и др.). Параллельно, активный Ф.XIIa воз-
действует на мембраны тромбоцитов (безъядерные клетки), которые начинают
объединяться в агрегаты и выбрасывают (освобождают) фактор 3 тромбоцитов.
Предполагается, что фактор III, и фактор 3 тромбоцитов, попадая при по-
вреждении тканей в плазму крови, создают предпосылки для образования не-
больших (затравочных) количеств тромбина из протромбина. Образовавшийся
тромбин катализирует превращение проакцелерина и проконвертина в акцеле-
рин (Ф.Va) и конвертин (Ф.VIIа) соответственно. Взаимодействие перечислен-
ных выше факторов с участием ионов кальция приводит к образованию актив
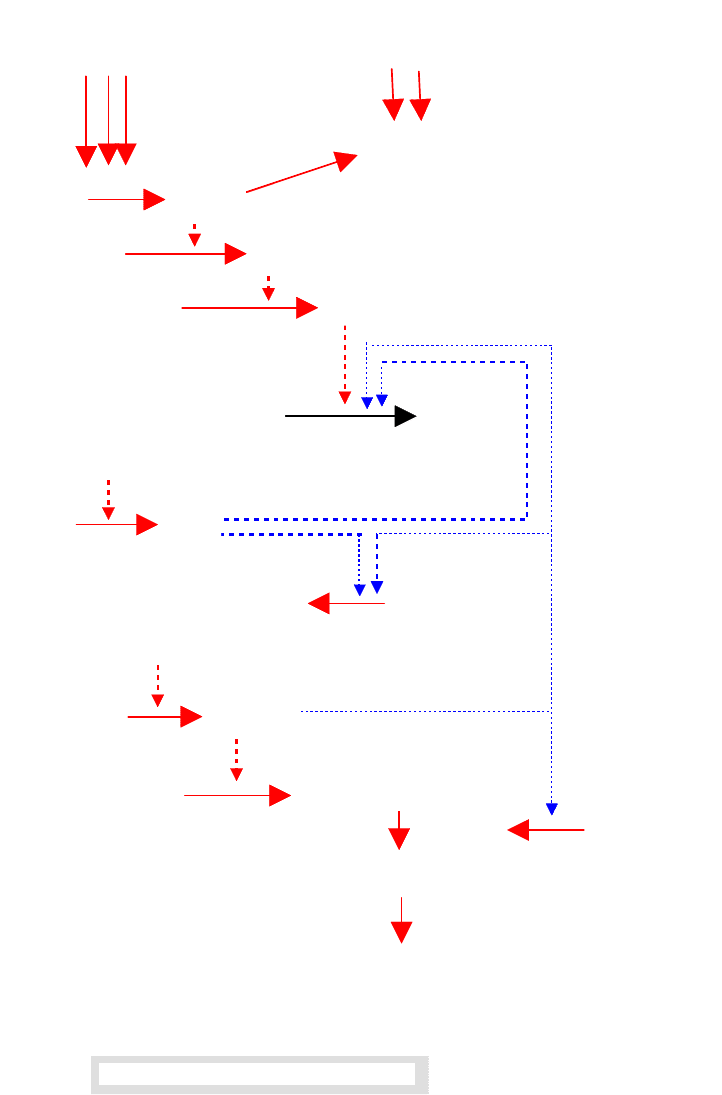
160
ного фактора Х (Ф.Ха). И наконец, под влиянием комплекса факторов: Xa, Va,
3 и ионов кальция образуется тромбин из протромбина.
Контакт крови с
поверхностью поврежденных сосудов
Агрегация, нарушение целостности
мембран тромбоцитов, освобождение
фактора Ф.3
Схема процесса свертывания крови
Ф.XII Ф.XIIa
Ф.XI Ф.XIa
Ф.IX Ф.IXa
Ф.VIII
Ф.VIIIa
[Ф.IXa, Ф.3, Ф.VIIIa, Ca(2+)]
Ф.X Ф.Xa
Ф.VФ.Va
[Ф.Xa, Ca(2+), Ф.3, Ф.Va]
Протромбин Тромбин
Фибриноген Фибрин-мономер
Фибрин-полимер
Ретрагированнный
фибрин
Ф.XIII
Ф.XIIIaCa(2+)
Ca(2+) ATP
Последовательность всех стадий процесса свертывания крови приведена
на схеме.
