Шендрик А.Н. Химия белка. Структура, свойства, методы исследования
Подождите немного. Документ загружается.

132
ры. Успешное решение этой задачи явилось результатом кропотливых исследо-
ваний на протяжении 25 лет, которые выполнены Перутцем с сотрудниками в
Кембридже. Одновременно и параллельно в этой же лаборатории был исследо-
ван методом РСА и миоглобин.
Молекула гемоглобина состоит из двух идентичных α- и двух β-цепей.
Каждая цепь вместе с гем-группой очень сходна с молекулой миоглобина. Каж-
дая из 4-х цепей свернута нерегулярным образом и состоит из ряда α-
спиральных участков, разделенных между собой местами сгибов. Подобно ми-
оглобину, α- и β-цепи гемоглобина содержат около 70% α-спиральных участ-
ков.
По третичной структуре α- и β-цепи очень близки. Они состоят из α-
спиральных участков одинаковой длины, согнутых под одинаковыми углами и
в одних и тех же направлениях. Кроме того, обе цепи гемоглобина имеют весь-
ма сходную с миоглобином третичную структуру. Это сходство связывают со
значительным числом одинаковых аминокислотных остатков в ключевых по-
ложениях пептидной цепи.
Многие олигомерные белки диссоциируют на субъединицы при высоких
и низких значениях рН, а также под действием больших концентраций мочеви-
ны или солей.
Денатурируют олигомерные белки в две стадии:
¾ первая стадия - разделение на субъединицы (отдельные цепи);
¾ вторая - разворачивание (денатурация) отдельных цепей.
Олигомерные белки наделены способностью к самосборке. Например, в
смеси, содержащей α- и β-цепи при благоприятных условиях идет самосборка
гемоглобина. Этот факт свидетельствует о том, что в аминокислотной последо-
вательности (первичной структуре) белков закодированы все структурные осо-
бенности вторичной, вторичной, третичной и четвертичной структур. Одна из
133
отличительных особенностей олигомерных белков - способность проявлять
кооперативный эффект.
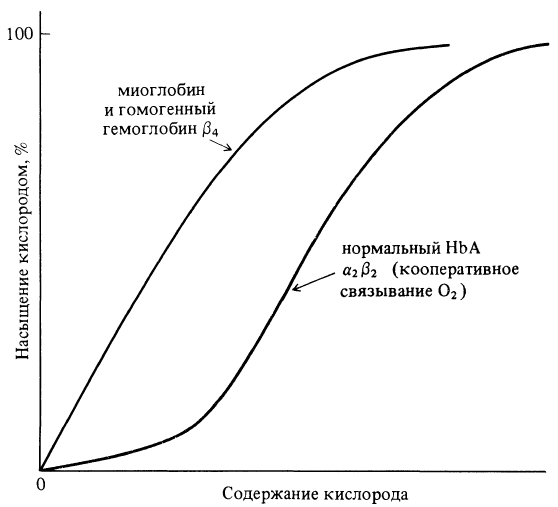
Суть кооперативного эффекта рассмотрим на конкретном примере. Срав-
ним между собой процессы насыщения кислородом молекул миоглобина (од-
ноцепочечный белок, не имеющий четвертичной структуры) и гемоглобина -
олигомерного белка. Полученные в эксперименте кривые насыщения кислоро-
дом для этих двух белков существенно различаются между собой (см.рис.2.4).
Рис. 2.4
Кривые поглощения кислорода миоглобином и гемоглобином
Кривая с насыщением у миоглобина характерна для процесса связывания
единственного лиганда. Сигмоидная кривая характерна для белков с несколь-
кими пептидными-цепями. В данном случае проявляется положительный коо-
перативный эффект. Подобное явление можно наблюдать у белков с различны-
ми функциями.
Качественно, положительную кооперативность можно описать так. Пер-
воначальное связывание одного лиганда в олигомерной молекуле белка облег
134
чает связывание второго лиганда этой молекулы, затем третьего, четвертого и
т.д. В гемоглобине, в частности, связывание молекулы О
2
с первой гем-группой
облегчает связывание с кислородом второго гема, третьего и четвертого.
В основе кооперативной связи между субъединицами в олигомерной мо-
лекуле белка лежит аллостеризм. Суть аллостеризма состоит в том, что белко-
вые молекулы способны принимать различные конформации в пространстве с
различной активностью. Важность этого свойства белков весьма велика. Очень
многие ферменты, контролирующие регуляторные функции (функции, обеспе-
чивающие поддержание требуемых скоростей реакций), относятся к классу
олигомерных белков.
2.2.4.1 Функциональное значение четвертичной структуры белка
Четвертичная структура характеристична для каждого белка не только с
точки зрения его пространственного строения, но и с позиций функциональной
направленности. Вместе с тем, с четвертичной структурой связывают и некото-
рые общие признаки присущие белкам, имеющим этот уровень структурной ор-
ганизации.
Ранее предполагалось, что образование четвертичных структур - это один
из путей уменьшения ошибок трансляции пептидных цепей в процессе биосин-
теза. Так, например, даже одна ошибка при трансляции пептидной цепи из 1000
аминокислот может привести к тому, что такая белковая молекула не сможет
принять необходимую пространственную конформацию, т.е. окажется функ-
ционально непригодной. Если же белок построен из 4-х пептидных цепей по
250 звеньев, то вероятность трансляционной ошибки существенно уменьшает-
ся. Результаты последних исследований убеждают однако в том, что такие
предположения, видимо, не верны. Ошибки трансляции практически не про-
слеживаются даже в биосинтезе белковых молекул, состоящих из нескольких
тысяч аминокислотных остатков, если специально не вмешиваться в генетиче-
ский аппарат клетки.
135
Более привлекательные гипотезы в отношении роли и значимости четвер-
тичной структуры белков состоят в следующем.
1.
Объединение нескольких взаимосвязанных функций. Эта особенность
четвертичной структуры реализуется через размещение нескольких функцио-
нальных центров по отдельным пептидным цепям объединенного в четвертич-
ную структуру олигомерного белка. Так устроены, например, РНК-полимераза,
крупные полиферментные комплексы.
2.
Архитектурная функция. Четвертичная структура позволяет формировать
из отдельных субъединиц самые различные объемные формы, которые и обес-
печивают специальные функциональные возможности белка. Например, моле-
кула ферритина построена из 24-х субъединиц собранных таким образом, что
внутри общей глобулы образуется полость. В этой полости запасается и хра-
нится до 3500 группировок FeO
.
OH. Другой пример - активные центры ряда де-
гидрогеназ формируются только после образования четвертичной структуры
аминокислотными остатками различных субъединиц.
3.
Регуляторная функция. Это главная функциональная особенность белка,
которая обеспечивается его четвертичной структурой. Проявляется она рас-
смотренным выше кооперативным эффектом.
2.2.4.2 Гибридные олигомерные белки
Некоторые олигомерные белки существуют в двух, трех и более про-
странственных формах. Эта особенность белков была впервые обнаружена в
1957 г. для тетрамерного фермента лактатдегидрогиназы и затем выявлена для
многих других белков. Гибридные формы называют изоферментами или изози-
мами. Существование изозимов обусловлено комплексообразованием разных
пептидных цепей в разных соотношениях. Например, семейство изозимов тет-
рамеров лактатдегидрогеназы включает в себя пять гибридных форм, состав-
ленных из различных комбинаций двух разных пептидных цепей, обозначае
136
мых как Н и L - это H
4
- , H
3
L- , H
2
L
2
-, HL
3
-
, L
4
-
лактатдегидрогеназа. Эти белки-
изозимы можно разделить методом электрофореза.
Соотношение изоферментов в биологических средах является, как прави-
ло, определенным и постоянным. Эта особенность не имеет пока строгого объ-
яснения, но используется в диагностике патологий.
2.2.5 Домены в белках
Молекулы белков с большой ММ (более 14-16 кДа) склонны формиро-
ваться в относительно независимые глобулы, составленные из отдельных уча-
стков пептидной цепи. Каждая из этих глобул имеет свое гидрофобное ядро,
окруженное мозаичной поверхностью гидрофобных и гидрофильных элементов
цепи. Эти структурные образования внутри одной и той же молекулы белка на-
званы доменами.
Домены определяют как области третичной структуры, которым присуща
определенная анатомия структурной организации. Молекулу белка часто удает-
ся расчленить на отдельные домены, подвергнув ее частичному гидролизу.
Помимо структурной организации, домены нередко различаются своими
биологическими функциями, т.е. обладают функциональной специфичностью.
Например, нуклеотидсвязывающий домен дегидрогеназ, независимо от функ-
ции фермента и способа укладки его пептидной цепи, отвечает за связывание с
коферментом NAD или NADH. Аминоконцевые домены (криглы) ферментов
системы свертывания крови, обеспечивают связывания с липидами мембраны и
другими белками. Аминоконцевые домены иммуноглобулинов содержат центр
связывания антигена и т.д.
Однозначно определить функциональную роль отдельных доменов уда-
ется, однако, далеко не всегда. Например, молекула протеолитического фер-
мента папаина содержит два хорошо различимых домена, однако функцио-
нальная направленность каждого из них пока не ясна (см рис. 2.5).
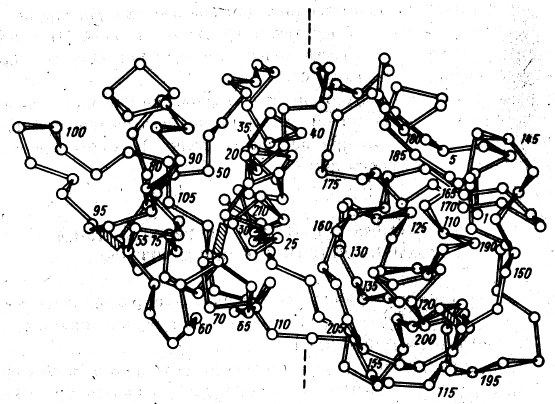
137
Рис. 2.5
Домены в пептидной цепи протеолитического фермента папаина
Домены формируются чаще всего автономным свертыванием последовательно
расположенных участков пептидной цепи. Известны, однако, случаи формиро-
вания доменов и далеко отстоящими друг от друга отрезками участками одной
и той же молекулы.
Предполагают, что домены относятся к раннему этапу эволюции про-
странственной структуры белков, которые образовались из менее крупных гло-
бул. Например, маленькая молекула протеазы вируса иммунодифицита челове-
ка (ВИЧ) имеет пептидную цепь, состоящую из 99 аминокислотных остатков.
Она имеет два домена и по структуре этих доменов очень сходна с протеазой
пепсином. Эти две протеазы весьма сходны и по своему действию. Предпола-
гают, поэтому, что протеаза ВИЧ является более ранним предшественником
пепсина.
По устоявшемуся мнению домены - есть промежуточный подуровень
структурной организации белка на пути от вторичной к третичной структуре.
Не исключено, что процесс упаковки молекулы белка в третичную структуру
включает стадию формирования доменов..
138
2.3 Поведение белков в растворах
2.3.1 Кислотно-основные свойства белков
Кислотно-основные свойства нативных белков определяются, главным
образом, наличием в них и числом ионизируемых R-групп в аминокислотных
остатках. Две концевые функциональные группы пептидной цепи: амино- и
карбоксигруппа практически не оказывают влияния на кислотно-основные
свойства белковой молекулы в целом.
Степень ионизации функциональных групп в R-остатках, входящих в
белковую молекулу аминокислот определяется не только его первичной струк-
турой (аминокислотной последовательностью), но и структурами более высо-
кой иерархии. Нельзя, поэтому, только на основании известной аминокислот-
ной последовательности в точности предсказать кислотно-основные свойства
белковой молекулы и ее суммарный заряд.
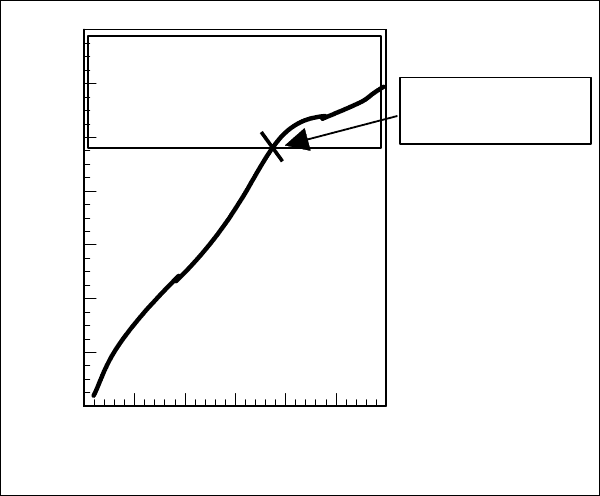
Рассмотрим кривую потенциометрического тирования рибонуклеазы.
0 5 10 15 20 25 30
Эквиваленты ОН
-
→
0
2
4
6
8
10
12
14
рН
Зона рН, в которой молекула
имеет суммаррный
отрицат. заряд
Зона рН, в которой
молекула имеет
суммарный
положительный заряд
Изоэлектрическая
точка, рН = 9.6
Рис. 2.6
Кривая потенциометрического тирования рибонуклеазы
139
Пептидная цепь
молекулы этого белка свернута в плотную глобулу, состоящую
из 124 аминокислот, последовательность которых известна. Помимо концевых
остатков с -NH
2
и -COOH группами, в пеп-
тидной цепи содержится 34 ионизируемые R-
группы, большая часть которых обладает ос-
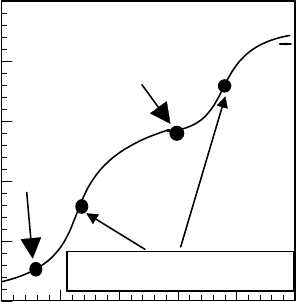
новными свойствами. Поэтому кривая титро-
вания имеет достаточно "сглаженную" форму,
по сравнению с кривыми титрования простых
соединений, например двухосновной кислоты
(см. рис.).
Как видно из кривой титрования рибо-
нуклеазы (см. рис. 2.6), изоэлектрическая точ-
ка для этого белка смещена в сторону больших значений рН, т.е. для молекулы
в целом характерны основные, а не кислотные свойства. Очень сходные резуль-
таты были получены при титровании β-лактоглобулина, яичного альбумина и
ряда других глобулярных белков. На основании полученных данных был сде-
лан вывод о доступности подавляющего большинства входящих в пептидную
цепь ионизирующихся R-групп кислотно-основному титрованию. Этот вывод
хорошо согласуется с данными рентгеноструктурного анализа о том, что почти
все ионогенные R-группы в глобулярных белках расположены на внешней по-
верхности молекулы, а большинство неполярных (гидрофобных) групп скрыто
внутри клубка. В некоторых глобулярных белках одна или несколько ионизи-
рующихся R-групп тем не менее не тируются. Предполагают, что они либо на-
ходятся внутри глобулы, либо вовлечены в образование прочных водородных
связей. Так например, в миоглобине 5 из 11 содержащихся в нем R-групп гис-
тидина удается оттитровать только после денатурации белка.
Для белков, так же как и для аминокислот характерно наличие изоэлек-
трических точек, т.е. таких значений рН, при которых их молекулы имеют сум-
марный нулевой заряд. На этом свойстве основан метод изоэлектрофокусиров
Количество добавленных
эквивалентов ОН
pH
→
pKa1
pKa2
Точки нейтрализации
Кривая титрования двухосновной
кислоты
140
ки белков. Положения изоэлектрических точек определяются числом и типом
входящих в белок аминокислот с ионизирующимися R-группами. Изоэлектри-
ческая точка будет располагаться тем выше величины рН = 7, чем больше в
пептидной цепи белка содержится основных R-групп, например, Лиз, Арг. И
наоборот, чем больше в молекуле белка кислотных R-остатков (Асп, Глу и др.),
тем ниже величина изоэлектрической точки. У большинства глобулярных бел-
ков изоэлектрические точки лежат в пределах рН 4.5 - 6.5 (см. табл. 2.1)
Таблица 2.1
Положения изоэлектрических точек некоторых белков
Белок рН изоэлектрической точки
Пепсин < 1.0
Яичный альбумин 4.6
Сывороточный альбумин 4.9
Уреаза 5.0
β-Лактоглобулин
5.2
γ
1
-Глобулин
5.6
Гемоглобин 6.8
Миоглобин 7.0
Химотрипсиноген 9.5
Цитохром с 10.65
Лизоцим 11.0
Кривые потенциометрического титрования позволяют определять вели-
чину и знак суммарного заряда белковой молекулы при заданном значении рН.
При рН выше изоэлектрической точки молекула белка заряжена отрицательно и
в электрическом поле будет двигаться к аноду. По мере повышения рН величи-
на отрицательного заряда белковой молекулы будет возрастать в соответствии с
формой кривой титрования. При рН ниже изоэлектрической точки молекула
белка заряжена положительно и движется к катоду.
Вид кривой титрования сильно зависит от присутствия в растворе ней-
тральных солей. Они по разному влияют на степень ионизации отдельных R-
141
групп. Кроме того белки склонны связывать неорганические катионы (Cu
2+
,
Mg
2+
, например) и анионы (например, хлор- и фосфат-ионы). По этой причине
положение изоэлектрической точки для одного же белка может значительно
варьировать в зависимости от состава среды.
2.3.2 Осаждение белков из растворов в виде солей
Большинство белков полностью осаждаются из водных растворов неко-
торыми кислотами. Наиболее часто для этих целей используют трихлоруксус-
ную и хлорную кислоты. Они образуют с белками водонерастворимые соли.
Эти кислоты широко применяют для «осветления» биологических жидкостей
или клеточных экстрактов перед анализом низкомолекулярных или других не-
белковых компонентов смесей. Например, глюкозы, аминокислот, нуклеиновых
кислот, углеводов, липидов и др.
Хорошими осадителями для белков являются также вольфрамовая, фос-
фовольфрамовая и метафосфорная кислоты. Хорошо осаждают белки и двухва-
лентные катионы Zn, Pb.
2.3.3 Растворимость белков и факторы ее определяющие
Существенное влияние на растворимость белков оказывает ряд факторов,
основными из которых являются:
¾ рН раствора;
¾ ионная сила среды;
¾ диэлектрические свойства растворителя;
¾ температура.
2.3.3.1 Зависимость растворимости белков от рН среды.
Рассмотрим конкретные экспериментальные данные по растворимости натив-
ного β-лактоглобулина от рН при различных концентрациях NaCl (см.рис.2.7)
