Поклонский Н.А. и др. Полупроводники: основные понятия
Подождите немного. Документ загружается.

141
водят следующие рассуждения. Первичное квантование заменя-
ет наблюдаемые величины операторами, а результаты экспери-
ментов рассматриваются как результат действия этих операто-
ров на волновые функции, полученные решением уравнения
Шредингера для рассматриваемой системы. Предпо ложим теперь
по аналогии, что мы интерпретируем волновые функции ψ
i
как
операторы, действующие на что-то иное. При этом мы выходим
за рамки привычной процедуры квантования и попадаем в мир
вторичного квантования, в котором действие оператора ψ
i
+
(на
нечто иное) порождает частицу в состоянии i, а действие опе-
ратора ψ
i
−
приво дит к уничтожению частицы в состоянии i. Мож-
но понять, что такая возможность порождать и уничтожать час-
тицы позволяет получить способ вывода уравнений для расчета
квантово-мех анических свойств многочастичных систем. В рам-
ках метода вторичного квантования переход квантовой системы
из одного состояния в другое можно трактовать как “рождение”
в системе одних частиц и, возмо жно, “уничтожение” других.
# Что такое матрица пло тности (статистический операт ор ) кван-
товой системы? Это квант ово-мех анический аналог классической
функции распределения вероятности зна чений наблюдаемой ве-
личины. Диагональные элементы матрицы плотности задаю т ста-
тистически усредненные заселенности состо яний, а недиагональ-
ные — усредненные корреляции между состояниями системы.
# Потенциальная энергия: энергия, которой обладает тело бла-
годаря своему положению (а не движению) в поле внешних сил.
Потенциальный барьер — ограниченная область пространства,
недоступная, согласно классическому описанию, для частицы
(системы) при заданной энергии. Формально в области барьера
потенциальная энергия частицы больше, чем ее полная энергия.
Потенциальная яма — область пространства, в которой потен-
циальная энергия частицы меньше, чем вне ее.
# Если на аморфную пленку, содержащую N ядер (пленку для
того, чтобы ядра не “затеняли” друг друга), падает параллель-
ный моноэнергетический пучок нейтронов с однородной и ста-
ционарной пространственно-временной плотностью потока I и
142
за время t происходит
αt
актов рассеяния, то полным сечением
рассеяния нейт ронов на одном ядре называется отношение
α
/
(IN). Длина свободного пробега — расстояние, проходимое
частицей между последовательными столкновениями.
# В модели Друде–Лоренца вместо того, чтобы рассматривать
внешние силы, действующие на отдельный электрон проводи-
мости, и затем усреднять результат по всем электронам, описы-
вается влияние внешних сил на некоторый “средний электрон”,
характерный для всего ансамбля. Чтобы выяснить макроскопи-
ческое поведение системы, следует вклад от “среднего электро-
на” умножить на число электронов.
# Туннельный эффект — явление проникновения квантовой си-
стемы (частицы) через область потенциального барьера, разде-
ляющего две классические доступные области. Температурная
зависимость вероятности туннельного перехода определяется: 1)
тепловым заселением высших энергетических уровней тунне-
лирующей частицы (указанный механизм может привести к су-
щественному ускорению туннельного перехода лишь при таких
температурах, когда уже нельзя пренебречь надбарьерными пе-
реходами); 2) термическими флуктуациями параметров потен-
циальног о барьера. Эффект Зинера — туннельный переход элек-
тронов из валентной зоны в зону проводимости при приложе-
нии к кристаллическому диэлектрику (полупроводнику) элект-
ростатического поля.
# Адиабатическое условие соответствует бо льшой величине от-
ношения времени пролета частицей атомной системы (времени
изменения взаимодействия) t
i
к периоду колебаний в атомной си-
стеме 2π
/
ω. Так, если скорость частицы столь мала, что выпол-
няется условие ω >> 1
/
t
i
, то частица не может вызвать квантовых
переходов, соответствующих частоте ω.
# В периодической (в пространстве) решетке рассеив ающих цен-
тров волна способна распространяться без затухания благодаря
когерентной интерференции рассеянных волн.
# В первом порядке теории возмущений скорость перехода (ве-
роятность перехода в единицу времени) квантовой системы из
143
состояния с энергией E
l
и волновой функцией ψ
l
в группу состо-
яний с энергетической плотностью ρ(E
f
) в окрестно сти энергии
E
f
= E
l
и волновой функцией ψ
f
под действием стационарного
возмущения U
$
определяется “золотым правилом Ферми”:
W
fl
= (2π
/
h)|
∫
ψ
f
∗
U
$
ψ
l
d
3
r|
2
ρ(E
f
),
где ∗ — знак комплексного сопряжения; d
3
r = r
2
sinϑ drdϑdϕ —
трехмерный элемент объема; W
fl
имеет размерность (время)
−1
.
# Неупругое рассеяние частицы — процесс столкновения, в
результате которого изменяется внутреннее состояние частицы
и
/
или мишени. В случае упругого рассеяния изменяются лишь
импульсы частицы и мишени (при сохранении их суммарной ки-
нетической энергии).
# Ааронова– Бома эффект — влияние внешнего электро магнит-
ного поля, сосредоточенного в области пространства, недоступ-
ной (в условиях эксперимента) для заряженной частицы, на ее
квантовое состояние.
# Метод адиабатического исключения переменных при ре-
шении уравнений движения. Если “быстрые” переменные, опи-
сывающие процессы в системе, достигают своего стационарно-
го состояния гораздо быстрее “медленных” переменных, кото-
рые остаются почти ст атичными, и их изменение во времени
можно описать как адиабатический дрейф, то выражения для
быстрых переменных можно представить в виде алгебраичес-
ких функций от медленных переменных. Эти функции можно
подставить в уравнения движения для медленных переменных,
получив таким образом самосогласованное решение.
# Вектор — направленный отрезок прямой в евклидовом про-
странстве; элемент векторного пространства. Ак сиальный (осе-
вой) вектор — вектор, преобразующийся в противоположный
при переходе от левой системы пространственных декартовых
координат к правой или наоборот. Примером аксиального векто-
ра является векторное произведение полярных векторов.
144
# Д етальное и “глобальное” тепловое равновесие
Когда система, состоящая из большого числа частиц, находится
в состоянии равновесия, постоянными во времени остаются лишь
величины, отнесенные к системе в целом (т. е. термодинамические
величины). Чтобы равновесие сохранялось, наряду с любым мик-
ропроцессом должен осуществляться и обратный ему. (Скорость
микропроцесса трактуется статистически: как среднее по большо-
му числу одинаковых микропроцессов).
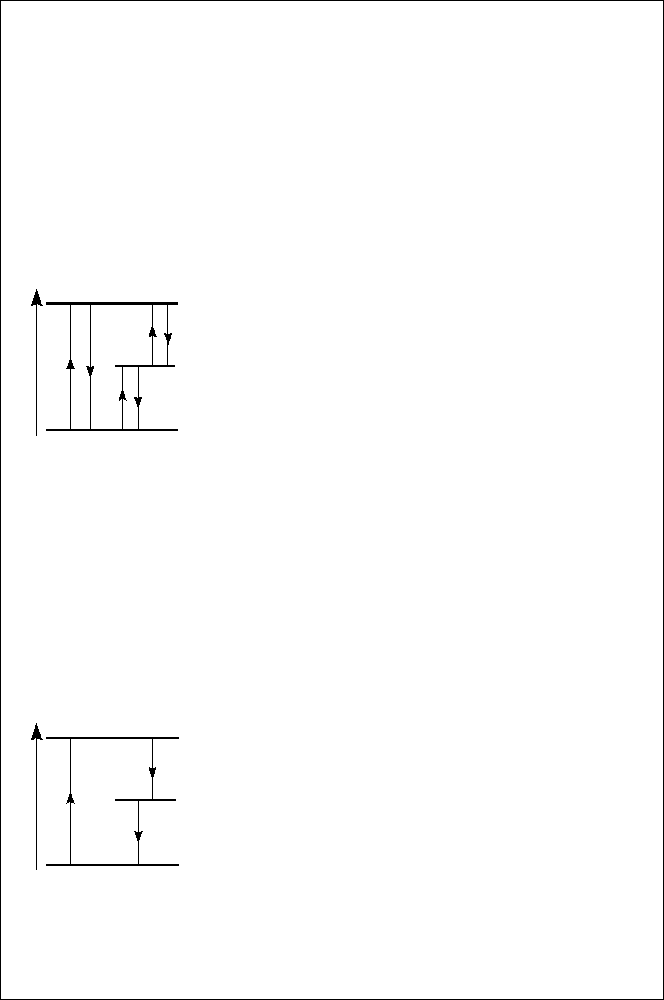
а) Д е т альное равновесие в системе с тремя энергетическими
уровнями. Принцип детального равновесия (п. д. р.) в равновесной
системе: скорости переходов для прямого и обратного микропро-
цессов равны и уравновешены в деталях (речь
идет о полном числе (квази)частиц, совершаю-
щих, например, переходы (1 → 2) и (2 → 1), а
не о вероятностях этих переходов для отдель-
ной частицы). Так, в образце нелегированного
кристаллического кремния при температуре
Т = 300 К элек тронно-дырочные пары (в концентрации 1.45⋅10
10
см
−3
)
генерируются оптически под воздействием изотропного излучения
фона (т. е. “черного” излучения в инфракрасной области спектра,
излучаемого термостатом). Для выполнения п . д. р. требуется, что-
бы рекомбинационное элек тром агнитное излучение имело то же рас-
пределение по энергии, поляризации и направлению распростра-
нения, что и излучение, поглощенное при образовании пар носите-
лей заряда. Принципом детального равновесия называется также
равенство вероятностей прямого и обратного микропроцессов.
б) Глобальное равновесие в трехуровневой системе. П. д. р. не
выполняется точно, например, когда в системе имеются взаимодей-
ствия, лишенные центра пространственной ин-
версии или зависящие от спина частиц. (Ин-
версия времени меняет знак и (квази)импульса
p, и спина, а инверсия коор динатного простран-
ства меняет только знак p). Тогда нарушение
детального равновесия компенсирует ся про-
цессами циклического характера. (Впервые установлено Л. Больц-
маном для газа, содержащего молекулы без центра инверсии (на-
пример, Н
2
О)).
Сценарий реализующегося в системе равновесия (детального или
глобального) может проявиться только в неравновесных процессах.
Энергия
3
2
1
Энергия
3
2
1
145
Примечание. Совокупность системы и резервуара, который предполагается значительно большим
системы (по числу степеней свободы), можно рассматривать как одну большую замкнутую (изолиро-
ванную) систему и сопо ставить ей микроканонический ансамбль Гиббса. Считается, что энергия си-
стемы в любом допустимом микросостоянии не зависит от температуры.
# Сводка статистических ансамблей (по Дж. Гиббсу)
Тип контакта
системы с резер-
вуаром
∑
−−ζ
=Χ
VlN
B
l
Tk
PVEN
,,
exp
Механический,
материальный,
тепловой
Контакт
отсутствует
Тепловой
Механический
(силовой),
тепловой
Материальный
(диффузион-
ный), тепловой
Статистическая сумма (по до-
пустимым микросостояниям
l системы)
∑
=Γ
l
1
∑
−=Ζ
l
B
l
Tk
E
exp
∑
+
−=Υ
Vl
B
l
Tk
PVE
,
)(
exp
∑
−ζ
=Ξ
lN
B
l
Tk
EN
,
exp
Основная термоди-
намическая функ-
ция
Энтропия
S = k
B
lnΓ
Свободная энергия
F = −k
B
T ln Ζ
Tk
N
B
ζ
−=Υln
Tk
PV
B
=Ξln
Название ансамбля;
независимые перемен-
ные
Обобщенный: T, P, ζ
Микроканонический:
V (объем), N (число
частиц), E (энергия)
Канонический: V, N, T
(температура)
Большой каноничес-
кий: V, T, ζ (химичес-
кий потенциал)
lnΧ = 0
Изобарно-изотермичес-
кий: N, T, P (давление)

146
Предположения: 1) E ≈ E
k
+ ε
l
, т. е. энергия взаимодействия под-
системы с резервуаром и их вместе с окружением пренебрежимо
мала; 2) объединенная система в термодинамическом равновесии с
равной вероятностью может находиться в любом из Γ(N, E, V) со-
стояний, т. е. распределена микроканонически.
Резуль та т. Вероятность того, что подсистема находится в од-
ном из γ(n, ε
l
) со стояний с числом частиц n и энергией, лежащей в
интервале (ε
l
, ε
l
+ ∆ε
l
), где ∆ε
l
<< ε
l
, есть:
P{n, ε
l
} ∝ γ(n, ε
l
)⋅Γ(N − n, E − ε
l
) = γ(n, ε
l
)exp[Ω(N − n, E − ε
l
)];
∑
n
∑
l
P{n, ε
l
} = 1;
P
{n, ε
l
} =
γ(n, ε
l
)
Ξ
exp
nζ − ε
l
k
B
T
.
Среднее (по ансамблю) число частиц и энергия подсистемы:
ζ∂
Ξ∂
=ε=
∑∑
ln
},{ TknnPn
B
nl
l
; ε
–
=
∑
n
∑
l
ε
l
P{n, ε
l
}.
Энтропия подсистемы S = −k
B
∑
n
∑
l
P{n, ε
l
}ln P{n, ε
l
} определяется
из тождества dε
–
= đq + đw, где đq = TdS =
∑
n
∑
l
ε
l
dP{n, ε
l
}.
Замечание. Для объединенной системы (P{N,E,V})
j
= 1
/
Γ(N,E,V)
и энтропия S = k
B
ln Γ(N, E, V) = −k
B
∑
Γ
j =1
[(1
/
Γ)ln(1
/
Γ)]
j
. Индекс j ну-
мерует допустимые микросостояния объединенной системы, а ин-
дексы k и l — резервуара и подсистемы соответственно.
Большая система (= резервуар однотипных частиц и тепла): чис-
ло микроскопических состояний с числом частиц N − n и энерги-
ей E
k
(N − n) равно Γ(N − n, E
k
).
Неподвижная перегородка, проницаемая для частиц и тепла.
Малая система (= подсистема): число состояний с числом частиц
n и энергией ε
l
(n) равно γ(n, ε
l
).
Объединенная система (= резервуар + подсистема): число час-
тиц N, энергия в интервале (E, E + ∆E), где ∆E << E, объем V, число
состояний Γ(N, E, V); изменение энтропии S
/
k
B
= Ω = ln Γ(N, E, V)
для обратимых процессов равно
dS
k
B
=
∂Ω
∂N
dN +
∂Ω
∂E
dE +
∂Ω
∂V
dV =
−ζdN + dE + PdV
k
B
T
=
đQ
k
B
T
=
dE − đ
W
k
B
T
,
где ζ — химический потенциал, P — давление, Q — теплота, W —
работа.
Изолирующая оболочка
# Сх ема выво да бо льшого каноническ ог о распре деления Г иббса
147
# Статистика фермионов и бозонов
Замечание. Энтропия одноатомного идеального газа (n
–
l
<< 1 для всех E
l
) определяется формулой:
π
+=−=
∑
3
23
)2(
ln
2
5
)ln1(
Nh
VTMk
NknnkS
B
B
l
llBST
, где N =
∑
l
n
–
l
— число атомов в объеме V; М —
масса атома, E =
∑
l
E
l
n
–
l
= 3Nk
B
T
/
2 — полная энергия газа. Если электроны атома обладают суммар-
ным спином j
e
, а ядро спином j
n
, то полная энтропия газа S = S
ST
+ k
B
lnγ, где γ = (2j
e
+ 1)
N
(2j
n
+ 1)
N
—
число независимых спиновых состояний, которые могут быть образованы N атомами.
Энтропия системы частиц
−S
/
k
B
=
∑
n
∑
l
P{n, E
l
}ln P{n, E
l
},
где индекс l — квантовое число орби-
тали с энергией E
l
Статистика невзаимодействующих
тождественных частиц
Возможно е число частиц системы в
каждом одночастичном состоянии (за-
селенность любой орбитали)
Вероятность P{n, E} того, что при тем-
пературе T и химиче ском потенциале ζ
одночастичное сос тояние с энергией E
запо лнено n частицами (число заполне-
ния орбитали равно n)
Среднее число заполнения состояния с
энергией E (т. е. n
–
=
∑
n
nP{n, E})
Ферми–Дирака
n = 0 или 1
[
]
[]
TkE
TkEn
B
B
)(exp1
)(exp
−ζ+
−
ζ
[]
1)(exp
1
+ζ− TkE
B
∑
−+
−
l
l
l
l
l
n
n
n
n
)1ln(
1
ln
Бозе–Эйнштейна
n = 0, 1, 2, 3, …
−ζ
−
−ζ
Tk
E
Tk
En
BB
exp1
)(
exp
,
где E > ζ
[]
1)(exp
1
−ζ− TkE
B
∑
+−
+
l
l
l
l
l
n
n
n
n )1ln(
1
ln

# Фрагмент вывода кинетического уравнения Больцмана для
электронов (дырок) кристаллического полупроводника
Модель. Для описания переноса электронов c-зоны в электри-
ческом поле E вводится одноэлектронная неравновесная функция
pаспределения f(k,r,t), где t — время, r и k — средние радиус-век-
тор и квазиволновой вектор, вокруг которых сосредоточена волно-
вая фyнкция электрона (заданная в форме волнового пакета). Сред-
нее число электронов в элементе объема фазового пространства
d
3
kd
3
r в момент времени t равно 2f (k,r,t)d
3
kd
3
r
/
(2π)
3
. В равнове-
сии имеем: V
−1
∫
f (k,
r)d
3
r
→
f
FD
= [1 + exp((E
k
− E
F
)
/
k
B
T)]
−1
, где
V — объем кристалла, E
k
— энергия одноэлектронного состояния,
E
F
(T) — химический потенциал для электронов (уровень Ферми),
k
B
Т — тепловая энергия. Плотность электрического ток а J(r,t) =
= −2e
∫
v
k
f (k,r,t)d
3
k
/
(2π)
3
= −(e
/
V)
∫
v
k
f (k,r,t)g
3
dE
k
, где интегрирова-
ние ведется в пределах 1-й зоны Бриллюэна; g
3
— плотность одно-
электронных состояний. В промежутках времени между столк-
новениями скорость электрона v
k
= dr
/
dt = hk
/
m ≈ ∇
k
E
k
/
h; dk
/
dt =
= −eE
/
h.
Резуль тат. Уравнение Больцмана (изменение функции распре-
деления во времени равно “интегралу столкновений”):
st
I
t
f
dt
df
dt
df
dt
tdf
=
∂
∂
+⋅
∂
∂
+⋅
∂
∂
=
r
r
k
k
rk ),,(
;
в случае упругого рассеяния электрона I
st
≈ [ f
FD
− f (k,
r,
t)]
/
τ(k), где
τ(k) — время релаксации квазиволнового вектора.
Замечания. 1) Блох овская волновая функция соответствует оп-
ределенному значению квазиимпульса, в то время как координата
электрона не определена. Этот недостаток можно исправить, сфор-
мировав волновой пакет из блоховских состояний; длина волны
внешнего электрического поля должна быть много больше шири-
ны волнового пакета. 2) Уравнение Больцмана справедливо, когда
взаимодействия электрона с другими электронами, с тепловыми
колебаниями решетки, примесными атомами носят характер стол-
кновений, т. е. хорошо локализованы в пространстве и во времени.
3) В полупроводниках генерационно-рекомбинационные процес-
сы гораздо более медленны, чем процессы рассеяния (столкнове-
ния), которые и “формируют” зависимо сть f (k,r,t) от k.
СПИСОК РЕКОМЕНДУЕМОЙ ЛИТЕРАТУРЫ
1. Ба тти Х., Принг А. Минералогия для студентов.— М.: Мир, 2001.—
429 с.
2. Бэрк Г.Ю. Справочное пособие по магнитным явлениям.— М.:
Энергоатомиздат, 1991.— 384 с.
3. Гонда С., Сэко Д. Оптоэлект роника в вопросах и ответах.— Л.:
Энергоатомиздат, 1989.— 184 с.
4. де Жен П.-Ж., Балос Ж. Хрупкие объекты.— М.: Мир, 2000.—
189 с.
5. Дикарев В.И. Справочник изобретателя.— СПб.: Издательство
“Лань”, 2001.— 352 с.
6. Карери Дж. Порядок и беспорядок в стру ктуре материи.— М.:
Мир, 1985.— 232 с.
7. Конюшая Ю.П. Открытия советских ученых.— М.: Изд-во Моск.
ун-та, 1988.— Ч. 1. 478с.; Ч. 2. 232 с.
8. Пиментел Г., Спратли Р. Как квантовая механика объясняет хими-
ческую связь.— М.: Мир, 1973.— 332 с.
9. Солимар Л., Уол ш Д. Лекции по электрическим свойствам ма те-
риалов.— М.: Мир, 1991.— 504 с.
10. Тригг Дж. Физика ХХ века: ключевые эксперименты.— М.: Мир,
1978.— 376 с.
11. Узоры симметрии
/
Под ред. М. С енешаль и Дж. Флека.— М.:
Мир, 1980.— 280 с.
12. Физическая энциклопедия. Т. 1–5.— М.: Сов. энцикл. — Бол. Рос.
энцикл., 1988–1999 гг.
13. Хоффман Р. Такой одинаковый и разный мир.— М.: Мир, 2001.—
294 с.
14. Чертов А.Г. Физиче ские величины (терминология, определения,
обозначения, размерности, единицы).— М.: Высш. шк., 1990.—
335 с.
15. Электроника: Энциклопедический словарь.— М.: Сов. энцикл.,
1991.— 688 с.
16. Эмсли Дж. Элементы.— М.: Мир, 1993.— 256 с.
17. Эткинс П. Кванты. Справочник концепций.— М.: Мир, 1977.—
496 с.
18. Эткинс П. Порядок и беспорядок в природе.— М.: Мир, 1987.—
224 с.
150
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
Автоэлектронная эмиссия 57
Автоэпитаксия 13
Адсорбция 58
Альбедо 119
Аморфное состояние 7, 9, 38, 73
Андреевское отражение 97
Антиферромагнетизм 105
Асимметрическая единица 15, 17
Ассоциаты 68
Базовый срез 19
Барнетта опыт 46
Биполярон 51, 68
Бифонон 68
Биэкситон 68
Блоха функция 137
Бозоны 140
Боровский радиус 77
Бурштейна–Мосса сдвиг 114
Вакансион 87
Вакуум 8
Ван Хова особенности 33
Варистор 128
Вектор
аксиальный 143
Бюргерса 69, 72
квазиволновой 30–33
трансляционный
обратной решетки 11–13, 40
прямой решетки 11–13
Вибронное взаимодействие 39
Волны
температурные 86
Вороного–Дирихле много-
гранник 11, 71
Время жизни носителя заряда 51
Вторичное квантование 140
Второй звук 87, 97
Габитус 15
Газ
фононный 38
электронный
вырожденный 49
кристаллизация 14
Гистерезис 108
Графит 8
Двойникование 15
Двойное отражение 15
Делокализованный электрон 44
Дефекты 66
собственные 71
стехиометрические беспримес-
ные 67
точечные 68
амфотерные 81
позиционные 81
упаковки 70
Диамагнетизм 104
Дивакансия 68
Диод Ганна 130
Дисклинация 69
Дислокация 68, 72
Диффузия
амбиполярная 92
атомов в кристалле 86
ко эффициент 89
точечных дефектов 86
Диэлектрик 8
полярный 8
Диэлектрическая проницае-
мость 112–113, 121
Длина
когерентности 96
магнитная 106
свободного пробега 142
Дырка (электронная вакансия)44
Емкость pn-перехода 65
Закалка 87
Закон
Гука 38
дисперсии 32, 35
Золотое правило Ферми 143
Зона
Бриллюэна 11, 22, 33
валентная 47, 52
примесная 78
проводимости 47, 52
энергетическая 29, 53
запрещенная 47
