Михеева Е.В., Пикула Н.П. Физическая и коллоидная химия
Подождите немного. Документ загружается.

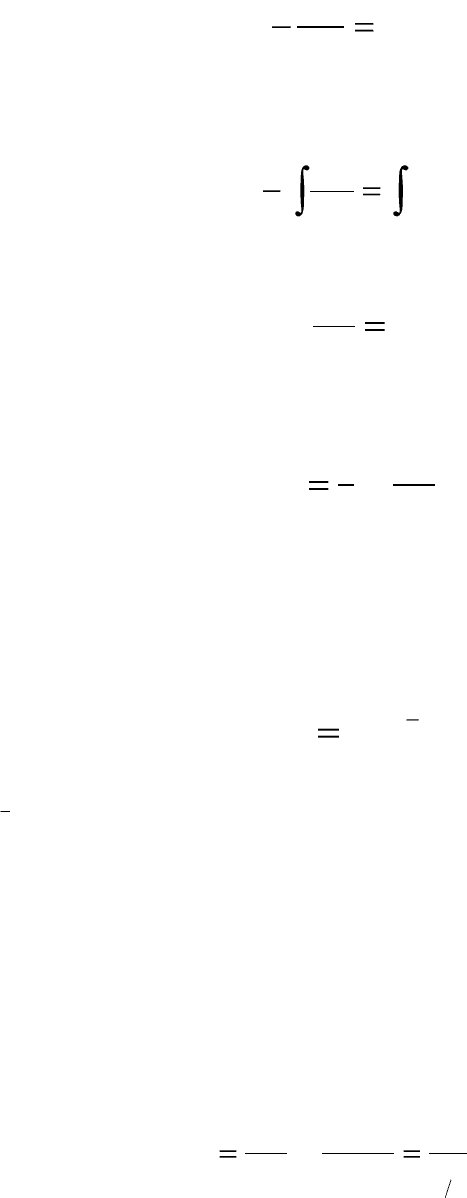
151
Приравнивая эти уравнения и опуская для простоты индекс А, по-
лучаем:
kC
dt
dC
.
Разделим переменные и проинтегрируем левую и правую части по-
лученного уравнения в пределах от С
0
до С и от 0 до t:
dtk
C
dC
tC
C 0
0
.
Получаем:
kt
C
C
0
ln
. (6.7)
Тогда выражение для константы скорости реакции первого по-
рядка имеет вид:
C
C
t
k
0
ln
1
, (6.8)
где С
0
– начальная концентрация исходного вещества; С = С
0
– х
– концентрация исходного вещества к моменту времени t.
Потенцируя полученное уравнение, получим кинетическое уравне-
ние, описывающее зависимость концентрации исходного вещества от
времени:
kt
eCC
0
. (6.9)
Константа скорости реакции первого порядка имеет размерность:
1
()время
. При этом время реакции может измеряться как в часах, так
и в долях секунды, в веках и др. При кинетическом исследовании реак-
ций первого порядка вместо концентрации можно использовать любые
другие величины, пропорциональные концентрации, так как в уравне-
ния для расчета константы скорости входит отношение концентраций.
Для характеристики скорости реакции наряду с константой скоро-
сти часто используют время полупревращения (t
1/2
) – время, в течение
которого прореагирует половина начального количества вещества
(С = С
0
/2):
2ln
1
2/
ln
1
210
0
2/1
tC
C
t
k
.
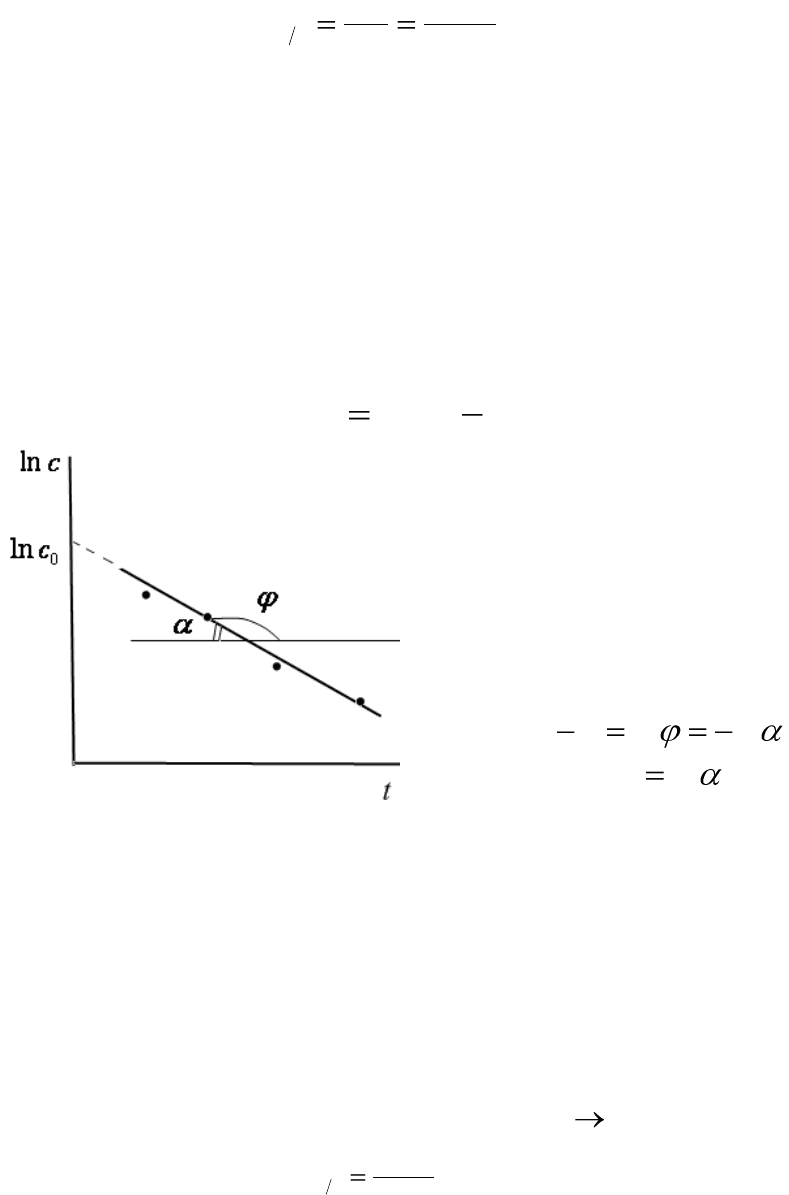
152
Отсюда выражение для расчета времени полупревращения для ре-
акций первого порядка будет иметь вид:
kk
t
693,02ln
21
. (6.10)
Из уравнения (6.10) видно, что время полупревращения для реак-
ций первого порядка не зависит от начальной концентрации исходного
вещества.
Полученные уравнения позволяют рассчитать концентрацию ис-
ходного вещества и продуктов реакции, скорость реакции в любой мо-
мент времени, если известна константа скорости реакции, то есть ре-
шить прямую задачу химической кинетики.
Константу скорости односторонней реакции первого порядка мож-
но найти графически. Для этого уравнение (6.7) приводят к линейному
виду:
ktCC
0
lnln
. (6.11)
Рис.6.2. Уравнение прямой для
расчета константы скорости односто-
ронней реакции первого порядка
Полученное уравнение (6.11)
представляет собой уравнение
прямой линии, тангенс угла ко-
торой равен константе скорости
реакции (рис.6.2):
tgtgk
;
tgk
.
(6.12)
Пример 6.1. Период полураспада некоторого вещества составляет
9,93 мин. Рассчитайте, сколько процентов этого вещества разложится за
1 час.
Решение:
1. Разложение – реакция первого порядка:
A продукты
.
2. Из уравнения (6.10)
k
t
693,0
21
, отсюда:
153
1
2/1
07,0
93,9
693,0693,0
мин
t
k
.
3. Пусть начальная концентрация вещества составляла 100%. За-
пишем уравнение для расчета константы скорости реакции первого по-
рядка (6.8):
1
0
07,0
100
100
ln
60
1
ln
1
мин
xC
C
t
k
.
4. Решим это уравнение относительно х:
х=98,48%
Пример 6.2. При изучении кинетики некоторой реакция первого
порядка были получены следующие данные:
Время, мин
0
15
30
Концентрация исходного вещества,
моль/л
0,20
0,08
0,03
Рассчитайте константу скорости.
Решение:
Проводим расчет значений констант скоростей при всех временах,
отличных от нуля по уравнению (6.8):
1
1
061,0
08,0
20,0
ln
15
1
минk
;
1
2
063,0
03,0
20,0
ln
30
1
минk
Равенство значений констант скоростей при разных значениях вре-
мени подтверждает то, что данная реакция является реакцией первого
порядка. Рассчитываем среднее значение константы скорости реакции:
1
062,0 минk
ср
.
Односторонние реакции второго порядка
Рассмотрим случай, когда в одном элементарном акте принимают
участие две одинаковые частицы или когда концентрации исходных
веществ равны между собой. Схематично такие реакции можно запи-
сать следующим образом:
продуктыA2
Выполняем аналогичные действия: записываем выражения для
скорости реакции по определению и по закону действующих масс и
приравниваем эти уравнения, получаем:
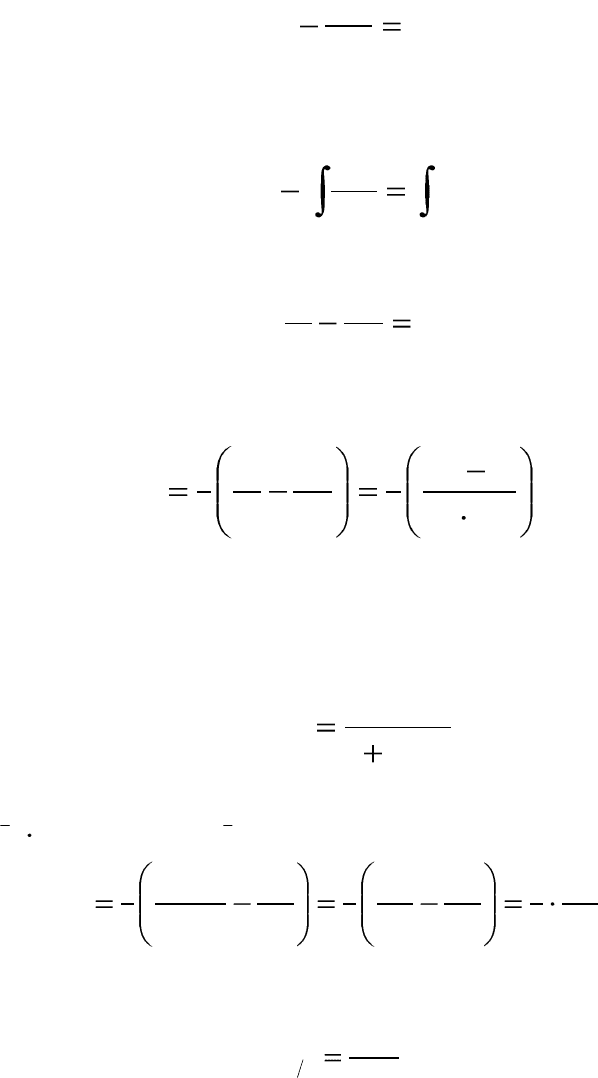
154
2
kC
dt
dC
Разделим переменные и проинтегрируем левую и правую части по-
лученного уравнения в пределах от С
0
до С и от 0 до t:
dtk
C
dC
tC
C 0
2
0
Получаем:
kt
CC
0
11
. (6.13)
Тогда выражение для константы скорости реакции второго по-
рядка имеет вид:
0
0
0
1111
CC
CC
tCCt
k
, (6.14)
где С
0
– начальная концентрация исходного вещества; С = С
0
– х
– концентрация исходного вещества к моменту времени t.
Кинетическое уравнение, описывающее зависимость концентрации
исходного вещества от времени будет иметь вид:
0
0
1 ktC
C
C
. (6.15)
Константа скорости реакции второго порядка имеет размерность:
11
ияконцентрацвремя
. Найдем время полупревращения:
00000
111211
2/
11
CtCCtCCt
k
. (6.16)
Выражение для расчета времени полупревращения реакций вто-
рого порядка будет иметь вид:
0
21
1
kC
t
. (6.17)
Из уравнения видно, что время полупревращения для реакций вто-
рого порядка обратно пропорционально начальной концентрации ис-
ходных веществ.
Константу скорости односторонней реакции второго порядка мож-
но найти графически. Для этого уравнение (6.13) приводят к линейному
виду:
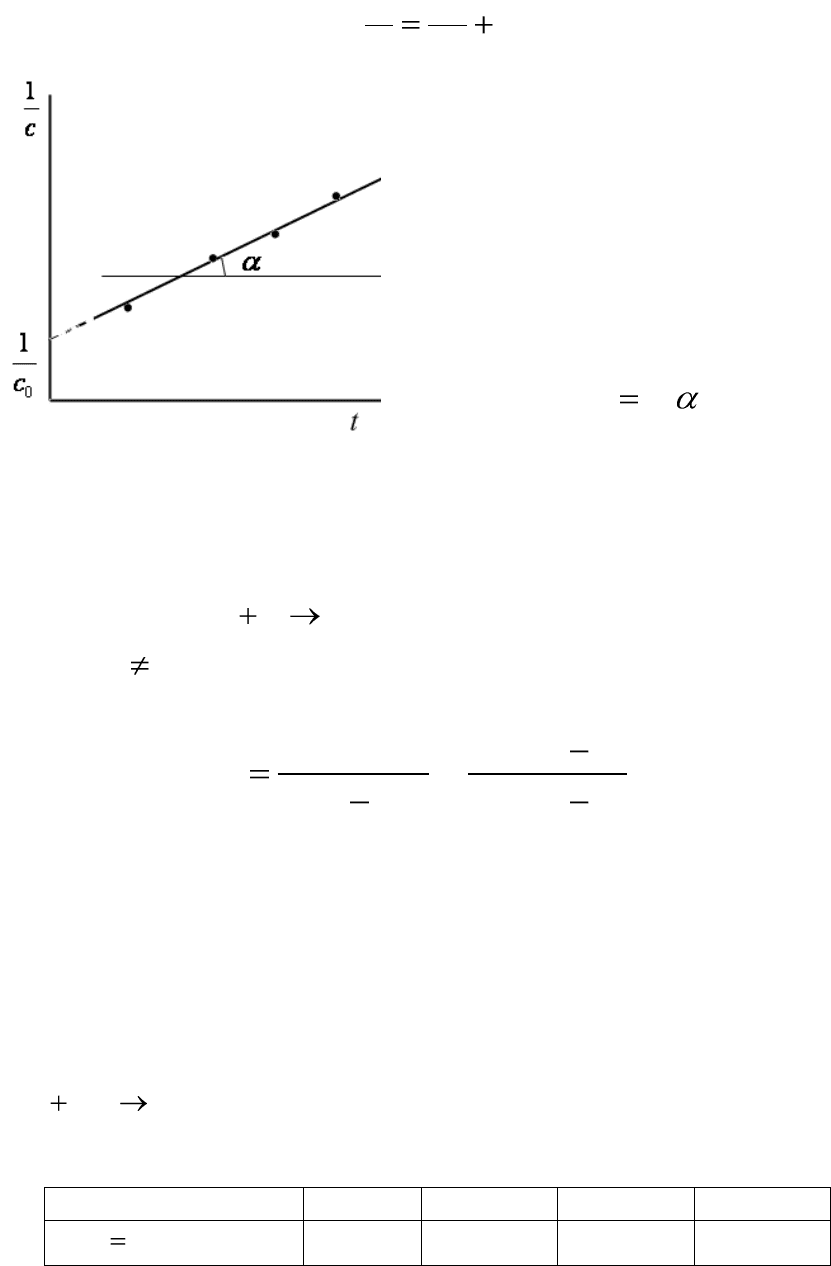
155
kt
CC
0
11
. (6.18)
Рис.6.3. Уравнение прямой для
расчета константы скорости одно-
сторонней реакции второго порядка
Полученное уравнение (6.18)
представляет собой уравнение
прямой линии, тангенс угла кото-
рой равен константе скорости
(рис.6.3):
tgk
. (6.19)
В случае, когда в одном элементарном акте принимают участие две
разные частицы
продуктыBA
, с разной начальной концентра-
цией (
00
BA
CC
), выражение для константы скорости реакции вто-
рого порядка имеет вид:
)(
)(
ln
)(
1
00
00
00
xCC
xCC
CCt
k
BA
AB
BA
, (6.20)
где
0
A
C
– начальная концентрация вещества А;
0
B
C
– начальная
концентрация вещества В; х – концентрация прореагировавших ве-
ществ А и В в момент времени t (вещества А и В реагируют в эквива-
лентных количествах).
Пример 6.3. Образование фосгена, протекающее по уравнению
22
COClClCO
, является реакцией второго порядка при одинако-
вых начальных концентрациях реагирующих веществ, изменение кон-
центрации которых приведено в таблице:
Время, мин
0
12
24
42
2
ClCO
CC
, моль/л
0,01873
0,01794
0,01734
0,01644
Рассчитайте константу скорости.

156
Решение: Проводим расчет значений констант скоростей при всех
временах, отличных от нуля по уравнению (6.14):
минмольлk /176,0
01873,0
1
01794,0
1
12
1
1
.
минмольлk /178,0
01873,0
1
01734,0
1
24
1
2
.
минмольлk /177,0
01873,0
1
01644,0
1
42
1
3
.
Равенство значений констант скоростей при разных значениях
времени подтверждает то, что данная реакция является реакцией второ-
го порядка. Рассчитываем среднее значение константы скорости реак-
ции:
минмольлk
ср
/177,0
.
Односторонние реакции третьего порядка
Такие реакции очень редки. Рассмотрим случай, когда в одном эле-
ментарном акте принимают участие три одинаковые частицы или когда
концентрации исходных веществ равны между собой. Схематично такие
реакции можно записать:
продуктыA3
.
Записываем выражения для скорости реакции по определению и по
закону действующих масс и приравниваем эти уравнения, получаем:
3
kC
dt
dc
.
Разделим переменные и проинтегрируем левую и правую части по-
лученного уравнения в пределах от С
0
до С и от 0 до t:
dtk
C
dC
tC
C 0
3
0
.
Получаем:
kt
C
C
2
0
2
2
1
2
1
. (6.21)
Выражение для константы скорости реакции третьего порядка
имеет вид:
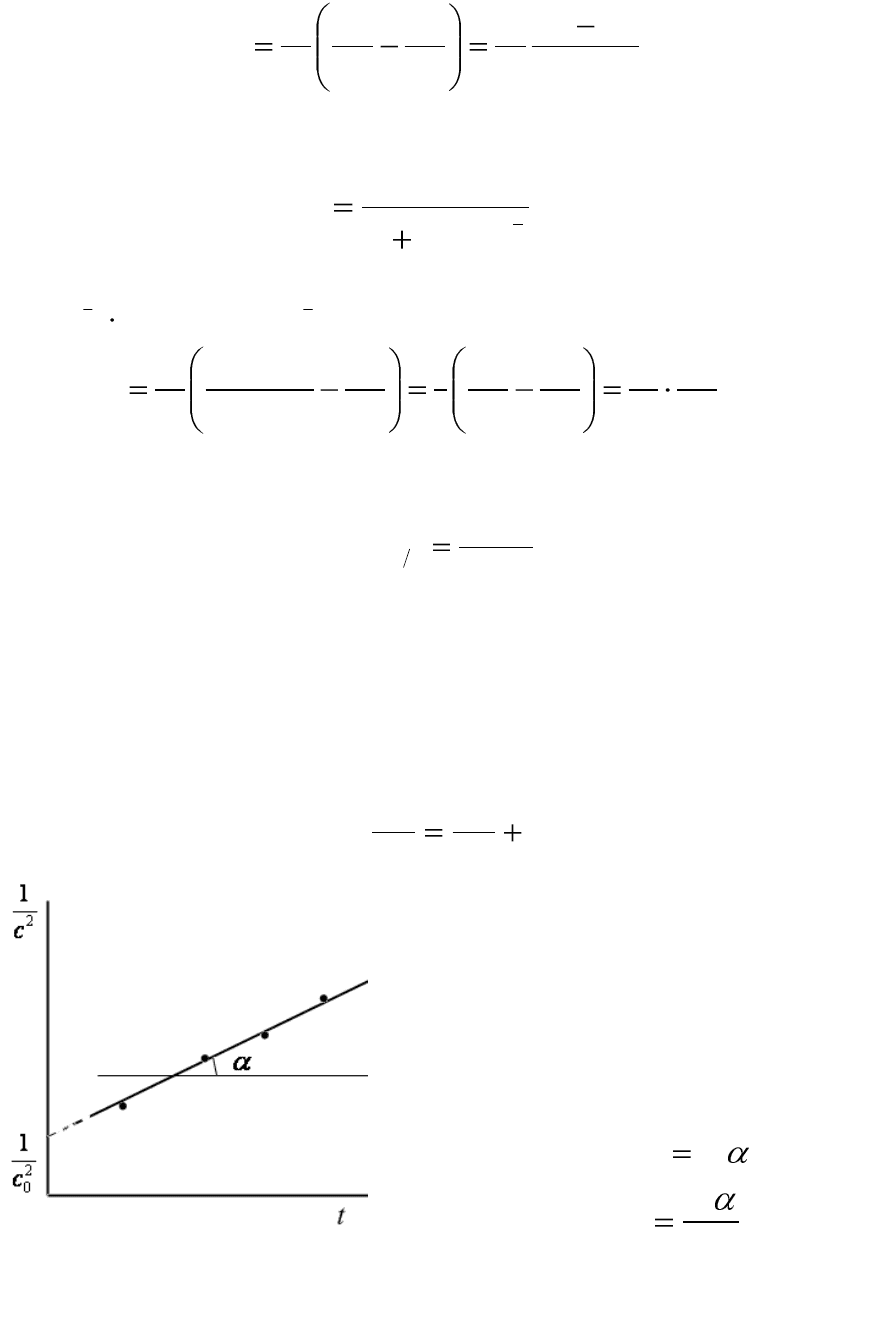
157
22
0
22
0
2
0
2
2
111
2
1
CC
CC
tCCt
k
. (6.22)
Кинетическое уравнение, описывающее зависимость концентрации
исходного вещества от времени будет иметь вид:
2
1
)21(
2
0
0
ktC
C
C
. (6.23)
Константа скорости реакции третьего порядка имеет размерность:
21
ияконцентрацвремя
. Найдем время полупревращения:
2
0
2
0
2
0
2
0
2
0
3
2
11411
)2/(
1
2
1
CtCCtCCt
k
. (6.24)
Отсюда выражение для расчета времени полупревращения реак-
ций третьего порядка будет иметь вид:
2
0
21
2
3
kC
t
. (6.25)
Из уравнения видно, что время полупревращения для реакций
третьего порядка обратно пропорционально начальной концентрации
исходных веществ во второй степени.
Константу скорости односторонней реакции третьего порядка мож-
но найти графически. Для этого уравнение (6.21) приводят к линейному
виду:
kt
CC
2
11
2
0
2
. (6.26)
Рис.6.4. Уравнение прямой для
расчета константы скорости односто-
ронней реакции третьего порядка
Полученное уравнение (6.26)
представляет собой уравнение
прямой линии, тангенс угла кото-
рой равен удвоенному значению
константы скорости (рис.6.4):
tgk2
;
2
tg
k
. (6.27)
158
Зависимость скорости реакции от температуры
Скорость большинства химических реакций сильно возрастает при
повышении температуры. При увеличении температуры возрастает
энергия сталкивающихся частиц и повышается вероятность того, что
при столкновении произойдет химическое превращение.
Правило Вант-Гоффа – повышение температуры на каждые 10
градусов увеличивает скорость реакции в 2 – 4 раза.
42
10
T
T
k
k
, (6.28)
где
T
k
и
10T
k
– константы скорости при температурах Т и Т+10;
– температурный коэффициент скорости реакции.
Это правило математически может быть записано и по-другому:
10
12
1
2
TT
T
T
k
k
. (6.29)
Правило Вант-Гоффа применимо только в узком интервале не
очень высоких температур, что обусловлено изменением самого темпе-
ратурного коэффициента с изменением температуры.
Более точная зависимость константы скорости реакции от темпера-
туры выражается полуэмпирическим уравнением Аррениуса:
RT
E
a
Aek
, (6.30)
где А – предэкспоненциальный множитель, который не зависит от
температуры, а определяется только видом реакции; Е
а
– энергия акти-
вации химической реакции.
Уравнение Аррениуса в дифференциальной форме имеет вид:
2
ln
RT
E
dT
kd
a
. (6.31)
Из уравнения (6.32) следует, что чем больше энергия активации,
тем быстрее растет скорость реакции с температурой.
Методы определения энергии активации
Энергия активации – избыточная энергия, которой должны обла-
дать частицы для вступления в химическую реакцию. Энергия актива-
ции является постоянной величиной для данной химической реакции и
практически не зависит от температуры.
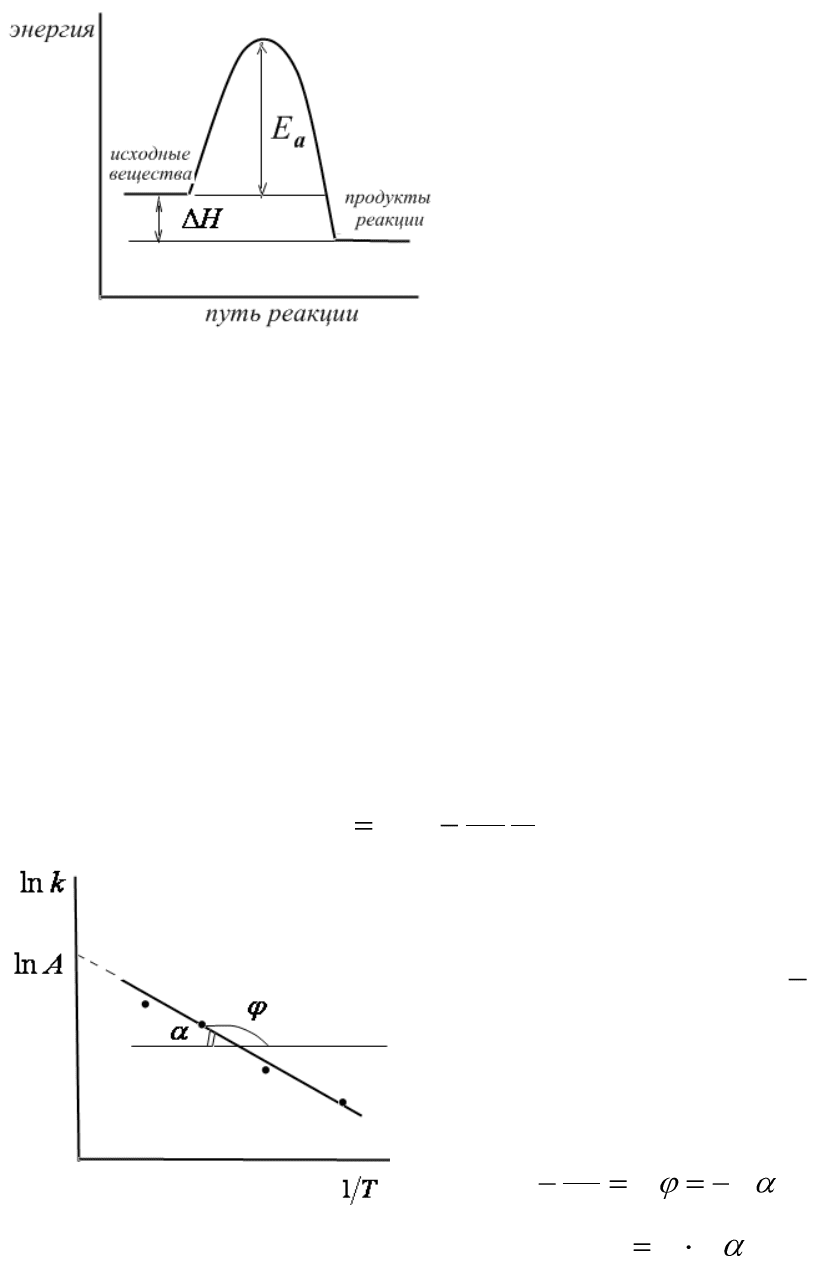
159
Рис.6.5. Энергетическая кривая:
ΔН – тепловой эффект химической
реакции, Е
а
– энергия активации.
Из рисунка (6.5) видно, что
на пути превращения исходных
веществ в продукты реакции мо-
лекулы (частицы) должны пре-
одолеть некоторый энергетиче-
ский барьер. Энергетический
барьер могут преодолеть не все
молекулы, а лишь те, которые об-
ладают достаточной энергией для
его преодоления (обладающие
достаточной энергией активации).
Такие молекулы называются ак-
тивными.
Чем больше активных молекул принимают участие в химической
реакции, тем больше скорость реакции. Увеличение скорости реакции
при повышении температуры обусловлено ростом доли активных моле-
кул и числа столкновений между ними.
Для определения величины энергии активации используют уравне-
ние Аррениуса в интегральной и дифференциальной формах. Расчет
энергии активации можно вести графическим и аналитическим спосо-
бом.
Графический способ:
Энергию активации графическим способом можно найти, если про-
логарифмировать уравнение Аррениуса (6.30):
TR
E
Ak
a
1
lnln
. (6.32)
Рис.6.6. Уравнение прямой для
расчета энергии активации по урав-
нению Аррениуса.
Полученное уравнение пред-
ставляет собой уравнение прямой
линии в координатах
Tk /1ln
,
тангенс угла которой равен отно-
шению энергии активации к уни-
версальной газовой постоянной
(рис.6.6):
tgtg
R
E
a
;
tgRE
a
. (6.33)
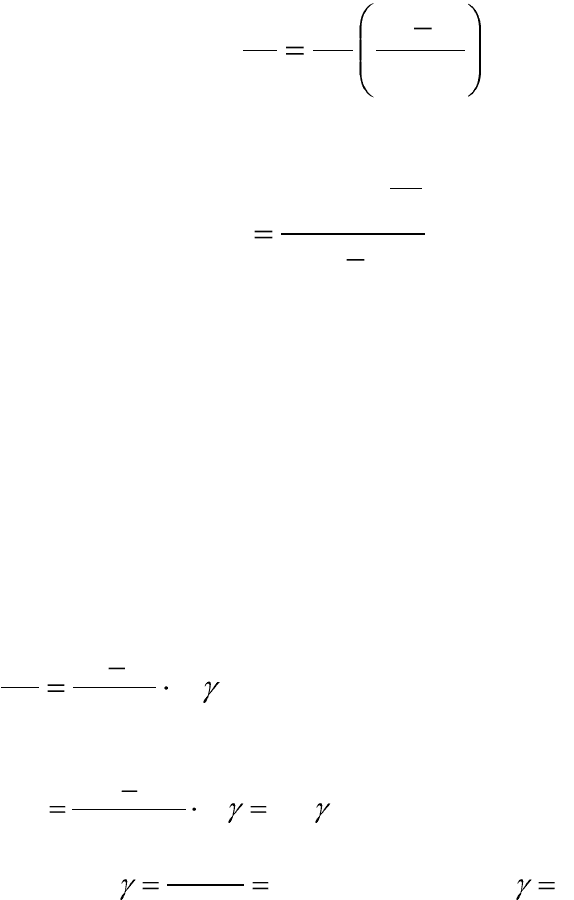
160
Аналитический способ:
Энергию активации химической реакции можно вычислить по зна-
чениям констант скоростей при двух различных температурах по урав-
нению:
12
12
1
2
ln
TT
TT
R
E
k
k
a
. (6.34)
Отсюда, уравнение для расчета энергии активации имеет вид:
12
1
2
21
ln
TT
k
k
TRT
E
a
. (6.35)
Теоретический вывод уравнения Аррениуса сделан для элементар-
ных реакций, но опыт показывает, что подавляющее большинство
сложных реакций также подчиняются этому уравнению.
Пример 6.4. Определите температурный коэффициент реакции
гидроциклизации циклопропанола, если известно, что при повышении
температуры от 750 К до 800 К скорость реакции увеличивается в 14,5
раз.
Решение:
Прологарифмируем это уравнение (6.29):
lg
10
lg
12
1
2
TT
k
k
T
T
.
Подставим числовые значения:
lg5lg
10
750800
5,14lg
Отсюда:
7,1;232,0
5
5,14lg
lg
.
Пример 6.5. Рассчитайте предэкспоненциальный множитель в
уравнении Аррениуса при 393 К, если при этой температуре константа
скорости реакции равна 4,02·10
-4
с
-1
, а при 413 К константа скорости со-
ставляет 19,83·10
-4
с
-1
.
Решение:
1. Рассчитаем энергию активации по уравнению (6.35):
