Михеева Е.В., Пикула Н.П. Физическая и коллоидная химия
Подождите немного. Документ загружается.


141
/
p
//
p
ЭДС такого элемента будет равна:
//
/
/
2
/
//
2
0
/
2
2
2
2
2
2
lg
2
lg
2
lg
2
H
H
H
H
0
HH
H
H
HH
p
p
b
p
a
b
E
p
a
b
EE
Пример 5.15. Рассчитайте при 298 К ЭДС элемента
(–)Pt, H
2
/ HCl
(aq)
/ АgCl, Аg, АgCl / НCl
(aq)
/ Н
2
, Pt (+)
/
a
= 0,01М
//
a
=0,1М
Средний коэффициент активности HCl в 0,01 М растворе равен 0,905, а
в 0,1 М – 0,88.
Решение:
Имеем концентрационный гальванический элемент без переноса. В
этом элементе ЭДС возникает за счет выравнивания активностей HCl.
ЭДС правого полуэлемента:
//0////0
/
lg2lglg
2
HCl
Cl
0
/AgCl,AgClHHH
прав
abEabEabEE
,
где
0
,/
0
/
0
2
AgAgClClHH
EEE
.
ЭДС левого полуэлемента:
/0//
,
lg2lglg
2
HCl
H
0
/HHCl
0
Ag/AgClCl
лев
abEabEabEE
,
где
0
,/
0
/
0
2
AgAgClClHH
EEE
.
Общая ЭДС гальванического элемента:
B
a
a
b
abEabEEEE
H Cl
H Cl
H ClH Clлевправ
114,0
95,001,0
88,01,0
lg059,02lg2
lg2lg2
/
//
/0//0
Концентрационные цепи c переносом ионов
Концентрационными цепями с переносом ионов называются галь-
ванические элементы с одинаковыми электродами и двумя растворами
одного и того же электролита разной концентрации, между которыми
имеется непосредственная граница соприкосновения в виде пористой
диафрагмы, замедляющей перемешивание раствора. На границе сопри-
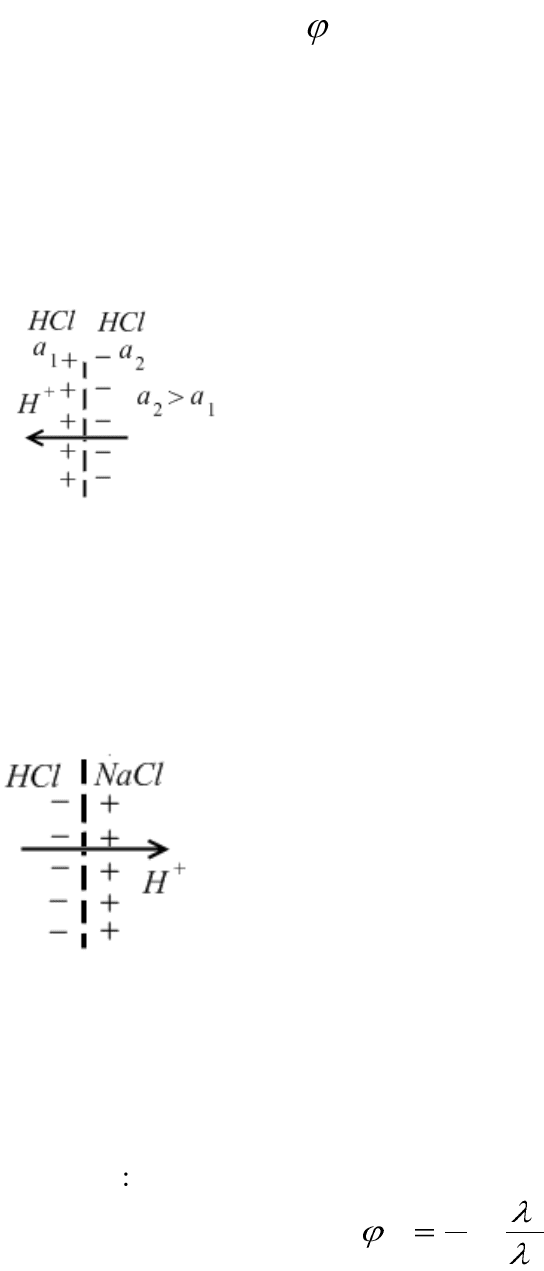
142
косновения растворов возникает дополнительный, так называемый,
диффузионный потенциал
д
, влияющий на величину ЭДС гальваниче-
ского элемента.
Причиной возникновения диффузионного потенциала является
различная скорость движения ионов в растворах.
Диффузионный потенциал может возникать: а) на границе раздела
двух растворов одного и того же электролита разной концентрации; б)
на границе раздела разных электролитов одинаковой концентрации с
различной подвижностью ионов.
а) если растворы одинаковы по природе, но
различны по концентрации, то катионы и анионы
будут перемещаться из области большей концен-
трации в область меньшей концентрации. Так как
подвижность ионов Н
+
много больше подвижно-
сти ионов Cl
¯
, то через некоторое время из кон-
центрированного раствора в разбавленный перей-
дет больше ионов Н
+
чем Cl
¯
. В результате этого
граница раздела получает с одной стороны положительный заряд. Обу-
словленный избытком ионов Н
+
, а с другой стороны – отрицательный
заряд, обусловленный избытком Cl
¯
. Образуется двойной электриче-
ский слой и соответствующий скачок потенциала, то есть диффузион-
ный потенциал.
б) если растворы электролитов одинаковы
по концентрации, но разные по своей природе, то
диффузионный потенциал возникает за счет раз-
ной подвижности ионов, например, Н
+
и Na
+
.
Ионы Н
+
обладают более высокой подвижностью
по сравнению с ионами Na
+
и будут быстрее пе-
реходить в раствор NaCl, чем ионы Na
+
– в рас-
твор HCl. В результате этого поверхность со
стороны раствора HCl зарядится отрицательно, а со стороны NaCl –
положительно. Образуется двойной электрический слой и соответст-
вующий скачок потенциала (диффузионный потенциал).
Для расчета диффузионного потенциала, возникающего на границе
двух различных растворов одинаковой концентрации, пользуются
уравнением
2
1
lg
z
b
Ä
, (5.39)

143
где
1
и
2
– подвижности одного и другого электролита.
Диффузионный потенциал всегда рассчитывается как величина по-
ложительная. На самом деле он может быть величиной как положи-
тельной, так и отрицательной.
ДД
EE
. (5.40)
Выбор знака ―+‖ или ―–‖ перед диффузионным потенциалом зави-
сит от взаимного направления электрических полей между электродами
элемента и направления электрических полей на границе двух раство-
ров. Если направления обоих электрических полей совпадают, то диф-
фузионный потенциал (абсолютная величина) прибавляется к ЭДС, ес-
ли направления электрических полей не совпадают, то вычитается.
Значение ЭДС концентрационного элемента с переносом ионов за-
висит от типов электродов, составляющих данный элемент.
1. Концентрационный элемент состоит из электродов, обратимых
относительно катиона. Например, для гальванического элемента:
(–) Сu / CuSO
4
¦ CuSO
4
/ Cu (+)
/
a
//
a
ЭДС с учетом диффузионного потенциала рассчитывается по урав-
нению:
/
//
д
lg2Е
a
a
z
b
t
, (
//
a
/
a
), (5.41)
где Е
Д
– ЭДС элемента с учѐтом диффузионного потенциала;
t
-
– число переноса аниона электролита; z – число электронов, участ-
вующих в электрохимической реакции.
Диффузионный потенциал (φ
Д
) в этом случае вычисляется по
формуле:
/
//
lg
z
1)(2
a
ab
t
Д
, (
//
a
/
a
), (5.42)
2. Концентрационный элемент состоит из электродов, обратимых
относительно аниона:
(–) Ag, AgCl / KCl ¦ KCl / AgCl, Ag (+)
/
a
//
a
В этом случае ЭДС с учетом диффузионного потенциала определя-
ется по соотношению:

144
//
/
+д
lg
z
2
a
ab
tE
, (
/
a
//
a
), (5.43)
где Е
Д
– ЭДС элемента с учѐтом диффузионного потенциала;
t
+
– число переноса катиона электролита; z – число электронов, участ-
вующих в электрохимической реакции.
Диффузионный потенциал (φ
Д
) в этом случае вычисляется по
формуле:
//
/
lg
z
1)(2
a
ab
t
Д
, (
/
a
//
a
). (5.44)
Величина диффузионного потенциала невелика, и в большинстве
случаев не превышает сотых долей вольта, однако он снижает точность
физико-химических измерений. Для устранения диффузионного потен-
циала используют солевой мостик (электролитический ключ), пред-
ставляющий собой U-образную трубку, содержащую концентрирован-
ный раствор электролита, катионы и анионы которого имеют приблизи-
тельно одинаковую подвижность (KCl, KNO
3
, NH
4
Cl, NH
4
NO
3
).
Пример 5.16. Вычислите при 291 К ЭДС цепи
(–) Pt, H
2
/ КОН
(aq)
¦ KCl
(aq)
¦ HCl
(aq)
/ Н
2
, Pt (+)
1Д
2Д
с учетом диффузионных потенциалов, возникающих на границах со-
прикасающихся растворов одинаковых концентраций, равных 0,001 М.
Средние коэффициенты активности для НС1, КС1, КОН примите рав-
ными единице. Ионное произведение воды равно 1,2·10
–14
. Подвижно-
сти ионов водорода, хлорид-ионов, ионов калия, гидроксид-ионов при
291 К соответственно равны 315; 65,5; 64,9 и 174 См·см
2
.
Решение.
1. Этот элемент относится к концентрационным элементам с пере-
носом ионов. В растворе КОН имеется некоторая концентрация (актив-
ность) Н
+
, обусловленная ионным произведением воды:
w
H OH
a a K
.
Активность ионов водорода в растворе гидроксида калия выразим
из ионного произведения воды:
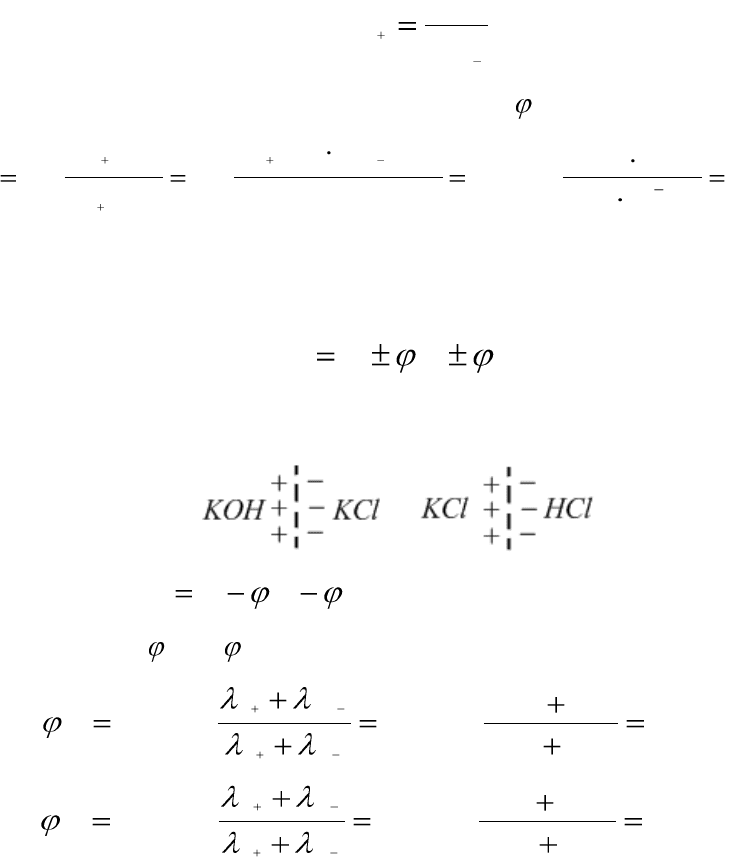
145
w
H
OH
K
a
a
.
2. Рассчитываем ЭДС элемента без учета
Ä
:
B
K
aa
b
a
a
bE
W
KOHOHH ClH
KOHH
HClH
45 9,0
102,1
00 1,0001,0
lg059,0lglg
14
)()(
)(
)(
3. ЭДС этого элемента с учетом диффузионного потенциала можно
рассчитать по выражению:
21 ДДД
EE
4. Электрические поля на границах растворов противоположны элек-
трическому полю между электродами:
Поэтому
21 ДДД
EE
.
Вычислим
1Ä
и
2Ä
:
B
ClK
OHK
Д
015,0
5,659,64
1749,64
lg059,0lg059,0
1
.
B
ClK
ClH
Д
027,0
5,659,64
5,65315
lg059,0lg059,0
1
.
Общая ЭДС цепи равна:
Е = 0,459 – 0,015 – 0,027 = 0,417 В.
Вопросы для самоконтроля
1. В чем отличие между химическими и концентрационными галь-
ваническими элементами?
2. Что вносит основной вклад в величину потенциала по уравнению
Нернста?
3. Каким образом проводится выбор знака электрода при написании
гальванического элемента?
4. Приведите способы устранения диффузионного потенциала.
146
6. ХИМИЧЕСКАЯ КИНЕТИКА
Законы химической термодинамики позволяют определить направ-
ление и предел протекания возможного при данных условиях процесса,
а также его энергетический эффект. Однако термодинамика не может
ответить на вопросы о том, как осуществляется данный процесс и с ка-
кой скоростью. Эти вопросы – механизм и скорость химической реак-
ции – являются предметом химической кинетики.
Основные понятия химической кинетики
Химическая кинетика – наука о скорости химических реакций, а
также о механизме химических превращений.
Химическая реакция состоит в превращении одного или несколь-
ких химических веществ, называемых исходными веществами, в одно
или несколько других химических веществ, называемых продуктами
реакции. Химические превращения, происходящие в ходе реакции,
представляют собой очень сложный процесс, при котором изменяется
природа отдельных частиц и их межмолекулярные связи. В большинст-
ве случаев химический процесс происходит не путем прямого превра-
щения исходных веществ в продукты реакции, а состоит из нескольких
стадий. Каждую из этих стадий можно рассматривать как самостоятель-
ную химическую реакцию со своими исходными веществами и продук-
тами. Такую стадию называют элементарной.
Элементарная стадия является наиболее простой составной ча-
стью сложного химического процесса и представляет собой совокуп-
ность большого числа однотипных элементарных актов непосредствен-
ного превращения одной или взаимодействия нескольких частиц. Эле-
ментарные стадии химического превращения могут быть весьма разно-
образны. Это может быть внутримолекулярная перегруппировка какой-
либо одной молекулы, распад молекулы на несколько частиц, или взаи-
модействие двух и более частиц и др.
Совокупность и последовательность элементарных стадий, из кото-
рых складывается реакция, называется механизмом (схемой) химиче-
ской реакции.
Скорость химической реакции
Важнейшей количественной кинетической характеристикой хими-
ческой реакции является ее скорость.
147
Скорость химической реакции (ω) – количество вещества (n),
прореагировавшего за единицу времени (t) в единице реакционного
пространства (R):
dt
dn
R
1
. (6.1)
Если реакция гомогенная, то реакционным пространством будет
являться объем; если реакция гетерогенная и протекает на границе раз-
дела фаз, то реакционным пространством будет являться поверхность.
Для реакций, проходящих в объеме (V), выражение для скорости
реакции имеет вид:
dt
dC
dt
dn
V
1
, (6.2)
где С – концентрация.
Скорость реакции величина всегда положительная.
Скорость химической реакции по i-му компоненту (ω
i
) – изме-
нение концентрации i-го компонента в единицу времени:
dt
dC
i
i
. (6.3)
Скорость реакции по компоненту может принимать как положи-
тельные, так и отрицательные значения, в зависимости от того является
ли данный компонент исходным веществом или продуктом реакции.
Если в ходе реакции компонент образуется (продукт реакции), то
0dtdc
i
, если же в ходе реакции компонент расходуется (исходное
вещество), то
0dtdc
i
.
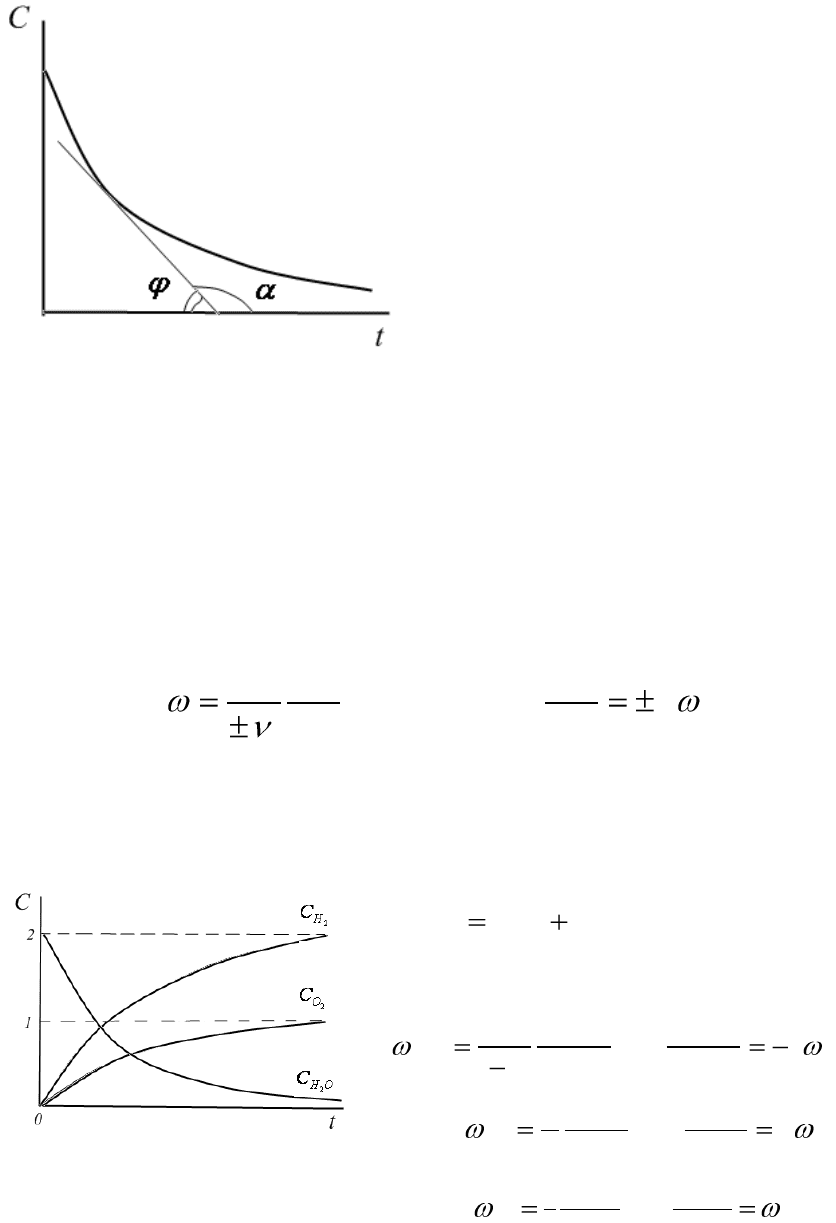
Графическое изображение зависимости концентрации реагирую-
щих веществ от времени показывает кинетическая кривая. В каждый
момент времени скорость реакции равна тангенсу угла наклона кинети-
ческой кривой в рассматриваемой точке:
tgtg
dt
dC
. (6.4)
148
Рис.6.1. Зависимость концентрации
исходного вещества от времени
(кинетическая кривая)
Угол наклона касательной к кине-
тической кривой показывает, на-
сколько быстро протекает реакция в
данный момент времени. Чем круче
угол наклона касательной, тем быст-
рее протекает реакция. Так как угол
наклона касательной к кинетической
кривой, соответствующей начальной
скорости реакции, максимален, то
скорость реакции в начальный мо-
мент времени максимальна. Посте-
пенно, по мере протекания реакции,
скорость реакции уменьшается
(уменьшается угол наклона каса-
тельной).
Когда реакция заканчивается, то кинетическая кривая становится
горизонтальной и скорость реакции становится равной нулю. Таким об-
разом, кинетическая кривая позволяет вычислить скорость реакции в
любой момент времени.
Скорость химической реакции и скорость химической реакции по
компоненту связаны между собой соотношением:
i
ii
i
v
dt
dC
dt
dC
,
1
, (6.5)
где
i
v
– стехиометрический коэффициент перед i-ым компонентом
в уравнении реакции: знак «+» для продукта реакции (компонент обра-
зуется), знак «–» для исходного вещества (компонент расходуется).
Рис.6.1. Зависимость концен-
трации реагирующих веществ от
времени (кинетические кривые)
Например, для реакции
222
22 OHOH
выражения для ско-
ростей реакции по компонентам запи-
шутся в виде:
OH
OHOH
OH
dt
dC
dt
dC
2
22
2
2,
)2(
1
;
2
22
2
2,
2
1
H
HH
H
dt
dC
dt
dC
;
2
22
2
,
1
1
O
OO
O
dt
dC
dt
dC
.
149
Закон действующих масс
Зависимость скорости реакции от концентрации реагирующих ве-
ществ описывается основным постулатом химической кинетики – зако-
ном действующих масс (Гульдберг, Вааге, 1867).
Закон действующих масс: скорость химической реакции пропор-
циональна произведению концентраций реагирующих веществ в степе-
нях, равных их стехиометрическим коэффициентам.
Для реакции
dDcCbBaA
, протекающей слева направо, за-
кон действующих масс запишется в виде:
b
B
a
A
CkC
, (6.6)
где k – константа скорости реакции.
Физический смысл константы скорости: константа скорости ре-
акции численно равна скорости реакции при концентрациях реагирую-
щих веществ, равных единице.
Показатели степеней a и b называют порядком реакции по компо-
нентам А и В соответственно. Сумму порядков по всем компонентам
называют общим порядком реакции или просто порядком реакции.
Порядок реакции (n) – сумма показателей степеней при концен-
трациях в уравнении для скорости химической реакции: n=a+b.
Порядок реакции может быть любым числом: целым, дробным и
даже отрицательным. Для простых элементарных реакций порядок ре-
акции совпадает со стехиометрическими коэффициентами и с молеку-
лярностью.
Молекулярность – число частиц, одновременным взаимодействи-
ем которых, осуществляется элементарный акт химической реакции.
Различают: моно-, би-, редко тримолекулярные реакции. Четырехмоле-
кулярные реакции не встречаются вообще, так как не возможно одно-
временное взаимодействие четырех частиц.
Формальная кинетика
Большинство реакций являются сложными, то есть проходят через
несколько элементарных стадий. Для моделирования кинетических
процессов вводят понятие формально простых реакций.
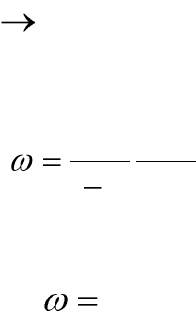
150
Формально простые реакции – это сложные реакции с образова-
нием очень неустойчивых промежуточных частиц, поэтому такие реак-
ции условно считают простыми, то есть проходящими через одну эле-
ментарную стадию.
Формальная кинетика – раздел физической химии, изучающий
формально простые реакции.
Формальная кинетика позволяет для формально простых реакций:
по известным значениям кинетических параметров (константа скорости)
построить кинетическую кривую, то есть найти зависимость изменения
концентрации реагирующих веществ от времени (прямая кинетическая
задача); по экспериментальным кинетическим данным (кинетическая
кривая) найти кинетические параметры – значения констант скоростей,
порядок реакции (обратная кинетическая задача).
Решение кинетических задач методами
формальной кинетики
Для всех реакций, относящихся к определенному порядку, выведе-
ны основные кинетические характеристики, позволяющие по опытным
данным рассчитывать: константу скорости химической реакции; время
полупревращения (период полураспада), изменение концентрации реа-
гирующих веществ во времени и др. Рассмотрим кратко расчет основ-
ных кинетических характеристик для односторонних формально про-
стых реакций разных порядков.
Односторонние реакции первого порядка
К таким реакциям относятся реакции, в которых превращение пре-
терпевает одна молекула: реакции разложения, внутримолекулярных
превращений, процессы радиоактивного распада и др. Схематично та-
кие реакции можно записать:
A продукты
Скорость реакции связана со скоростью изменения концентрации
вещества А соотношением:
dt
dC
A
)1(
1
.
По закону действующих масс скорость односторонней реакции
первого порядка равна:
A
kC
.
