Михеева Е.В., Пикула Н.П. Физическая и коллоидная химия
Подождите немного. Документ загружается.

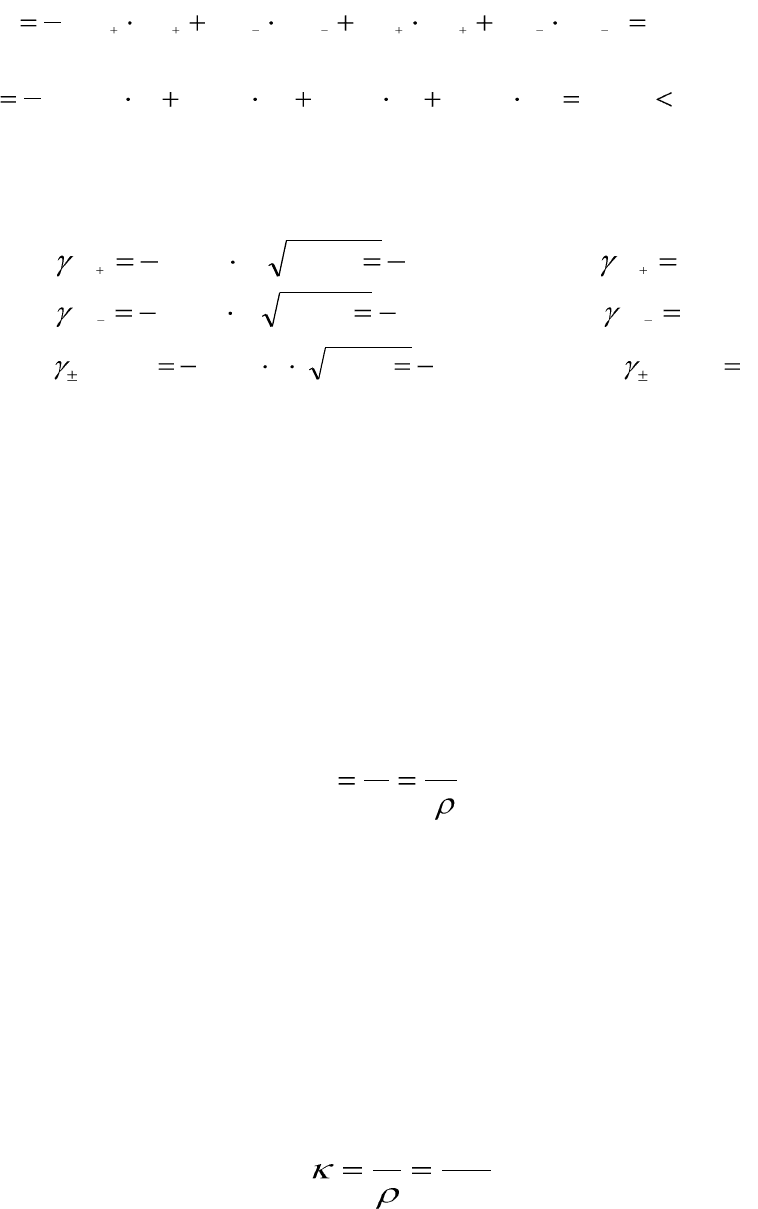
111
02,0015,0)1003,03001,02003,01006,0(
2
1
)(
2
1
2222
2222
33
332
4
2
4
NONOAlAlSOSONaNa
zczczczcI
3. Вычисляем индивидуальные коэффициенты активности ионов
Аl
3+
и NO
3
¯
и средний ионный коэффициент активности нитрата алю-
миния:
1.
27,0;56,0015,03509,0lg
33
2
AlAl
;
2.
87,0;062,0015,01509,0lg
33
2
NONO
;
3.
65,0;187,0015,013509,0lg
3333
)()(, NOAlNOAl
.
С увеличением концентрации раствора зависимость γ
±
ионной силы
раствора становится более сложной, так как усложняются межионные
взаимодействия и проявляются индивидуальные свойства электролитов.
Электрическая проводимость растворов
электролитов
Электрическая проводимость (L) – это способность вещества
проводить электрический ток под действием внешнего электрического
поля. По физическому смыслу эта величина обратна сопротивлению(R):
l
S
R
L
1
, (5.19)
где ρ – удельное сопротивление, Ом/м; S – поперечное сечение
проводника, м
2
; l – длина проводника, м.
Различают удельную и молярную электрические проводимости
растворов электролитов.
Удельная электрическая проводимость (κ) – электрическая про-
водимость объема раствора, заключенного между двумя параллельными
электродами площадью 1 м
2
, расположенными на расстоянии 1 м друг
от друга. Удельная электрическая проводимость является величиной,
обратной удельному сопротивлению.
RS
l1
. (5.20)
Единицей измерения удельной электрической проводимости:
Ом
-1
м
-1
=См/м (См – сименс).
112
В электрохимии часто пользуются традиционным определением
удельной электрической проводимости: это электрическая проводи-
мость столбика вещества длиной 1 см и с сечением 1 см
2
, при этом раз-
мерность Ом
-1
см
-1
=См/см.
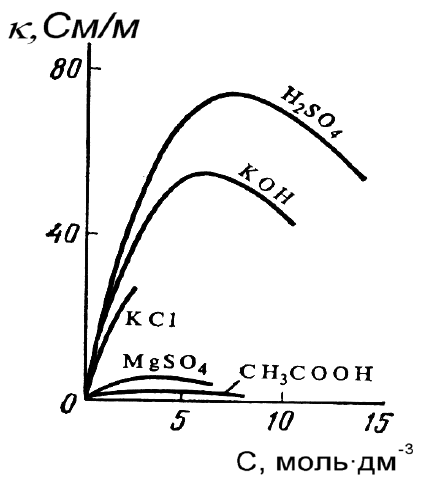
Рис. 5.1. Зависимость удельной
электрической проводимости силь-
ных и слабых электролитов от кон-
центрации раствора.
Удельная электрическая про-
водимость электролитов определя-
ется количеством и зарядом ионов,
переносящих электричество, а
также скоростью их движения в
электрическом поле.
График зависимости κ от кон-
центрации раствора для сильных
электролитов представляет собой
кривую с четко выраженным мак-
симумом, а для слабых – этот мак-
симум в значительной степени
размыт и практически не проявля-
ется (рис. 5.1).
В области малых концентра-
ций растворов сильных и слабых
электролитов рост электрической
проводимости обусловлен увели-
чением количества ионов – пере-
носчиков электричества.
При увеличении концентрации растет плотность раствора, что сни-
жает скорость движения ионов, при этом у слабых электролитов замет-
но снижается степень диссоциации; поэтому κ для умеренно слабых
электролитов начинает уменьшаться в области значительно более раз-
бавленных растворов и роста электропроводности практически не на-
блюдается, а максимум на кривой получается очень пологим.
Повышение температуры на 1 К увеличивает удельную электро-
проводность на 2–2,5 % для сильных электролитов за счет понижения
вязкости раствора и уплотнения гидратированных ионов, а для раство-
ров слабых электролитов – за счет увеличения степени диссоциации в
случае эндотермической реакции растворения электролита.
На величину удельной электрической проводимости, кроме пере-
численных факторов, влияет валентность (заряд) иона: чем больше за-
ряд иона, тем большее количество электричества он переносит.
Молярная электрическая проводимость (λ) – электрическая про-
водимость объема раствора электролита, содержащего 1 моль-
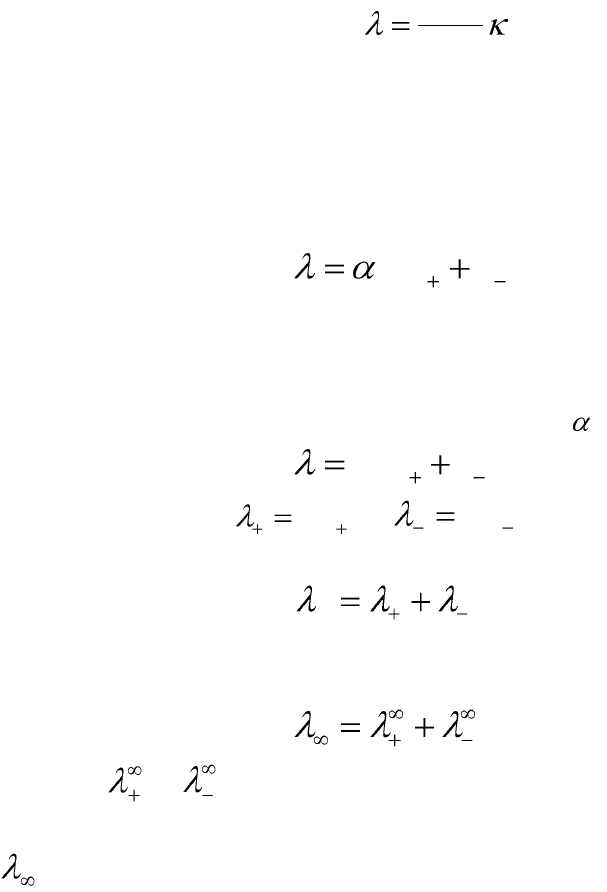
113
эквивалент растворенного вещества, находящегося между двумя парал-
лельными электродами, расположенными на расстоянии 1 м друг от
друга. Единицей измерения молярной электрической проводимости яв-
ляется: См·м
2
/моль.
Удельная и молярная электрические проводимости связаны между
собой соотношением:
C
1000
, (5.21)
где С – молярная концентрация растворенного вещества, моль/л;
λ – молярная электрическая проводимость, См·м
2
/моль; κ – удельная
электрическая проводимость, См/м.
Зависимость λ от скорости движения для одно-одновалентных ио-
нов выражается уравнением:
)( uuF
, (5.22)
где u
+
и u
-
– абсолютные скорости движения положительных и от-
рицательных ионов соответственно, α – степень диссоциации электро-
лита, F – постоянная Фарадея.
Для сильных электролитов можно принять = 1, поэтому
)( uuF
. (5.23)
Произведения
Fu
и
Fu
называются подвижностя-
ми ионов:
. (5.24)
Для предельно разбавленных растворов (С→0, α→1) справедливо
равенство:
, (5.25)
где и – подвижности ионов при предельном (бесконечном)
разведении, являются специфическими величинами для ионов;
– электрическая проводимость гипотетического бесконечно разбав-
ленного раствора, характеризующегося полной диссоциацией электро-
лита и отсутствием сил электростатического взаимодействия между ио-
нами.
Уравнение (5.25) справедливо как для сильных, так и для слабых
электролитов и называется законом независимого движения ионов
Кольрауша (законом аддитивности электрической проводимости). Со-
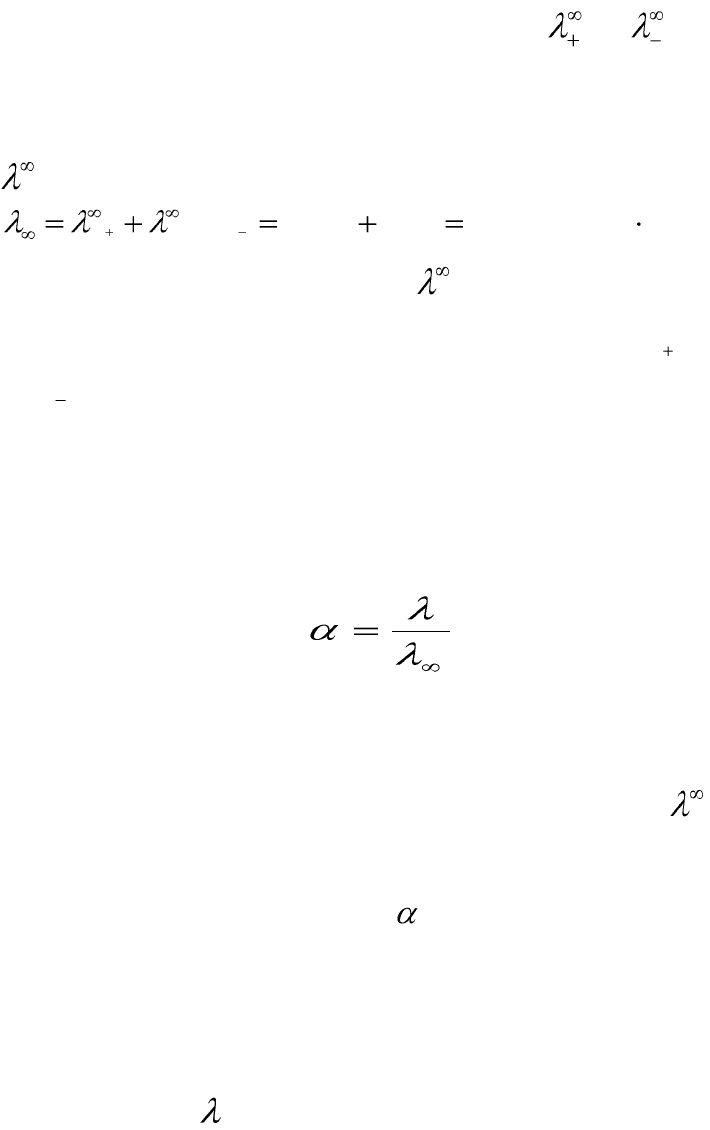
114
гласно закону Кольрауша, молярная электрическая проводимость при
предельном разведении равна сумме подвижностей ионов при предель-
ном разведении.
Численные значения подвижностей ионов и в настоящее
время оценены практически для всех ионов и приводятся в справочни-
ках. Например, пользуясь справочными данными, молярную электриче-
скую проводимость предельно разбавленного раствора уксусной кисло-
ты можно определить:
мольсмCм
COOCHH
/7,3909,408,349
2
3
Сравнение численных значений для различных ионов показы-
вает, что аномально высокими величинами электрических проводимо-
стей в водном растворе обладают ионы гидроксония
ОН
3
и гидрокси-
ла
ОН
. Это объясняется эстафетным механизмом перемещения
указанных ионов в растворе. Поэтому растворы кислот и щелочей по
сравнению с растворами солей при одинаковых концентрациях облада-
ют большей электрической проводимостью.
В разбавленных растворах слабых электролитов электрическое
взаимодействие между ионами мало, поэтому:
. (5.26)
Из выражения (5.26) следует, что степень диссоциации раствора
слабого электролита при изменении концентрации можно определить,
используя экспериментальные данные значений молярной электриче-
ской проводимости его разбавленных растворов. Так как для элек-
тролита постоянна, то изменение электрической проводимости разбав-
ленного раствора слабого электролита при изменении его концентрации
определяется только зависимостью от концентрации раствора.
В растворах сильных электролитов изменение молярной электриче-
ской проводимости с концентрацией обусловлено влиянием электроста-
тического взаимодействия ионов на скорость их движения.
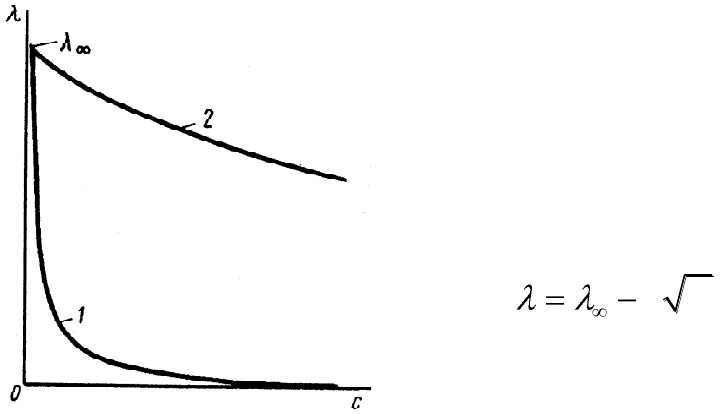
График зависимости молярной электрической проводимости от
концентрации раствора для слабых электролитов выражается более кру-
тым уменьшением при увеличении концентрации, чем кривая этой
же зависимости для сильных электролитов (рис.5.2).
115
Рис.5.2. Зависимость моляр-
ной электрической проводимости
растворов слабых (1) и сильных (2)
электролитов от их концентрации.
Зависимость молярной прово-
димости раствора от концентрации
сильных электролитов изучалась
многими исследователями. Наибо-
лее известно эмпирическое уравне-
ние Кольрауша для разбавленных
растворов, называемое законом
квадратного корня:
hC
, (5.27)
где h – эмпирический коэф-
фициент.
Эта зависимость подтверждена
многочисленными экспериментами
и теоретически обоснована в тео-
рии Дебая — Хюккеля — Онзагера.
По этой теории уменьшение молярной электрической проводимо-
сти разбавленных растворов сильных электролитов при увеличении
концентрации электролита объясняется уменьшением скорости движе-
ния ионов за счет электростатического взаимодействия ионов, окружен-
ных их ионными атмосферами, при движении таких ионов в электриче-
ском поле.
Кондуктометрия
Кондуктометрия – метод исследования, основанный на измерении
электрической проводимости растворов электролитов. Этот метод дос-
таточно прост, точен, позволяет решить ряд важных научно-
исследовательских и производственных задач. Измеряя электрическую
проводимость растворов, определяют основность органических кислот,
растворимость и произведение растворимости малорастворимых соеди-
нений, константу и степень диссоциации слабых электролитов, степень
минерализации почв, вод и грунтов. Широко используется кондукто-
метрическое титрование различных (особенно мутных) растворов.
Экспериментальное определение электрической проводимости рас-
твора электролита основано на измерении сопротивления раствора при
прохождении электрического тока методом компенсации. Для этого ис-
пользуется мостовая схема (рис.5.3):
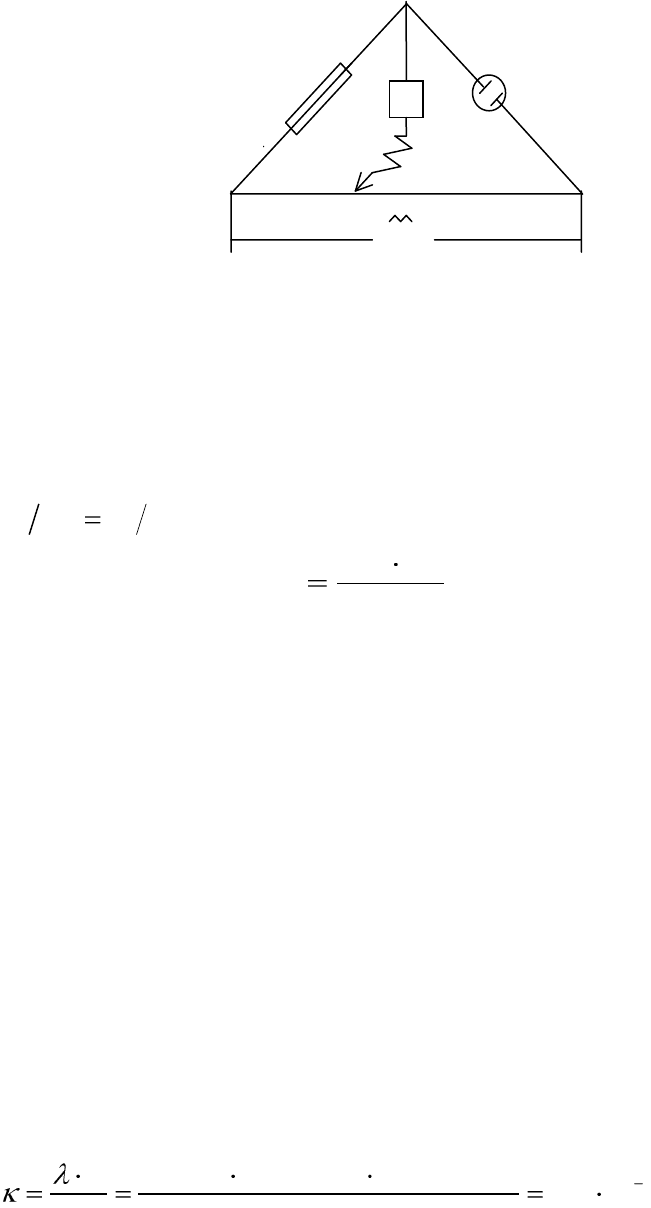
116
Рис.5.3. Схема установки для измерения электрического сопротивления
раствора: АВ – реохорд с фиксированными значениями сопротивлений в различных
положениях скользящего контакта С; Rм – магазин сопротивлений; Rx – сосуд с ис-
следуемым раствором, сопротивление которого следует определить; Г – нуль-
инструмент (гальванометр или осциллограф);
U
~
– генератор тока высокой частоты.
Перемещая контакт С по реохорду АВ, добиваются отсутствия тока
или его минимума в цепи CD. При этом справедливо соотноше-
ние:
12МХ
R R R R
, отсюда:
2
1
М
X
RR
R
R
. (5.28)
Переменный ток высокой частоты (в схеме измерения) использует-
ся для того, чтобы избежать последствий электролиза на электродах в
сосуде с исследуемым раствором и для уменьшения емкостного сопро-
тивления.
Пример 5.3. Две никелевые пластины, площадью по 4 см
2
каждая,
расположены параллельно друг другу на расстоянии 11 см. Пространст-
во между ними заполнено раствором 0,34 М NiSO
4
. Молярная электри-
ческая проводимость этого раствора равна 98,7 См·см
2
/моль. Какое пе-
ременное напряжение должно быть приложено к пластинам, чтобы сила
тока была равна 0,07 А?
Решение:
1. Для расчета сопротивления раствора рассчитаем удельную элек-
трическую проводимость из значений молярной электрической прово-
димости:
cмCм
лмольмольcмCм
/10335
1000
/34,0/7,98
1000
C
4
2
.
R
2
R
1
R
м
R
x
A
B
D
Г
C
117
2. Рассчитаем сопротивление раствора:
Ом
смСмсм
см
S
l
R 1,82
/103354
11
42
.
3. Рассчитаем по закону Ома напряжение, приложенное к электро-
дам:
BОмАRIU 75,51,8207,0
.
Пример 5.4. Удельная электрическая проводимость 0,05 М рас-
твора роданида аммония равна 0,572·10
-2
См/см. Рассчитайте степень
диссоциации соли.
Решение:
1. Рассчитываем молярную электрическую проводимость по урав-
нению (5.21):
мольcмСм
C
/4,114
05,0
10572,010001000
2
2
.
2. По справочнику находим значения подвижностей ионов и рас-
считываем по уравнению (5.25):
мольcмСм
CNSNH
/9,1394,665,73
2
4
3. Степень диссоциации роданида аммония рассчитываем по урав-
нению (5.26):
%8282,0
9,139
4,114
Пример 5.5. Молярная электрическая проводимость 0,02 М рас-
твора уксусной кислоты равна 12,77 См·см
2
/моль. Вычислите константу
диссоциации и рН этого раствора.
Решение:
1. Согласно справочным данным при 25°С предельная молярная
электрическая проводимость уксусной кислоты составит:
мольсмСм
COOCHH
/7,3909,408,349
2
3
2. Рассчитаем степень диссоциации уксусной кислоты по уравне-
нию (5.26):
033,0
7,390
77,12
118
3. Рассчитаем константу диссоциации уксусной кислоты по уравне-
нию (5.2):
5
22
107,1
033,01
015,0033,0
1
С
К
4. Так как уксусная кислота является слабым электролитом, то кон-
центрация ионов водорода, полученных в результате электролитической
диссоциации кислоты, будет равна:
лмольCC
тык
H
/1095,4015,0033,0
4
5. Рассчитаем рН раствора уксусной кислоты:
3,31095,4lglg
4
H
CрH
Электролиз
Электролиз – процесс, в котором химические реакции идут под
действием электрического тока от внешнего источника, при этом элек-
трическая энергия превращается в химическую. Путем электролиза
можно осуществлять реакции, самопроизвольное протекание которых
невозможно.
Электролиз проводят в электролизерах (электрохимических ячей-
ках), состоящих из двух электродов, погруженных в раствор электроли-
та.
Отрицательно заряженный электрод, на котором происходит про-
цесс восстановления (присоединения электронов), называется катодом:
0
:)( MeezMeкатодеНа
z
.
Положительно заряженный электрод, на котором происходит про-
цесс окисления (отдача электронов), называется анодом:
z
MeezMeанодеНа
0
:)(
.
В результате электролиза на электродах происходит выделение ве-
щества из раствора электролита и изменение его состава возле поверх-
ности электродов. Химические превращения при электролизе зависят от
природы электролита и растворителя, материала электрода и присутст-
вия других веществ в растворе.
Правила записи реакций на электродах при электролизе
Для того, чтобы написать уравнение электрохимической реакции,
идущей на электроде, необходимо записать все теоретически возмож-
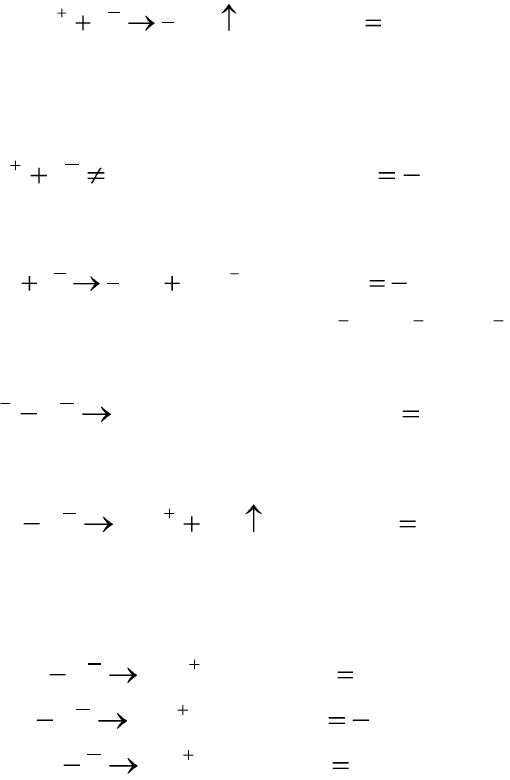
119
ные электрохимические реакции на данном электроде. Затем по величи-
не стандартного электродного потенциала в ряду напряжений следует
выбрать наиболее вероятную реакцию для данного электрода. Наиболее
вероятной будет та электрохимическая реакция, стандартный электрод-
ный потенциал которой (Е
0
) будет самым маленьким по абсолютному
значению.
Существуют эмпирические правила записи реакций на электродах
при электролизе:
1. Все кислоты на катоде из любого материала разряжаются с выде-
лением газообразного водорода:
BEHeH 0,1
0
2
2
1
2. Щелочные и щелочноземельные металлы (Li
+
, Na
+
, K
+
, Ca
2+
,
Ba
2+
, Mg
2+
) из водных растворов на катоде не выделяются из-за высо-
кого потенциала разложения:
BEидетнеNaeNa 7,2;,1
00
При электролизе водных растворов щелочных и щелочноземельных
металлов на катоде идет выделение газообразного водорода из воды:
BEOHHeOH 828,0,1
0
2
2
1
2
3. Все кислородсодержащие анионы (
3
43
2
4
,, PONOSO
) на аноде
не разряжаются из-за высокого потенциала разложения:
BEидетнеeSO 01,2,2
02
4
При электролизе кислородсодержащих анионов на аноде идет вы-
деление кислорода из воды:
BEOHeOH 229,1,442
0
22
4. Если анод изготовлен из растворимого металла (Сu
2+
, Zn
2+
,
Cd
2+
, Pb
2+
, Co
2+
, Sn
2+
, Ag
+
), то при электролизе происходит раство-
рение материала анода:
BECueCu 337,0,2
020
;
BEZneZn 763,0,2
020
;
BEAgeAg 799,0,
00
Пример 5.6. Электролиз водного раствора соляной кислоты на
инертных (Pt) электродах. Запишем все теоретически возможные элек-
трохимические реакции на электродах и выберем наиболее вероятную:
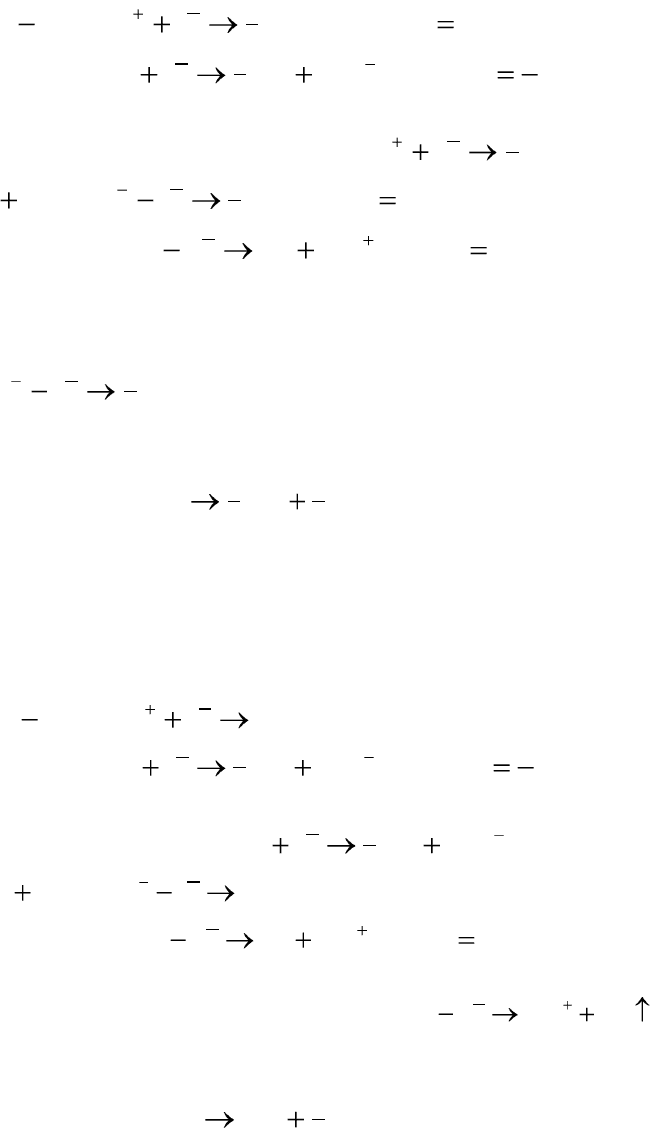
120
BEOHHeOH
BEHeHкатодеНа
828,0,1
0,1:)(
0
2
2
1
2
0
2
2
1
Так как потенциал выделения водорода из протонов меньше, чем из
молекул воды, то на катоде протекает реакция:
2
2
1
1 HeH
.
BEHOeOH
BECleClанодеНа
229,1,442
360,1,1:)(
0
22
0
2
2
1
Так как стандартные потенциалы выделения хлора и кислорода
близки, следовательно, возможны обе реакции в зависимости от мате-
риала анода. На платиновом аноде преимущественно идет реакция вы-
деления хлора:
2
2
1
1 CleCl
.
Суммарная реакция на электродах при электролизе водного раство-
ра соляной кислоты:
2
2
1
2
2
1
ClHHCl
.
Пример 5.7. Электролиз водного раствора нитрата натрия на
инертных (Pt) электродах. Запишем все теоретически возможные элек-
трохимические реакции на электродах и выберем наиболее вероятную:
BEOHHeOH
идетнеeNaкатодеНа
828,0,1
1:)(
0
2
2
1
2
Так как щелочные металлы на катоде не выделяются, идет выделе-
ние водорода из воды по реакции:
OHHeOH
2
2
1
2
1
.
BEHOeOH
идетнеeNOанодеНа
229,1,442
1:)(
0
22
3
Так как кислородсодержащие анионы на аноде не разряжаются,
идет выделение кислорода из воды по реакции:
22
442 OHeOH
.
Суммарная реакция на электродах при электролизе водного раство-
ра нитрата натрия – электролиз воды:
2
2
1
22
OHOH
.
Пример 5.8. Электролиз водного раствора хлорида меди на мед-
ных электродах. Запишем все теоретически возможные электрохимиче-
ские реакции на электродах и выберем наиболее вероятную:
