Михеева Е.В., Пикула Н.П. Физическая и коллоидная химия
Подождите немного. Документ загружается.

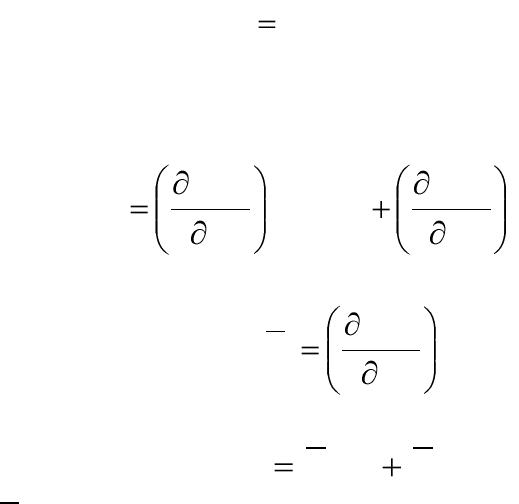
91
для выражения численного значения какого-либо свойства одного моль
компонента раствора.
Например, парциальный молярный объем компонента – это объем
одного моль данного компонента в растворе. В зависимости от того, на-
сколько и в каком направлении изменились силы взаимодействия между
частицами при образовании раствора, величина парциального молярно-
го объема компонента может быть больше или меньше объема, который
имел тот же моль этого компонента до внесения в раствор. Так, моляр-
ный объем воды равен 18,0 мл (при плотности 1 г/см
3
). При образовании
40%-го водного раствора этилового спирта каждый моль воды умень-
шается в объеме на 0,4 мл и становится равным 17,6 мл. Этот объем и
следует называть парциальным молярным объемом.
Рассмотрим какое-либо экстенсивное (зависящее от количества
раствора) термодинамическое свойство (Х
общ
) раствора. К экстенсив-
ным термодинамическим свойствам относятся: энергия Гиббса (G
общ
),
энтальпия (Н
общ
), энтропия (S
общ
), объем (V
общ
), теплоемкость (С
общ
) и
др.
Для двухкомпонентного раствора, состоящего из растворителя и
растворенного вещества, его экстенсивное свойство (Х
общ
) зависит от
числа моль n
1
растворителя, числа моль n
2
растворенного вещества,
давления и температуры:
),,,(
21
TpnnfX
общ
(4.3)
Учитывая, что экстенсивное свойство раствора (Х
общ
) является
функцией состояния, возьмем полный дифференциал этого выражения
при постоянстве р и Т:
2
,,
2
1
,,
1
12
dn
n
X
dn
n
X
dX
nTp
общ
nTp
общ
общ
. (4.4)
Обозначим:
njTp
i
общ
i
n
X
X
,,
. (4.5)
Тогда
2211
dnXdnXdX
общ
, (4.6)
где
i
X
– парциальная молярная величина или свойство i-го ком-
понента в растворе.

92
Парциальной молярной величиной i-го компонента раствора на-
зывается изменение данного экстенсивного свойства раствора при до-
бавлении 1 моль i-го компонента к большему количеству раствора при
постоянстве температуры и давлении.
Несколько замечаний:
1. Большее количество раствора означает, что состав раствора
практически не изменяется после добавления одного моль компонента.
2. Парциальная молярная величина чистого вещества равна свойст-
ву чистого вещества:
0
ii
XX
.
3. Парциальная молярная величина всегда относится к какому-либо
компоненту.
4. Среди парциальных молярных величин наибольшее значение
имеет парциальная молярная энергия Гиббса (
i
G
), которая тождествен-
на химическому потенциалу:
ii
G
Практическое значение парциальных молярных величин состоит в
том, что между ними сохраняются те же термодинамические соотноше-
ния, что и между обычными термодинамическими величинами.
Например:
iii
STHG
, где:
i
G
– парциальная молярная энергия
Гиббса i-го компонента,
i
H
– парциальная молярная энтальпия i-го
компонента;
i
S
– парциальная молярная энтропия i-го компонента.
Таким образом, при помощи парциальных молярных величин к
описанию поведения отдельного компонента в растворе можно приме-
нить весь математический аппарат химической термодинамики, что да-
ет возможность выразить через термодинамические уравнения любые
равновесные свойства раствора.
Основные соотношения между парциальными
молярными величинами
Общее экстенсивное свойство раствора (Х
общ
) выражается через
парциальные молярные свойства его компонентов уравнением:
2211
nXnXX
общ
. (4.7)
Это уравнение позволяет найти парциальную молярную долю од-
ного компонента, если известны общее свойство раствора, парциальная
молярная величина другого компонента и состав раствора.
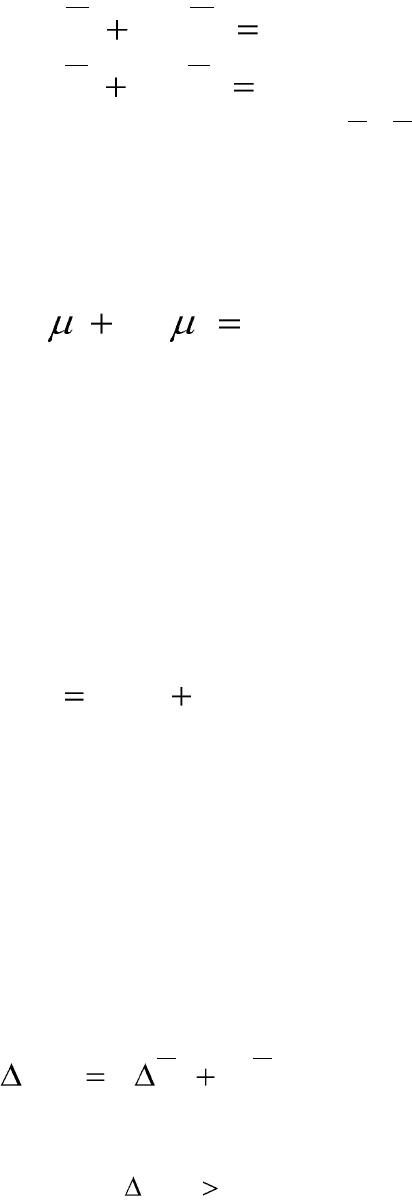
93
Соотношения между парциальными молярными величинами ком-
понентов раствора устанавливают уравнения Гиббса-Дюгема:
0
2211
XdnXdn
, (4.8)
0
2211
XdxXdx
, (4.9)
где n
1
, n
2
– число моль компонентов раствора,
21
, XX
– парциаль-
ные молярные величины компонентов раствора, х
1
, х
2
– мольные доли
компонентов раствора.
Особенно важное значение имеет уравнение Гиббса-Дюгема, когда
парциальной молярной величиной является химический потенциал:
0
2211
dxdx
. (4.10)
Уравнения Гиббса-Дюгема позволяют рассчитать парциальную мо-
лярную величину одного компонента раствора по парциальной моляр-
ной величине другого компонента раствора.
Аддитивные и неаддитивные свойства растворов
Аддитивное свойство – свойство раствора, которое изменяется
пропорционально составу раствора (складывается из свойств чистых
компонентов пропорционально их содержанию в растворе):
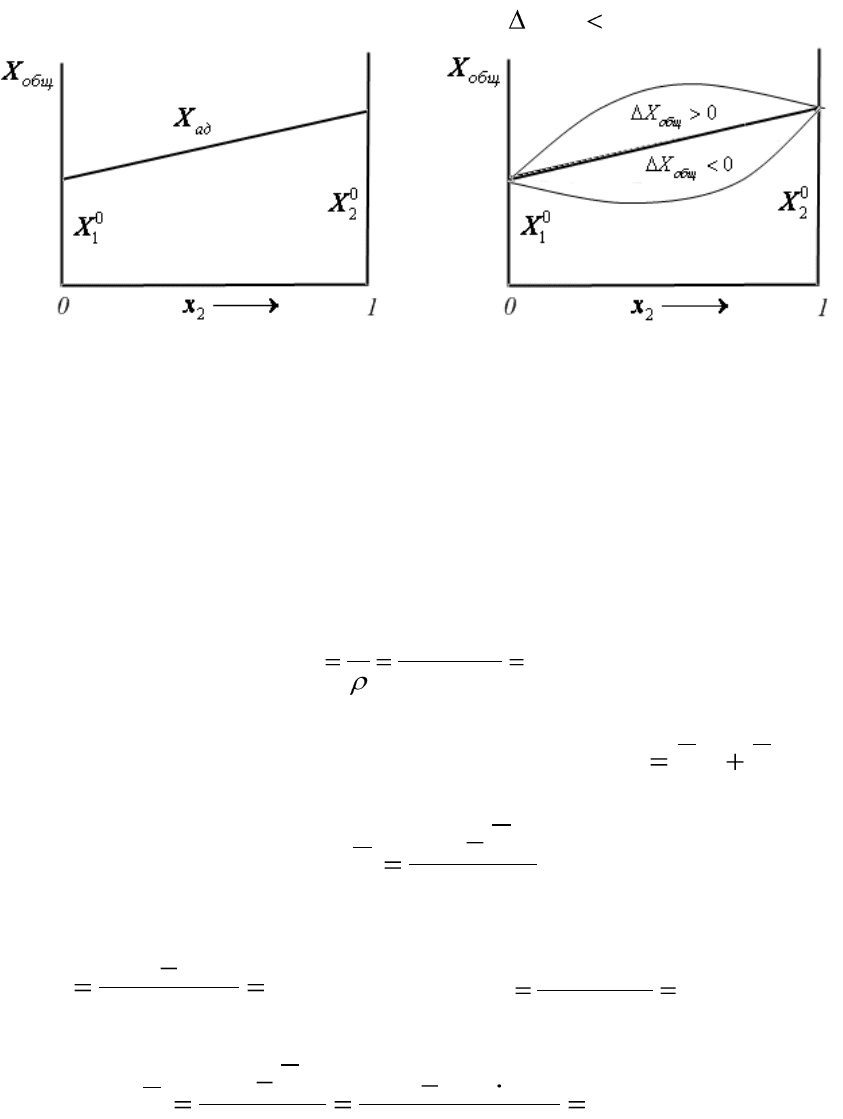
0
22
0
11
XxXxX
ад
, (4.11)
где Х
ад
– аддитивное свойство раствора,
0
1
X
– свойство 1 моль
чистого растворителя,
0
2
X
– свойство 1 моль чистого растворенного
вещества; х
1
, х
2
– мольные доли растворителя и растворенного вещест-
ва.
В этом случае зависимость Х
ад
от состава раствора линейная
(рис.4.1).
Отклонения свойств раствора от аддитивности могут быть положи-
тельными и отрицательными и называются изменением общего свойст-
ва раствора:
2211
XxXxX
общ
. (4.12)
Если в процессе образования раствора его общее свойство больше
суммы свойств чистых компонентов, то наблюдаются положительные
отклонения от аддитивности (
0
общ
X
). Если же общее свойство
94
меньше суммы свойств чистых компонентов, то наблюдаются отрица-
тельные отклонения от аддитивности (
0
общ
X
) (рис.4.2).
Рис.4.1. Линейное изменение адди-
тивного свойства раствора
Рис.4.2. Положительные и отрица-
тельные отклонения от аддитивности
Пример 4.4. Определите объем 1 моль метанола в водно-
спиртовом растворе, содержащем 60масс.% метанола. Плотность рас-
твора 0,9 г/см
3
, парциальный молярный объем воды в растворе этого со-
става равен 16,8 см
3
.
Решение:
1. Рассчитаем общий объем 100 г раствора:
3
3
1,111
/9,0
100
см
смг
гm
V
общ
2. Общий объем раствора (V
общ
) выражается через парциальные
молярные объемы его компонентов уравнением:
2211
nVnVV
общ
, от-
сюда:
2
11
2
n
nVV
V
общ
.
3. Рассчитаем количество моль воды (n
1
) и метанола (n
2
):
моль
мольг
г
n 22,2
/18
)60100(
1
;
моль
мольг
г
n 88,1
/32
60
2
3. Найдем парциальный молярный объем этанола:
3
2
11
2
26,39
88,1
22,28,161,111
см
n
nVV
V
общ

95
Типы растворов
В чистом жидком веществе между однородными молекулами суще-
ствует взаимодействие, обусловленное физическими и химическими си-
лами. В растворе наряду с взаимодействием между однородными моле-
кулами имеет место и взаимодействие между разнородными частицами
различных компонентов, при этом частицы растворенного вещества мо-
гут значительно изменять взаимодействие между молекулами раствори-
теля и наоборот. Таким образом, в растворе взаимодействие между од-
нородными частицами иное, чем между теми же частицами в индивиду-
альном веществе.
В одних случаях при образовании раствора взаимодействие между
частицами изменяется незначительно, в других случаях – весьма суще-
ственно. В связи с этим введены понятия: идеальный, неидеальный и
предельно разбавленный раствор.
Идеальные растворы
По своему физическому смыслу идеальный раствор – это раствор,
при образовании которого энергия взаимодействия между разнородны-
ми молекулами растворенного вещества и растворителя равна энергии
взаимодействия однородных молекул растворителя и растворенного
вещества, а объемы молекул всех компонентов раствора равны между
собой.
С термодинамической точки зрения идеальный раствор – это
раствор, образование которого из компонентов, взятых в одинаковом
агрегатном состоянии в любых соотношениях, не сопровождается теп-
ловым эффектом (ΔН = 0) и изменением объема(ΔV = 0), а изменение
энтропии равно изменению энтропии при смешении идеальных газов
ΔS = –x
1
Rlnx
1
– x
2
Rlnx
2
.
Выражения парциальных молярных величин для растворителя (1) и
растворенного вещества (2) имеют вид:
.ln;ln
;0;0
;0;0
2211
21
21
xRSxRS
VV
HH
(4.13)
Как не существует строго идеальных газов, так и не существует
строго идеальных растворов, но растворы, близкие по свойствам к иде-
альным, существуют в действительности. К ним относятся: смеси изо-
96
топов, смеси изомеров, смеси соседних гомологов в рядах органических
соединений и т.д.
Чем больше по природе отличаются компоненты раствора, тем
больше такой раствор отличается от идеального. Это отличие зависит
также и от концентрации раствора. При увеличении концентрации рас-
творенного вещества увеличивается интенсивность взаимодействия ме-
жду частицами составляющих его компонентов. С разведением взаимо-
действие между разнородными частицам ослабевает и свойства раство-
ра приближаются к свойствам чистого растворителя.
Предельно разбавленные растворы
По своему физическому смыслу предельно разбавленный раствор
– это раствор, в котором концентрация растворенного вещества беско-
нечно мала.
С термодинамической точки зрения предельно разбавленный
раствор – это раствор, в котором растворитель подчиняется законам
идеальных растворов, а растворенное вещество – не подчиняется. Таким
образом, в предельно разбавленных растворах для растворителя можно
использовать все уравнения, справедливые для идеальных растворов:
1111
ln;0;0 xRSVH
. Для растворенного вещества эти
соотношения справедливы не будут.
Неидеальные растворы
Все растворы, которые не подчиняются термодинамическим зако-
номерностям идеальных и предельно разбавленных растворов, называ-
ют неидеальными (реальными) растворами. Равновесные свойства не-
идеальных растворов определяют термодинамическим путем при по-
мощи эмпирического метода активности, предложенного Льюисом.
Термодинамические свойства неидеального раствора зависят от состава
раствора. Характер этих зависимостей для каждого раствора может
быть установлен только экспериментально.
Давление насыщенного пара компонента над
раствором
При испарении жидкости в закрытом сосуде устанавливается фазо-
вое равновесие между жидкостью и ее насыщенным паром. Фазовое
равновесие жидкость – пар характеризуется равенством химических по-

97
тенциалов i-го испаряющегося компонента в жидком и газообразном
состояниях:
)()( г
i
ж
i
. (4.14)
Пар, находящийся в равновесии с жидкостью, называется насы-
щенным, а давление, которое он оказывает на стенки сосуда, называет-
ся давлением насыщенного пара.
Если внести в растворитель нелетучее вещество (нелетучим счита-
ется вещество, температура кипения которого примерно на 150° выше
температуры кипения растворителя), то в результате взаимодействия
молекул растворителя с молекулами нелетучего растворенного вещест-
ва давление пара растворителя над раствором понизится.
Давление насыщенного пара растворителя над раствором нелетуче-
го вещества (
0
1
p
) всегда меньше, чем над чистым растворителем (
1
p
):
0
11
pp
. (4.15)
В случае, когда растворенное вещество является летучим, пар над
раствором состоит из молекул растворителя и молекул растворенного
вещества, а общее давление над раствором (р) равно сумме парциаль-
ных давлений растворителя (р
1
) и растворенного вещества (р
2
):
21
ppp
. (4.16)
Зависимость давления насыщенного пара компонента над раство-
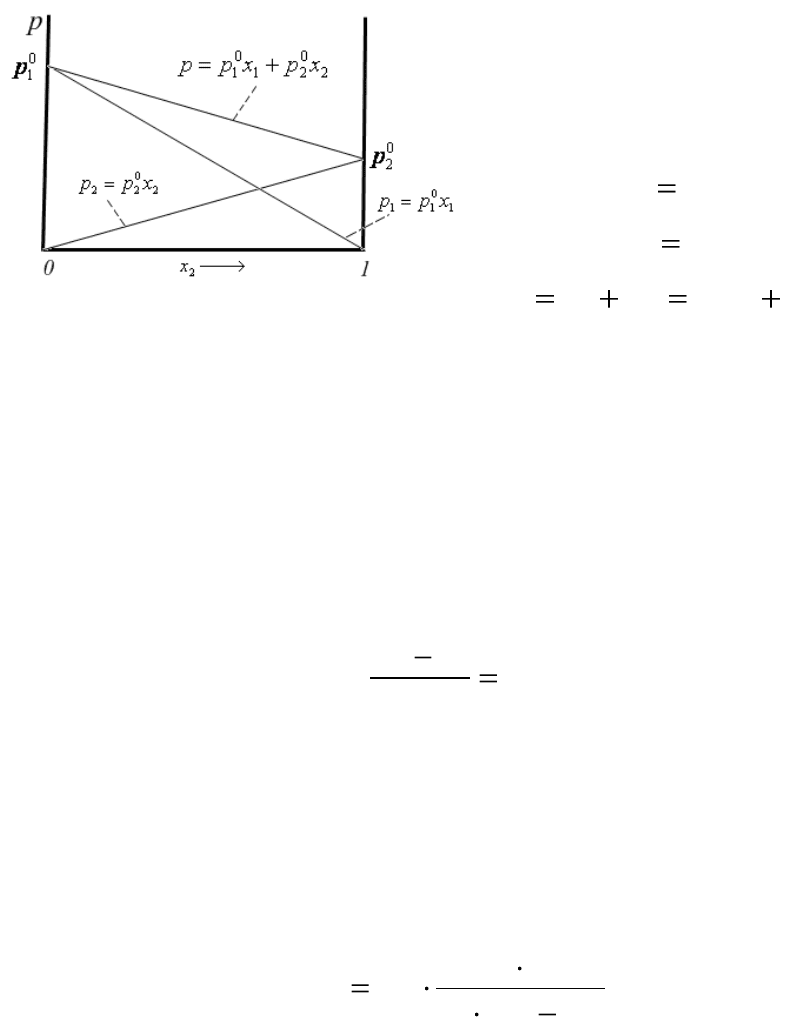
ром для разных типов растворов устанавливают законы Рауля.
Закон Рауля для идеальных растворов: равновесное парциальное
давление пара i-го компонента над идеальным раствором пропорцио-
нальна мольной доле этого компонента в растворе:
ii
xpp
i
0
, (4.17)
где р
i
– парциальное давление насыщенного пара i-го компонента
над раствором,
0
i
p
– давление насыщенного пара над чистым i-ым ком-
понентом; х
i
– мольная доля i-го компонента в растворе.
98
Рис.4.3. Зависимость давления пара от
состава раствора
Закон Рауля для идеальных
растворов справедлив как для
растворителя, так и для раство-
ренного вещества:
2
0
21
0
121
2
0
22
1
0
11
;
;
xpxpppp
xpp
xpp
Зависимость парциального давления пара каждого компонента от
его мольной доли имеет вид прямой, выходящей из начала координат.
Для предельно разбавленных растворов, в которых растворитель
подчиняется законам идеальных растворов, а растворенное вещество не
подчиняется, закон Рауля формулируется следующим образом:
Закон Рауля для предельно разбавленных растворов: относитель-
ное понижение давления насыщенного пара растворителя над раство-
ром равно мольной доле растворенного вещества:
2
0
1
1
0
1
x
p
pp
, (4.18)
где р
1
– парциальное давление насыщенного пара растворителя над
раствором,
0
1
p
– давление насыщенного пара чистого растворителя; х
2
–
мольная доля растворенного вещества.
Из уравнения (4.17) можно определить молярную массу растворен-
ного вещества, если известно давление насыщенного пара растворителя
над раствором:
)(
1
0
11
0
12
12
ppg
pg
MM
, (4.19)
где М
1
– молярная масса растворителя; М
2
– молярная масса рас-
творенного вещества; р
1
– давление насыщенного пара растворителя над
раствором,
0
1
p
– давление насыщенного пара над чистого растворителя;
g
1
– масса растворителя; g
2
– масса растворенного вещества.
В предельно разбавленных растворах к растворенному веществу
закон Рауля не применим. В этом случае зависимость парциального
давления пара растворенного вещества от его мольной доли в растворе
описывается законом Генри.
99
Закон Генри: парциальное давление пара растворенного вещества
над предельно разбавленным раствором пропорционально его мольной
доле:
222
xKp
, (4.20)
где р
2
–давление насыщенного пара растворенного вещества над
раствором; х
2
– мольная доля растворенного вещества; К
2
– постоянная
Генри.
Уравнение Генри имеет большое практическое значение для изуче-
ния растворимости газов в растворах.
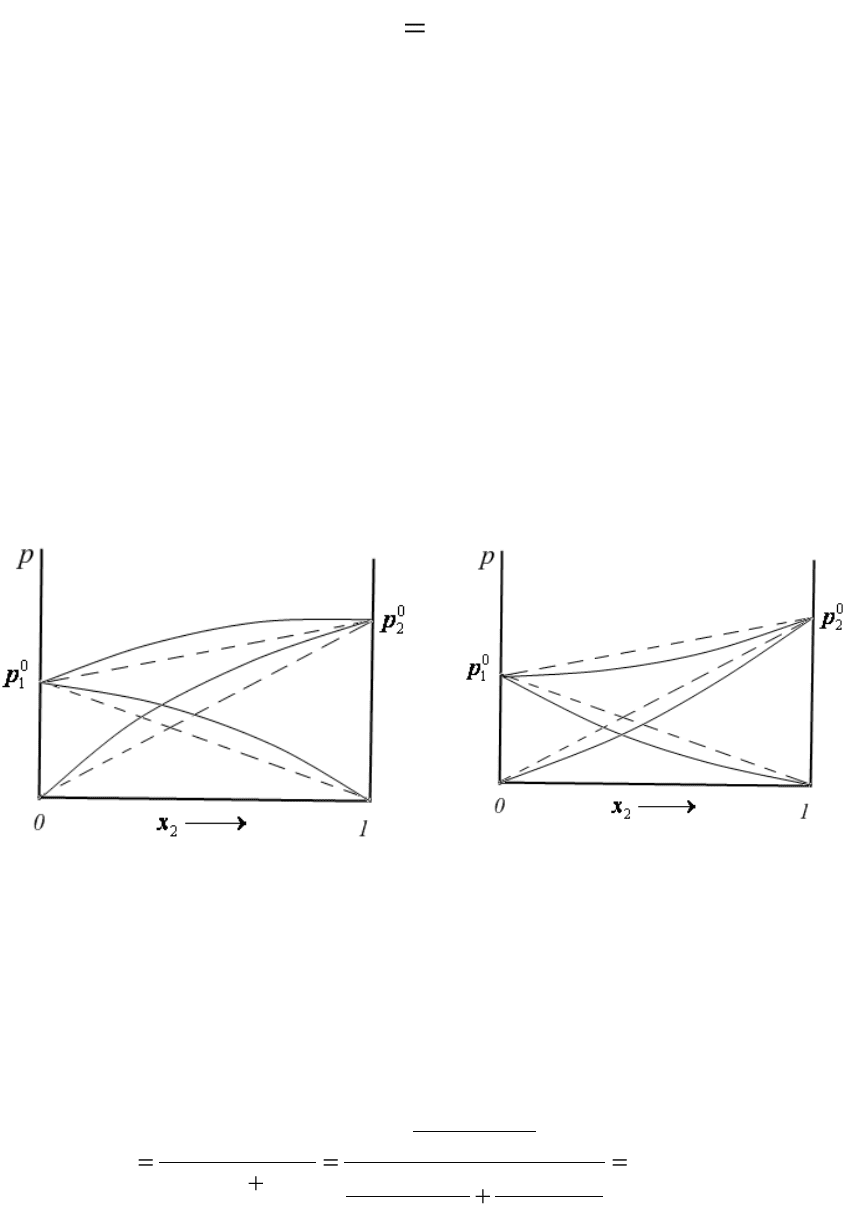
Для неидеальных растворов наблюдаются отклонения от закона
Рауля, различные как по величине, так и по знаку.
Если при образовании раствора притяжение между молекулами
становится меньше, чем в чистых веществах, то молекулы из раствора
переходят в пар легче, чем из чистых жидкостей. В этом случае наблю-
даются положительные отклонения от закона Рауля (рис.4.4). Примером
такого раствора является система вода – 1,4-диоксан.
Если при образовании раствора силы притяжения между молекула-
ми увеличиваются, наблюдаются отрицательные отклонения от закона
Рауля (рис.4.5). Например, раствор вода – серная кислота.
Рис.4.4. Положительные отклонения
от закона Рауля
Рис.4.5. Отрицательные отклонения
от закона Рауля
Пример 4.5. Вычислите давление насыщенного пара над 2% вод-
ным раствором сахарозы при 373К. Считайте этот раствор подчиняю-
щимся законам предельно разбавленных растворов.
Решение:
1. Мольная доля сахарозы в ее водном растворе составит:
00107,0
/18
98
/342
2
/342
2
2112212
112212
112212
мольг
г
мольг
г
мольг
г
nn
n
x
OHOHC
OHC
OHC

100
2. На основании закона Рауля для предельно разбавленных раство-
ров имеем:
2
0
1
1
0
1
x
p
pp
.
3. Давление насыщенного водяного пара над раствором сахарозы
будет равно:
Паxppр
555
2
0
1
0
11
10012,100107,010013,110013,1
Повышение температуры кипения растворов
нелетучих веществ
Каждая жидкость при нагревании до определенной температуры
начинает кипеть. Кипение – это процесс парообразования во всем объе-
ме жидкости; в отличие от испарения, при котором парообразование
идет только от поверхности. Испарение идет при любых температурах,
кипение же происходит только при той температуре, при которой дав-
ление насыщенного пара, образующегося в жидкости, достигает вели-
чины внешнего давления. Это относится как к чистым жидкостям, так и
к растворам. Однако между понятиями «температура кипения чистого
жидкого вещества» (
0
кип
T
) и «температура кипения раствора» (
кип
T
) су-
ществует разница. Чистое жидкое вещество (жидкость), сколько бы ни
кипела, состава не изменяет и кипит при постоянной температуре. При
кипении же раствора состав раствора изменяется, что влечет за собой
изменение его температуры кипения.
Температура кипения раствора нелетучего вещества всегда выше
температуры кипения чистого растворителя, и тем выше, чем выше
концентрация нелетучего растворенного вещества:
0
кипкип
TT
. (4.21)
Для идеальных и предельно разбавленных растворов неэлектроли-
тов между концентрацией раствора и повышением температуры его ки-
пения существует связь:
EmT
кип
, (4.22)
где
0
кипкипкип
TTT
– повышение температуры кипения (раз-
ность между температурами кипения раствора
кип
T
и чистого раствори-
