Михеева Е.В., Пикула Н.П. Физическая и коллоидная химия
Подождите немного. Документ загружается.

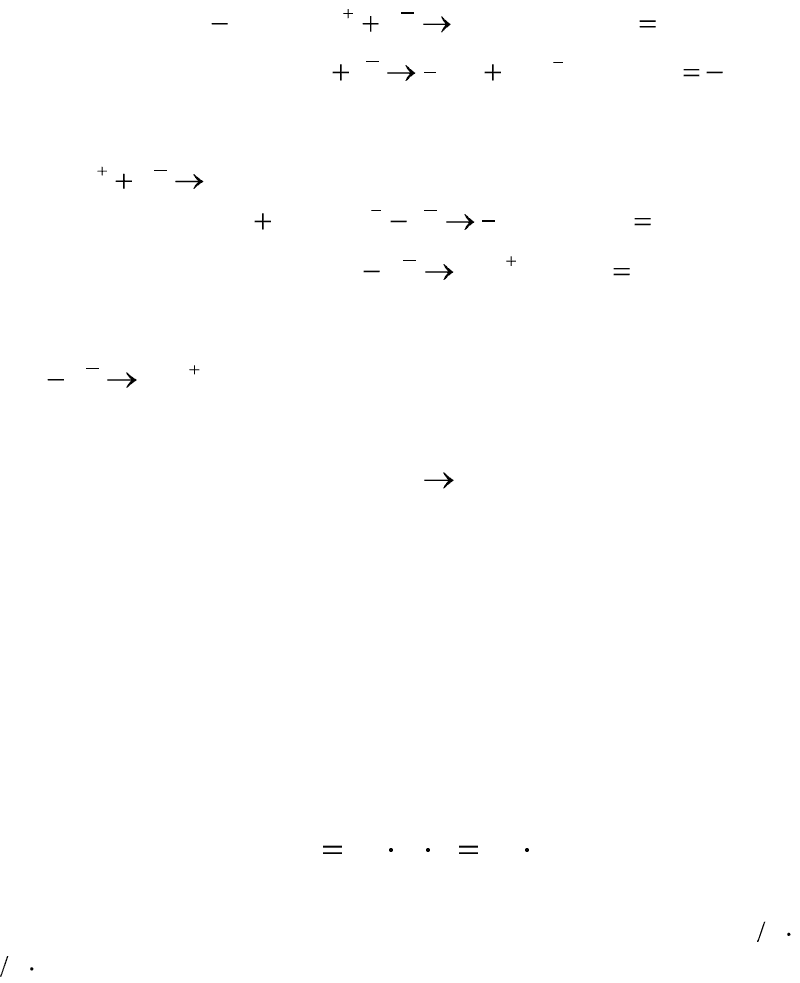
121
BEOHHeOH
BECueCuкатодеНа
828,0,1
337,0,2:)(
0
2
2
1
2
002
Так как потенциал выделения меди меньше потенциала выделения
водорода из воды, то на медном катоде будет выделяться медь по реак-
ции:
02
2 CueCu
.
BECueCu
BECleClанодеНа
337,0,2
360,1,1:)(
020
0
2
2
1
Так как потенциал растворения медного анода меньше потенциала
выделения хлора, то медный анод будет растворяться по реакции:
20
2 CueCu
.
Суммарная реакция на электродах при электролизе хлорида меди –
медь с анода переходит в раствор, и выделяется на катоде:
)()( катодCuанодCu
.
Законы Фарадея
Между количеством прошедшего через раствор электричества и
количеством вещества, прореагировавшего на электроде, существуют
определенные соотношения, выраженные законами Фарадея.
Первый закон Фарадея: масса вещества (m), прореагировавшего на
электроде, пропорциональна количеству электричества (Q), прошедшего
через раствор:
QktIkm
ээ
, (5.29)
где k
э
– электрохимический эквивалент (масса прореагировавшего
вещества при протекании единицы количества электричества, г A c или
г А ч).
Второй закон Фарадея: при прохождении через различные элек-
тролиты одного и того же количества электричества массы прореагиро-
вавших на электроде веществ, пропорциональны их молярным массам
эквивалентов (Мэкв):
m
1
: m
2
: m
3
= Mэкв
1
: Mэкв
2
: Мэкв
3
. (5.30)
Из второго закона Фарадея следует, что для электрохимического
превращения 1 моль-экв. любого вещества требуется одинаковое коли-
чество электричества F, которое называется постоянной Фарадея
(F = 96485 кулон).
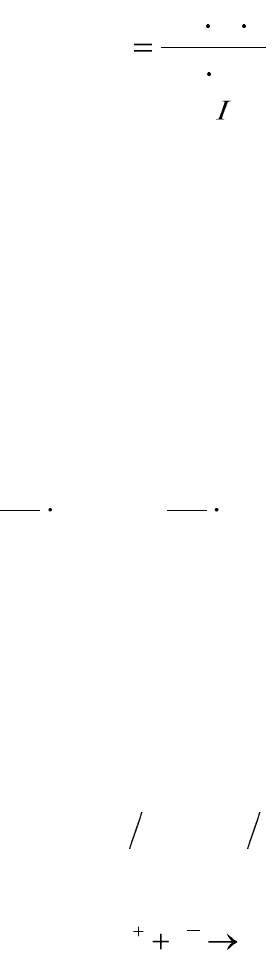
122
Уравнение, объединяющее оба закона Фарадея:
Fz
tIM
m
, (5.31)
где М – молярная масса вещества; – сила тока; t – время электро-
лиза; z – число электронов, участвующих в электрохимической реак-
ции.
Законы Фарадея являются общими и точными законами электро-
химии. Однако при электрохимических процессах часто наблюдаются
отклонения от этих законов: масса m
д
действительно полученного или
разложившегося продукта не соответствует теоретической m
Т
, вычис-
ленной по законам Фарадея. Эти отклонения – кажущиеся, они возни-
кают за счѐт одновременного протекания побочных электрохимических
или химических процессов. Эффективность основного электрохимиче-
ского процесса оценивается выходом по току:
В =
m
m
Д
T
100% =
Q
Q
Т
Д
100%. (5.32)
Для измерения количества прошедшего электричества использу-
ются электролизеры, в которых нет параллельных электрохимических и
побочных химических реакций. Они называются кулонометрами. По
методам определения количества образующихся веществ кулонометры
делятся на весовые, объемные, титрационные и др.
Например, действие серебряного кулонометра, представляющего
собой электролизер с двумя серебряными электродами, погруженными
в раствор нитрата серебра,
(–) Ag AgNO
3
Ag (+)
основано на взвешивании массы серебра, осевшей на катоде во время
электролиза по реакции:
0
1 AgeAg
При пропускании одного Фарадея электричества на катоде выделя-
ется один моль-эквивалент cеребра, равный 108 г.
Пример 5.9. Металлический предмет, поверхностью 100 см
2
, тре-
буется покрыть никелем слоем в 0,3 мм. Плотность никеля 9,0 г/см
3
.
Сколько времени требуется пропускать ток силой 3 А, если 10% тока
теряется в аппарате для электролиза?

123
Решение:
При электролизе на катоде протекает реакция:
02
2 NieNi
1. Определим массу никеля, необходимую для покрытия
m S ,
г.
2. По закону Фарадея найдем необходимое количество электриче-
ства:
Кл
M
Fzm
Q
Ni
88800
63,58
96500227
.
3. При силе тока в 3 А потребуется время электролиза:
c
I
Q
t 29600
3
88800
.
4. Учтем 10% возможных потерь:
t =
c
9 ч 8 мин.
Пример 5.10. При электролизе раствора NaCl на платиновых
электродах получено 400 мл раствора, содержащего 18 г NaOH. За это
же время в медном кулонометре, включенном параллельно с электроли-
зером, выделилось 20,2 г меди. Вычислите выход по току.
Решение: Запишем все теоретически возможные электрохимиче-
ские реакции на электродах и выберем наиболее вероятную:
1. При электролизе водного раствора хлорида натрия на электродах
идут реакции:
BEOHHeOH
идетнеeNaкатодеНа
828,0,1
1:)(
0
2
2
1
2
Так как щелочные металлы на катоде не выделяются, идет выделе-
ние водорода из воды по реакции:
OHHeOH
2
2
1
2
1
.
BEHOeOH
BECleClанодеНа
229,1,442
360,1,1:)(
0
22
0
2
2
1
Так как стандартные потенциалы выделения хлора и кислорода
близки, следовательно, возможны обе реакции в зависимости от мате-
риала анода. На платиновом аноде преимущественно идет реакция вы-
деления хлора:
2
2
1
1 CleCl
.
В результате выделения водорода и хлора в газовую фазу в раство-
ре остаются ионы Na
+
и OH
¯
(NaOH).
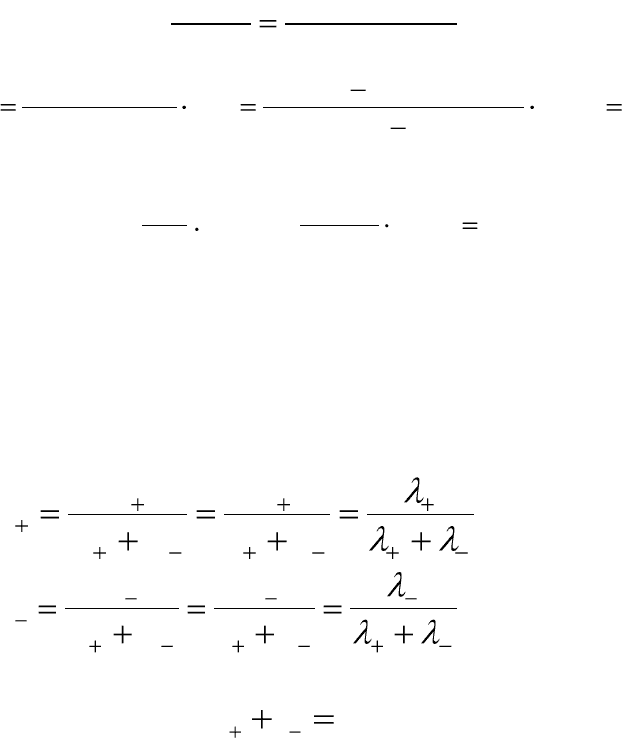
124
2. Рассчитаем теоретическую массу гидроксида натрия, полученно-
го в результате электролиза по второму закону Фарадея:
)(
)(
CuM
NaOHM
m
m
экв
экв
Cu
NaOH
;
гг
мольэквг
мольэквг
m
CuM
NaOHM
m
Cu
экв
экв
NaOH
44,252,20
/)2/54,63(
/40
)(
)(
.
3. Рассчитаем выход по току:
В =
m
m
Д
T
100% =
%71%100
44,25
18
г
г
.
Числа переноса
Числом переноса ионов называется доля количества электричест-
ва, переносимая данным видом ионов, по отношению к общему количе-
ству электричества, прошедшему через раствор:
t
Q
Q Q
u
u u
; (5.32)
t
Q
Q Q
u
u u
, (5.33)
где t
+
и t
–
– число переноса катиона и аниона.
1tt
. (5.34)
К методам определения чисел переноса относят метод Гитторфа,
основанный на определении изменения концентрации электролита в ре-
зультате электролиза в катодном или анодном пространстве, а также
метод движущейся границы, основанный на измерении изменения по-
ложения перемещающейся границы.
Вопросы для самоконтроля
1. Чем отличаются удельная и молярная электрические проводи-
мости? Их зависимости от концентрации электролита.
2. В чем заключается практическое использование метода кондук-
тометрии?
3. Приведите примеры по применению электролиза.

125
Электродвижущие силы
электрохимических элементов
Основные понятия и определения
Электрохимические элементы – это устройства для получения
электрического тока за счет самопроизвольного протекания электрохи-
мических реакций на электродах.
Электрод в электрохимическом элементе есть двух- или трехфаз-
ная система, состоящая из окисленной и восстановленной форм одного
и того же вещества, находящихся в равновесии. Следовательно, элек-
трод – электрохимическая система, состоящая из веществ, обладающих
различными видами проводимости и находящихся в контакте друг с
другом.
При переходе заряженных частиц (ионы, электроны) через границу
раздела двух фаз, например, раствор электролита – металл, возникает
электрохимическая реакция. В результате этого металл и раствор
приобретают электрический заряд, и на границе их раздела создаѐтся
двойной электрический слой, которому соответствует скачок потен-
циала.
Электродные процессы представляют собой окислительно-
восстановительные реакции. На отрицательном электроде идет процесс
окисления:
ezMeMe
z0
, на положительном электроде – процесс
восстановления:
0
MeezMe
z
.
Различают обратимые и необратимые электроды. При перемене
направления электрического тока на обратимых электродах возникают
реакции, противоположные по направлению, на необратимых – проте-
кают другие реакции.
Примером обратимого электрода служит электрод, состоящий из
металлической меди, погруженный в раствор, содержащий ионы Cu
2+
.
При прохождении тока в противоположных направлениях идут реак-
ции:
eCuCuCueCu 2;2
2002
К необратимым электродам относится, электрод, состоящий из ме-
таллической меди в растворе кислоты. Перемена направления тока при-
водит к реакциям:
eCuCuHeH 2;22
20
2
Из обратимых электродов могут быть составлены обратимые
электрохимические элементы (гальванические элементы).
126
Правила записи электрохимических элементов
При схематической записи электрохимических систем, а также
уравнений протекающих в них реакций, необходимо соблюдать сле-
дующие основные правила:
для электродов (полуэлементов): вещества, находящихся в рас-
творе, указываются слева от вертикальной черты, справа указываются
вещества, образующие другую фазу, или электродный материал. Если
одна фаза содержит несколько веществ, то их символы разделяются за-
пятыми;
для электрохимических цепей: слева располагается электрод,
имеющий более отрицательный потенциал. По краям цепей записыва-
ются металлы. Растворы обоих электродов отделяются вертикальной
пунктирной линией, если они контактируют друг с другом, например:
(–)Pt, H
2
HCl ¦ CuCl
2
Cu (+)
если между растворами находится солевой мостик, то растворы
обоих электродов отделяются двумя сплошными линиями, например:
(–)Pt, H
2
HCl CuCl
2
Cu (+)
Электрической характеристикой каждого электрода является по-
тенциал, а электрохимической цепи – электродвижущая сила (ЭДС),
равная алгебраической сумме всех скачков потенциалов, возникающих
на границах раздела фаз.
Таким образом, в гальваническом (электрохимическом) элементе
окислительный и восстановительный процессы происходят на разных
электродах. Это позволяет превращать химическую энергию окисли-
тельно-восстановительной реакции в электрический ток, который мож-
но использовать для полезной работы. При обратимом изотермическом
проведении реакции работа будет максимальной. В этом случае наи-
большая часть энергии перейдет в электрическую. Измеренная при
этом разность потенциалов между электродами также называется элек-
тродвижущей силой гальванического элемента.
Электродные потенциалы
Условным электродным потенциалом (Е
(+)
или E
( )
), или просто
электродным потенциалом, называют ЭДС гальванического элемента,
составленного из данного электрода и второго электрода, электродный
потенциал которого условно принят за нуль.
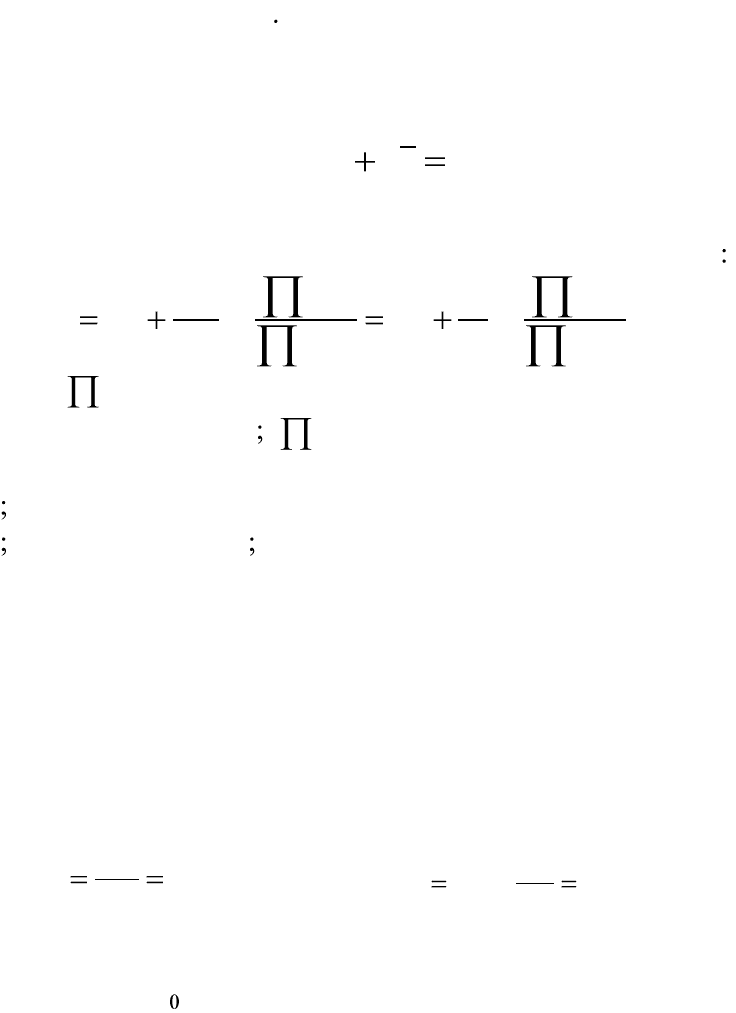
127
В настоящее время для вычисления условных электродных потен-
циалов пользуются водородной шкалой, в которой при всех температу-
рах за нуль выбран потенциал стандартного водородного электрода с
активностью водородных ионов в растворе, равной единице, и давлени-
ем водорода, равном 1,013 10
5
Па.
При работе электрохимического элемента на каждом из электродов
протекает электрохимическая реакция и устанавливается равновесие
между окисленной (Оx) и восстановленной (Red) формами вещества:
dezOx Re
.
Зависимость равновесного электродного потенциала (Е
р
) от актив-
ностей компонентов реакции выражается уравнением Нернста
d
Ox
d
Ox
a
a
z
b
E
a
a
zF
RT
EE
Re
0
0
р
Re
0
рр
lnln
, (5.35)
где
Ox
a
– произведение активностей окисленной формы веществ,
участвующих в реакции
d
a
Re
– произведение активностей восста-
новленной формы веществ, участвующих в электрохимической реак-
ции z – число электронов, принимающих участие в электродной реак-
ции Т – температура, К R=8,314 Дж/(моль.К) – универсальная газовая
постоянная; F = 96485 Кл/моль-экв – число Фарадея;
0
p
E
– стандартный
равновесный электродный потенциал.
Комбинация констант (RT/F) часто встречается в электрохимиче-
ских уравнениях; она имеет размерность напряжения. При использова-
нии натуральных логарифмов в она обозначается через b
0
; с учетом мо-
дуля перехода к десятичным логарифмам – через b. При 298 К значения
b
0
и b соответственно равны:
B
F
RT
b 02569,0
0
;
B
F
RT
b 05916,0303,2
. (5.36)
При других температурах значения постоянных b
0
и b должны
быть рассчитаны.
Величину
Е
р
в уравнении Нернста называют стандартным рав-
новесным электродным потенциалом. Он соответствует значению
электродного потенциала при значениях активностей компонентов в
растворе, равных единице.

128
Значение
Е
р
– количественная характеристика окислительно-
восстановительных свойств веществ, участвующих в электродной реак-
ции. Величина стандартного электродного потенциала зависит не толь-
ко от химической природы элемента, но и от величины заряда его ио-
нов в растворе. Стандартный электродный потенциал является констан-
той, свойственной каждому электроду. Индекс р при Е и Е
0
часто
при записи на практике опускают.
Расположенные в порядке возрастания стандартных электродных
потенциалов металлы представляют собой так называемый ряд напря-
жений.
Значения равновесных стандартных электродных потенциалов по
водородной шкале, включающие электродные реакции для многих ве-
ществ, приводятся в справочных таблицах в справочниках физико-
химических величин. При пользовании этими справочными данными
необходимо иметь в виду, что парциальные давления газообразных ве-
ществ следует подставить в уравнение Нернста в относительных еди-
ницах:
~
р
= р
экс.
/ р
станд.
, (5.37)
где
~
р
– относительное парциальное давление, р
экс
.
и р
станд.
– экс-
периментальное и стандартное давление, выраженное в одних и тех же
единицах измерения.
Типы электродов
Электрод в электрохимическом элементе представляет собой
двух- или трѐхфазную систему, состоящую из окисленной и восстанов-
ленной форм одного и того же вещества, находящихся в равновесии.
Различают несколько типов электродов: электроды первого рода,
электроды второго рода, газовые электроды, окислительно-
восстановительные и др.
Электроды первого рода
К электродам первого рода относятся следующие электроды:
1. Металлические электроды – электроды, состоящие из металла,
погруженного в раствор, содержащий катионы этого металла. Напри-
мер, медный электрод первого рода.
Схематическая запись электрода:
CuCu /
2
.
Реакция, протекающая на электроде:
CueCu 2
2
.
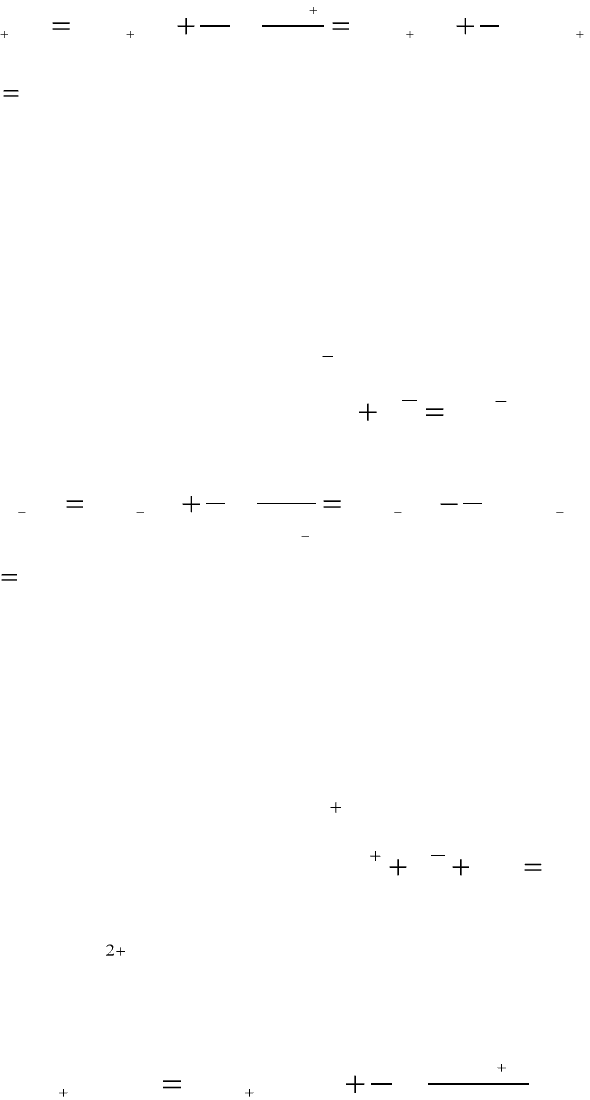
129
Уравнение Нернста:
22
2
22
lg
2
lg
2
0
/
0
// CuCuCu
Cu
Cu
CuCuCuCu
a
b
E
a
a
b
EE
,
так как
1
Cu
a
.
Так как электродный потенциал зависит от активности катионов
электролита, то металлические электроды первого рода называют также
электродами, обратимыми относительно катиона.
2. Неметаллические электроды – электроды, состоящие из неме-
талла, погруженного в раствор, содержащий анионы этого неметалла.
Например, селеновый электрод первого рода.
Схематическая запись электрода:
02
/SeSe
.
Реакция, протекающая на электроде:
2
2 SeeSe
.
Уравнение Нернста:
22
2
22
lg
2
lg
2
0
/
0
// SeSeSe
Se
Se
SeSeSeSe
a
b
E
a
a
b
EE
,
так как
1
Se
a
.
Этот электрод обратим относительно аниона.
3. Амальгамные электроды – электроды, состоящие из амальгамы
металла (раствора металла в ртути), погруженного в раствор, содержа-
щий катионы этого металла. Например, амальгамный кадмиевый элек-
трод.
Схематическая запись электрода:
)(/
2
HgCdCd
.
Реакция, протекающая на электроде:
)(2
2
HgCdHgeCd
.
Поскольку в таких системах может изменяться концентрация как
окисленной формы (
a
Сd
), так и восстановленной формы (
a
Сd Hg( )
),то
уравнение Нернста для амальгамного кадмиевого электрода запишется
следующим образом:
)(
0
)(/)(/
2
22
lg
2
HgCd
Cd
HgCdCdHgCdCd
a
a
b
EE
.
4. Газовые электроды – электроды, состоящие из инертного ме-
талла (обычно платины), находящегося в одновременном контакте с га-
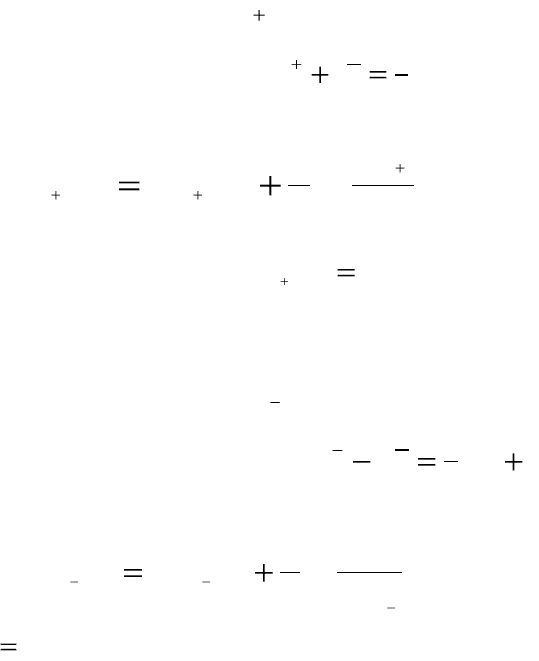
130
зом и с раствором, содержащим ионы этого газа. Газовые электроды
могут быть обратимы относительно катиона или аниона.
Примером газового электрода, обратимого относительно ка-
тиона, является водородный электрод.
Схематическая запись электрода:
PtHH ,/
2
.
Реакция, протекающая на электроде:
2
2
1
1 HeH
.
Уравнение Нернста:
1/2
H
H
HHHH
р
a
b
EE
2
22
~
lg
1
0
//
.
По водородной шкале потенциалов
0
0
/
2
HH
E
.
Примером газового электрода, обратимого относительно анио-
на, является кислородный электрод.
Схематическая запись электрода:
PtOOH ,/
2
.
Реакция, протекающая на электроде:
OHOeOH
22
2
1
22
.
Уравнение Нернста:
2
2/1
0
//
2
22
~
lg
2
OH
O
OOHOOH
a
p
b
EE
,
поскольку
1
2
OH
a
.
Как видно из приведенных выше электрохимических реакций,
протекающих на электродах первого рода, одной из форм (окисленной
или восстановленной) является простое соединение (атомы металла,
неметалла или молекулы газа), а другой формой – ионы этого соедине-
ния.
Электроды второго рода
Электроды второго рода состоят из металла, покрытого малорас-
творимым соединением этого металла, и погруженного в раствор соли,
содержащий анионы малорастворимого соединения. Название электро-
да аналогично названию малорастворимого соединения. Например,
хлорсеребряный электрод второго рода – серебряный электрод, покры-
тый малорастворимым хлоридом серебра, погруженный в раствор рас-
творимого хлорида калия.
