Михеева Е.В., Пикула Н.П. Физическая и коллоидная химия
Подождите немного. Документ загружается.

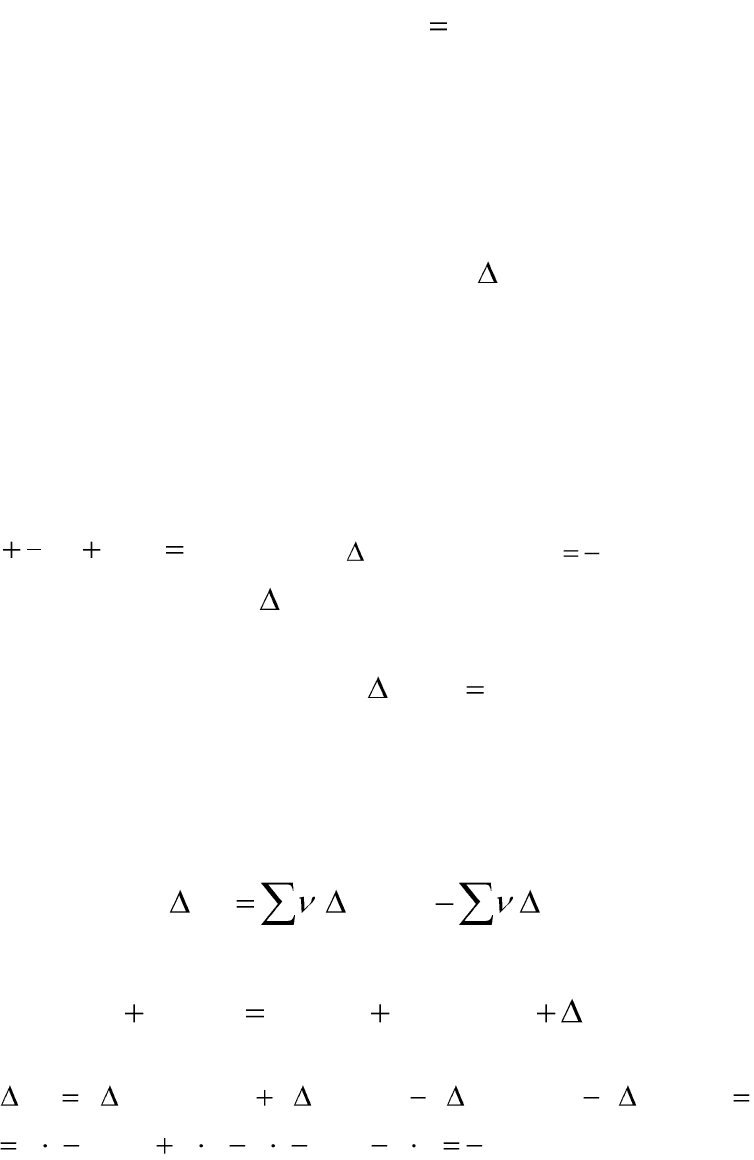
11
Если в химической реакции участвуют только конденсированные
фазы (жидкие или твердые вещества), для которых ΔV=0, то
Vp
QQ
. (1.15)
Следствия из закона Гесса. Методы расчета тепловых
эффектов химических реакций
1. Расчет по стандартным теплотам образования
Стандартная теплота образования (
0
298,f
H
) – тепловой эффект
химической реакции образования 1 моль вещества из простых веществ
при стандартных условиях.
Индекс f обозначает «formation – образование».
Стандартные условия: Т =25°С = 298К, р = 1атм = 760 мм.рт.ст.=
= 1,013·10
5
Па.
Например, образование сульфата алюминия из простых веществ
можно теоретически представить в виде следующей реакции:
34222
2
3
)(62 SOAlOSAl
,
молькДжSOAlH
f
/8,3441))((
342
0
298,
Численные значения
0
298,f
H
для различных веществ приводятся в
справочниках. Для простых веществ (N
2
, O
2
, H
2
, C, Cl
2
) стандартные
теплоты образования равны нулю (
0
0
298,f
H
).
Первое следствие из закона Гесса: тепловой эффект химической
реакции равен разности между суммарными теплотами образования
продуктов реакции и суммарными теплотами образования исходных
веществ:
0
,
0
,
0
исхf
i
iпродf
j
jr
HHH
. (1.16)
Например, для реакции
0
..2223
)(6)(2)(3)(4
рх
HжОНгNгOгNH
,
тепловой эффект химической реакции можно рассчитать:
.2,153103)9,45(402)8,285(6
)(3)(4)(2)(6
2
0
3
0
2
0
2
00
кДж
OHNHHNHOHHH
fffжfr
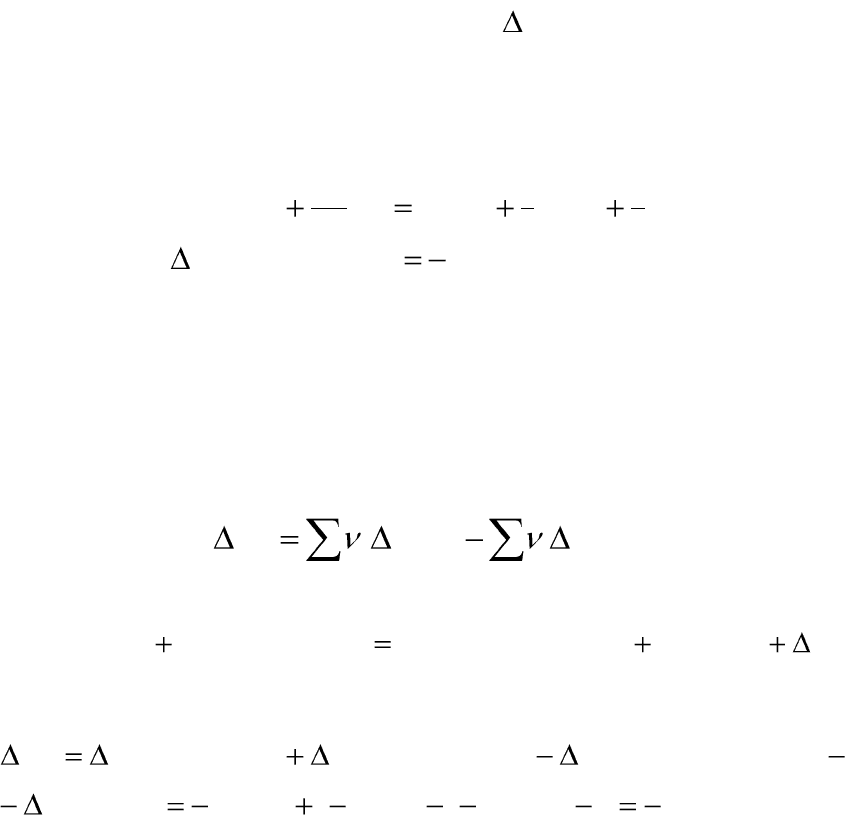
12
2. Расчет по стандартным теплотам сгорания
Стандартная теплота сгорания (
0
298,c
H
) – тепловой эффект
химической реакции сгорания 1 моль вещества до конечных продуктов
сгорания (СO
2
, H
2
О, SO
2
, HCl, N
2
).
Например, сгорание нитробензола можно теоретически представить
в виде следующей реакции:
2
2
1
2
2
5
22
2
5,14
256
6 NOHCOONOHC
,
молькДжNOHCH
c
/2,3091)(
256
0
298,
.
Теплоты сгорания используют для расчетов тепловых эффектов
химических реакций, участниками которых являются органические со-
единения.
Второе следствие из закона Гесса: тепловой эффект химической
реакции равен разности между суммарными теплотами сгорания исход-
ных веществ и суммарными теплотами сгорания продуктов реакции
0
,
0
,
0
продc
i
iисхc
j
jr
HHH
. (1.17)
Например, для реакции:
0
2523352
)()()()(
r
НжОНжHCOOCCHжCOOHCHжOHHС
,
тепловой эффект химической реакции можно рассчитать:
.5,130)2,2254()8,873(9,1366)(
)()()(
2
0
523
0
3
0
52
00
кДжOНH
НСООССНHСООНСНHОННСHH
с
сссr
4. Метод термохимических уравнений
Термохимическое уравнение – уравнение, в котором указывается
агрегатное состояние веществ и тепловой эффект химической реакции.
Методом алгебраического сложения или вычитания термохимиче-
ских уравнений можно определить тепловой эффект требуемой реакции,
если известны тепловые эффекты других реакций получения этого про-
дукта. Термохимические уравнения можно складывать, вычитать, ум-
ножать на любой коэффициент, то есть выполнять любые алгебраиче-
ские действия.
Покажем применение метода термохимических уравнений на при-
мере ряда реакций окисления железа. При окислении железа возможно
образование оксида железа (III) по реакции:
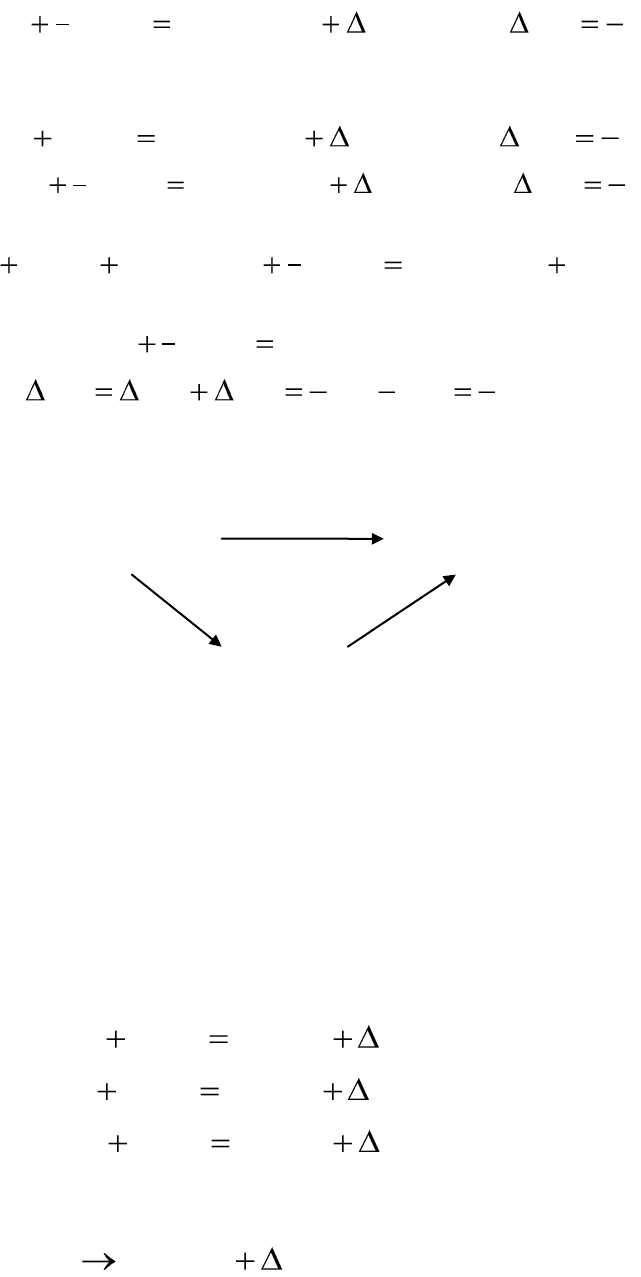
13
1)
кДжННтвOFeгOтвFe
rr
821;)()()(2
11322
2
3
.
Эта же реакция может осуществляться другим путем с образовани-
ем промежуточного продукта оксида железа (II):
2)
кДжННтвFeOгOтвFe
rr
527;)(2)()(2
222
,
3)
кДжННтвOFeгOтвFeO
rr
294;)()()(2
33322
2
1
.
Проведем алгебраическое сложение уравнений 2 и 3:
)()(2)()(2)()(2
322
2
1
2
твOFeтвFeOгOтвFeOгOтвFe
.
После сокращения одинаковых слагаемых получим:
.821294527
),()()(2
321
322
2
3
кДжHHH
твOFeгOтвFe
rrr
4. Метод термохимических схем
Процесс возгонки льда можно представить в виде схемы:
Н
2
О(тв) ΔН
возг
H
2
O(г)
ΔН
пл
ΔН
исп
Н
2
О(ж)
Согласно закону Гесса, тепловой эффект химической реакции не
зависит от пути ее протекания, поэтому ΔН
возг
= ΔН
пл
+ ΔН
исп
.
Пример 1.1. Рассчитайте теплоту аллотропного превращения:
1) аморфного углерода в графит; 2) графита в алмаз, если стандартные
теплоты сгорания аморфного углерода, графита и алмаза соответствен-
но равны: –409,2; –394,6 и –395,3 кДж/моль.
Решение:
Составляем термохимические уравнения сгорания аморфного угле-
рода, графита и алмаза:
1)
угл
C
угл
HгCOгOтвC )()()(
22
;
2)
гр
C
гр
HгCOгOтвC )()()(
22
;
3)
алм
C
алм
HгCOгOтвC )()()(
22
.
Уравнение реакции аллотропного перехода аморфного углерода в
графит и графита в алмаз запишутся в виде:
1
)()(
r
гругл
НтвCтвC
;
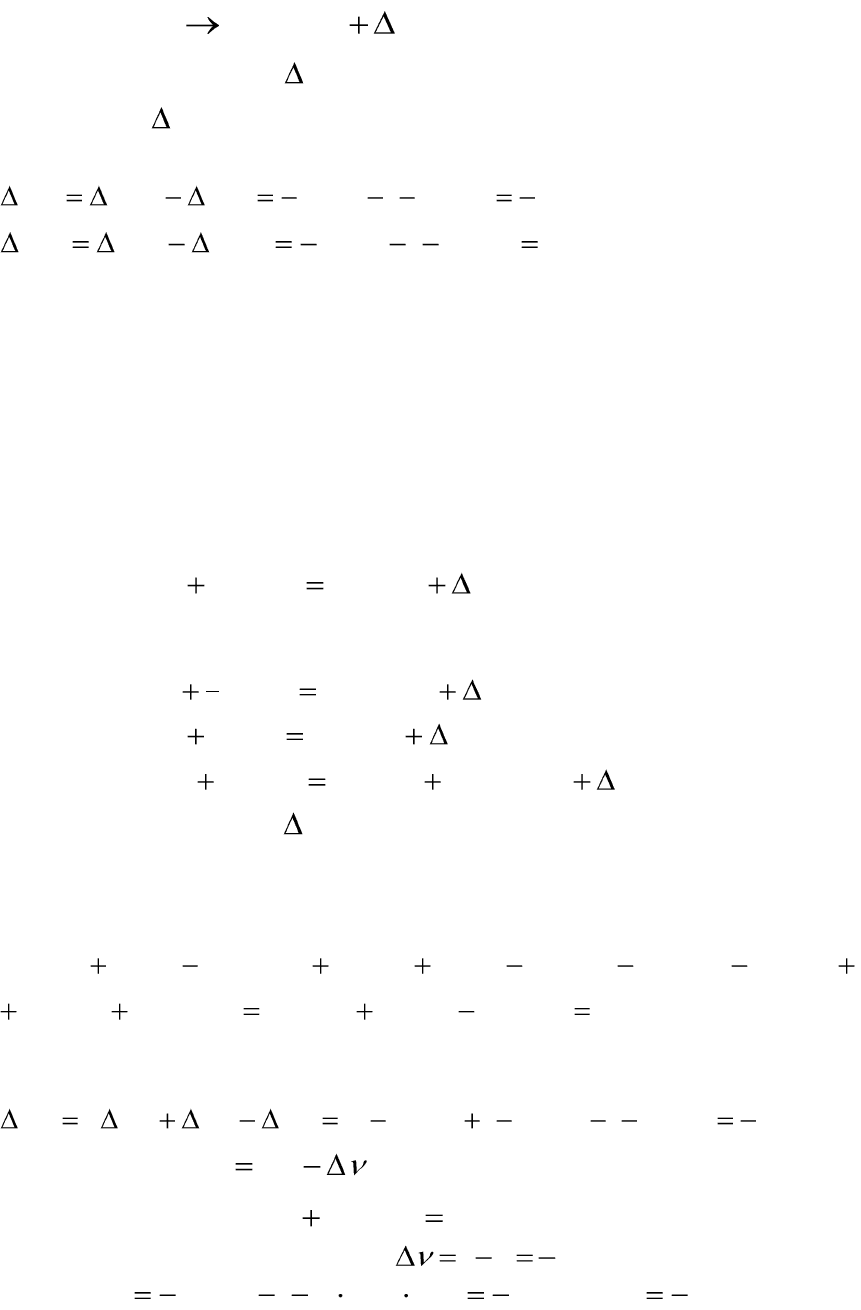
14
2
)()(
r
алмгр
НтвCтвC
.
Для вычисления
1r
Н
вычтем из уравнения 1 уравнение 2; для
вычисления
2r
Н
вычтем из уравнения 2 уравнение 3, аналогичные ал-
гебраические действия проводим и с тепловыми эффектами:
кДжНHH
гр
с
угл
cr
6,14)6,394(2,409
0
1
;
кДжНHH
алм
с
гр
cr
7,0)3,395(6,394
0
2
.
Пример 1.2. Теплоты образования жидкой воды и газообразного
диоксида углерода соответственно равны –285,8 и –393,5 кДж/моль. Те-
плота сгорания метана при тех же условиях равна –890,3 кДж/моль.
Рассчитайте теплоту образования метана из элементов при условиях:
1) р=const; 2) V=const, Т=298 К.
Решение:
Запишем термохимическое уравнение образования метана из эле-
ментов при (р=const):
1)
142
)()(2)( HгCHгHтвC
.
Запишем термохимические уравнения образования воды и диок-
сида углерода и термохимическое уравнение сгорания метана:
2)
222
2
1
2
)()()( HжОHгOгH
;
3)
322
)()()( HгCOгOтвC
;
4)
42224
)(2)()(2)( HжОHгСОгOгСH
.
Для вычисления
1
Н
проведем следующие алгебраические дей-
ствия с термохимическими уравнениями: Уравнение 2 умножим на 2,
прибавим уравнение 3 и вычтем уравнение 4, получим уравнение 1.
Проверим это:
0)()()(2)(2)(
)(2)()()()()()()(2
4222
2422222
гСНтвСгНгОНгСО
гОгСНгСОгОтвCжОHгOгH
Аналогичные алгебраические действия проведем и с тепловыми
эффектами:
кДжННHH 8,74)3,890()5,393()8,285(22
4321
При V=const:
RTQQ
pv
.
Для реакции
)()(2)(
42
гCHгHтвC
изменение числа моль га-
зообразных продуктов составит:
121
.
кДжДжQ
v
41,727241029831,8)1(74800
.
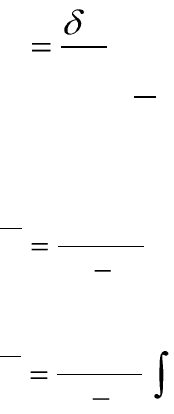
15
Теплоемкость
Количество теплоты, подведенное к термодинамической системе,
изменение внутренней энергии, энтальпии можно определить по тепло-
емкости вещества.
Теплоемкость – количество теплоты, необходимое для нагревания
единичного количества вещества на 1 К.
Различают удельную и молярную теплоемкость.
Удельная теплоемкость – количество теплоты, необходимое для
нагревания 1 г вещества на 1 К.
Удельная теплоемкость является экстенсивным термодинамиче-
ским параметром: теплоемкость 100 г воды в 100 раз больше теплоем-
кости 1 г воды (то есть количество теплоты, необходимое для нагрева-
ния 100 г вещества до той же самой температуры, в 100 раз больше, чем
для 1г вещества). Единицы измерения удельной теплоемкости Дж/(г·К).
Молярная теплоемкость – количество теплоты, необходимое для
нагревания 1 моль вещества на 1 К.
Молярная теплоемкость является интенсивным термодинамиче-
ским параметром (не зависит от массы вещества). При физико-
химических и термодинамических расчетах, как правило, используют
молярную теплоемкость вещества. Единицы измерения молярной теп-
лоемкости Дж/(моль·К).
Молярная теплоемкость бывает истинная и средняя.
Истинная молярная теплоемкость (С) – отношение бесконечно
малого количества теплоты к бесконечно малому изменению темпера-
туры:
dT
Q
C
. (1.18)
Средняя молярная теплоемкость (
C
) в интервале температур от
Т
1
до Т
2
– отношение конечного количества теплоты, подведенного к 1
моль вещества, отнесенное к разности температур Т
2
– Т
1
:
12
TT
Q
C
. (1.19)
Средняя теплоемкость связана с истинной соотношением:
2
1
12
1
T
T
CdT
TT
C
. (1.20)
Для вычисления истинной теплоемкости по средней используют
соотношение:

16
dT
TTCd
C
)([
12
. (1.21)
В зависимости от условий нагревания или охлаждения вещества
различают истинную молярную теплоемкость при постоянном объеме
С
V
и истинную молярную теплоемкость при постоянном давлении С
Р
:
VV
V
T
U
dT
Q
C
, (1.22)
PP
P
T
H
dT
Q
C
. (1.23)
В расчетах С
Р
определяют по опытным данным для С
V
и наоборот.
Разность теплоемкостей для идеального газа равна универсальной газо-
вой постоянной R (формула Майера):
С
р
– С
V
= R. (1.24)
Для конденсированных (твердых или жидких) веществ: С
р
= С
V
.
Большая величина теплоемкости означает, что данное количество
теплоты вызовет лишь небольшое повышение температуры. Бесконечно
большое значение теплоемкости означает, что, сколько бы теплоты ни
подводили к системе, ее температура не изменится (например, при фа-
зовом переходе – плавлении или испарении вещества).
Влияние температуры на теплоемкость
Теплоемкость твердых, жидких и газообразных веществ обычно
возрастает с увеличением температуры. Зависимость С
Р
от температу-
ры представляют в виде интерполяционных уравнений, полученных
опытным путем, и пригодных только в том температурном интервале, в
котором они получены экспериментально:
– для органических веществ
2
cTbTaC
P
; (1.25)
– для неорганических веществ
2
TcbTaC
P
, (1.26)
где а, b, с, с
/
– эмпирические коэффициенты.
В результате химического превращения одних веществ в другие те-
плоемкость системы изменяется на величину ΔС
р
, которая представляет

17
собой разность сумм молярных теплоемкостей продуктов реакции и ис-
ходных веществ, взятых с учетом стехиометрических коэффициентов:
исх
p
i
i
прод
p
j
jр
CCC
. (1.27)
Тогда зависимость изменения молярной теплоемкости системы от
температуры можно представить в виде:
...
22
TccTbTaC
P
(1.28)
Зависимость теплового эффекта химической ре-
акции от температуры. Закон Кирхгофа
По следствиям из закона Гесса можно рассчитать тепловой эффект
химической реакции только при стандартной температуре 298 К. Зави-
симость теплового эффекта химической реакции от температуры опи-
сывает закон Кирхгофа.
Закон Кирхгофа: температурный коэффициент теплового эффекта
химической реакции равен изменению теплоемкости веществ в резуль-
тате протекания этого процесса.
Температурным коэффициентом теплового эффекта называется ве-
личина, показывающая, как изменится тепловой эффект при изменении
температуры на 1 К.
Уравнение Кирхгофа в дифференциальной форме записывается в
виде:
– при р = const:
p
C
dT
Hd
; (1.29)
– при V = const:
V
C
dT
Ud
, (1.30)
где
исх
p
i
i
прод
p
j
jр
CCC
.
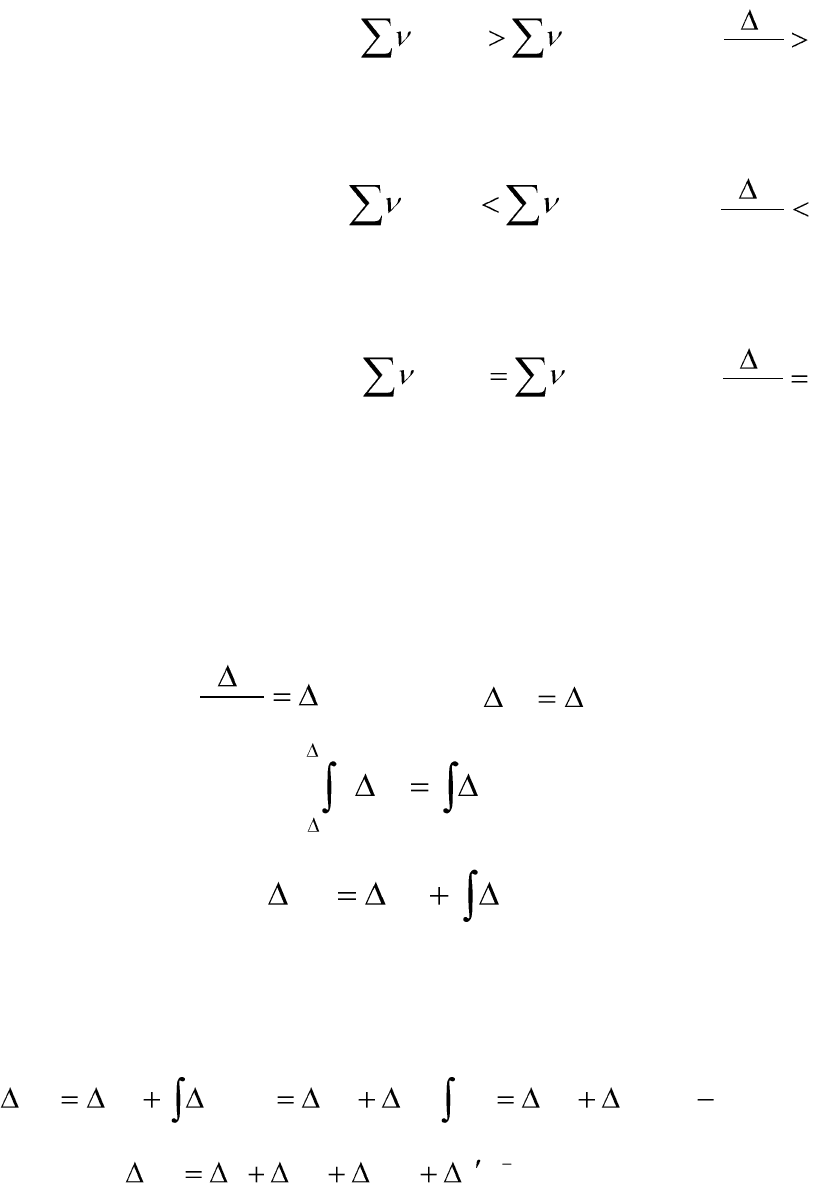
18
Исследование уравнения Кирхгофа
Зависимость теплового эффекта химической реакции от температу-
ры определяется знаком и величиной изменения теплоемкостей ве-
ществ, участвующих в реакции, например:
а) если ΔС
р
> 0, то есть
исх
p
i
i
прод
p
j
j
CC
, тогда
0
dT
Hd
,
следовательно, с увеличением температуры тепловой эффект химиче-
ской реакции увеличивается;
б) если ΔС
р
< 0, то есть
исх
p
i
i
прод
p
j
j
CC
, тогда
0
dT
Hd
,
следовательно, с увеличением температуры тепловой эффект химиче-
ской реакции уменьшается;
в) если ΔС
р
= 0, то есть
исх
p
i
i
прод
p
j
j
CC
, тогда
0
dT
Hd
,
следовательно, тепловой эффект химической реакции от температуры
не зависит.
Расчет тепловых эффектов химических реакций
по уравнению Кирхгофа
Для расчета тепловых эффектов химической реакции при любой
температуре уравнение Кирхгофа интегрируют:
p
C
dT
Hd
,
dTCHd
p
;
dTCHd
p
T
T
H
H
2
1
2
1
;
dTCHH
p
T
T
2
1
12
. (1.31)
При этом получают следующие уравнения для расчета тепловых
эффектов химической реакции при любых температурах:
1. При ΔС
р
= const:
)(
121112
2
1
2
1
TTCHdTCHdTCHH
p
T
T
pp
T
T
. (1.32)
2. При
22
TccTbTaC
P
:

19
21
3
1
3
2
2
1
2
2121
22
12
11
)(
3
)(
2
)(
)(
2
1
TT
cTT
c
TT
b
TTaH
dTTccTbTaHH
T
T
(1.33)
Пример 1.3. Определите тепловой эффект реакции
)(3)()()(
224
гHгСОгOHгСH
при 1200 К по справочным данным:
Вещество
0
298,f
H
а
b·10
3
c
/
·10
-5
СН
4
(г)
Н
2
О(г)
СО(г)
Н
2
(г)
–74,85
–241,81
–110,53
0
14,32
30,00
28,41
27,28
74,66
10,71
4,10
3,26
–17,43
0,33
–0,46
0,50
Решение:
1. Рассчитываем тепловой эффект реакции при стандартных усло-
виях по следствию из закона Гесса:
кДж
OHHCHНHНCOHH
ffff
13,206)81,241()85,74(0353,110
)()()(3)(
2
0
298,4
0
298,2
0
298,
0
298,298
2. Рассчитываем изменение эмпирических коэффициентов:
93,6500,3032,1428,27341,28
)()()(3)(
242
OHaCHaHaCOaa
;
33
242
1049,7110)71,1066,7426,3310,4(
)()()(3)( OHbCHbHbCObb
;
55
2
/
4
/
2
///
1014,1810)33,0)43,17(50,0346,0(
)()()(3)( OHcCHcHcCOcc
3. Рассчитываем тепловой эффект реакции при 1200 К по уравне-
нию (1.33):
кДжДж
H
4,2219,221388
1200
1
298
1
1014,18
)2981200(
2
1049,71
)2981200(39,65206130
5
22
3
1200
20
Второе начало термодинамики
Первое начало термодинамики позволяет решить многие вопросы
химии и химической технологии, связанные с определением количества
теплоты и работы при различных физических и химических процессах.
Однако на вопрос возможен ли данный процесс вообще и, если возмо-
жен, то в каком направлении и с какой полнотой он будет протекать в
заданных условиях, первое начало термодинамики ответить не может.
На этот вопрос отвечает второе начало термодинамики, которое, как и
первое начало термодинамики, является постулатом и имеет несколько
формулировок. Но прежде, чем приступить к формулировкам, необхо-
димо познакомиться с понятиями: процессы самопроизвольные и неса-
мопроизвольные, термодинамически обратимые и необратимые.
Основные понятия и определения
Самопроизвольные процессы – процессы, которые протекают без
вмешательства со стороны окружающей среды. Такие процессы сопро-
вождаются уменьшением внутренней энергии системы и передачей
энергии в окружающую среду в форме теплоты или работы, или, наобо-
рот, увеличением внутренней энергии за счет теплоты или работы, по-
лученной из окружающей среды. К самопроизвольным процессам отно-
сятся: переход теплоты от горячего тела к холодному, диффузия веще-
ства из области большей концентрации в область меньшей концентра-
ции, растекание одной жидкости по поверхности другой и т.д.
Несамопроизвольные процессы – процессы, которые сами собой
совершаться не могут, протекающие за счет «вмешательства извне».
Примерами таких процессов являются: переход теплоты от холодного
тела к горячему, переход вещества из области с меньшей концентрации
в область с большей концентрацией, выделение продуктов электролиза
на электроде за счет затраты электрической работы извне и т.д. Не са-
мопроизвольные процессы в изолированных системах невозможны.
Различают обратимые и необратимые процессы.
Обратимые процессы – процессы, после протекания которых, и
систему, и окружающую среду можно вернуть в первоначальное со-
стояние. При этом в обратном процессе система проходит через те же
промежуточные состояния, что и в прямом процессе, но в обратном по-
рядке. В обратимом процессе все термодинамические функции прини-
мают экстремальные значения. Например, работа, совершаемая в обра-
тимом процессе, наибольшая, она называется максимально полезной
работой. Обратимые процессы являются идеализацией реальных про-
