Михеева Е.В., Пикула Н.П. Физическая и коллоидная химия
Подождите немного. Документ загружается.

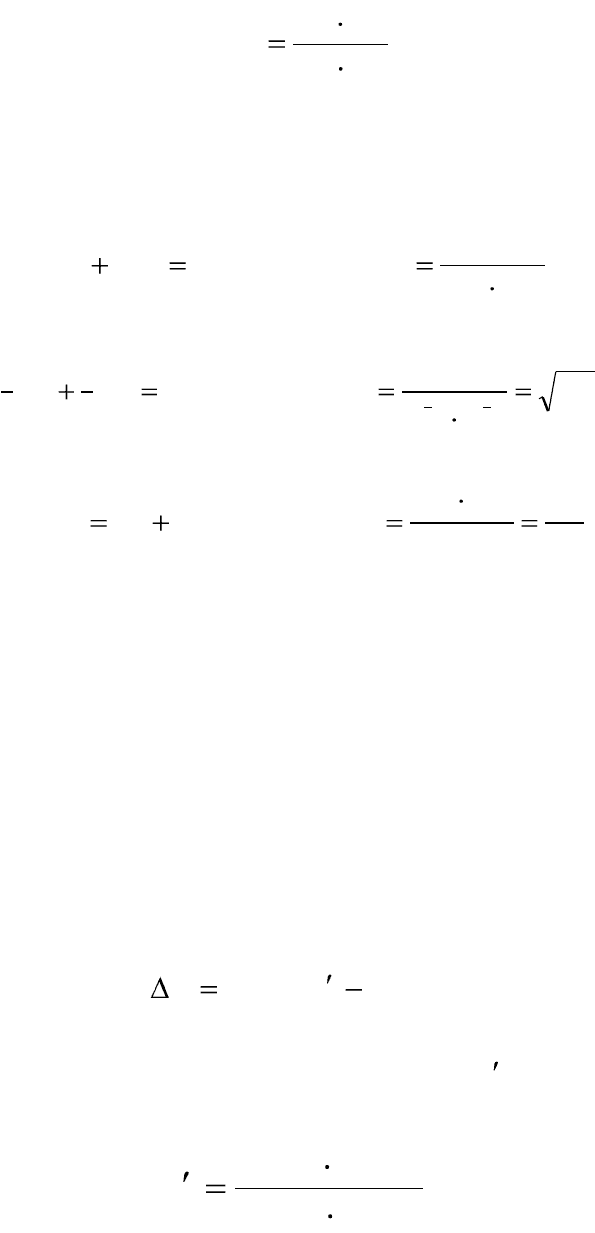
41
Для равновесной реакции, протекающей в газовой фазе аА + bB =
cC + dD, закон действующих масс запишется в виде:
b
B
a
A
d
D
c
C
p
pp
pp
K
. (2.1)
Выражение константы равновесия и ее числовое значение зависят
от того, в каком направлении и для каких количеств веществ написано
уравнение реакции.
Например, реакцию синтеза аммиака можно записать:
3
2
322
22
3
;23
HN
NH
p
pp
p
KNHHN
.
Та же реакция получения 1 моль аммиака запишется:
p
HN
NH
p
K
pp
p
KNHHN
2
3
2
2
1
2
3
/
32
2
3
2
2
1
;
.
При записи уравнения реакции в обратном направлении:
pNH
HN
p
Kp
pp
KHNNH
1
;32
2
3
//
223
3
22
.
Основное значение закона действующих масс состоит в том, что он
устанавливает связь между равновесными концентрациями всех участ-
ников реакции и позволяет рассчитывать численное значение константы
равновесия, которое является мерой полноты превращения исходных
веществ в продукты реакции. С помощью закона действующих масс
можно проводить расчет выхода продукта, степени диссоциации, опти-
мальных условий процесса и др.
Уравнение изотермы химической реакции
Связь между концентрациями реагентов в равновесной смеси и об-
щими условиями термодинамического равновесия устанавливает урав-
нение изотермы химической реакции:
pp
KRTПRTG lnln
, (2.2)
где ΔG – изменение энергии Гиббса в ходе химической реакции,
К
р
– константа равновесия химической реакции,
р
П
– произведение
начальных (неравновесных) парциальных давлений:
b
B
a
A
d
D
с
C
p
pp
pp
П
)()(
)()(
//
//
. (2.3)

42
Определение направления процесса по изотерме химической реакции
При изучении химической реакции важно знать, будет ли она про-
текать, а если будет, то в каком направлении. Из уравнения изотермы
химической реакции видно, что величина и знак энергии Гиббса зависят
от соотношения величин К
р
и
р
П
.
1. Если
pр
KП
, то ΔG < 0, процесс необратимый самопроиз-
вольный.
2. Если
pр
KП
, то ΔG = 0, состояние равновесия.
3. Если
pр
KП
, то ΔG > 0, процесс необратимый не самопроиз-
вольный.
Таким образом, при помощи уравнения изотермы химической ре-
акции можно расчетным путем предсказать направление реакции, если
известны константа равновесия и начальное содержание компонентов в
системе.
Уравнение химического сродства. Стандартная энергия
Гиббса реакции
Различные химические реакции можно сопоставлять по их способ-
ности к самопроизвольному протеканию при условии, что все участни-
ки реакции находятся в одинаковых (стандартных) состояниях. Для га-
зов таким условием является равенство неравновесных парциальных
давлений всех компонентов 1 атм:
0ln;1
11
11
;1
////
р
ba
dс
рBADC
ППатмpppp
.
Тогда из уравнения изотермы химической реакции получим:
00
ln
p
KRTG
, (2.4)
где
0
G
– стандартная энергия Гиббса реакции (энергия Гиббса
реакции при стандартных парциальных давлениях всех компонентов
системы, равных 1 атм),
0
p
K
– стандартная константа равновесия.
Уравнение (2.4) называют уравнением химического сродства (урав-
нением стандартной изотермы).
43
Различные способы выражения константы равновесия
Константа химического равновесия может быть выражена через
парциальные давления (р), молярные концентрации (С) и мольные доли
компонентов (х).
1. Выражение константы равновесия через равновесные парциаль-
ные давления компонентов (К
р
):
b
B
a
A
d
D
c
C
p
pp
pp
K
. (2.5)
2. Выражение константы равновесия через равновесные молярные
концентрации компонентов (К
с
):
b
B
a
A
d
D
c
C
C
CC
CC
K
. (2.6)
3. Выражение константы равновесия через равновесные мольные
доли компонентов (К
х
):
b
B
a
A
d
D
c
C
x
xx
xx
K
. (2.7)
Различные способы выражения константы химического равновесия
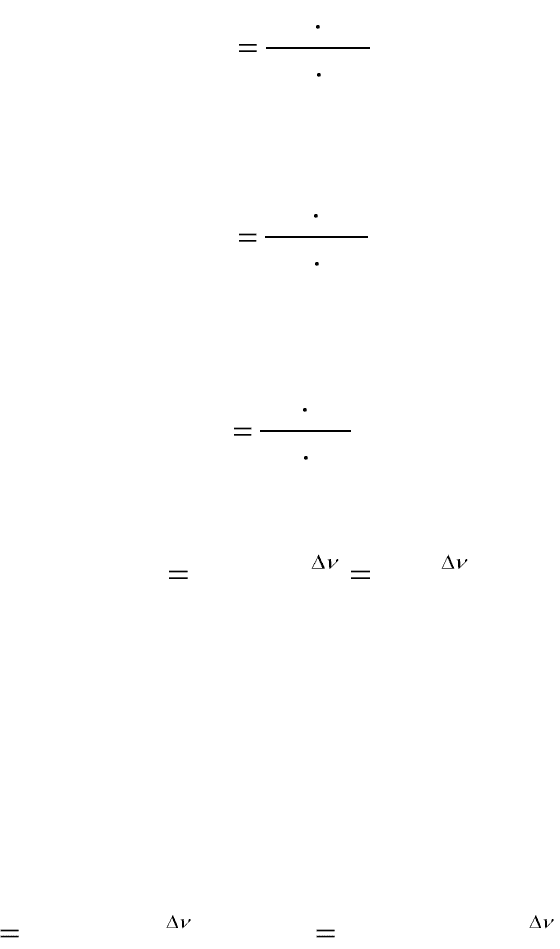
связаны между собой соотношением:
PKRTKK
xCp
)(
, (2.8)
где RT – произведение универсальной газовой постоянной и тем-
пературы; Р – общее давление газа; Δν=(с+d–a–b) – изменение сте-
хиометрических коэффициентов реагирующих веществ.
Единицы измерения констант равновесия оказываются очень раз-
ными, так как различны единицы измерения и показатели степеней ве-
личин. Подставляемых в уравнение закона действующих масс, поэтому
в некоторых случаях они не указываются. Если же единицы измерения
К
р
и К
с
(К
х
– безразмерная величина) необходимо указать, то следует
руководствоваться соотношениями:
][][;][][ молярностьKдавлениеK
Cp
(2.9)
где Δν – изменение стехиометрических коэффициентов реагирую-
щих веществ.
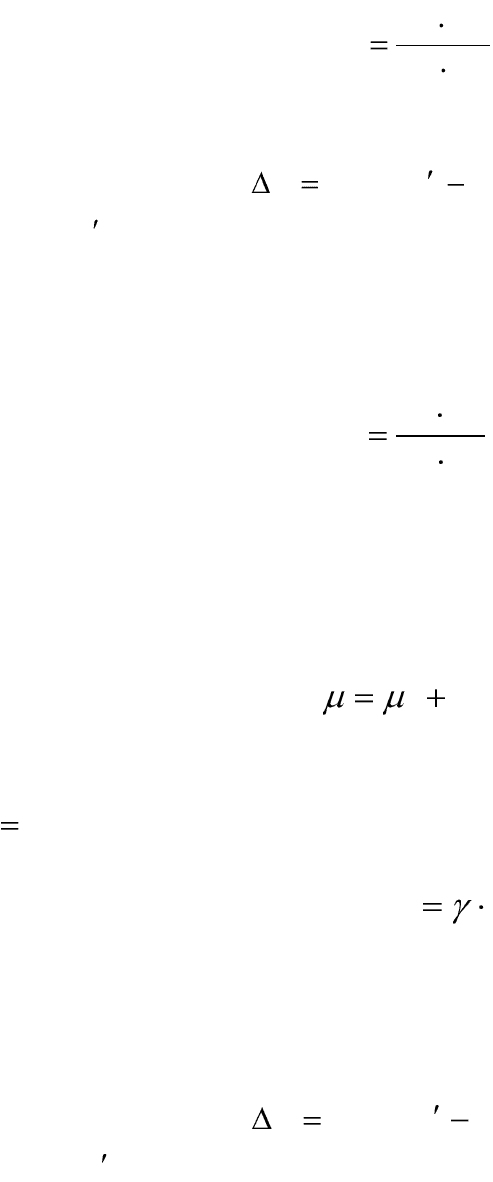
44
4. Выражение константы равновесия через фугитивность (для смеси
реальных газов) (К
f
):
b
B
a
A
d
D
c
C
f
ff
ff
K
, (2.10)
где f
i
– равновесные фугитивности компонентов.
В этом случае уравнение изотермы химической реакции примет вид:
ff
KRTПRTG lnln
, (2.11)
где:
f
П
– произведение начальных не равновесных фугитивностей
компонентов.
5. Выражение константы равновесия через активность (для реаль-
ных растворов) (К
а
):
b
B
a
A
d
D
c
C
a
aa
aa
K
, (2.12)
где а
i
– равновесные активности компонентов.
Активность – расчетная величина, которую нужно подставить в
выражение для химического потенциала идеального раствора вместо
концентрации, чтобы получить значение химического потенциала ре-
ального раствора:
i
aRT ln
0
, (2.13)
где μ
0
– стандартный химический потенциал реального раствора,
a
i
– активность i-ого компонента в растворе (в стандартном состоянии
1
0
i
a
).
Активность компонента связана сего концентрацией уравнением:
Ca
, (2.14)
где γ – коэффициент активности.
Коэффициент активности является мерой отклонения реального
раствора от идеального.
В случае неидеального раствора уравнение изотермы химической
реакции примет вид:
aa
KRTПRTG lnln
, (2.15)
где:
a
П
– произведение начальных неравновесных активностей
компонентов раствора.
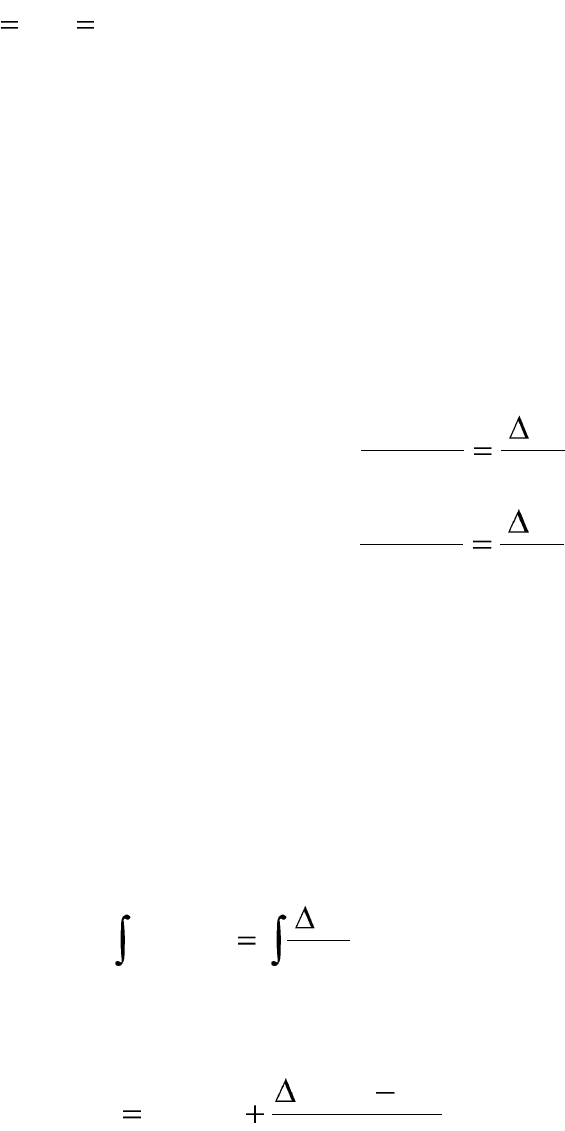
45
Выводы:
а) константа равновесия К
х
для реакций в газовой фазе в отличие
от констант равновесия К
р
и К
с
зависит от общего давления Р;
б) если реакция в газовой фазе протекает без изменения числа моль
(Δν=0), то
xCp
KKK
;
в) К
f
, К
а
также как и К
р
зависят только от температуры и являют-
ся термодинамическими константами равновесия;
г) значение изменения энергии Гиббса (ΔG) не зависит от способа
выражения константы равновесия.
Зависимость константы равновесия от температуры
Химическая термодинамика позволяет определить константу рав-
новесия химической реакции при какой-либо температуре по уравне-
нию изобары или изохоры химической реакции:
Уравнение изобары химической ре-
акции в дифференциальном виде
(р=const)
2
ln
RT
H
dT
Kd
p
. (2.16)
Уравнение изохоры химической ре-
акции в дифференциальном виде
(V=const)
2
ln
RT
U
dT
Kd
C
. (2.17)
Интегрирование уравнения изобары химической реакции
Для того, чтобы вычислить насколько изменится константа равно-
весия в результате изменения температуры на определенную величину,
уравнение изобары (изохоры) следует проинтегрировать. Примем, что
тепловой эффект химической реакции в небольшом интервале темпера-
тур постоянен и не зависит от температуры (ΔH=const). Проведем ин-
тегрирование уравнения изобары химической реакции:
1. Возьмем определенный интеграл в интервале температур Т
1
и Т
2
.
dT
RT
H
Kd
T
T
K
K
p
p
p
2
1
2
1
2
ln
. (2.18)
Получим уравнение, позволяющее рассчитать константу равнове-
сия химической реакции К
р2
при Т
2
, если известны К
р1
при Т
1
:
21
12
21
)(
lnln
TRT
TTH
KK
pp
. (2.19)
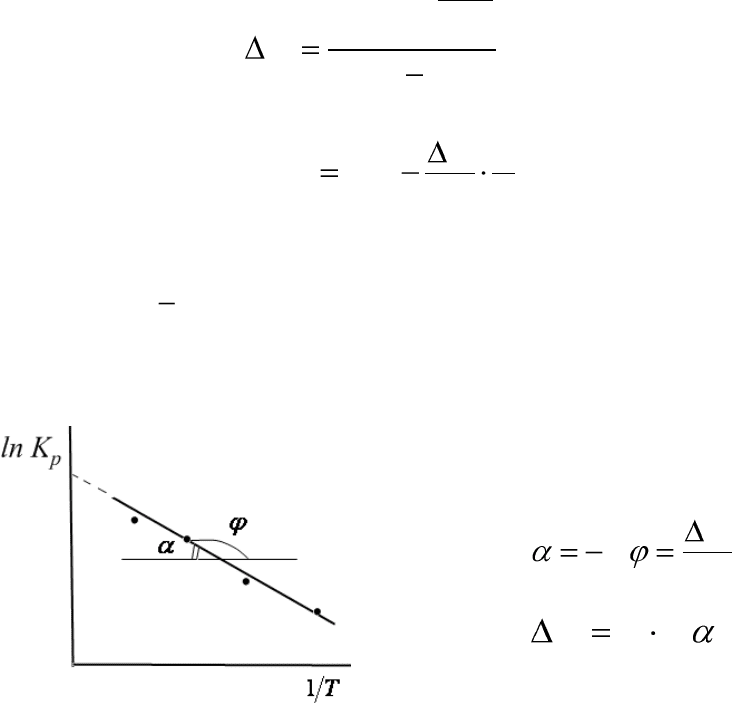
46
Получим уравнение, позволяющее рассчитать тепловой эффект хи-
мической реакции по константам равновесия при разных температурах:
12
1
2
21
ln
TT
K
K
TRT
H
p
p
. (2.20)
2. Возьмем неопределенный интеграл, получим уравнение прямой:
TR
H
BK
p
1
lnln
, (2.21)
где ln В – постоянная интегрирования.
Полученное уравнение представляет собой уравнение прямой в ко-
ординатах
TK
p
/1ln
, тангенс угла которой равен отношению тепло-
вого эффекта химической реакции к универсальной газовой постоянной.
Эту зависимость можно использовать для графического нахождения те-
плового эффекта химической реакции:
Рис.2.1. Линейная зависимость ln K
p
от
обратной температуры
R
H
tgtg
,
tgRH
(2.22)
Влияние давления и температуры на химическое равновесие.
Принцип Ле-Шателье
Принцип Ле-Шателье: если на систему, находящуюся в равнове-
сии оказывается внешнее воздействие, то в системе происходит такое
смещение равновесия, которое ослабляет это внешнее воздействие.
1. Влияние давления на смещение химического равновесия
Давление влияет на химическое равновесие в газовой фазе и равно-
весие гетерогенных реакций с участием газообразных веществ. Для вы-
яснения зависимости константы равновесия от давления используется
47
константа равновесия, выраженная через мольные доли компонентов К
х
(К
р
и К
с
от давления не зависят).
Из уравнения (2.8):
PKK
xp
, отсюда
P
K
K
p
x
, (2.23)
а) если в ходе химической реакции число моль компонентов увели-
чивается (Δν > 0), то при повышении общего давления (Р) константа
равновесия, выраженная через мольную долю (К
х
), уменьшается. Рав-
новесие сдвигается в сторону исходных веществ.
б) если в ходе химической реакции число моль компонентов
уменьшается (Δν < 0), то при повышении общего давления (Р) констан-
та равновесия, выраженная через мольную долю (К
х
), увеличивается.
Равновесие сдвигается в сторону продуктов реакции.
в) если в ходе химической реакции число моль компонентов не ме-
няется (Δν = 0), то изменение давления не влияет на положение равно-
весия химической реакции.
Аналогично трактует влияние давления и принцип Ле-Шателье:
при повышении давления равновесие сдвигается в сторону образования
веществ, занимающих меньший объем.
2. Влияние температуры на равновесие химической реакции
Влияние температуры на направление химической реакции позво-
ляет предвидеть уравнение изобары химической реакции:
2
ln
RT
H
dT
Kd
p
. (2.24)
Выражение
dTKd
p
/ln
называется температурным коэффициен-
том константы равновесия, знак которого определяется только знаком
теплового эффекта (R>0, Т
2
>0). Следовательно, для определения
влияния температуры на константу равновесия и выяснения направле-
ния смещения равновесия, необходимо определить знак теплового эф-
фекта процесса, при расчете которого возможны три случая:
а) если реакция эндотермическая (ΔН > 0), то
0/ln dTKd
p
, с
увеличением температуры константа скорости химической реакции то-
же увеличивается, равновесие сдвигается в сторону образования про-
дуктов реакции.
б) если реакция экзотермическая (ΔН < 0), то
0/ln dTKd
p
, с
увеличением температуры константа скорости химической реакции

48
уменьшается, равновесие сдвигается в сторону образования исходных
веществ.
в) если ΔН = 0, то
0/ln dTKd
p
, константа равновесия от
температуры не зависит.
Аналогично трактует влияние температуры и принцип Ле-Шателье:
при повышении температуры равновесие сдвигается в сторону процес-
са, протекающего с поглощением тепла.
Гетерогенное химическое равновесие
Гетерогенные реакции – реакции, в которых компоненты находятся
в разных фазах.
Для гетерогенных реакций константа равновесия (К
р
) определяется
толь через парциальные давления газообразных веществ и не зависит от
количества твердых и жидких веществ.
Например, для реакции CaCO
3(тв)
=CaO
(тв)
+СО
2(г)
константа
равновесия запишется в виде:
2
COp
pK
.
Пример 2.1. Определите К
р
для реакции: 2SO
2
+O
2
=2SO
3
, если
при 1000К и 1,013·10
5
Па из исходной смеси, содержащей 1 моль SO
2
и
0,6 моль O
2
, при достижении равновесия образовалось 0,22 моль SO
3
.
Решение:
Согласно уравнению реакции, на образование 0,22 моль SO
3
израс-
ходовано 0,22 моль SO
2
и 0,22/2=0,11 моль O
2
.
2SO
2
O
2
2SO
3
состав исходной смеси
1
0,6
0
состав равновесной смеси
1-0,22=0,78
0,6-0,11=0,49
0,22
Сумма моль всех компонентов в смеси:
49,122,049,078,0
i
n
.
Парциальные давления компонентов в момент равновесия равны:
Паp
SO
45
1031,510013,1
49,1
78,0
2
;
Паp
O
45
1022,310013,1
49,1
49,0
2
;
Паp
SO
45
105,110013,1
49,1
22,0
3
.
49
Константа равновесия реакции К
р
равна:
14
424
24
2
2
104,2
1022,3)1031,5(
)105,1(
22
3
Па
pp
p
K
OSO
SO
p
Пример 2.2. Степень диссоциации фосгена по реакции
22
ClCOCOCl
при 600°С и 1,38·10
5
Па равна 0,9. Определите, в
каком направлении будет протекать процесс при следующих значениях
парциальных давлений компонентов:
Вариант
Паp
COCl ,
2
Паp
CO,
Паp
Cl ,
2
1
1,013·10
5
1,013·10
5
1,013·10
5
2
1,048·10
5
2,026·10
5
3,039·10
5
3
1,048·10
5
3,039·10
5
3,039·10
5
Решение:
1.Определяем константу равновесия реакции:
СOCl
2
CO
CO
2
состав равновесной смеси
n (1 – α)
nα
nα
)1()1( nnnnnnnnn
i
.
P
n
n
p
COCl
)1(
)1(
2
;
P
n
n
pp
ClCO
)1(
2
,
Па
P
p
pp
K
COCl
ClCO
p
5
2
52
2
2
10883,5
9,01
1038,19,0
1
2
2
.
2. Направление процесса определяем по уравнению изотермы хи-
мической реакции (2.2):
кДжKПRTG
pp
76,1210883,5ln
10013,1
)10013,1(
ln87331,8)ln(ln.1
5
5
25
010883,5ln
10048,1
10039,310026,2
ln87331,8.2
5
5
55
G
кДжG 39,210883,5ln
10048,1
)10039,3(
ln87331,8.3
5
5
25
Следовательно, в первом случае процесс возможен в прямом на-
правлении; во втором случае система находится в состоянии равнове-
сия; в третьем случае процесс диссоциации фосгена не возможен, но
возможен обратный процесс образования фосгена из оксидов.

50
3. ФАЗОВОЕ РАВНОВЕСИЕ
Основные понятия и определения
Фазовые равновесия – равновесия в гетерогенных системах, в ко-
торых не происходит химического взаимодействия, а имеет место лишь
переход компонентов из одной фазы в другую или другие.
Фаза – гомогенная часть гетерогенной системы, находящаяся в
одном и том же агрегатном (и модификационном) состоянии, обладаю-
щая одинаковыми свойствами и имеющая четкую границу раздела, при
переходе через которую свойства системы меняются скачком.
Независимые компоненты – составляющие вещества, наимень-
шее число которых необходимо для однозначного выражения состава
каждой фазы при любых условиях существования системы.
Если в системе нет химического взаимодействия между компонен-
тами, то число независимых компонентов равно общему числу компо-
нентов системы. Так для смеси, состоящей из газообразных водорода,
гелия и аргона, между которыми нет химического взаимодействия,
число независимых компонентов равно числу составляющих веществ,
то есть трем.
При наличии химического взаимодействия между компонентами в
системе число независимых компонентов системы равно общему числу
компонентов минус число уравнений, связывающих равновесные кон-
центрации компонентов:
К=К
общ
-У.
В смеси трех газов HJ, H
2
и J
2
(гомогенная однофазная система)
возможна реакция
)(2)()(
22
гHJгJгH
. Между концентрациями трех
веществ устанавливается соотношение, определяемое константой рав-
новесия K
C
:
22
2
JH
HJ
C
CC
C
K
Поэтому, зная концентрации двух составляющих веществ, (напри-
мер HJ и Н
2
), можно определить концентрацию третьего (J
2
). Следова-
тельно, для данного случая число независимых компонентов равно
двум: К=3-1=2. Если концентрации водорода и йода в равновесной
смеси одинаковы (
22
JН
СС
), то К=3-2=1.
Число степеней свободы (вариантность системы) – число неза-
висимых переменных (температура, давление, концентрация), которые
