Михеева Е.В., Пикула Н.П. Физическая и коллоидная химия
Подождите немного. Документ загружается.

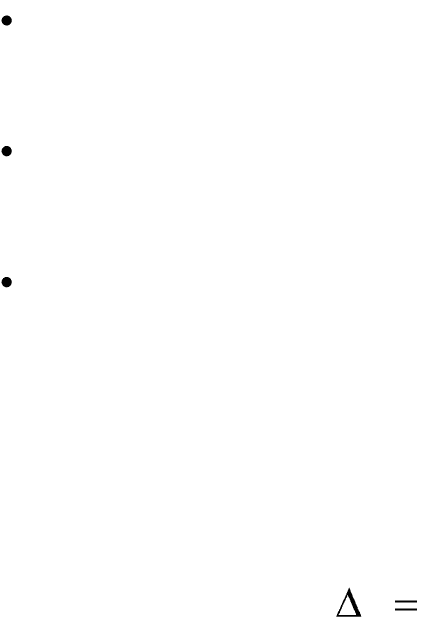
21
цессов. Экспериментально к ним можно приблизиться, но нельзя дос-
тигнуть.
Необратимые процессы – процессы, после протекания которых,
систему и окружающую среду одновременно нельзя вернуть в прежнее
состояние. При необратимом процессе систему можно вернуть в перво-
начальное состояние, но при этом в окружающей среде останутся неко-
торые изменения. К необратимым процессам относятся: механическое
трение твердых поверхностей, потеря тепла в окружающую среду, элек-
трическое сопротивление, переход вещества из области с высоким дав-
лением в область с низким давлением и т.д. Необратимые самопроиз-
вольные процессы протекают в направлении, которое приближает сис-
тему к состоянию равновесия.
Второе начало термодинамики. Энтропия
Второе начало термодинамики является одним из наиболее общих
законов природы, действие которого простирается на самые разные сис-
темы. Как и первое начало, второе начало термодинамики является по-
стулатом, все выводы, вытекающие из него, всегда находили подтвер-
ждение на опыте.
Формулировки второго начала термодинамики
никакая совокупность процессов не может сводиться к передаче те-
плоты от холодного тела к горячему, тогда как передача теплоты от го-
рячего тела к холодному является единственным результатом процесса
(формулировка Клаузиуса);
никакая совокупность процессов не может сводиться только к пре-
вращению теплоты в работу, тогда как превращение работы в теплоту
может быть единственным результатом процесса (формулировка Том-
сона);
невозможно создание вечного двигателя второго рода (формули-
ровка Оствальда). Под вечным двигателем второго рода понимают ма-
шину, которая производила бы работу только за счет поглощения теп-
лоты из окружающей среды без передачи части тепла холодильнику.
Приведенные формулировки сводятся к тому, что протекание са-
мопроизвольных процессов сопровождается рассеиванием тепла в ок-
ружающую среду. Для количественной характеристики рассеянной
энергии в 1865 г. Клаузиус ввел новую функцию состояния «энтро-
пия», которая является функцией теплоты процесса:
)(QfS
.

22
Физический смысл энтропии
Второе начало термодинамики – это обобщение наблюдений о том,
что в теплоту превращаются любые виды энергии в эквивалентных ко-
личествах, тогда как теплоту в другие виды энергии в эквивалентных
количествах превратить нельзя (из теплоты нельзя получить эквива-
лентное количество работы). При превращении теплоты в работу какое-
то количество теплоты всегда будет рассеиваться в окружающую среду.
В связи с этим внутреннюю энергию изолированной системы рас-
сматривают как сумму свободной и связанной энергий. Свободная энер-
гией – это та часть внутренней энергии, которая способна превращаться
в полезную работу. Связанная энергия – это та часть внутренней энер-
гии, которая рассеивается в виде теплоты и никогда, ни при каких усло-
виях не может превратиться в работу.
Мерой связанной энергии является энтропия. Величина энтропии
является критерием работоспособности изолированной системы: чем
больше S, тем больше связанная энергия (TS), и меньше свободная
энергия (так как их сумма – величина постоянная), тем меньше работо-
способность системы.
Энтропия характеризует интенсивность броуновского движения
частиц и меру беспорядка в системе и возрастает при любых процессах,
связанных с увеличением интенсивности движения частиц и хаотично-
сти их расположения в пространстве (повышение температуры, смеше-
ние, испарение, плавление, диссоциация молекул и т.д.).
Статистическая природа второго
начала термодинамики
Физический смысл энтропии объясняет и уравнение Больцмана, в
котором абсолютная энтропия связана с термодинамической вероятно-
стью процесса:
lnkS
, (1.34)
где S – абсолютная энтропия, k – постоянная Больцмана; ω – тер-
модинамическая вероятность процесса (число микросостояний, с помо-
щью которых осуществляется данное макросостояние).
Из уравнения (1.34) следует, что:
–энтропия является мерой термодинамической вероятности про-
цесса;
–энтропия является мерой неупорядоченности (беспорядка) в сис-
теме, поскольку, термодинамическая вероятность тем выше, чем больше
беспорядка в системе.

23
Энтропия вещества в газообразном состоянии будет всегда больше
энтропии этого же вещества в жидком состоянии, и больше, чем в твер-
дом, например:
мольК
Дж
мольК
Дж
мольК
Дж
гOHжOHтвOH
SSS
7,1880,703,39
)(
0
,298
)(
0
,298
)(
0
,298
222
Энтропия данного количества вещества увеличивается по мере ус-
ложнения молекул, например:
мольК
Дж
мольК
Дж
графитCалмазC
SS
74,537,2
)(
0
,298
)(
0
,298
,
мольК
Дж
мольК
Дж
гCOгCO
SS
66,21355,197
)(
0
,298
)(
0
,298
2
.
Математическая запись второго начала термодинамики
для обратимых процессов
Для обратимо протекающих процессов математическая запись вто-
рого начала термодинамики записывается в виде:
T
Q
dS
, (1.35)
где
TQ/
– приведенная теплота.
Для обратимых процессов в изолированной системе энтропия явля-
ется постоянной величиной:
0,0,0 SdSQ
обр
. (1.36)
Таким образом, для обратимых процессов второе начало термоди-
намики выступает как закон о существовании и сохранении энтропии.
Энтропия – функция состояния системы, ее изменение не зави-
сит от пути процесса, а зависит только от начального и конечного со-
стояния системы.
Энтропия – величина аддитивная. Энтропия равновесной систе-
мы равна сумме энтропий отдельных ее частей, а изменение энтропии
всей системы равно сумме изменений энтропий ее частей. Изменение
энтропии в сложном процессе равно сумме изменений энтропий в от-
дельных стадиях процесса:
ΔS
процесса
= ΔS
1
+ ΔS
2
+ ΔS
3
.
(1.37)
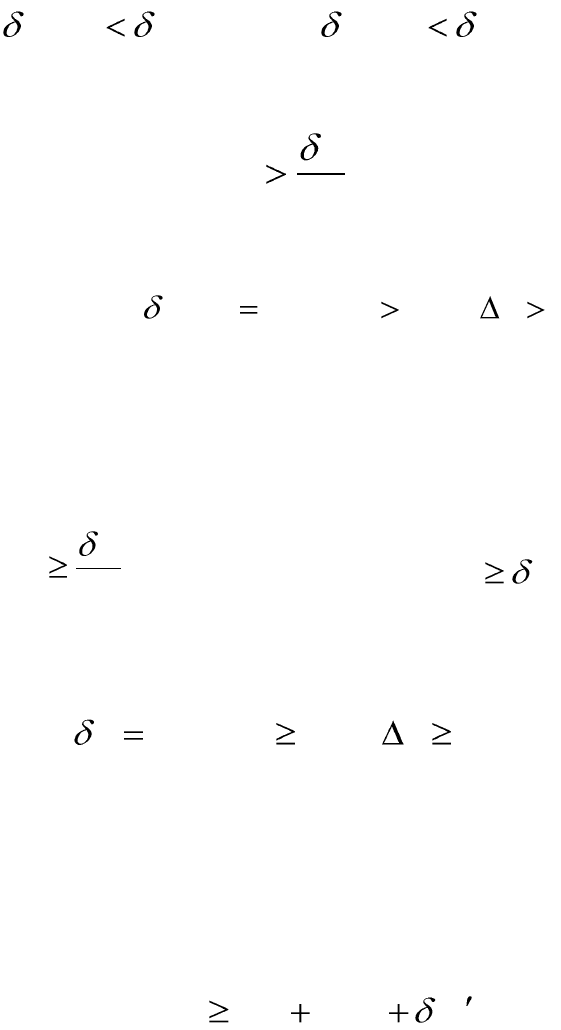
24
Математическая запись второго начала термодинамики
для необратимых процессов
Для необратимо протекающих процессов следствием второго нача-
ла термодинамики являются неравенства:
обрнеобробрнеобр
WWQQ ;
. (1.38)
Так как теплота в необратимом процессе меньше, чем в обратимом,
то математическая запись второго начала термодинамики имеет вид:
T
Q
dS
. (1.39)
Для необратимых самопроизвольных процессов в изолированной
системе:
0,0,0 SdSQ
необр
. (1.40)
Таким образом, для необратимых процессов второе начало термо-
динамики выступает как закон о существовании и возрастании энтро-
пии.
Для обратимых и необратимых процессов математическая за-
пись второго начала термодинамики имеет вид:
T
Q
dS
или
QTdS
. (1.41)
Знак равенства соответствует обратимым процессам, знак неравен-
ства – необратимым.
Для изолированных систем:
0,0,0 SdSQ
. (1.42)
Таким образом, в изолированных системах самопроизвольно мо-
гут совершаться лишь такие процессы, в результате которых эн-
тропия системы возрастает; процесс идет до тех пор, пока энтро-
пия не достигнет максимального для данных условий значения.
Подставляя вместо δQ выражение из первого начала термодинами-
ки получим объединенное уравнение первого и второго начал термо-
динамики:
WpdVdUTdS
. (1.43)
25
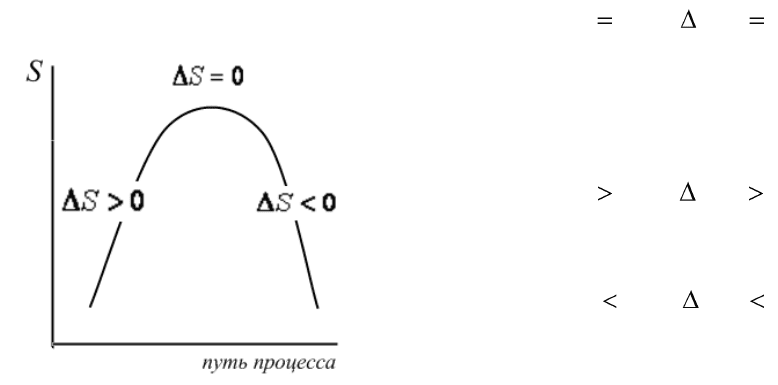
Изменение энтропии как критерий направления процесса
в изолированной системе
Изменение энтропии является критерием направления процесса в
изолированной системе. Изолированная система имеет постоянную
внутреннюю энергию и постоянный объем (U, V=const).
Рис.1.1. Изменение энтропии при
протекании процесса
Если
0,0
,, VUVU
SdS
, то в
изолированной системе протекает об-
ратимый равновесный процесс. В этом
случае энтропия достигает максималь-
но возможной величины.
Если
0,0
,, VUVU
SdS
, то в
изолированной системе протекает не-
обратимый самопроизвольный процесс.
Если
0,0
,, VUVU
SdS
, то в
изолированной системе протекает не-
обратимый не самопроизвольный про-
цесс. Такие процессы термодинамиче-
ски не вероятны и в изолированной
системе не осуществимы.
Расчет изменения энтропии в различных процессах
Большинство реальных процессов необратимо, то есть рассчитать
энтропию нельзя.
Так как энтропия является функцией состояния системы, то ее из-
менение в обратимом и необратимом процессе одинаково. Для вычис-
ления изменения энтропии в данном реальном необратимом процессе,
этот процесс (мысленно) разбивают на стадии, которые проводятся об-
ратимо и вычисляют для них изменение энтропии для обратимых про-
цессов, суммируют изменение энтропии всех обратимых стадий и полу-
чают изменение энтропии в данном необратимом процессе.
Например, для расчета изменения энтропии в необратимом процес-
се нагревания льда, находящегося при Т= –10°С до состояния жидкой
воды при Т=10°С (ΔS
проц
), процесс разбиваем на три обратимые стадии:
стадию нагревание льда от Т= –10°С до Т=0°С (ΔS
1
); стадию фазового
перехода – плавления льда (ΔS
2
); стадию нагревания воды от Т=0°С до
Т=10°С (ΔS
3
), тогда: ΔS
процесса
= ΔS
1
+ ΔS
2
+ ΔS
3.
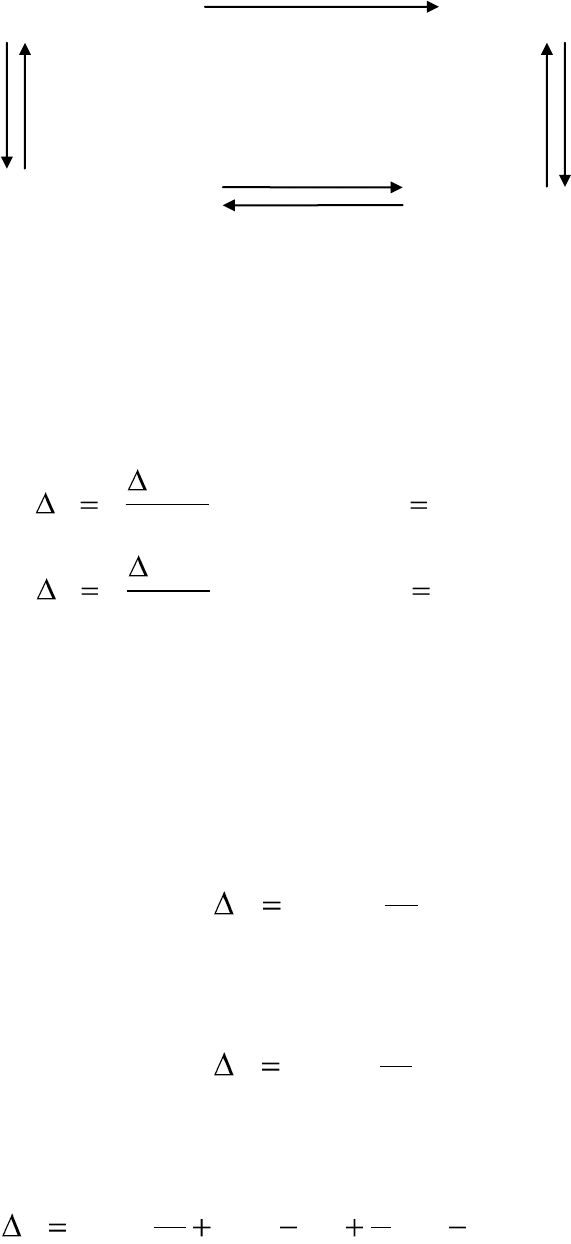
26
ΔS
проц
H
2
O
(тв)
(Т=-10°С) H
2
O
(ж)
(Т=10°С)
ΔS
1
нагревание нагревание ΔS
3
ΔS
2
H
2
O
(тв)
(Т=0°С) H
2
O
(ж)
(Т=0°С)
фазовый переход
Рассмотрим, как рассчитывается энтропия в различных процессах.
1. Расчет изменения энтропии в процессе фазового перехода
Процессы фазового перехода (плавление, испарение, возгонка)
проходят при постоянной температуре (Т=const). Изменение энтропии
рассчитывают по уравнениям:
)(
..
constVпри
T
U
nS
пф
; (1.44)
)(
..
constpпри
T
H
nS
пф
, (1.45)
где ΔU
ф.п.
и ΔН
ф.п
.
– теплоты фазового перехода, Т – абсолютная
температура фазового перехода, n – число моль.
2. Расчет изменения энтропии при нагревании жидких или
твердых тел от Т
1
до Т
2
а) процесс протекает при постоянном объеме и теплоемкости
(V, C
V
= const):
1
2
ln
T
T
nCS
V
, (1.46)
б) процесс протекает при постоянном давлении и теплоемкости
(р, C
р
= const):
1
2
ln
T
T
nCS
p
, (1.47)
в) процесс протекает при постоянном давлении (р = const), тепло-
емкость зависит от температуры (C
р
= а+bT+cT
2
):
)](
2
)(ln[
2
1
2
212
1
2
TT
c
TTb
T
T
anS
. (1.48)
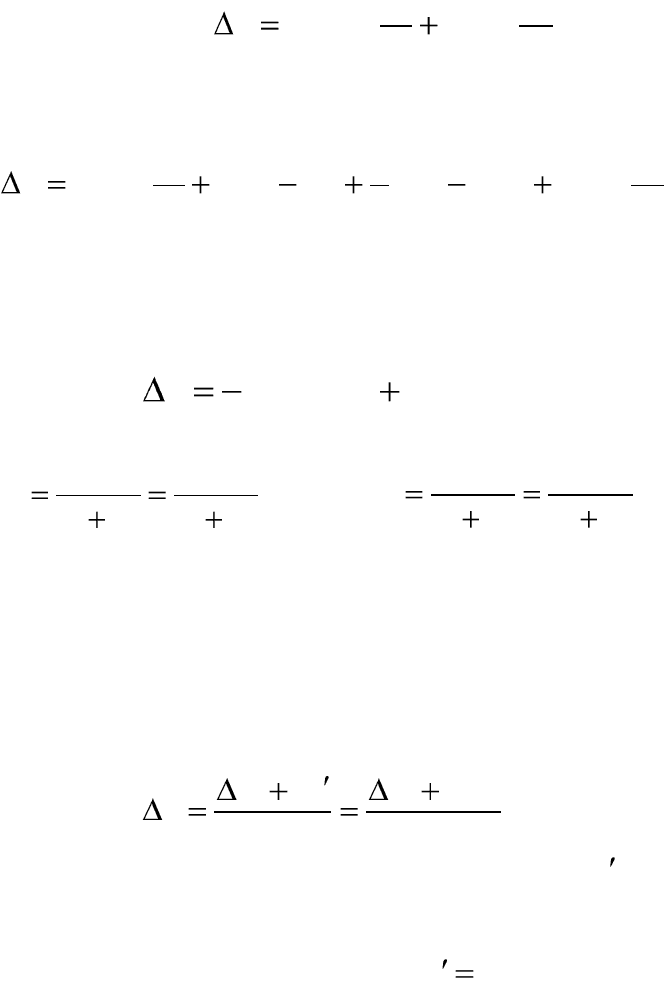
27
3. Расчет изменения энтропии при нагревание идеального газа
от Т
1
до Т
2
а) процесс протекает при постоянной теплоемкости газа
(C
V
= const):
1
2
1
2
lnln
V
V
nR
T
T
nCS
V
, (1.49)
б) при протекании процесса теплоемкость зависит от температуры
(C
V
= а+bT+cT
2
):
1
2
2
1
2
212
1
2
ln)](
2
)(ln[
V
V
nRTT
c
TTb
T
T
anS
. (1.50)
4. Расчет изменения энтропии при взаимной диффузии газов
Изменение энтропии при взаимной диффузии двух идеальных газов
с образованием 1 моль смеси газов рассчитывается по уравнению:
)lnln(
2211
xxxxRS
, (1.51)
где х – мольная доля газа в смеси:
21
1
21
1
1
VV
V
nn
n
x
;
21
2
21
2
2
VV
V
nn
n
x
. (1.52)
5. Расчет изменения энтропии в обратимо работающем элек-
трохимическом элементе
Изменение энтропии при необратимой химической реакции, проте-
кающей при постоянном давлении и температуре, например, в обратимо
работающем электрохимическом элементе рассчитывается по уравне-
нию:
T
zFEH
T
WH
S
, (1.53)
где ΔН – тепловой эффект химической реакции;
W
– максималь-
но полезная работа химической реакции, то есть работа химической ре-
акции, которую можно определить, например, по ЭДС обратимо рабо-
тающего электрохимического элемента (
zFEW
); z – число электро-
нов, участвующих в электродной реакции на одну реагирующую части-
цу; F – постоянная Фарадея, равная 96500 Кл; Е – электродвижущая си-
ла электрохимического элемента.

28
6. Расчет изменения энтропии для химической реакции по зна-
чениям стандартных абсолютных энтропий
0
298
S
Согласно третьему началу термодинамики (постулат Планка), эн-
тропия правильно образованного кристалла при абсолютном нуле
температуры равна нулю. Этот постулат позволяет проводить расчет
значений абсолютных энтропий S. Абсолютная энтропия чистого веще-
ства увеличивается с температурой по уравнению:
Т
Т
гр
исп
исп
Т
Т
жр
пл
пл
T
твр
исп
исп
пл
пл
Т
dTС
Т
H
Т
dTС
Т
H
Т
dTС
S
)()(
0
)(
0
(1.54)
Как видно из уравнения (1.54), с увеличением температуры
Рис.1.2. Изменение энтропии при
повышении температуры
энтропия возрастает, причем,
при нагревании вещества воз-
растание энтропии носит плав-
ный характер, а в области фазо-
вых переходов наблюдается
скачкообразное возрастание эн-
тропии, что связано с резким
увеличением беспорядка в сис-
теме. Рассчитанные по уравне-
нию (1.54) абсолютные значения
энтропии при стандартных ус-
ловиях
0
298
S
, приводятся в
справочниках физико-химических величин. По этим значениям рассчи-
тывают изменение энтропии при Т=298 К по уравнению:
исх
исх
прод
прод
SSS
298298
0
(1.55)
Пример 1.4. Рассчитайте изменение энтропии при нагревании
1 моль Cd от 25 до 727°С, если температура и теплота плавления кадмия
соответственно равны 321°С и 6109 Дж/моль. Зависимость изменения
теплоемкости от температуры для Cd(тв) выражена уравнением:
Кмоль
Дж
ТC
твCd
р
3)(
1030,1222,22
;
Кмоль
Дж
C
жCd
р
83,29
)(
.
Решение:
Данный процесс состоит из трех стадий: 1) нагревания твердого
кадмия до температуры плавления; 2) плавление кадмия; 3) нагревания
жидкого кадмия.
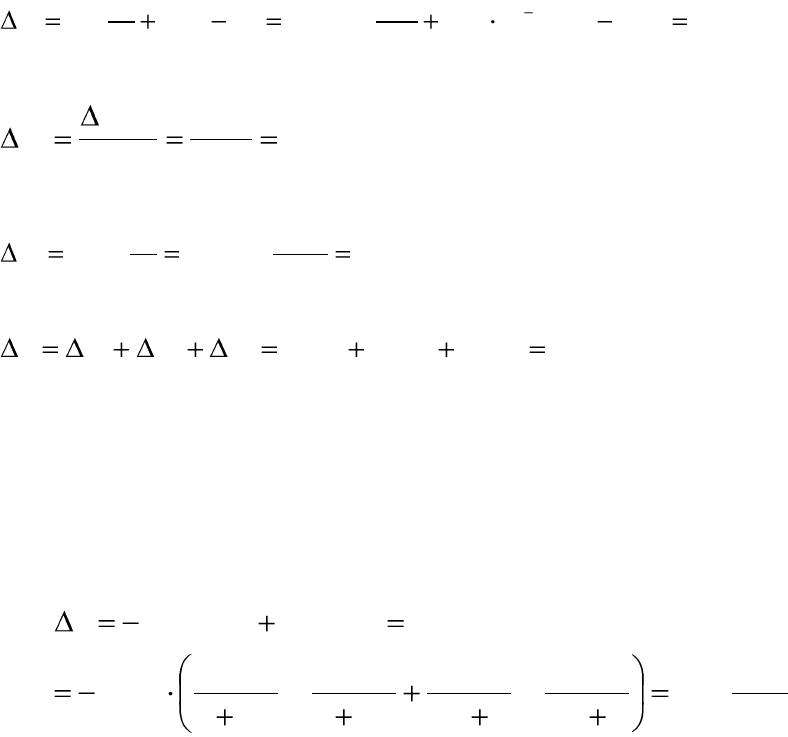
29
1) Изменение энтропии в 1 стадии:
КДжTTb
T
T
aS /18,16)298594(103,12
298
594
ln22,22)(ln
3
12
1
2
1
.
2) Изменение энтропии в процессе фазового перехода:
КДж
T
H
S
пф
пф
/28,10
594
6109
..
..
2
3) Изменение энтропии в 3 стадии:
КДж
T
T
СS
р
/28,19
594
1000
ln83,29ln
1
2
3
4) Общий прирост энтропии составит:
КДжSSSS /74,4528,1928,1018,16
321
Пример 1.5. При 298 К смешиваются 4 моль водорода и 2,5 моль
углекислого газа. Рассчитайте энтропию в получившейся смеси газов.
Решение:
Изменение энтропии при взаимной диффузии двух идеальных газов
рассчитаем по уравнениям (1.51) и (1.52):
К
Дж
xxxxRS
54,5
45,2
5,2
ln
45,2
5,2
5,24
4
ln
5,24
4
314,8
)lnln(
2211
Вопросы для самоконтроля
1. Для каких целей используются уравнения первого и второго начала
термодинамики?
2. Можно ли по первому началу термодинамики определить возмож-
ность протекания и направление процесса? Почему?
3. Каковы основные свойства энтропии?
4. Охарактеризуйте основные методы определения тепловых эффек-
тов химической реакции.
5. Каким образом можно рассчитать тепловой эффект реакции при
любой температуре?
6. При каких условиях по величине изменения энтропии можно су-
дить о направлении процесса?
30
Термодинамические потенциалы
Изменение энтропии однозначно определяет направление и предел
самопроизвольного протекания процесса лишь для изолированных сис-
тем. На практике же приходится иметь дело с системами, взаимодейст-
вующими с окружающей средой. Многие процессы химической техно-
логии протекают при постоянных давлении и температуре в открытых
системах или при постоянных объеме и температуре в закрытых систе-
мах (автоклавах). Критериями равновесия и направления процесса в та-
ких системах являются термодинамические потенциалы.
Энергией называется способность тела совершать работу. Чем
большим запасом энергии обладает тело, тем большую работу оно спо-
собно произвести. Запас энергии, меру работоспособности тела называ-
ют эго потенциалом. Таким образом, потенциал – это величина, харак-
теризующая ту часть полной энергии системы, которую она может из-
расходовать на совершение работы. В химической термодинамике рабо-
тоспособность системы характеризуется термодинамическими потен-
циалами. Наиболее часто используемыми среди них являются: энергия
Гиббса (G) – изобарно-изотермический потенциал и энергия Гельм-
гольца (А) – изохорно-изотермический потенциал.
Энергия Гиббса
Физический смысл энергии Гиббса
Для выяснения физического смысла энергии Гиббса запишем объе-
диненное уравнение первого и второго начал термодинамики:
WpdVdUTdS
. (1.56)
Решим это уравнение относительно полезной работы
W
:
TdSpdVdUW
. (1.57)
В обратимом процессе полезная работа имеет наибольшее значение
и называется максимально полезной работой
max
W
. В случае обрати-
мого процесса при р,Т=const:
dGTSHdTSpVUdW )()(
, (1.58)
Где функция состояния
TSHTSpVUG
называется
энергией Гиббса (изобарно-изотермический потенциал).
Из уравнения (1.58) вытекает физический смысл энергии Гиббса:
dGW
. (1.59)
