Михеева Е.В., Пикула Н.П. Физическая и коллоидная химия
Подождите немного. Документ загружается.

31
При постоянных давлении и температуре максимально полез-
ная работа для обратимого процесса совершается за счет уменьше-
ния энергии Гиббса.
То есть любая термодинамическая система всегда стремится к
уменьшению термодинамического потенциала до минимального в дан-
ных условиях значения. Это стремление, называемое химическим срод-
ством (стремление вступить в химическое взаимодействие), является
движущей силой процесса. За количественную меру химического срод-
ства принята величина максимально полезной работы, равная убыли со-
ответствующего термодинамического потенциала. В изобарно-
изотермических условиях мерой химического сродства является убыль
энергии Гиббса.
Энергия Гиббса как критерий направления процесса
Термодинамически необратимый самопроизвольный процесс в не-
изолированной системе всегда идет с уменьшением термодинамическо-
го потенциала. Поэтому величину изменения термодинамического по-
тенциала можно использовать в качестве критерия принципиальной
возможности процесса, его направленности, а также в качестве крите-
рия равновесия в системе.
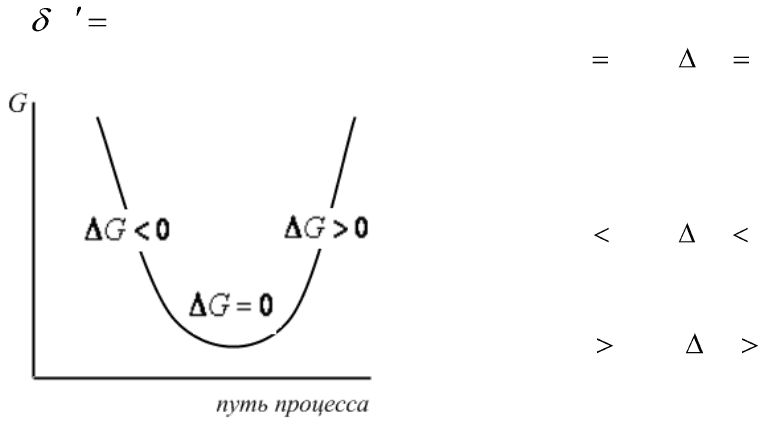
Изменение энергии Гиббса является критерием направления про-
цесса в открытых системах при р,Т=const. В отсутствие полезной рабо-
ты
0W
:
Рис.1.3. Изменение энергии Гиббса
при протекании процесса
Если
0,0 GdG
, то в
системе протекает обратимый рав-
новесный процесс. В этом случае
энергия Гиббса достигает мини-
мально возможного значения.
Если
0,0 GdG
, то в
системе протекает необратимый са-
мопроизвольный процесс.
Если
0,0 GdG
, то в
системе протекает необратимый не
самопроизвольный процесс. Такие
процессы протекают лишь при со-
вершении работы извне над систе-
мой.

32
Поведение всякой термодинамической системы определяется одно-
временным действием двух факторов: энтальпийного – стремление сис-
темы к минимуму тепловой энергии и энтропийного – стремление сис-
темы к максимальному беспорядку.
Величина стандартного изменения энергии Гиббса
0
298
G
есть мера
химического сродства исходных веществ.
По уравнению
STHG
можно сделать заключение о
возможности протекания химических процессов:
1. Экзотермические реакции (ΔН < 0):
а) если ΔS > 0, то ΔG < 0, экзотермические реакции, сопровож-
дающиеся увеличением энтропии, всегда протекают самопроизвольно;
б) если ΔS < 0, то процесс будет идти самопроизвольно при
ΔН > TΔS (при низких температурах).
2. Эндотермические реакции (ΔН > 0):
а) если ΔS > 0, то процесс будет идти самопроизвольно при
ΔН < TΔS (при высоких температурах).
б) если ΔS < 0, то ΔG > 0, самопроизвольное протекание эндо-
термических реакций, сопровождающихся уменьшением энтропии, не-
возможно.
Расчет изменения энергии Гиббса в различных процессах
Изменение энергии Гиббса в обратимом процессе можно рассчи-
тать по уравнению:
SdTVdpdG
. (1.60)
Из уравнения (1.60) следует, что энергия Гиббса увеличивается с
ростом давления и уменьшается с повышением температуры.
Энергия Гиббса является функцией состояния системы и величиной
аддитивной. Если процесс является сложным и необратимым, то его
(мысленно) разбивают на обратимые стадии, рассчитывают изменение
энергии Гиббса для каждой из обратимых стадий и находят изменение
энергии Гиббса в сложном необратимом процессе:
обрнеобр
GG
. (1.61)
Рассмотрим, как рассчитывается изменение энергии Гиббса в раз-
личных процессах.

33
1. Расчет изменения энергии Гиббса в изотермическом процессе
расширения или сжатия n моль идеального газа
При расширении или сжатии n моль идеального газа при постоян-
ной температуре изменение энергии Гиббса рассчитывается по уравне-
нию:
2
1
1
2
lnln
V
V
nRT
p
p
nRTG
. (1.61)
2. Расчет изменения энергии Гиббса в изотермическом процессе
расширения или сжатия жидких и твердых тел
При изотермическом расширении или сжатии n моль жидких или
твердых тел изменение энергии Гиббса рассчитывается по уравнению:
)(
12
ppnVG
. (1.62)
3. Расчет изменения энергии Гиббса в обратимо работающем
электрохимическом элементе
Изменение энергии Гиббса в обратимо работающем электрохими-
ческом элементе рассчитывается по уравнению:
zFEG
. (1.63)
4. Расчет изменения энергии Гиббса химической реакции по зна-
чениям стандартных энтальпий и энтропий
Изменение энергии Гиббса химической реакции можно рассчитать
с использованием справочных значений термодинамических свойств
простых веществ и соединений. Для химической реакции, протекающей
в стандартных условиях (Т=298 К, р=1,013·10
5
Па), изменение энергии
Гиббса рассчитывают двумя способами:
а) по стандартным значениям изменений энергии Гиббса при обра-
зовании данного вещества из простых веществ
0
298,f
G
:
исх
fисх
прод
fпрод
GGG
298,298,
0
(1.64)
б) по стандартным значениям изменений энтальпий образования
0
298,f
H
и абсолютных энтропий
0
298
S
веществ, используя уравнения:
000
STHG
, (1.65)
исх
fисх
прод
fпрод
ННH
298,298,
0
, (1.66)
исх
исх
прод
прод
SSS
298298
0
. (1.67)
34
Энергия Гельмгольца
Физический смысл энергии Гельмгольца
Для выяснения физического смысла энергии Гельмгольца запишем
объединенное уравнение первого и второго начал термодинамики:
WpdVdUTdS
. (1.68)
Решим это уравнение относительно полезной работы
W
:
TdSpdVdUW
. (1.69)
В обратимом процессе полезная работа имеет наибольшее значение
и называется максимально полезной работой
max
W
. В случае обрати-
мого процесса при V,Т=const:
dATSUdW )(
. (1.70)
Где функция состояния
TSUA
называется энергией Гельм-
гольца (изохорно-изотермический потенциал).
Из (1.70) вытекает физический смысл энергии Гельмгольца:
dAW
При постоянных объеме и температуре максимально полезная
работа для обратимого процесса совершается за счет уменьшения
энергии Гельмгольца.
Энергия Гельмгольца как критерий направления процесса
Изменение энергии Гельмгольца является критерием направления
процесса в закрытых системах при V,Т=const. В отсутствие полезной
работы
0W
:
Рис.1.4. Изменение энергии Гельм-
гольца при протекании процесса
Если
0,0 AdA
, то в
системе протекает обратимый рав-
новесный процесс. В этом случае
энергия Гельмгольца достигает ми-
нимально возможного значения.
Если
0,0 AdA
, то в
системе протекает необратимый са-
мопроизвольный процесс.
Если
0,0 AdA
, то в
системе протекает необратимый не
самопроизвольный процесс. Такие
процессы протекают лишь при совершении работы извне над системой.
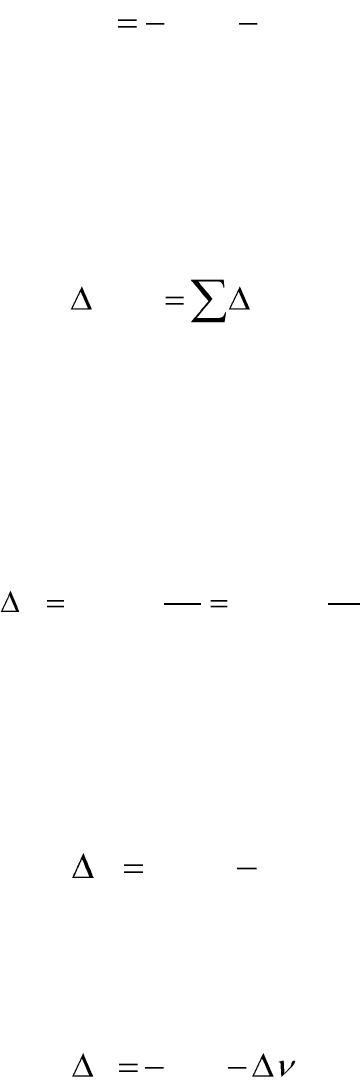
35
Расчет изменения энергии Гельмгольца
в различных процессах
Изменение энергии Гельмгольца в обратимом процессе можно рас-
считать по уравнению:
SdTpdVdA
. (1.71)
Из уравнения (1.71) следует, что энергия Гельмгольца убывает при
возрастании объема и температуры.
Энергия Гельмгольца является функцией состояния системы и ве-
личиной аддитивной. Если процесс является сложным и необратимым,
то его (мысленно) разбивают на обратимые стадии, рассчитывают изме-
нение энергии Гельмгольца для каждой из обратимых стадий и находят
изменение энергии Гельмгольца в сложном необратимом процессе:
обрнеобр
AA
. (1.72)
Рассмотрим, как рассчитывается энергия Гельмгольца в различных
процессах.
1. Расчет изменения энергии Гельмгольца в изотермическом
процессе расширения или сжатия n моль идеального газа
При расширении или сжатии n моль идеального газа при постоян-
ной температуре изменение энергии Гельмгольца рассчитывается по
уравнению:
2
1
1
2
lnln
V
V
n RT
p
p
n RTA
. (1.73)
2. Расчет изменения энергии Гельмгольца в изотермическом
процессе расширения или сжатия жидких и твердых тел
При изотермическом расширении или сжатии n моль жидких или
твердых тел изменение энергии Гельмгольца рассчитывается по уравне-
нию:
)(
21
VVnpA
. (1.74)
3. Расчет изменения энергии Гельмгольца в обратимо рабо-
тающем электрохимическом элементе
Изменение энергии Гельмгольца в обратимо работающем электро-
химическом элементе рассчитывается по уравнению:
RTzFEA
. (1.75)
36
Химический потенциал
При изменении количества вещества во время протекания процесса,
например, при протекании химической реакции, энергия Гиббса изме-
няется. Таким образом, энергия Гиббса является функцией не только
давления и температуры, но и количества моль реагирующих веществ:
)...,,,(
21 i
nnnTpfG
.
Запишем полный дифференциал от энергии Гиббса как сумму част-
ных производных:
...
2
,,
2
1
,,
1
,
,
dn
n
G
dn
n
G
dT
T
G
dp
p
G
dG
jj
i
i
nTpnTp
np
nT
(1.76)
где n
i
– постоянное число моль всех компонентов, n
j
– постоянное
число моль всех компонентов кроме одного (изменение которого рас-
сматривается).
Введем обозначение:
i
nTp
i
j
n
G
,,
(1.77)
где μ
i
– химический потенциал i–го компонента.
Физический смысл химического потенциала: химический потен-
циал i–го компонента равен изменению энергии Гиббса при добавлении
1 моль этого компонента к большему объему системы при постоянных
давлении и температуре.
Химический потенциал – это работа, которую совершает каждый
i–ый компонент в химической реакции.
Рассмотрим несколько замечаний:
1. Понятие «большой объем системы» означает, что объем системы
практически не изменяется после добавления одного моль компонента.
2. Химический потенциал чистого вещества равен энергии Гиббса
одного моль этого компонента: μ = G.
Условие равновесия в системе с переменным числом моль
В системе с переменным числом моль при постоянных параметрах
процесса (р и Т) в состоянии равновесия изменение энергии Гиббса:
0...
2211,
dndndG
Tp
, или
0)(
,, TpiiTp
dndG
,
следовательно:
0
i
i
i
dn
(1.78)
Выражение (1.78) является условием равновесия в системе с пере-
менным числом моль.

37
Зависимость химического потенциала от давления
1. Область малых давлений (идеальный газ)
pRT
~
ln
0
, (1.79)
где: μ
0
– стандартный химический потенциал при р
0
=1,013·10
5
Па;
p
~
– относительное давление (безразмерная величина)
0
~
p
p
p
.
2. Область высоких давлений (реальные газы)
В области высоких давлений наблюдаются отклонения от уравне-
ния состояния идеального газа. Льюис предложил сохранить структуру
зависимости химического потенциала реального газа от давления в та-
кой же форме, как и для идеального газа, но вместо давления использо-
вать некоторую расчетную величину, зависящую от давления, которую
назвал фугитивность (летучесть).
Фугитивность – расчетная величина, которую нужно подставить в
выражение для химического потенциала идеального газа вместо давле-
ния, чтобы получить значение химического потенциала реального газа:
fRT
~
ln
0
, (1.80)
где μ
0
– стандартный химический потенциал реального газа,
f
~
– относительная фугитивность реального газа
0
~
f
f
f
,
00
pf
–
стандартная фугитивность реального газа, которая считается равной
стандартному давлению.
Фугитивность, учитывающая все отклонения реального газа от иде-
ального, не имеет физического смысла. Фугитивность связана с давле-
нием уравнением:
pf
, (1.81)
где γ – коэффициент фугитивности (расчетная величина), имеющая
размерность давления.
Коэффициент фугитивности (безразмерная величина) является ме-
рой отклонения реального газа от идеального состояния.
К использованию фугитивности вместо парциального давления
приходится прибегать при высоких давлениях, например, 5–10 МПа
(50–100 атм).
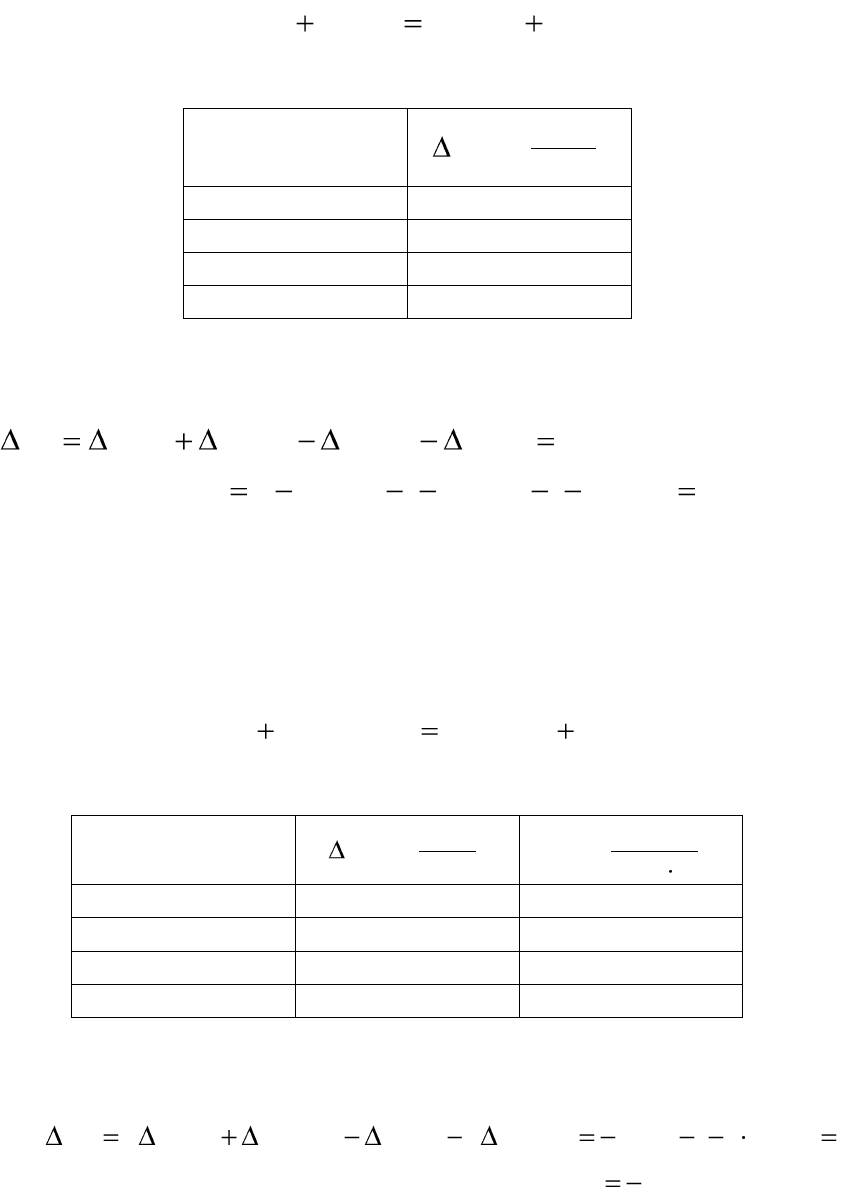
38
Пример 1.6. Вычислите стандартное изменение энергии Гиббса
для реакции
)()()()(
2
гCOтвZnгCOтвZnO
и сделайте заключение о термодинамической возможности реакции в
стандартных условиях.
Вещество
моль
кДж
G
f
,
0
298,
,
Zn(тв)
0
CO
2
(г)
–394,370
ZnO(тв)
–318,10
CO (г)
–137,15
Решение:
Рассчитаем стандартное изменение энергии Гиббса по уравнению
(1.64):
кДж
GGGGG
COfZnOfCOfZnf
88,60)15,137()10,318(37,3940
0
,
0
,
0
,
0
,
0
2
Так как вычисленное стандартное изменение энергии Гиббса имеет
положительное значение, следовательно, данная реакция в стандартных
условиях не возможна.
Пример 1.7. Вычислите стандартное изменение энергии Гиббса
при 25°С для реакции
)()(2)(2)(
2
твCdClтвAgтвAg ClтвCd
по стандартным значениям изменений энтальпий образования и абсо-
лютных энтропий химических соединений:
Вещество
моль
кДж
H
f
,
0
298,
,
Кмоль
Дж
S ,
0
298
Cd(тв)
0
51,76
Ag(тв)
0
42,69
AgCl(тв)
–126,8
96,07
CdCl
2
(тв)
–389,0
115,3
Решение:
Рассчитаем стандартное изменение энергии Гиббса по уравнениям
(1.65 – 1.67):
.4,135
)8,1262(0,38922.1
0
,
0
,
0
,
0
,
0
2
кДж
HНHНH
AgClfCdfCdClfAgf
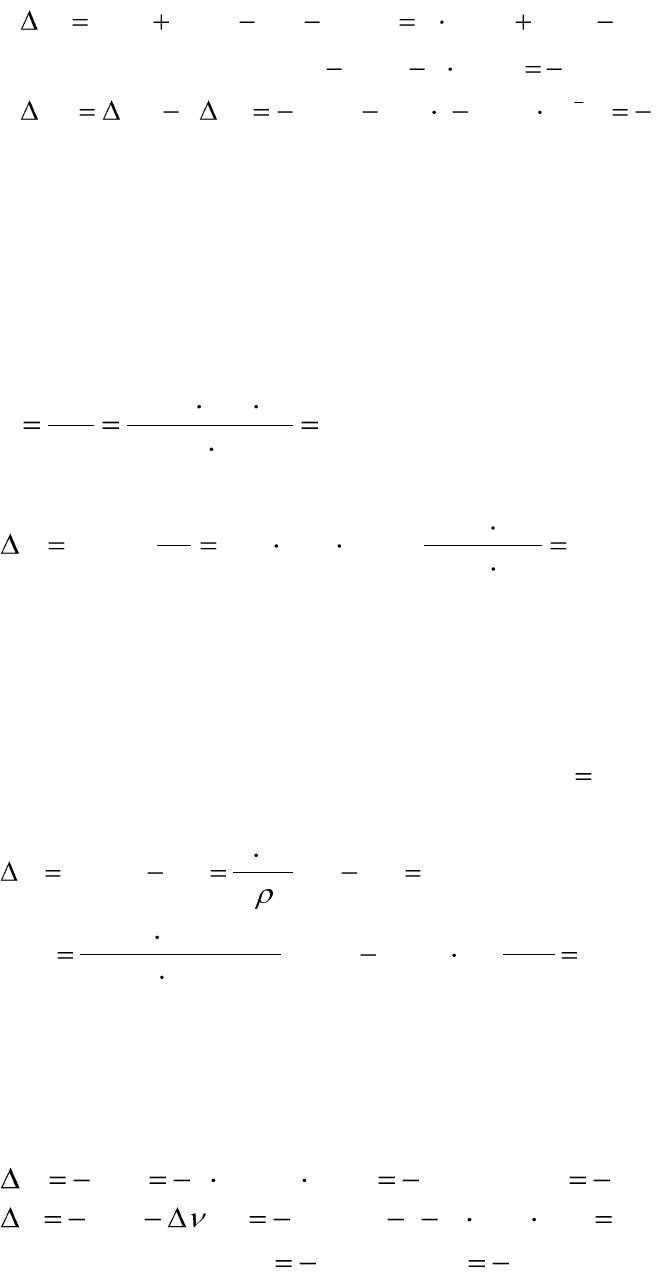
39
./22,4307,96276,51
3,11569,42222.2
00000
2
КДж
SSSSS
AgClCdCdClAg
кДжSTHG 52,122)1022,43(2984,135.3
3000
.
Пример 1.8. Вычислите изменение энергии Гиббса при изотерми-
ческом сжатии 10 м
3
кислорода от 1,013·10
5
до 10,13·10
5
Па при 25°С.
Газ считать идеальным.
Решение:
1. Рассчитаем количество моль кислорода по уравнению Менделее-
ва – Клапейрона для идеального газа:
моль
RT
pV
n 409
29831,8
1010013,1
5
.
2. Рассчитаем изменение энергии Гиббса:
кДж
p
p
nRTG 2330
10013,1
1013,10
ln29831,8409ln
5
5
1
2
.
Пример 1.9. Рассчитайте изменение энергии Гиббса при изотер-
мическом сжатии 1 моль жидкого бензола от 1,013·10
5
до 5,065·10
5
Па
(ρ=0,879 г/мл).
Решение:
1. Рассчитаем молярную массу бензола:
мольгM
HC
/78
66
.
2. Рассчитаем изменение энергии Гиббса:
.96,3510)013,1065,5(
/10879,0
/781
)()(
3
5
36
1212
Дж
м
Дж
мг
мольгмоль
pp
Mn
ppnVG
Пример 1.10. Рассчитайте изменение энергии Гиббса и энергии
Гельмгольца для реакции: Pb(тв)+Cl
2
(г)=PbCl
2
(тв). ЭДС электрохими-
ческого элемента равна 1,192 В.
Решение:
кДжДжzFEG 0,230230056192,1965002
.
.6,227227580
29831,8)1(230056
кДжДж
RTzFEA
40
2. ХИМИЧЕСКОЕ РАВНОВЕСИЕ
При протекании химической реакции через некоторое время уста-
навливается химическое равновесие. При наступлении химического
равновесия число молекул веществ, составляющих химическую систе-
му, перестает меняться и остается постоянным во времени при неиз-
менных внешних условиях.
Химическое равновесие не является статическим, то есть состояни-
ем покоя. При изменении внешних условий равновесие сдвигается и
возвращается в исходное состояние, если внешние условия приобретают
первоначальные значения. Бесконечно малое изменение внешних усло-
вий влечет за собой также бесконечно малое изменение состояния рав-
новесия. Состояние химического равновесия определяется двумя при-
знаками:
1. Неизменность во времени – если система находится в состоянии
равновесия, то ее состав с течением времени при постоянстве внешних
условий не меняется.
2. Подвижность – если система, находящаяся в равновесии, будет
выведена из этого состояния вследствие внешних воздействий, то с пре-
кращением их действия система возвратится в прежнее состояние.
Система, которая характеризуется этими двумя признаками, назы-
вается равновесной системой, а ее состав – равновесным составом.
При равновесии достигаются экстремальные значения термодина-
мических потенциалов, следовательно, химические реакции могут про-
текать как термодинамически равновесные процессы, т.е. к ним можно
применять общие условия термодинамического равновесия.
Химическая термодинамика позволяет предсказать концентрации
реагентов в равновесной реакционной смеси и влияние на них измене-
ния внешних условий, предвидеть выход полезного продукта, что имеет
большое практическое значение.
Закон действующих масс
Основной количественный закон химического равновесия был
впервые установлен Гульбергом и Ваге (1867г.) и назван законом дейст-
вующих масс.
Закон действующих масс (ЗДМ): константа равновесия химиче-
ской реакции равна отношению произведений равновесных парциаль-
ных давлений продуктов реакции в степени их стехиометрических ко-
эффициентов к произведению равновесных парциальных давлений ис-
ходных веществ в степени их стехиометрических коэффициентов.
