Михеева Е.В., Пикула Н.П. Физическая и коллоидная химия
Подождите немного. Документ загружается.

251
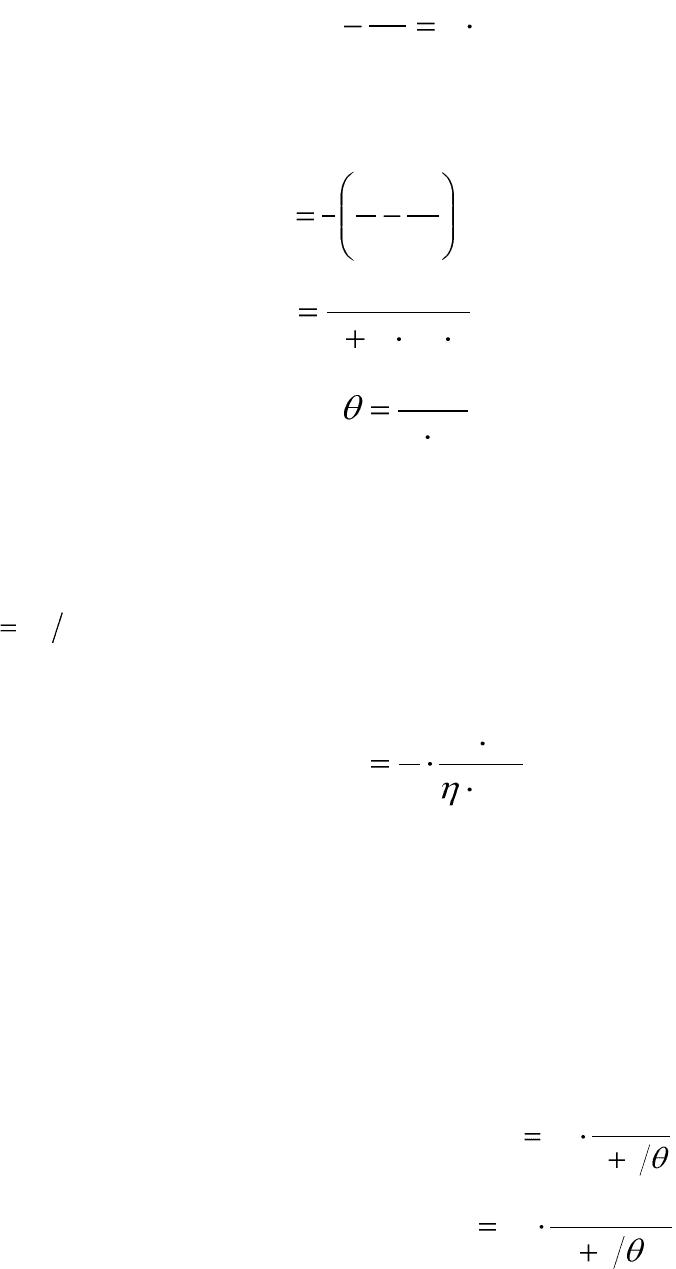
2
nk
dt
dn
. (12.1)
После интегрирования уравнения (12.1) получаем выражения для
расчета константы скорости процесса коагуляции, числа частиц и вре-
мени половинной коагуляции в любой момент времени:
0
111
nnt
k
, (12.2)
tnk
n
n
0
0
1
, (12.3)
0
1
nk
, (12.4)
где n
0
– общее число частиц в единице объема золя до коагуляции,
n – число частиц к моменту времени t, k – константа скорости процесса
коагуляции, θ – временя половинной коагуляции: время, в течение ко-
торого начальная концентрация частиц уменьшится в два раза
2
0
nn
.
Константа скорости быстрой коагуляции k является постоянной для
данной коллоидной системы и вычисляется по уравнению:
A
N
TR
k
3
4
, (12.5)
где η – вязкость дисперсионной среды, r – радиус коагулирующих
частиц; N
A
– число Авогадро.
Если величина k, вычисленная из экспериментальных данных, не
совпадает с величиной, полученной по уравнению (12.5) (k
эксп
<k
теор
),
то в системе протекает не быстрая, а медленная коагуляция.
Смолуховский предложил формулы, позволяющие определить,
сколько частиц того или иного порядка (первичных, вторичных и т.д.)
имеется в золе в момент времени t:
Для общего числа частиц:
t
nn
1
1
0
. (12.6)
Для первичных частиц:
2
01
)1(
1
t
nn
. (12.7)
252
Для вторичных частиц:
3
02
)1( t
t
nn
. (12.8)
Для частиц т – ого порядка:
1
1
0
)1(
)(
m
m
m
t
t
nn
. (12.9)
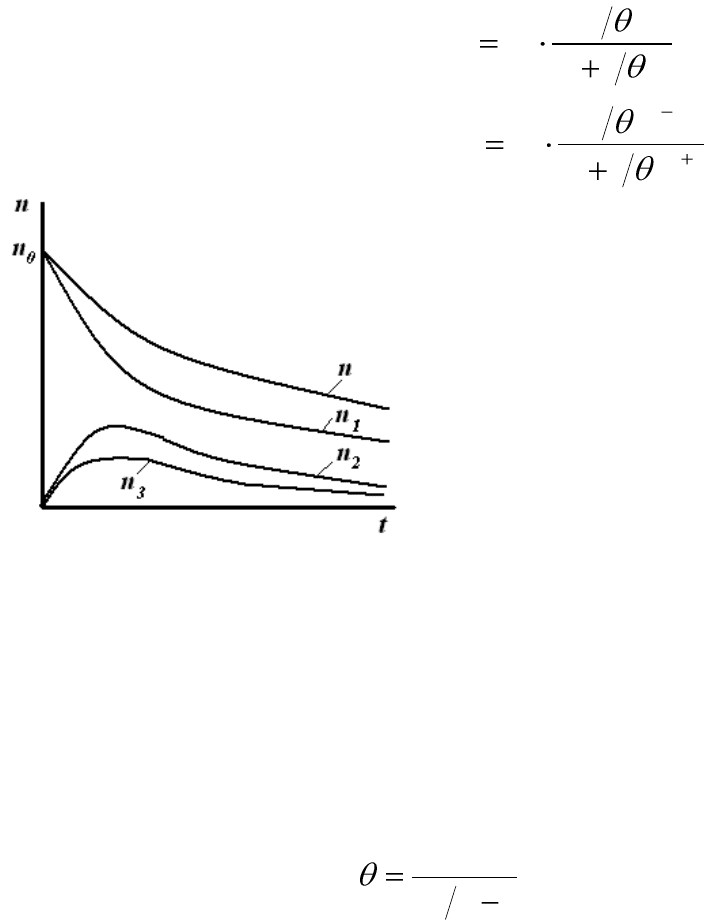
Рис.12.1. Изменение числа частиц во
времени при быстрой коагуляции.
Графическая зависимость
изменения числа частиц от вре-
мени коагуляции изображена на
рис.12.1.
Из рисунка видно, что функ-
ции распределения общего числа
частиц n и частиц первого поряд-
ка n
1
– монотонно убывающие,
причем число первичных частиц
n
1
уменьшается быстрее, чем об-
щее число частиц n, т.к. начина-
ют появляться двойные, тройные
и т.д. частицы.
Для частиц высших порядков кривые проходят через максимум,
высота которого уменьшается по мере увеличения размера частиц.
Согласно теории Смолуховского, время половинной коагуляции не
зависит от времени коагуляции. Чтобы проверить применимость теории
по экспериментальным данным вычисляют θ для нескольких значений
t:
1
0
nn
t
. (12.10)
Если величина θ остается постоянной при различных значениях
времени коагуляции, то в системе протекает быстрая коагуляция, для
которой применима теория Смолуховского. Представления Смолухов-
ского объясняют коагуляцию монодисперсных золей.
Правила электролитной коагуляции
Причины, вызывающие коагуляцию очень разнообразны: дейст-
вие теплоты или холода, электромагнитных полей, жестких излучений,
механические воздействия, химические реагенты, время и т.д. Основ-
253
ным фактором, вызывающим коагуляцию, является действие на колло-
идный раствор электролитов.
Эмпирические правила электролитной коагуляции
1. Все без исключения сильные электролиты при определенной
концентрации могут вызвать коагуляцию коллоидного раствора.
2. Правило знака заряда: коагуляцию золя вызывает тот ион элек-
тролита, знак заряда которого противоположен заряду коллоидной час-
тицы. Этот ион электролита называют ионом-коагулятором.
3. Каждый электролит по отношению к коллоидному раствору об-
ладает порогом коагуляции.
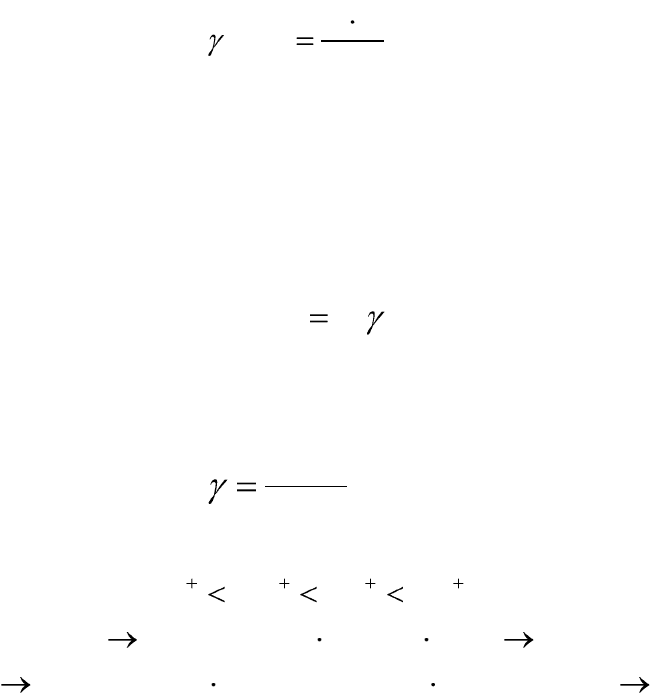
Порог коагуляции (γ) – некоторая минимальная концентрация
электролита, достаточная для того, чтобы вызвать коагуляцию золя:
W
CV
C
кр
)(
, (12.11)
где γ (С
кр
) – порог коагуляции (критическая концентрация элек-
тролита, вызывающая коагуляцию золя), моль/л; V – объем электролита,
вызывающего коагуляцию, мл; C – концентрация электролита, моль/л;
W – объем золя, мл.
Коагулирующая способность (сила) электролита (P) – величина,
обратно пропорциональная порогу коагуляции:
/1Р
. (12.12)
4. Влияние заряда (валентности) иона коагулятора (правило
Шульца-Гарди). Коагулирующая способность электролита возрастает с
увеличением валентности иона-коагулятора.
n
z
const
, (12.13)
где
z
– валентность (заряд) иона-коагулятора, n = 2 ÷ 6
испособностщейкоагулируюевозрастани
ионазарядаевозрастани
ThAlCaNa
432
5. Коагулирующая сила ионов-коагуляторов одной и той же ва-
лентности возрастает с увеличением радиуса иона-коагулятора (лио-
тропные ряды).
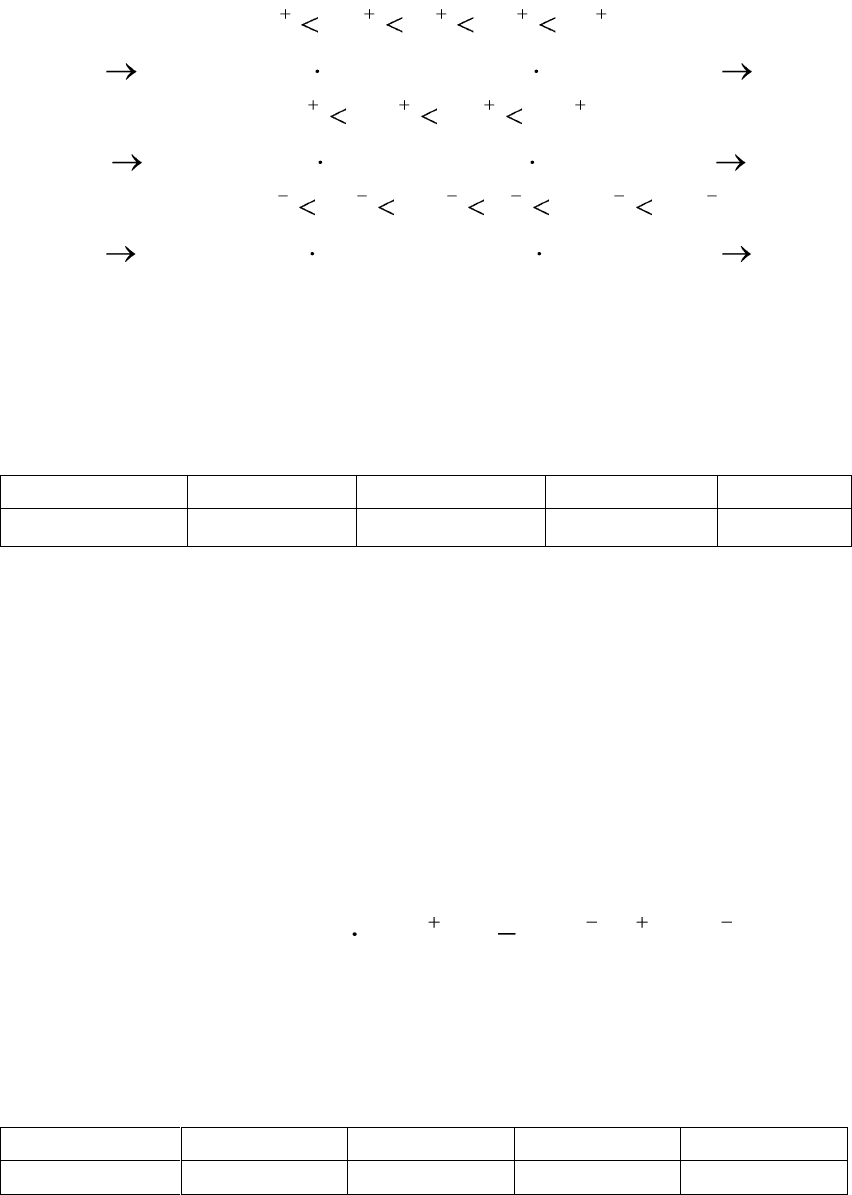
254
испособностщейкоагулируюевозрастани
CsRbKNaLi
испособностнойадсорбциооевозрастани
BaSrCaMg
2222
испособностющейкуоагулируевозрастани
OHCNSJNOBrCl
3
Пример 11.1. Золь гидроксида цинка получен путем сливания
растворов ZnCl
2
и NaOH. Определите знак заряда коллоидной части-
цы, напишите формулу мицеллы, если пороги коагуляции растворов
электролитов следующие:
Электролит
Na
2
SO
4
Mg(NO
3
)
2
Na
3
PO
4
NaCl
γ, моль/л
0,05
3,0
0,004
3,0
Решение:
Определим знак заряда частиц золя.
Так как катионы всех электролитов-коагуляторов одновалентны, а
их пороги коагуляции разные, что не соответствует правилу Шульце -
Гарди, следовательно, коагуляцию золя вызывают не катионы, а анионы
электролитов. В данном случае получается: чем выше заряд аниона, тем
меньше порог коагуляции (справедливо правило Шульце – Гарди). Сле-
довательно, согласно «правилу знака заряда», заряд коллоидной части-
цы положительный.
Следовательно, ПОИ – Zn
2+
, ПИ – Сl
-
.
Запишем строение мицеллы:
xClClxnnZnOHZnm
x
2})(2])([{
22
2
Пример 11.2. Золь иодида серебра получен сливанием растворов
KJ и AgNO
3
. Определите знак заряда коллоидной частицы, напишите
формулу мицеллы, если пороги коагуляции растворов электролитов
следующие:
Электролит
KCl
KNO
3
Ba(NO
3
)
2
La(NO
3
)
3
γ, моль/л
5,2
5,1
0,08
0,007
Решение:
Определим знак заряда частиц золя.
Так как анионы всех электролитов - коагуляторов одновалентны, а
их пороги коагуляции разные, что не соответствует правилу Шульце -

255
Гарди, следовательно, коагуляцию золя вызывают не анионы, а катионы
электролитов. В данном случае получается: чем выше заряд катиона,
тем меньше порог коагуляции (справедливо правило Шульце – Гарди).
Следовательно, согласно «правилу знака заряда», заряд коллоидной
частицы отрицательный.
Следовательно, ПОИ – J
-
, ПИ – K
+
.
Запишем строение мицеллы:
xKKxnnJAgJm
x
})(][{
Пример 11.3. Золь гидроксида алюминия получен путем сливания
растворов AlCl
3
и NaOH. Определите знак заряда коллоидной части-
цы, напишите формулу мицеллы, если пороги коагуляции электролитов
следующие:
Электролит
Na
2
SO
4
Mg(NO
3
)
2
Na
3
PO
4
NaCl
γ, моль/л
0,011
0,70
0,001
0,70
Решение:
Определим знак заряда частиц золя.
У Mg(NO
3
)
2
и NaCl одинаковые пороги коагуляции, одинаковый
заряд аниона, но разный заряд катиона. Следовательно, коагуляцию зо-
ля вызывают анионы электролитов.
В данном случае получается: чем выше заряд аниона, тем меньше
порог коагуляции (справедливо правило Шульце – Гарди). Следова-
тельно, согласно «правилу знака заряда», заряд коллоидной частицы
положительный.
Следовательно, ПОИ – Al
3+
, ПИ – Сl
-
.
Запишем строение мицеллы:
xClClxnnAlOHAlm
x
3})(3])([{
33
3
Теория устойчивости лиофобных
дисперсных систем ДЛФО
В процессе развития коллоидной химии возникало много теорий,
авторы которых пытались связать устойчивость гидрофобных золей, в
частности коагулирующее действие электролитов, с теми или иными
параметрами системы и явлениями, возникающими при взаимодействии
дисперсной фазы с дисперсионной средой.
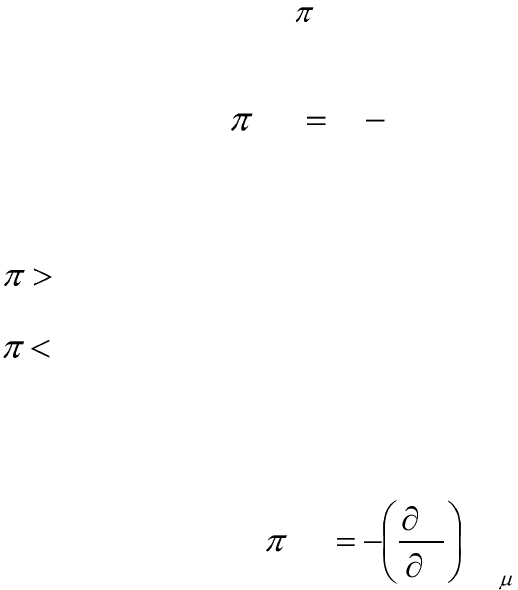
256
Каждая из теорий (химическая, адсорбционная, электростатическая
и др.) объясняла только ряд факторов, но оказывалась бессильной перед
множеством других факторов, так как все эти теории носили, в основ-
ном, односторонний характер и связывали сложный процесс коагуляции
с каким-либо одним параметром системы.
Современная физическая теория устойчивости была предложена
Б.В.Дерягиным, совместно с Л.Д.Ландау (1937 – 1941г.). Несколько
позже теоретическая разработка, почти аналогичная и приводящая к тем
же результатам, была осуществлена независимым путем Е.Фервеем и
Дж. Овербеком. Поэтому, современная теория устойчивости обознача-
ется в литературе как теория ДЛФО (DLFO).
Современная теория устойчивости ДЛФО рассматривает процесс
коагуляции как результат совместного действия Ван-дер-Ваальсовых
сил притяжения и электростатических сил отталкивания между части-
цами. В зависимости от баланса этих сил в тонкой прослойке жидкости
между сближающимися частицами возникает «расклинивающее давле-
ние».
Расклинивающее давление
Расклинивающее давление ( ) – избыточное давление, которое
возникает в межфазной прослойке жидкости при достаточном ее
утоньшении (уменьшении):
0
)( ррh
, (12.14)
где р – давление в межфазной прослойке; р
0
– гидростатическое
давление в окружающей среде, h – толщина межфазной прослойки
жидкости.
Если
0
, то преобладают силы отталкивания (система агрега-
тивно устойчива).
Если
0
, то преобладают силы притяжения, частицы самопро-
извольно сближаются, происходит коагуляция .
С термодинамической точки зрения расклинивающее давление есть
частная производная энергии Гиббса по толщине межфазной прослойки
жидкости:
,,
)(
pT
h
G
h
. (12.15)
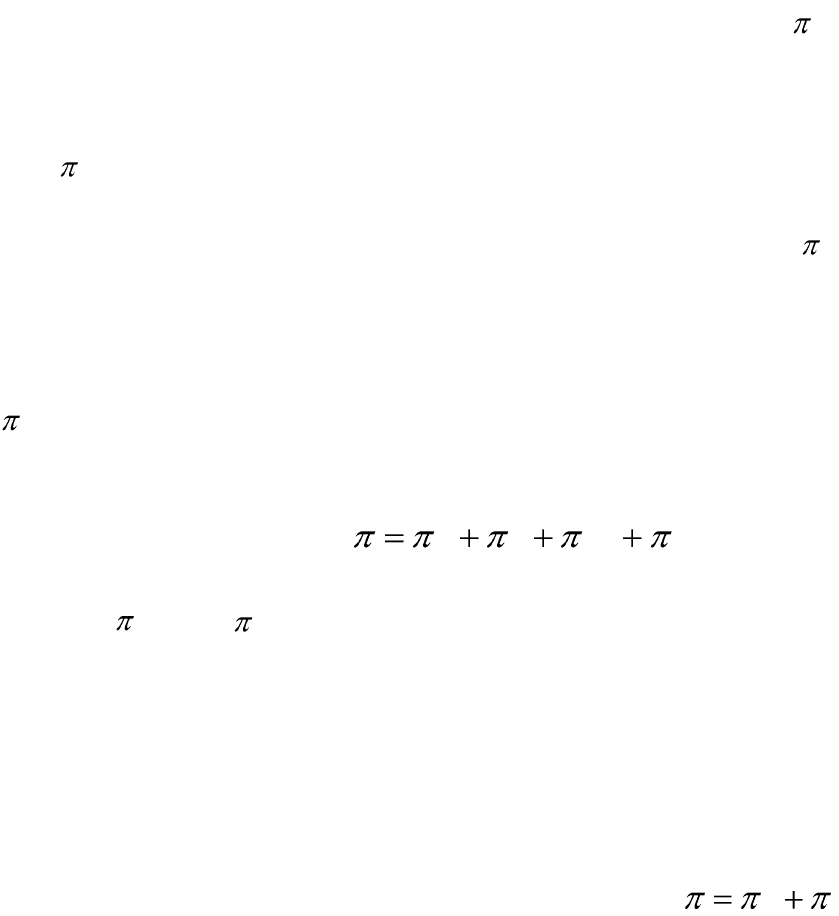
257
Представление о расклинивающем давлении является одним из
фундаментальных в коллоидной химии. Расклинивающее давление про-
является во всех случаях образования тонких слоев жидкости
В теории ДЛФО рассматривается баланс (соотношение) сил, кото-
рые действуют в межфазной прослойке между мицеллами.
Рассмотрим природу сил, определяющих расклинивающее давле-
ние.
Составляющие расклинивающего давления
1. Молекулярная составляющая расклинивающего давления (
м
) –
обусловлена силами Ван–дер–Вальса (силами притяжения, действую-
щими между ядрами мицелл).
2. Электростатическая составляющая расклинивающего давле-
ния (
Э
) – возникает при перекрывании ДЭС мицелл, обусловлена
электростатическими силами отталкивания.
3. Адсорбционная составляющая расклинивающего давления (
адс
)
– возникает в случаях, когда на поверхности твердой фазы адсорбиру-
ются молекулы, обладающие большой адсорбционной способностью
(длинноцепочечные ПАВ, молекулы белков, ВМС и т.д.).
4. Структурная составляющая расклинивающего давления
(
струк
) – обусловлена существованием особых слоев жидкости вблизи
поверхности твердого тела (например, молекулы воды образуют упру-
гие слои, которые препятствуют сближению частиц).
Таким образом:
струкадсЭм
Структурная и адсорбционная составляющие расклинивающего
давления
струк
и
адс
носят название адсорбционно-структурного
барьера, который имеет большое значение в устойчивости лиофильных
коллоидных систем.
В теории устойчивости ДЛФО для лиофобных коллоидных систем
адсорбционную и структурную составляющие расклинивающего давле-
ния не учитывают и рассматривают только баланс (соотношение) сил
притяжения и отталкивания, которые действуют между мицеллами
лиофобного золя.
Таким образом, для лиофобных коллоидных систем:
Эм
.
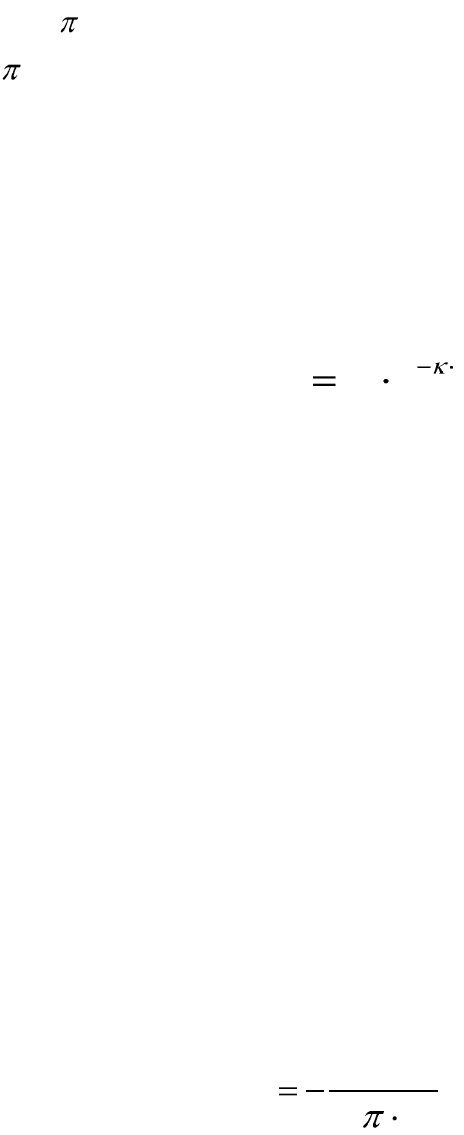
258
Зная
м
, рассчитывают энергию притяжения между частицами,
зная
Э
, рассчитывают энергию отталкивания. Суммарную энергию
взаимодействия двух частиц лиофобных золей рассчитывают как сумму
энергии притяжения и энергии отталкивания.
Энергия электростатического отталкивания
Энергия электростатического отталкивания зависит от расстояния
между частицами и рассчитывается по уравнению:
h
отт
eВU
, (12.16)
где В и κ – соответствующие сложные величины, зависящие от
многих факторов, h – расстояние между поверхностями твердых фаз
двух сближающихся мицелл.
Таким образом, энергия отталкивания частиц уменьшается с увели-
чением расстояния h между двумя сближающимися частицами по экс-
поненциальному закону.
Энергия молекулярного притяжения
Притяжение между частицами обусловлено силами Ван-дер-
Ваальса. Из сил Ван-дер-Ваальса наиболее универсальными являются
дисперсионные взаимодействия. Это связано с тем, что дисперсионное
взаимодействие является: всеобщим, аддитивным и слабоэкранируе-
мым. Поэтому взаимодействие двух частиц дисперсной фазы, находя-
щихся на расстоянии h, практически целиком определяется дисперси-
онными силами.
В этом случае энергия дисперсионного взаимодействия (притяже-
ния) изменяется с расстоянием по уравнению:
2
*
12 h
А
U
прит
, (12.17)
где А
*
– постоянная Ван-дер-ваальсовых сил притяжения (посто-
янная Гамакера), учитывающая природу взаимодействующих частиц и
диэлектрическую проницаемость среды.
259
Постоянная Гамакера вычисляется из квантово-статистических
расчетов и выражается в единицах энергии и имеет значение порядка
10
-19
Дж.
Отрицательный знак в уравнении свидетельствует о стремлении
частиц к сближению под действием сил межмолекулярного притяжения.
Принято считать, что силы притяжения отрицательны.
Общая энергия взаимодействия между двумя частицами U(h) по-
лучается сложением энергий электростатического отталкивания и энер-
гии притяжения:
оттприт
UUhU )(
, (12.18)
2
*
12
)(
h
А
eВhU
h
. (12.19)
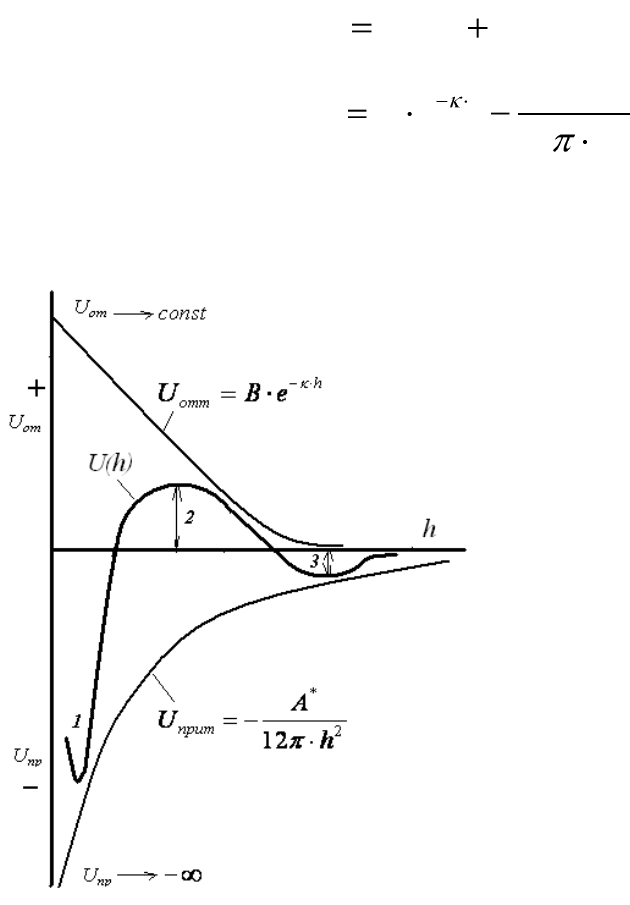
Потенциальные кривые взаимодействия частиц
Рис.12.2. Зависимость энергии притяжения,
отталкивания и суммарной энергии взаимо-
действия частиц от расстояния
Взаимодействие двух
частиц дисперсной фазы
характеризуют с помощью
потенциальных кривых –
зависимостей энергий
взаимодействия между час-
тицами от расстояния.
В соответствии с тео-
рией ДЛФО соотношения
(12.16 – 12.19) определяют
поведение дисперсных сис-
тем, их устойчивость или
скорость коагуляции зави-
сят от знака и значения об-
щей потенциальной энергии
взаимодействия частиц
U(h).
260
На малых расстояниях (при h → 0 U
от
→ const, U
пр
→ -∞) и на
больших расстояниях при h > 200 нм (экспонента убывает значительно
быстрее, чем степенная функция) преобладает энергия взаимного при-
тяжения, а на средних расстояниях – энергия электростатического от-
талкивания. В результате геометрического сложения этих двух кривых
(потенциальных кривых притяжения и отталкивания) получается ре-
зультирующая кривая (U(h)) – полная энергия системы (суммарная
энергия взаимодействия).
На потенциальной кривой суммарной энергии взаимодействия
можно выделить три участка:
1 – область первичного минимума – непосредственное слипание
частиц. Коллоидная система с частицами, находящимися друг от друга
на малых расстояниях коагулирует в результате ближнего взаимодейст-
вия. Осадки получаются плотными и необратимыми, т.к. энергия при-
тяжения намного превышает энергию отталкивания.
3 – область вторичного минимума – притяжение частиц через про-
слойку среды. Коллоидная система коагулирует в результате дальнего
взаимодействия, осадки получаются рыхлыми и обратимыми, так как
минимум не глубокий. Для систем с частицами на таком расстоянии ха-
рактерно явление пептизации.
2 – область с преобладанием сил отталкивания между мицеллами –
система агрегативно устойчива – наличие потенциального барьера, пре-
пятствующего слипанию частиц.
Закономерности коагуляции гидрофобных золей
электролитами
Типичные лиофобные золи агрегативно устойчивы, благодаря про-
явлению электростатического фактора стабилизации и коагулируют при
введении в систему сравнительно небольших количеств любых элек-
тролитов.
В соответствии с теорией ДЛФО введение электролита в дисперс-
ную систему вызывает сжатие двойного электрического слоя на поверх-
ности частиц, вследствие чего частицы могут подойти друг к другу на
расстояния, при которых преобладают силы притяжения.
В зависимости от механизма сжатия ДЭС различают два вида коа-
гуляции: концентрационную и нейтрализационную.
