Лекции - коллоидная химия
Подождите немного. Документ загружается.


81
Дальнейшее прибавление ПАВ ведет к образованию мицелл в объеме
раствора и, поэтому, почти не сказывается на уменьшении поверхностного
натяжения Абсцисса C
к
соответствует критической концентрации
мицеллообразования. Поверхностную активность коллоидных ПАВ
характеризуют, как и в случав истинно растворенных ПАВ, максимальным
значением производной поверхностного натяжения по концентрации:
0C
d
G
dC
→
σ
⎛⎞
=−
⎜⎟
⎝⎠
. Практически G определяют как тангенс угла наклона
касательной, проведенной через начальную точку изотермы (С = 0). Можно
иначе:
0min
ККМ
G
σ
−σ
= . Для большинства коллоидных ПАВ
σ
0
- σ
min
= 40-45 эрг/см
2
и эта разность примерно одинакова, а ККМ различается
на 2-3 порядка. Поэтому приближенно считают, что поверхностная активность
мылоподобных ПАВ обратно пропорциональна ККМ.
Взяв данные по ККМ из таблицы и рассчитав поверхностную активность,
увидим, что коллоидные ПАВ отличаются высокой поверхностной
активностью, равной 10
7
-10
8
Гиббсов. Это означает, что концентрация ПАВ в
поверхностном слое даже очень разбавленных растворов в десятки тысяч раз
превышает их объемную концентрацию.
Поверхностная активность зависит главным образом от длинs и строения
углеводородного радикала, а природа полярной группы слабо влияет на
активность. Это связано с тем, что адсорбция на поверхности раздела раствор-
воздух по П.А. Ребиндеру носит «пассивный характер», то есть сводится к
выталкиванию углеводородных цепей из воды вследствие сильного притяжения
молекул воды друг к другу. Свободная энергия понижается на величину,
равную той работе, которую необходимо совершить в изотермическом
процессе раздвигания молекул воды пря введении углеводородной цепи из
поверхностного слоя в объем
раствора. Эта работа, отнесенная к 1 молю ПАВ,
называется адсорбционным потенциалом.
На поверхностное натяжение растворов коллоидных ПАВ влияют: рН
раствора; концентрация нейтральных солей; примеси; время существования
поверхности.
Величина рН существенно влияет на поверхностное натяжение
разбавленных растворов тех коллоидных ПАВ, которые способны к гидролизу
в воде. Степень гидролиза находится в сложной зависимости
от концентрации
мыла, проходя ряд максимумов и минимумов, Образующаяся в результате
гидролиза жирная кислота слабо диссоциирована. Нейтральные молекулы
кислоты ассоциируются с ионами мыла в комплексы – «кислые мыла»
неопределенной стехиометрии – x RCOO
–
⋅ y RCOOH. Эти «кислые мыла»
адсорбируются сильнее, чем анион жирной кислоты. Поэтому изменение рН
резко меняет поверхностное натяжение.
82
Введение неорганических солей в растворы ионогенных ПАВ не меняет
форму изотермы σ – С, но кривая идет круче, то есть поверхностная активность
повышается. Объясняется этот факт действием противоионов – тех ионов
введенного электролита, заряд которых противоположен по знаку заряду
поверхностно-активного иона. По эффективности действия ионы добавленного
электролита одинаковой валентности располагаются в
лиотропные ряды. Для
одновалентных катионов эффективность действия снижается в ряду:
K
+
> NH
4
+
> Na
+
> Li
+
. Этот же ряд показывал выше нам эффективность
уменьшения ККМ. В этом ряду убывает ионный радиус и поляризуемость
ионов, растет их гидратация.
В растворах неионогенных ПАВ действие электролитов проявляется
слабее и сводится к высаливающему действию ионов – частичной дегидратации
ПАВ, повышению их гидрофобности. Возможно выпадение в осадок
коллоидного ПАВ.
Временной фактор – время
существования поверхности сказывается при
измерении поверхностного натяжения. Адсорбционные слои формируются не
мгновенно, а в течение некоторого времени. Лимитирует скорость адсорбции
диффузия молекул или ионов ПАВ, особенно с большой молярной массой.
Лимитирует и электрический заряд адсорбционного слоя ионизированных
молекул ПАВ.
Известно явление, называемое старением адсорбционных слоев мыл.
Старение, сопровождающееся медленным понижением поверхностного
натяжения, продолжается десятки, сотни часов. Наиболее резко проявляется
оно в разбавленных растворах ПАВ и исчезает при концентрациях, выше ККМ.
83
7. АДСОРБЦИЯ НА ГРАНИЦЕ ТВЕРДОЕ ТЕЛО – ГАЗ
Адсорбент – твердое тело
Адсорбат (адсорбтив)
– адсорбируемое вещество (газ, пар)
При адсорбции на поверхности твердое тело-газ, следует принимать во
внимание следующие особенности:
•
Твердая поверхность неэквипотенциальна;
•
Поверхностное натяжение на границе раздела твердое тело-газ значительно
больше, чем на границе жидкость-газ; оно зависит от физического
состояния, химического состава поверхности. Пока еще нет доступных
способов экспериментального измерения поверхностного натяжения на
границе твердое тело-газ или твердое тело-жидкость;
•
Координаты изотермы адсорбции:
X – моль адсорбата/г адсорбента;
Г – моль адсорбата/см
2
;
P – давление пара;
P/P
0
– относительное давление;
Х (Г)
P (P/P
0
)
Рис. 7.1. Изотерма адсорбции.
•
Важной характеристикой адсорбционных взаимодействий является теплота
адсорбции. Поскольку поверхность твердого тела неэквипотенциальна (есть
выступы, впадины, поры, трещины, неоднороден химический состав и
прочее), то различают следующие понятия теплот адсорбции:
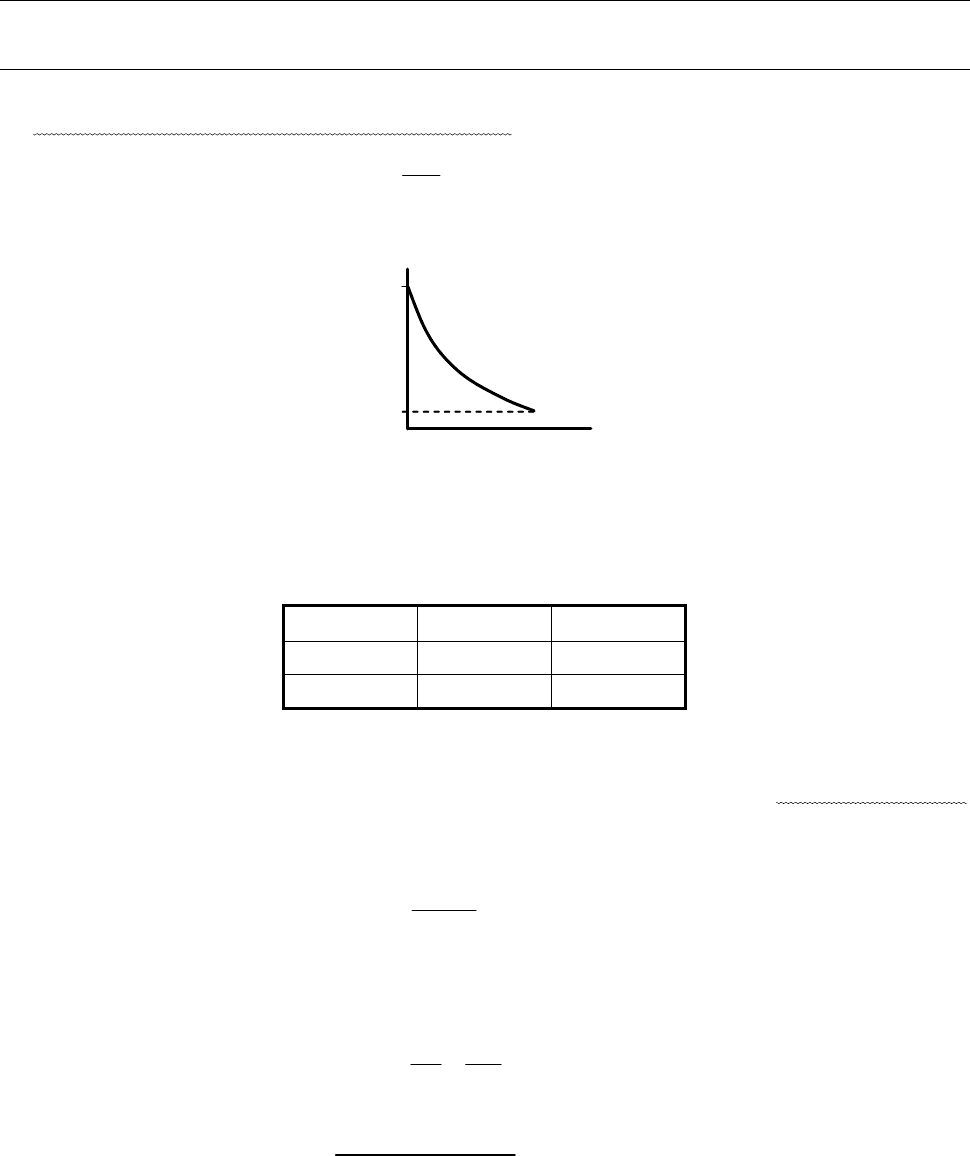
а) Интегральная теплота адсорбции
– общее количество выделившейся
теплоты, отнесенное к 1 г адсорбента:
Q, кДж/г
(адсорбента)
m
адсорбат
а
Рис. 7.2. Зависимость интегральной теплоты адсорбции от массы абсорбата.
Зависимость идет до насыщения, т. к. поверхность твердого тела
неэквипотенциальна, первые порции адсорбата взаимодействуют с более
активными центрами.
84
Так, отравление катализаторов наступает при малой доле занятой
поверхности адсорбента.
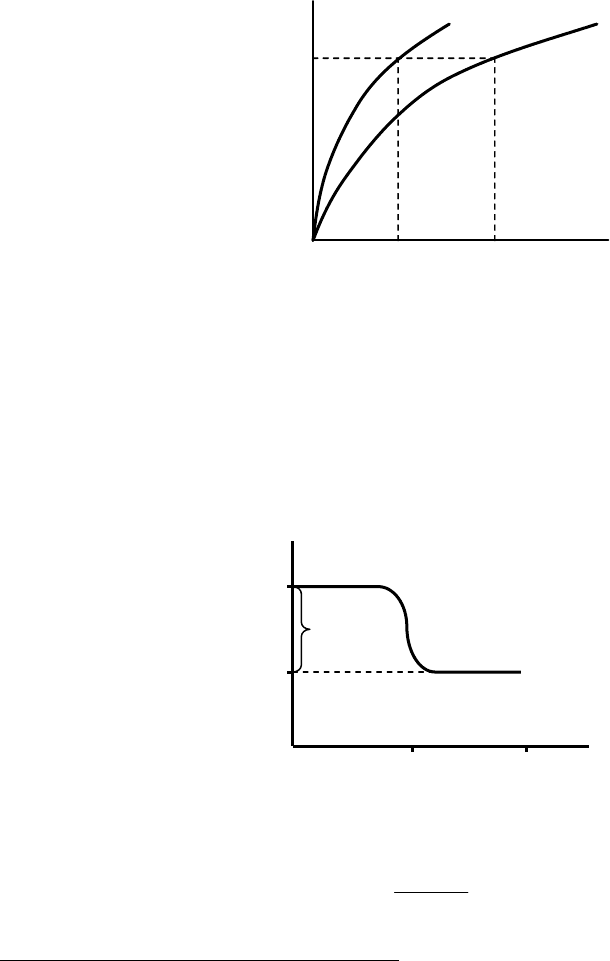
б) Дифференциальная теплота адсорбции q:
dm
dQ
q = (7.1)
dm – приращение массы (или моль) адсорбата на адсорбенте.
q, кДж/г
(адсорбата)
m
адсорбат
а
q
0
q
τ
Рис. 7.3. Зависимость дифференциальной теплоты адсорбции от массы
абсорбата.
например:
Таблица 7.1
q
0
q
τ
O
2
– Pt 161 104
H
2
– W 34 17
в) Т. к. дифференциальная теплота адсорбции зависит от степени заполнения
поверхности адсорбента адсорбатом, то для исключения этого эффекта
используется дифференциальная молярная обратимая изостерическая
теплота адсорбции q
a
, т. е. дифференциальная теплота адсорбции в расчете на
моль при одной и той же степени заполнения поверхности адсорбента
2
ln
a
P
qRT
T
x
∂
⎛⎞
=
⎜⎟
∂
⎝⎠
(7.2)
Теплота адсорбции q
a
мало зависит от температуры, поэтому можем
проинтегрировать:
∫∫
=
2
1
2
1
2
ln
T
T
a
P
P
T
dT
R
q
Pd (7.3)
(
)
12 2 1
21
ln /
a
R
TT P P
q
TT
=
−
(7.4)
Таким образом изостерическую теплоту адсорбции q
a
можно рассчитать
по двум изотермам адсорбции при X
1
= X
2
:
85
X
P
T
1
T
2
P
1
P
2
Рис. 7.4. Схема расчета изостерической теплоты адсорбции по двум изотермам.
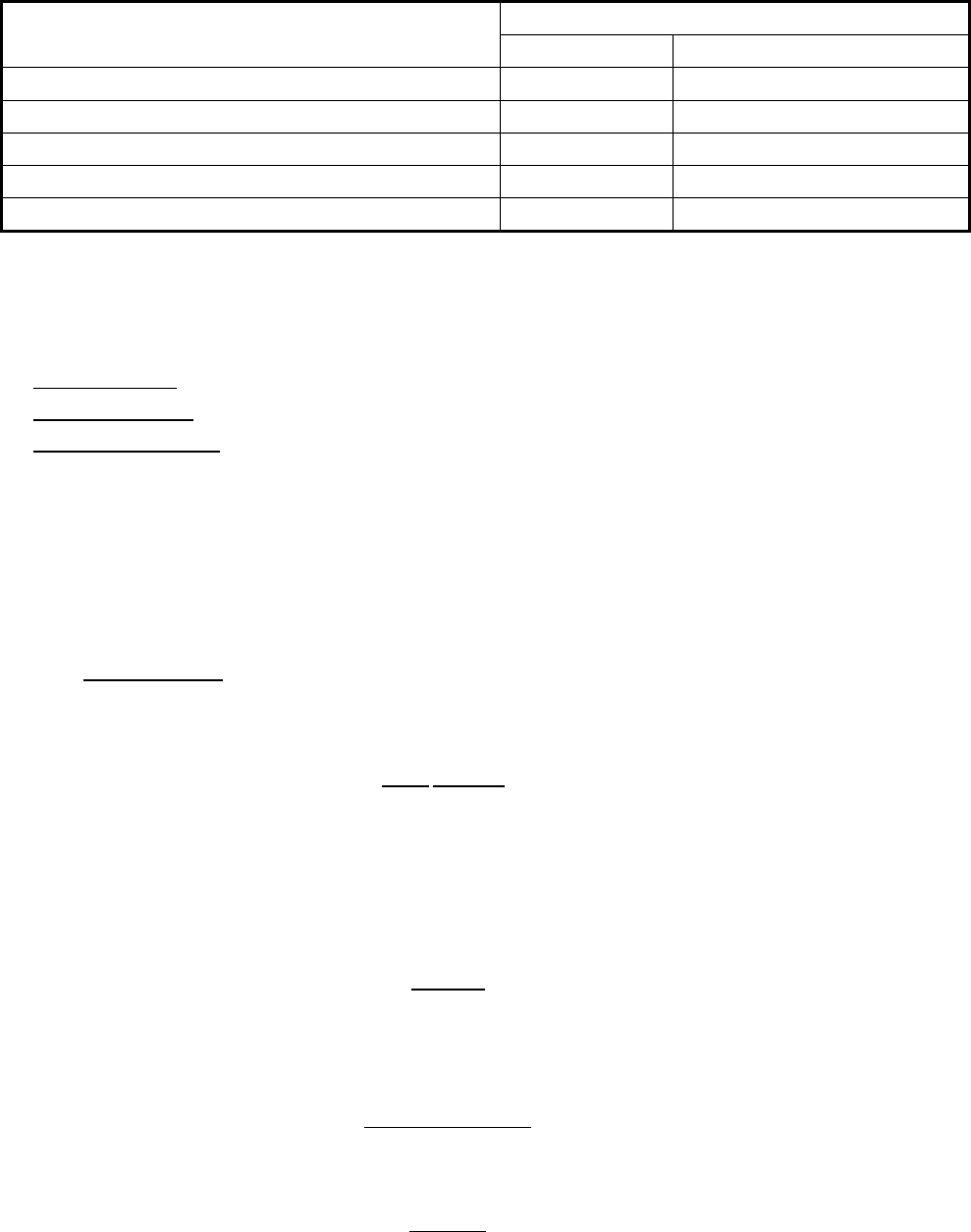
г) изостерическая теплота адсорбции q
a
при адсорбции пара состоит из 2-х
слагаемых:
Lxa
qqq
+
=
(7.5)
q
x
– чистая теплота адсорбции, т. е. теплота смачивания,
q
L
– теплота конденсации.
При адсорбции паров первый слой адсорбата – жидкий.
Рис. 7.5. Зависимость дифференциальной теплоты адсорбции паров.
⎟
⎠
⎞
⎜
⎝
⎛
∂
∂
=
T
P
RTq
L
0
2
ln
(7.6)
– Уравнение Клазиуса-Клайперона
, P
0
–давление насыщенного пара.
Установив величину q
L
экспериментально, можем найти и
x
x
x
Qdxq =
∫
0
Lxa
QQQ
+
=
(7.7)
Величину Q
x
и Q
a
измеряют калориметрически. Их значение зависит от
типа межмолекулярных взаимодействий. Q
x
отражает энергию взаимодействия
твердое тело – жидкость.
Значение Q
x
велико при контакте полярного вещества с полярным
адсорбатом. Для демонстрации этой зависимости, в таблице 7.2 приведены
значения величин Q
x
для адсорбатов и адсорбентов с различной полярностью.
10
8
12
слои адсорбата
q
L
q
x
q
a
, ккал/моль адсорбата
θ
(доля адс.)
86
Таблица 7.2
Q
x
, эрг/см
2
для адсорбатов
Твердая поверхность
Н
2
О Неполярная жидкость
Графит 48 бензол – 225
SiO
2
(силикагель) 210 бензол – 220
TiO
2
(анатаз) 510 гексан – 137
BaSO
4
490 бензол – 140
Тефлон (политетрафторэтилен (СF
2
)
n
) 6,0 гептан – 60
В литературе можно встретить разные способы выражения теплот
адсорбции на твердом адсорбенте: кДж/масса адсорбента; кДж/см
2
; кДж/моль
адсорбата.
Различают адсорбцию:
– физическую
Q
a
= 0,4 ÷ 40 кДж/моль адсорбата (≈ Q
L
)
– хемосорбцию
Q
a
> 40 кДж/моль;
– специфическую
(с образованием водородных, донорно-акцепторных связей).
Процесс адсорбции обязательно экзотермичен (т. к. при этом энтропия в
поверхностном слое уменьшается из-за упорядочивания молекул адсорбата).
7.1. Типы межмолекулярных взаимодействий при адсорбции на
границе твердое тело – газ
Физическое (вандерваальсовое).
Для изолированных молекул различают:
1) Электростатическое взаимодействие диполей (ориентационное).
22
12
ор
6
2
3
U
kT r
μ⋅μ
=−
(7.8)
μ – дипольные моменты молекул, r – расстояние между взаимодействующими
диполями.
2) Индукционное взаимодействие (дипольный момент одной из молекул
индуцирует дипольный момент и во второй молекуле)
2
21
инд
6
U
r
α⋅μ
=− (7.9)
– для случая, когда одна молекула полярна, а вторая – нет, α – поляризуемость
молекулы;
22
21 12
инд
6
U
r
α⋅μ+α⋅μ
=− (7.10)
– обе молекулы полярные, или
2
инд
6
2
U
r
α⋅μ
=− (7.11)
– обе одинаковые.
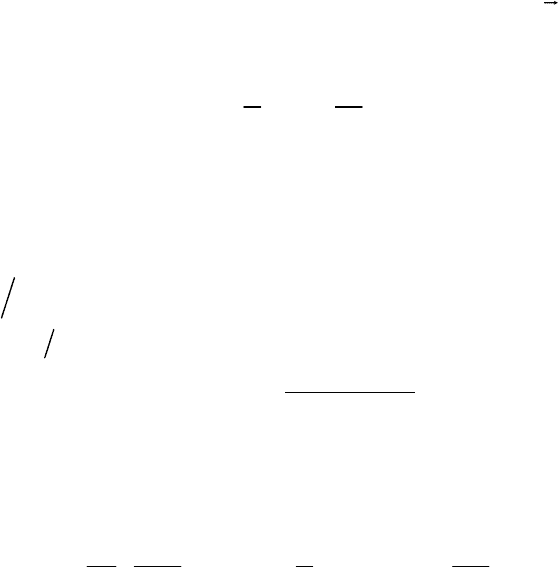
87
Индукционное взаимодействие не зависит от температуры, в отличие от
ориентационного.
3)
Дисперсионное взаимодействие (также не зависит от температуры).
Обусловлено возникновением дипольного момента в неполярной молекуле
вследствие нарушения симметрии распределения электронной плотности. При
колебаниях, создается мгновенный дипольного момента
μ, который поляризует
соседние молекулы и атомы.
2
дисп 0
6
31
4
Uh
r
=− να (7.12)
ν
0
– частота колебаний атома неполярной молекулы, α – средняя
поляризуемость молекулы (способность электронной оболочки
деформироваться). Вычислить ее можно, измерив показатель преломления
вещества, предварительно вычислив молекулярную рефракцию
(
)
(
)
(
)
22
12/Rn n M
⎡⎤
=− +⋅ρ
⎣⎦
. Затем можно вычислить и поляризуемость
молекулы
эл
43
A
RN=πα
.
Дисперсионные силы – аддитивны
(Лондоновские), объясняется
квантово-механически.
Обычно индукционное взаимодействие составляет менее 5% от общего,
дисперсионное – 20% для полярных молекул и до 100% в неполярных.
4) Общая энергия взаимодействия одинаковых молекул тогда:
12
2
0
2
4
6
1
4
3
2
3
21
r
Bh
kT
r
U +
⎟
⎟
⎠
⎞
⎜
⎜
⎝
⎛
αν+αμ+
μ
−=
(7.13)
Силы отталкивания действуют на очень малых расстояниях когда
соприкасаются электронные оболочки атомов в составе молекул.
Согласно этим выражениям энергия притяжения взаимодействующих
молекул должна убывать с увеличением расстояния обратно пропорционально
его шестой степени. Т. е. взаимодействие близкодействующее. Реально же, при
взаимодействии молекул адсорбата с поверхностью адсорбента, наблюдается
дальнодействующее взаимодействие – степень при
расстоянии должна быть
меньше шести.
Теперь рассмотрим как влияет то, что взаимодействие происходит не с
точечной молекулой, а с поверхностью.
88
I. Адсорбция полярных молекул на ионном кристалле
Рис. 7.6. Схема для расчета энергии адсорбции полярной молекулы на ионном
кристалле.
ор
r
Ufdr
∞
=−ν ⋅
∫
(7.14)
l – длина диполя, r – расстояние адсорбат–адсорбент, ν – число молекул,
адсорбированных 1 г адсорбента.
ze
H
f
= (7.15)
3
2
r
H
μ
= (7.16)
H – напряженность поля диполя.
(7.16) подставим в (7.14):
0
ор
3
2
r
dr
Uze
r
∞
=− ν μ
∫
(7.17)
ор
2
0
ze
U
r
νμ
=−
(7.18)
– дальнее взаимодействие (~
r
–2
)
Проверка по теплоте адсорбции H
2
O на BaSO
4
показывает:
Q
x
эксп.
= – 2,4 кДж/г
U
ор
расч.
= – 2 кДж/г; U
дисп
расч.
= – 0,012 кДж/г
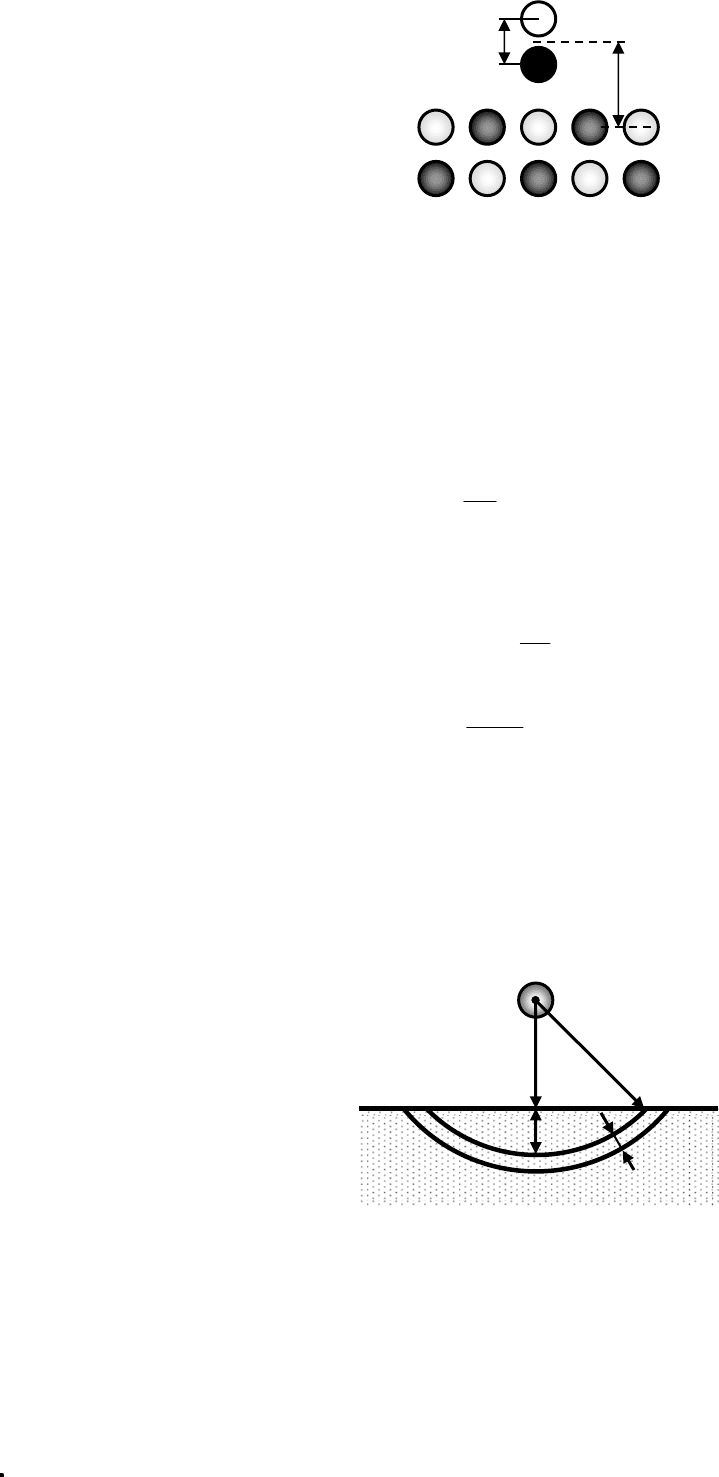
II. Адсорбция неполярных молекул на ионном кристалле
Рис. 7.7. Схема для расчета энергии адсорбции неполярной молекулы на
ионном кристалле.
r
0
r
h
dr
–
e
+e
l
r
89
Молекула взаимодействует с атомами, расположенными в объеме
dV
адсорбента. Число этих атомов:
n·dV = nS·dr (7.19)
n – число атомов в единице объема
S – площадь поверхности сферического сегмента
S = 2πrh = 2πr(r – r
0
) (7.20)
Индукционное взаимодействие мало, поэтому учитываем только
дисперсионное:
0
дисп
6
r
UndV
r
∞
β
=
−⋅
∫
(7.21)
(7.20) подставим в (7.19) и в (7.21), получаем:
дисп
3
0
6
n
U
r
π
β
=−
(7.22)
где
2
0 адсорбента
3
4
hβ= ν α
.
Так получили, что
U
дисп
~ r
–3
– дальнодействие.
Сопоставив расчет с экспериментом, увидели, что расчетное
U
дисп
составляет всего 10% от экспериментально определенной теплоты адсорбции;
индукционное взаимодействие
U
инд
мало' и его учет ситуацию не улучшит.
Был произведен более совершенный расчет:
а) кроме поляризуемости учтена диамагнитную восприимчивость:
2
12
11 2 2
6mc
α
α
β=
α
χ+α χ
(7.23)
– формула Кирквуда-Мюллера
;
б) вместо интегрирования произведено суммирование по 250 ионам решетки;
в) учет энергии отталкивания (также сумма, но по 16 ионам решетки из-за
близкодействия сил отталкивания);
г)
β ионного кристалла = β катионов + β анионов.
Результат расчета этим методом удовлетворительно согласуется с
экспериментом: энергия адсорбции аргона на кристалле KCl над центром
кристаллической ячейки
U
дисп
= 1,6 ккал/моль, а экспериментально
Q
a
= 2,1 ккал/моль.
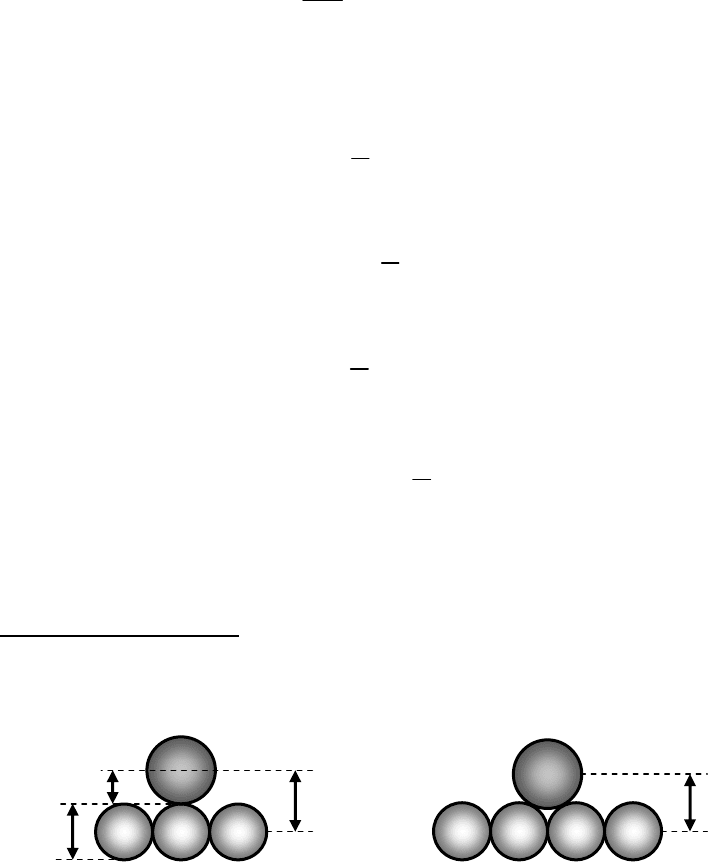
III. Адсорбция неполярных молекул на неполярном адсорбенте
Рассматривается адсорбция аргона на базисной грани графита при
температуре жидкого азота (77 K)
612
дисп ii
ii
UCrBr
−
−
=− +
∑
∑
(7.24)
суммирование по 100 ÷ 200 атомам решетки;
C – константа дисперсионного взаимодействия;
B – константа отталкивания.
90
Заменим сумму расстояний для простоты математических вычислений
аппроксимирующей степенной зависимостью:
q
i
pzr
−−
=
∑
6
(7.25)
n
i
mzr
−−
=
∑
12
(7.26)
(7.25), (7.26) подставим в (7.24):
дисп
qn
U Cpz Bmz
−−
=− +
(7.27)
В равновесном состоянии при
z = z
0
имеем минимум энергии:
U
min
, 0
0
=
⎟
⎠
⎞
⎜
⎝
⎛
∂
∂
z
z
U
(7.28)
подставим (7.27) в (7.28):
1
0
1
0
−−−−
=
nq
nBmzqCpz (7.29)
0
1
nq
B
mqCpz
n
−
= (7.30)
(7.30) подставляем в (7.27):
д 0
1
qnqn
U Cpz qCp z z
n
−−−
=− + , (7.31)
или
д 0
1
qnqnq
q
UCpz zz
n
−−−+
⎡⎤
=− −
⎢⎥
⎣⎦
, (7.32)
при
z = z
0
получим U
min
:
min
дисп
1
q
q
UCpz
n
−
⎡
⎤
=− −
⎢
⎥
⎣
⎦
, (7.33)
где слагаемое
q/n характеризует долю отталкивания и составляет примерно
0,3 ÷ 0,4
U
дисп
.
Результаты расчета.
Может быть два положения молекулы адсорбата:
1) над атомом углерода;
2) между атомами:
С С С
Ar
z
01
=3,61Ǻ
3,40Ǻ
1,91Ǻ
С С С С
z
02
=3,32Ǻ
Ar
Рис. 7.8. Возможные положения молекулы аргона при адсорбции на графите.
В уравнении (7.24) константу притяжения рассчитаем по формуле
Кирквуда.
α
C
= 0,94·10
–24
см
3
;
α
Ar
= 1,63·10
–24
см
3
;
χ
C
= –10,54·10
–30
см
3
;
