Лекции - коллоидная химия
Подождите немного. Документ загружается.

61
(
)
xlG
Δ
σ
−
σ
=
Δ
0
(4.81)
т. к. (4.80) = (4.81), тогда:
σ
−
σ
=
π
0
(4.82)
Поверхностное давление π (двухмерное) – аналог трехмерного
осмотического давления. Поплавок – аналог мембраны непроницаемой для
масла, но проницаемой для воды.
Передвигая барьер можно регулировать площадь, занимаемую
молекулами пленки и тем самым изменять ее давление. Зависимость
поверхностного давления от площади – кривая сжатия.
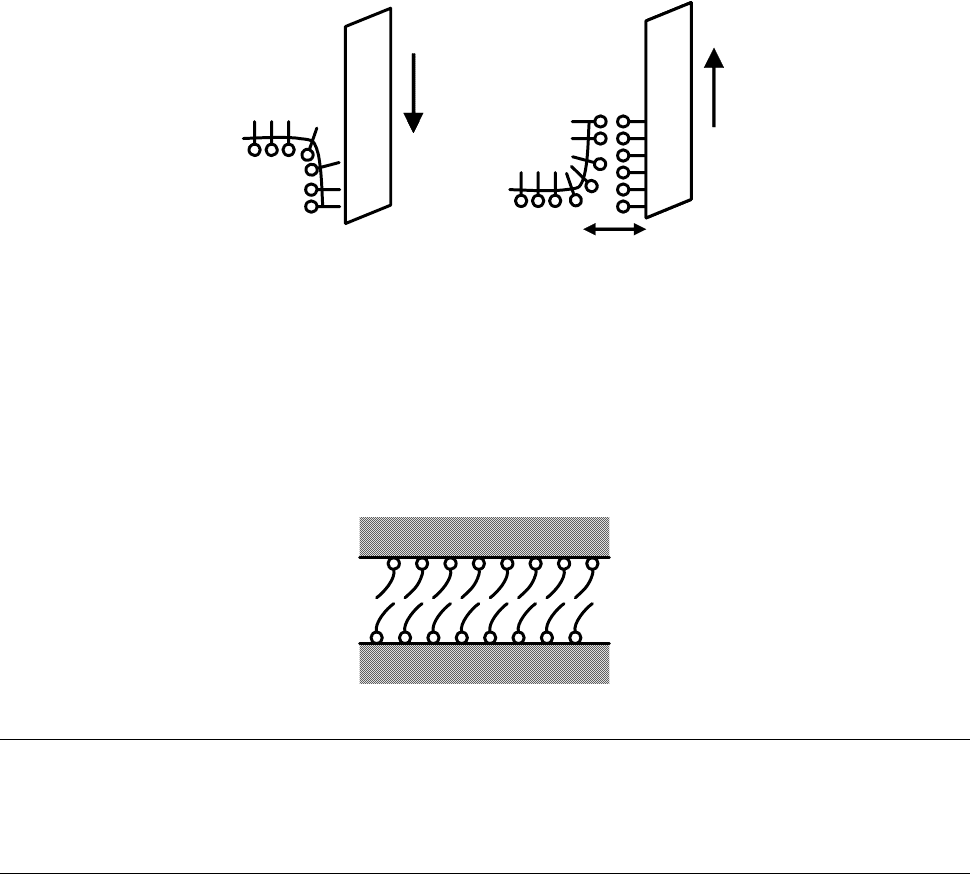
Монослои могут переходить на твердую подложку.
l
Рис. 4.31. Схема нанесения пленок на подложку.
● Так готовят тонкопленочные электрические конденсаторы, емкость их
~ 1/l (с уменьшением толщины емкость увеличивается).
● Пленки на стеклянной линзе уменьшают отражение ⇒ больше
пропускают свет (просветленная оптика). Слои добавляют до тех пор, пока
толщина слоя не станет равной четверти длины волны света: l ≈
0,25λ.
● Используются для смазки:
Рис. 4.32. Схема действия смазывающего эффекта.
Если на воде имеется масляная пленка, то рыбаки лучше видят рыбу в
воде, так как уменьшается дифракция света из-за мелкой ряби на воде.
Древние мореплаватели, предвидя сильное волнение моря, выливали оливковое
масло на воду, и морские волны сглаживались.
Типы поверхностных пленок
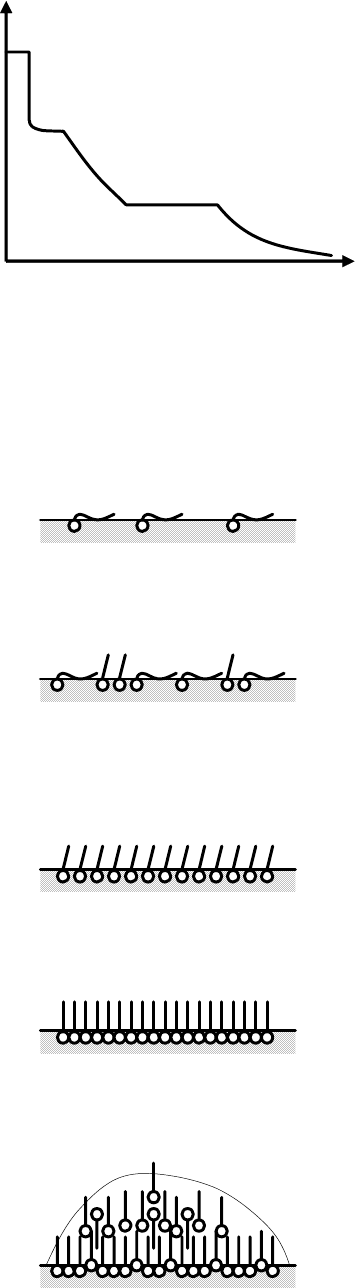
Типы поверхностных пленок определяют по кривым сжатия.
Обобщенная кривая сжатия представлена на рис. 4.33.
62
S
π
a
b
c
d
e
f
Рис. 4.33. Обобщенная кривая сжатия.
a) Газообразные пленки. Состояние молекул – хвосты свободно лежат не мешая
друг другу. Их состояние на поверхности воды подобно состоянию идеального
двумерного газа. Уравнение этого состояния:
πS = RT (4.83)
S – площадь, занятая пленкой. Эту пленку и называют двумерным газом
(образное сравнение).
Рис. 4.34. Схема расположения молекул газообразной пленки.
b) Сосуществование двумерного газа и двумерной жидкости.
π не увеличивается при сжатии
Рис. 4.35. Схема расположения молекул для сосуществования двумерного газа
и двумерной жидкости.
с) Жидко-растянутая
π увеличивается при сжатии
Рис. 4.36. Схема расположения молекул для жидко-растянутой пленки.
d) сосуществование (c) и (e)
e) конденсированная плотная пленка
Рис. 4.37. Схема расположения молекул для конденсированной пленки.
(c) и (e) – сплошные пленки.
f) Разрушение мономолекулярной пленки, образование «линзы», капли.
Рис. 4.38. Схема расположения молекул
при нарушении мономолекулярности пленки.
63
Зависимость типа пленки от характеристик вещества и «масла»
Пленки образуют дифильные молекулы нерастворимых в воде веществ
(ПАВ).
При числе атомов углерода в гидрофобном углеводородном радикале
8 ≤ n
C
≤ 12 образуются газообразные пленки;
При n
C
> 12 – конденсированные, жидкорастянутые пленки.
При n
C
> 12 на воде:
1. жидкие ПАВ дают жидкорастянутые пленки (напр. C
17
H
33
COOH олеиновая
кислота)
2. твердые ПАВ
а) с низкой температурой плавления при малых концентрациях –
жидкорастянутые, при больших – конденсированные пленки
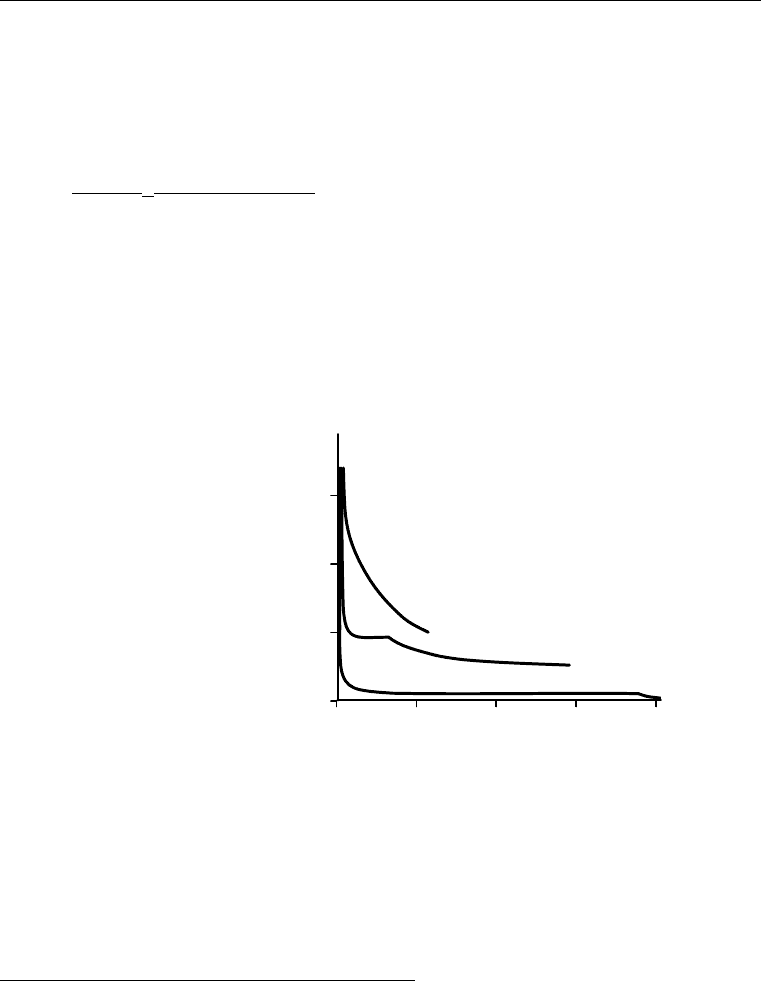
б) с высокой температурой плавления – конденсированные пленки. Чем выше
температурой плавления, тем ближе к оси ординат кривая сжатия.
Рис. 4.39. Реальные кривые сжатия:
1 – лауриновая кислота CH
3
(CH
2
)
10
COOH;
2а – миристиновая CH
3
(CH
2
)
12
COOH;
2б – пальмитиновая CH
3
(CH
2
)
14
COOH.
Зависимость от состава подложки:
Жирные кислоты на нейтральных и кислых подложках образуют
жидкорастянутые пленки, на щелочных – газообразные (из-за отталкивания
одноименных зарядов RCOO
–
)
–HC=CH–COOH + KMnO
4
(H
2
O) → (–CHOH–CHOH–)
при окислении конденсированные пленки ⇒ газообразные
Хорошо растекаются белки по воде. В зависимости от состава подложки
они могут быть свернуты, развернуты. Таким образом можно управлять
реакциями белков с различными реагентами.
1
2а
2б
0
0,2
0,4
0,6
6 12 18 24
S
M
⋅
10
-24
, нм
2
/моль
π
⋅
10
3
, Дж/м
2

64
Влияние температуры:
На рис. 4.40 показана зависимость площади, приходящейся на молекулу
при постоянном π в зависимости от температуры. При некоторой температуре
наблюдается фазовый переход («плавление» пленки).
Рис. 4.40. Зависимость молекулярной площади от температуры.
Описание состояния пленки.
Уравнение идеального двумерного газа:
πA = kT (4.84)
(k = 1,38·10
-16
эрг/К, A – площадь, занимаемая одной молекулой)
При Т = 298 К, kT = πA = 400 (если A выражено в Å
2
)
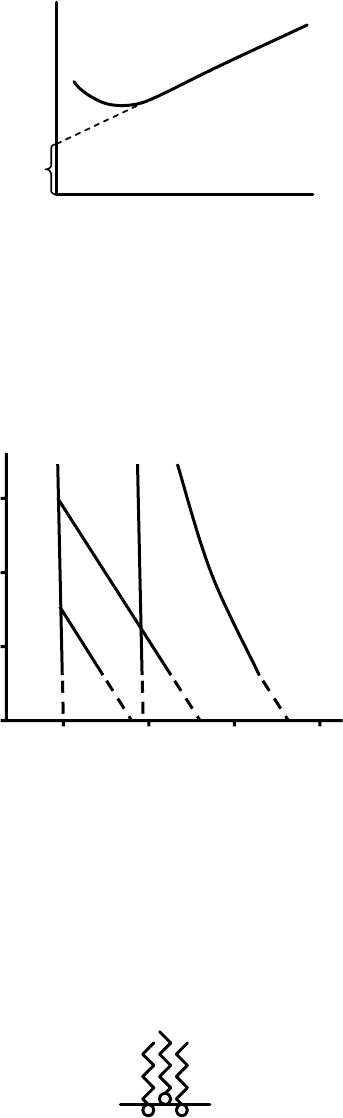
Рис. 4.41. Кривая сжатия в координатах π⋅A – π. 1, 2 – реальные газы (2 – димер)
Уравнение реального двумерного газа:
()
kTbA
A
a
=−
⎟
⎠
⎞
⎜
⎝
⎛
+π
2
(4.85)
При малых поверхностных давлениях π – сказывается слагаемое a/A
2
(учет межмолекулярного взаимодействия), при больших – b (поправка на
собственную площадь молекул).
Фольмер
изучая процесс растекания белков предложил соотношение:
()
kTbA β=−π (4.86)
β – коэффициент активности, при β = 1:
bkT
M
G
S π+
⎟
⎠
⎞
⎜
⎝
⎛
=π (4.87)
G – навеска вещества пленки,
M – молярная масса,
S – занятая пленкой площадь.
π
A
π
400
200
1
2
ид.
A, Å
2
t,°C
20
40
0
10 20
65
π
S
π
x
Рис. 4.42. Построение зависимости по соотношению (4.87)
x = GkT/M, отсюда можно получить молярную массу белка M.
Конденсированные пленки
(Образуются при n
C
> 14)
Типы кривых сжатия:
Рис. 4.43. Кривые сжатия для конденсированных пленок:
I – пленки с плотной упаковкой цепей R–COOH, S
COOH
= 20,5 Å
2
;
II – ROH, S
OH
= 25 Å
2
;
III –C=C–COOH, S = 28 Å
2
; есть легко сжимаемые участки.
Предполагается, что излом обусловлен тем, что полярные группы не
сжимаются, а лишь приподнимаются, входят в зигзаги цепей, образуя
двухслойную структуру.
II, III – пленки с перегруппировкой головных групп.
Рис. 4.44. Схема перегруппировки полярных групп.
IV – без излома; сечение полярных групп меньше чем у основной части
молекулы (C
6
H
5
OH)
V – крупные полярные группы – пленки с плотнейшей упаковкой
головных полярных групп (R–CHX–COOH) S = 35 Å
2
.
20 25 30 35
0
5
10
15
π, дин/см
A, Å
2
I
II
III
IV
V

66
Исследование белков (М ≈ 44000)
50 140
π
A, нм
2
Рис. 4.45. Кривая сжатия для белков.
50 нм
2
– площадь полипептидной цепи;
140 нм
2
– вся площадь макромолекулы.
Видим
: при малых поверхностных давлениях π, вся молекула развернута
в поверхностной пленке, ее полипептидная и боковые гидрофильные и
гидрофобные группы лежат на поверхности, занимая площадь 14000 Å
2
.
Вывод:
1) В развернутом состоянии в молекуле белка открыты неполярные
части для
ферментативной атаки, поэтому увеличивается скорость расщепления белков
.
2) В пленке благоприятные условия для синтеза белка при больших π
;
3) Соприкосновение открытых неполярных групп с неполярной фазой
благоприятно для растворения белков в липидах.
В объемной жидкой фазе in vitro это явление не наблюдается, но может
быть смоделировано при помощи поверхностных пленок.
На скорость реакций в пленках существенно влияет заряд пленки. Часто
переходное состояние в химической реакции имеет заряд. Если пленка
заряжена
, тогда энергия активации изменится на величину zFΔϕ, чем можно
добиться облегчения протекания реакции. Так, при Δϕ = 500 мВ, экспонента
Аррениуса и, соответственно, скорость реакции изменится в 10
8
раз!
Рис. 4.46. Схема возникновения потенциала поверхностной пленки.
В кислой среде пленка, образованная жирными кислотами (рис. 4.46а) со
стороны газовой фазы будет нести положительный заряд. В щелочной среде,
более сильным будет ионный диполь O
–
– Na
+
и пленка будет заряжена
отрицательно. Следовательно, изменяя pH раствора, меняем тем самым заряд
поверхностной пленки и можем влиять на скорость реакции в пленках.
()
C
+
()
O
−
()
OH
−
2
CH
O
−
Na
+
()
C
+
()
O
−
2
CH
а б
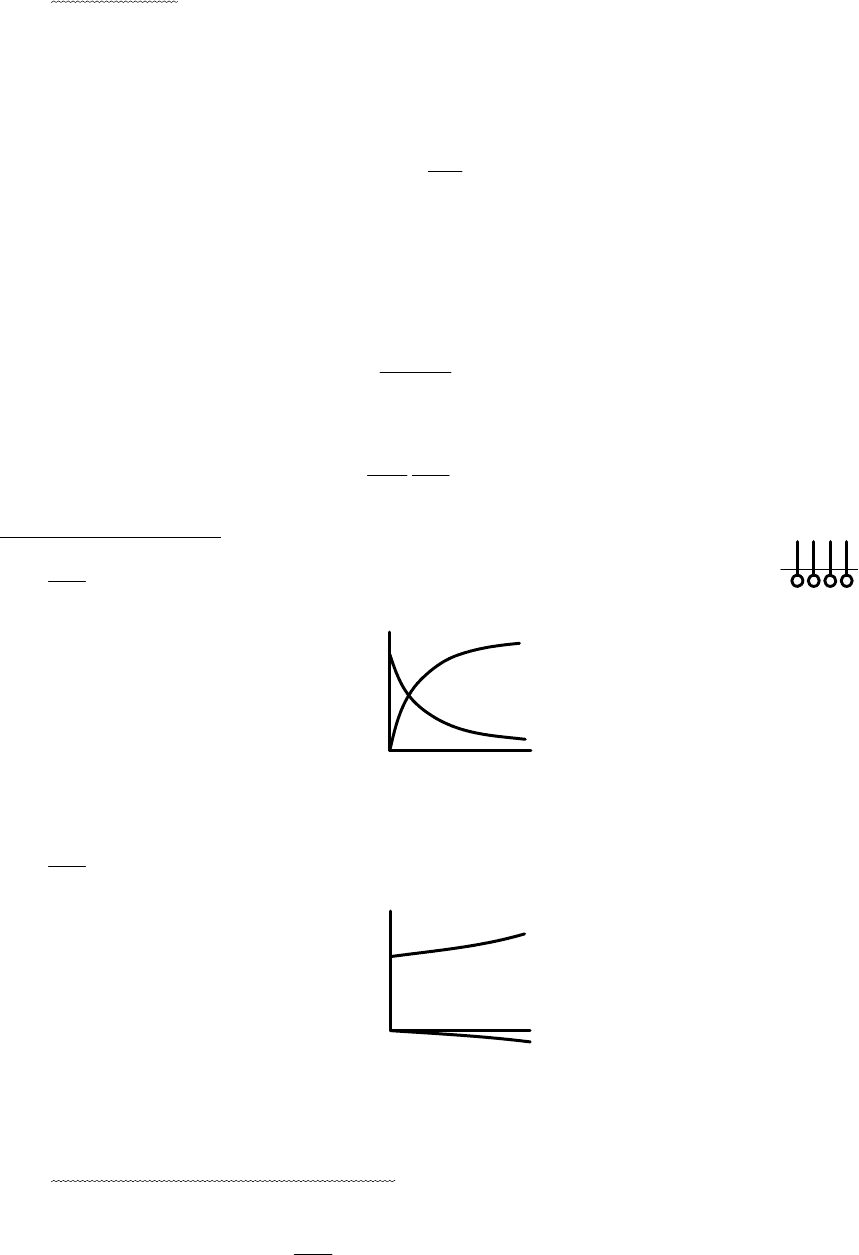
67
5. АДСОРБЦИЯ НА ГРАНИЦЕ ЖИДКОСТЬ-ГАЗ
Адсорбция – Г [моль/см
2
] – избыток вещества на поверхности по
сравнению с объемом.
Значение адсорбции на один моль поверхностного избытка:
Г = 1/S (5.1)
Изменение свободной поверхностной энергии:
Γ
σ
=σ=
d
SddG (5.2)
При адсорбции совершается осмотическая работа при удалении того же
количества вещества из объема на поверхность:
dA d
=
−πv (5.3)
Т. к. C = 1/
v; v = 1/C; dπ = RTdC, то:
C
RTdC
dA −= (5.4)
т. к. (5.4) = (5.2), то
dC
d
RT
C
σ
−=Γ
(5.5)
– Уравнение Гиббса
Если
0,0 >Γ<
σ
dC
d
, такое вещество поверхностно-активно (ПАВ):
Г(С)
σ
(С)
Рис. 5.1. Характерный вид изотерм поверхностного натяжения и изотерм
адсорбции для поверхностно-активных веществ.
Если
0,0 <Γ>
σ
dC
d
, такое вещество поверхностно-инактивное (ПИАВ).
Г(С)
σ
(С)
Рис. 5.2. Характерный вид изотерм поверхностного натяжения и изотерм
адсорбции для поверхностно-инактивных веществ.
Поверхностная активность
(G) – способность понижать поверхностное
натяжение:
[Гиббс]
d
G
dC
σ
−= (5.6)
68
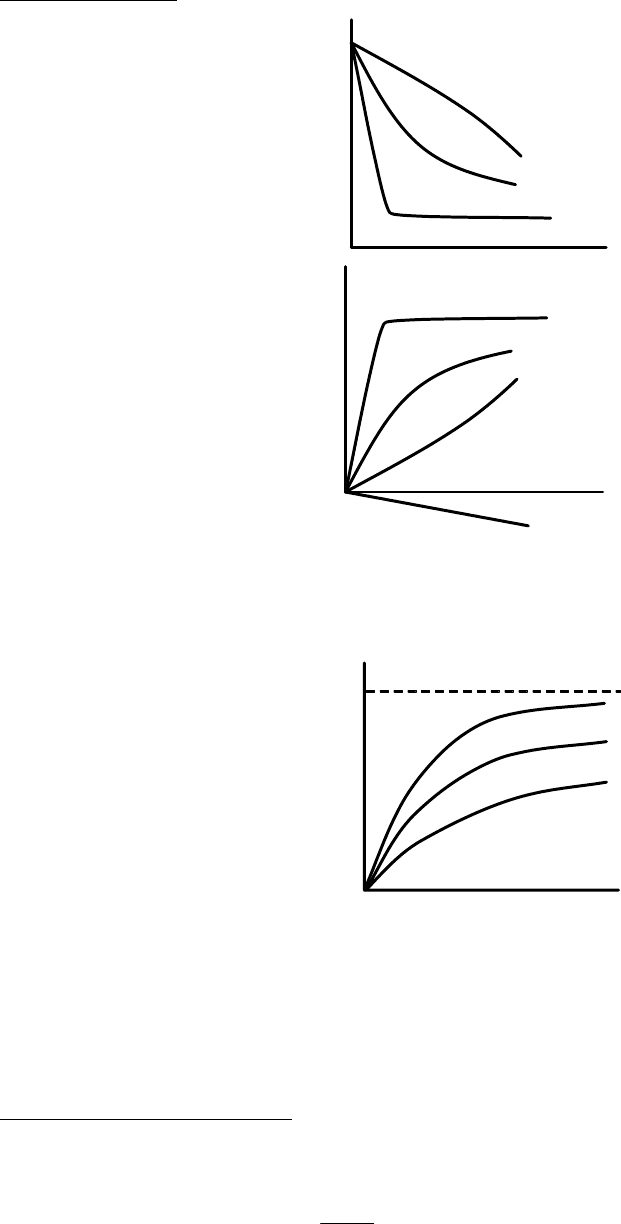
Виды изотерм.
1
2
3
σ
C
1
2
3
Γ
C
ПИАВ
Рис. 5.3. Виды изотерм поверхностного натяжения (верхний рисунок)
и изотерм адсорбции (нижний рисунок).
1 – мыла; 2 – R–OH, R–COOH; 3 – C
n
H
2n
без полярных групп.
1
2
3
Γ
C
Γ
∞
Рис. 5.4. Изотермы адсорбции при различных температурах (T
1
< T
2
< T
3
).
С возрастанием температуры адсорбция падает вследствие теплового
движения)
В гомологическом ряду способность к адсорбции увеличивается
(выталкиваются гидрофобные углеводородные цепи).
Правило Дюкло-Траубе:
В гомологическом ряду с увеличением углеводородного радикала на одну
CH
2
-группу, поверхностная активность увеличивается в 3 – 3,5 раза.
5,33
1
−≈
+
n
n
G
G
(5.7)
Правило справедливо:
а) для комнатной температуры
б) для разбавленных растворов (C→0)
69
в) для водных растворов.
Характеристики поверхностно-инактивных веществ:
1) σ
в-ва
> σ
H2O
2) растворимы в воде
– это неорганические кислоты, соли, щелочи. Их ионы сильно гидратированы.
Чем больше заряд иона, тем больше изменение поверхностного натяжения Δσ.
Причина:
взаимодействие ион–H
2
O (ион-дипольное) больше чем H
2
O–
H
2
O (диполь-дипольное).
Поверхностно-активные вещества в большей степени понижают
поверхностное натяжение чем поверхностно-инактивные повышают, например:
мыла: C ~ 10
-3
моль/л → Δσ ≈ –40 эрг/см
2
;
ПИАВ: C = 1 моль/л → Δσ ≈ +1 эрг/см
2
.
Обусловлено это тем, что молекулам ПИАВ, в отличие от молекул ПАВ,
невыгодно находиться на поверхности, и, таким образом, на поверхности их
находится гораздо меньше и, соответственно, в меньшей мере изменяются
энергетические характеристики поверхности.
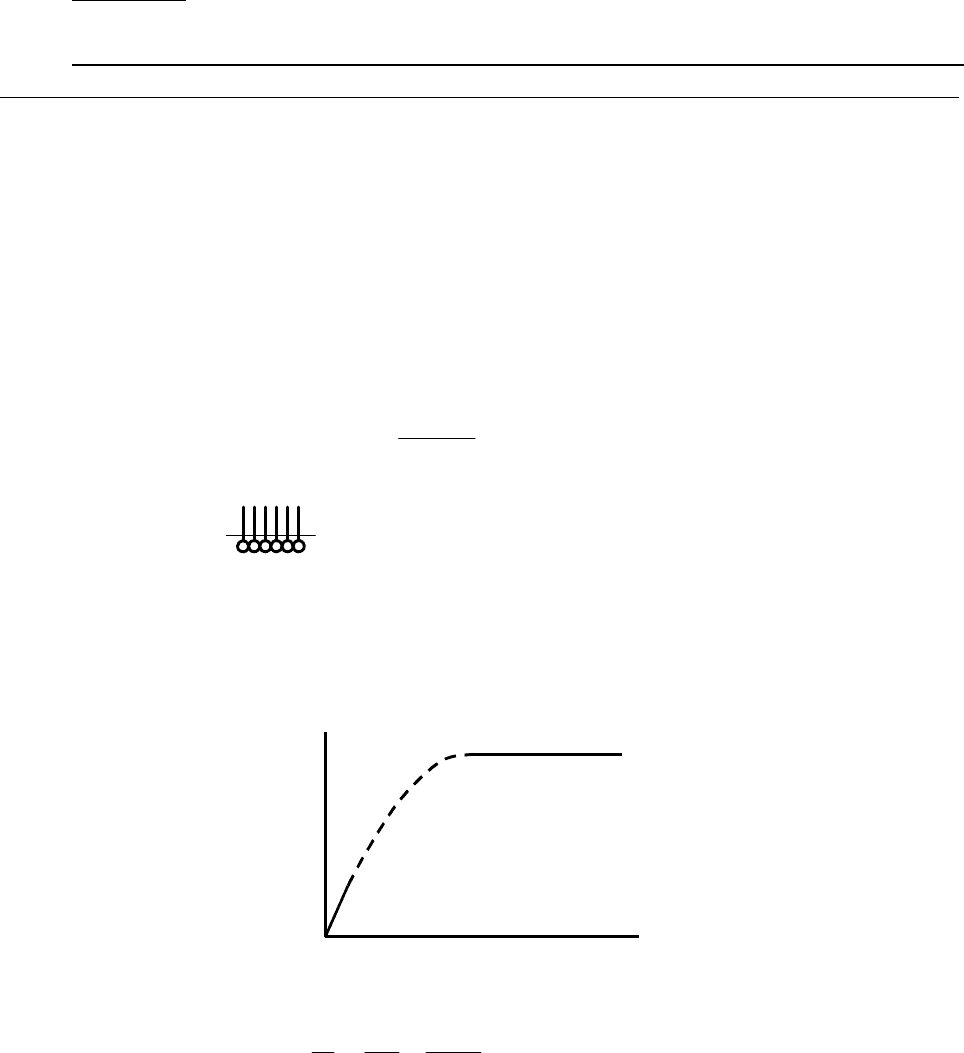
5.1. Уравнение Лэнгмюра
KC
KC
+
Γ=Γ
∞
1
(5.8)
Г
∞
– максимальная адсорбция, соответствует полному заполнению поверхности
молекулами ПАВ:
Анализ уравнения:
1) C мало ⇒ Г = Г
∞
KC – прямо-пропорциональная зависимость при малых
концентрациях;
2) C велико (KC >> 1) ⇒ Г = Г
∞
= const – при больших концентрациях
зависимость выходит на насыщение:
Г
С
Рис. 5.5. Лэнгмюровская изотерма адсорбции.
Приведем уравнение к линейному виду:
K
CC
∞∞
Γ
+
Γ
=
Γ
1
(5.9)
Тогда в координатах C/Г = f(C), котангенс угла α даст максимальную
адсорбцию Г
∞
, а отсекаемый отрезок a = 1/ Г
∞
K:

70
C
C/Г
α
0
a
Рис. 5.6. Построение изотермы адсорбции в линейных координатах.
Для гомологического ряда:
C
Г
Г
∞
Рис. 5.7. Изотермы адсорбции для гомологического ряда.
Максимальная адсорбция Г
∞
гомологов = const.
A
N
∞
Γ⋅ дает максимальное число молекул, способных адсорбироваться на
одном квадратном сантиметре площади поверхности раствора ПАВ. Тогда по
пропорции
Г
∞
·N
A
молекул – 1 см
2
1 молекула – S
0
можем рассчитать площадь приходящуюся на одну молекулу:
A
N
S
∞
Γ
=
1
0
(5.10)
S
0
– площадь полярной группы.
Масса 1 см
2
поверхностного слоя:
m = M·Г
∞
(5.11)
С другой стороны массу 1 см
2
слоя толщиной в одну молекулу можем
рассчитать, зная плотность ПАВ:
m = l·d
ПАВ
(5.12)
Т. к. (5.11) = (5.12), можем рассчитать длину молекулы ПАВ:
ПАВ
d
M
l
∞
Γ⋅
= (5.13)
Длина, приходящаяся на одну связь C–C: l/n
C
≈ 1,35 Å
