Лекции - коллоидная химия
Подождите немного. Документ загружается.


111
автор получил пять основных типов изотерм, но в отличие от теории БЭТ
исходя из представлений о монослойности.
8.7. Адсорбция на пористых адсорбентах
Адсорбция на пористых адсорбентах описывается только теорией
Поляни.
Рис. 8.23. Адсорбция C
6
H
6
на SiO
2
: 1 – r
пор
= 25 Å, 2 – r
пор
= 75 Å
(при малых давлениях).
Причина отличия изотерм адсорбции – аддитивность дисперсионных сил
в узких порах.
При больших давлениях: S-образная полимолекулярная адсорбция за счет
капиллярной конденсации.
Рис. 8.24. Изотерма полимолекулярной адсорбции с капиллярной
конденсацией.
Роль капиллярной конденсации зависит от адсорбционного потенциала
(ε): Если адсорбционный потенциал велик, то поры заполняются при
небольших давлениях, недостаточных
для капиллярной конденсации
При несмачивании происходит капиллярное выталкивание вещества из
пор, адсорбция минимальна и возможна только на ровных поверхностях и в
крупных порах.
На переходнопористых телах адсорбция идет. в основном, по механизму
капиллярной конденсации, которая начинает проявляться при определенной
степени заполнения адсорбента или при определенном значении давления пара,
характерного для
данной системы.
P
x
P
0
P
/
P
0
x
, мкмоль/м
2
0,5 0
2
4
2
1
112
При смачивании стенок пор сконденсированной жидкостью формируется
сферический мениск, над которым давление насыщенного пара можно
рассчитать по уравнению Томсона:
сф 0
2
exp
m
PP
rRT
σ
⎛⎞
=⋅ −
⎜⎟
⎝⎠
v
(8.60)
– уравнение Томпсона
, тогда с учетом (8.21), адсорбционный потенциал:
2
m
r
σ
ε=
v
(8.61)
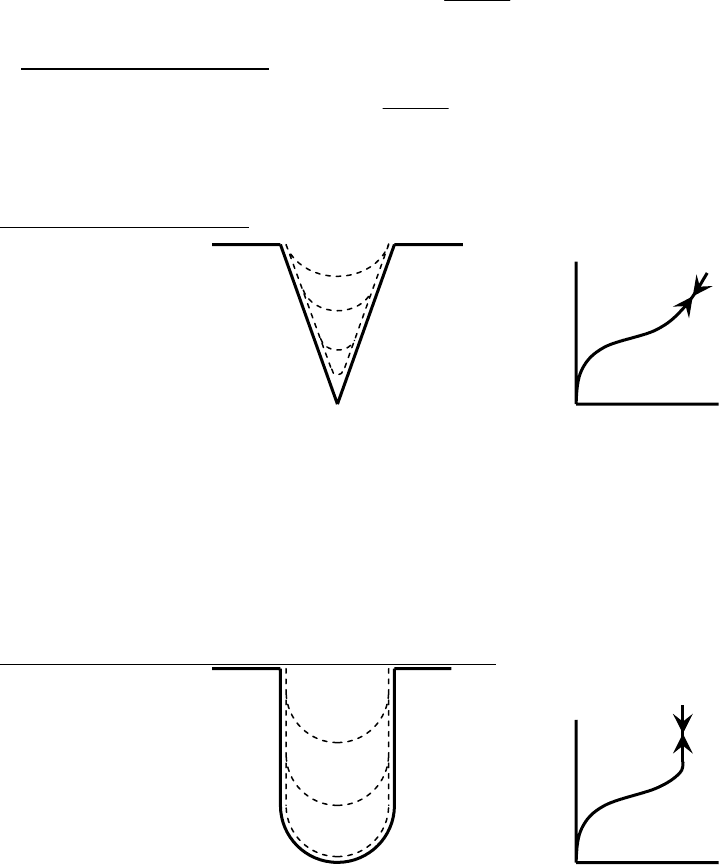
Рассмотрим случаи капиллярной конденсации на порах различной формы:
1) Конические поры:
Рис. 8.25. Схема адсорбции (десорбции) на конических порах и
соответствующая изотерма адсорбции и десорбции.
При адсорбции, сначала идет адсорбция на стенках пор (первая часть
изотермы адсорбции), при достижении давления (8.60) происходит адсорбция
по механизму капиллярной конденсации с увеличивающимся радиусом
кривизны. Процесс обратим, десорбция идет по той же кривой
2) Цилиндрическая пора, закрытая
снизу:
Рис. 8.26. Схема адсорбции (десорбции) на глухих циллиндрических порах и
соответствующая изотерма адсорбции и десорбции.
Сначала идет адсорбция на стенках, затем вогнутый сферический мениск
с постоянным радиусом и конденсация идет при постоянном давлении. Процесс
также обратим.
P
x
P
x
113
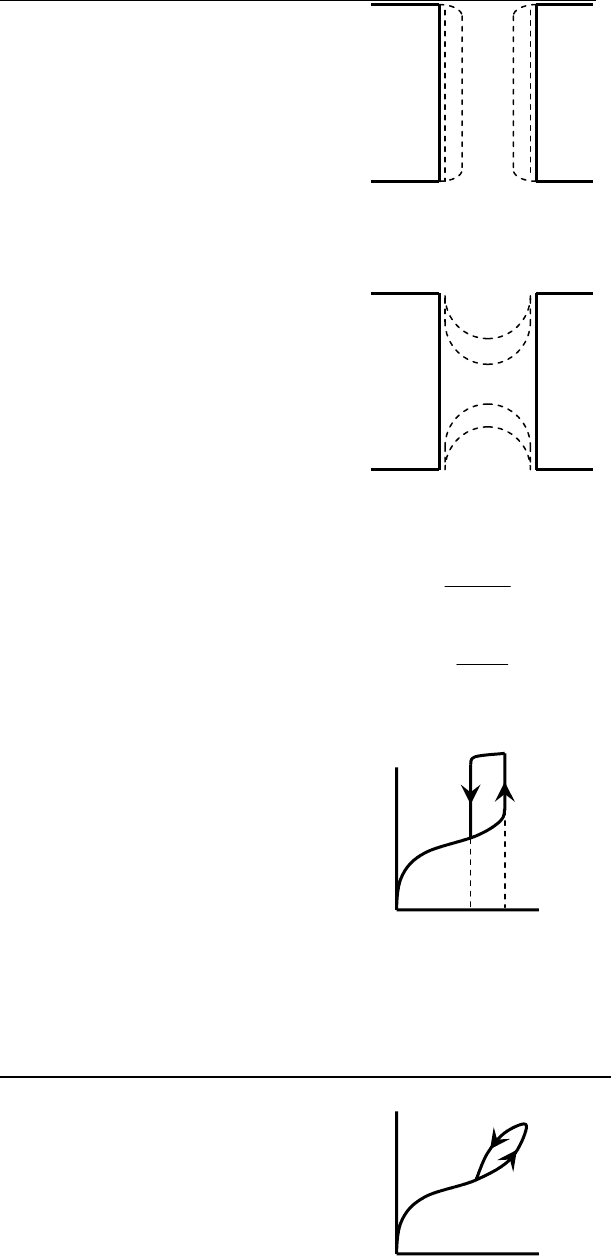
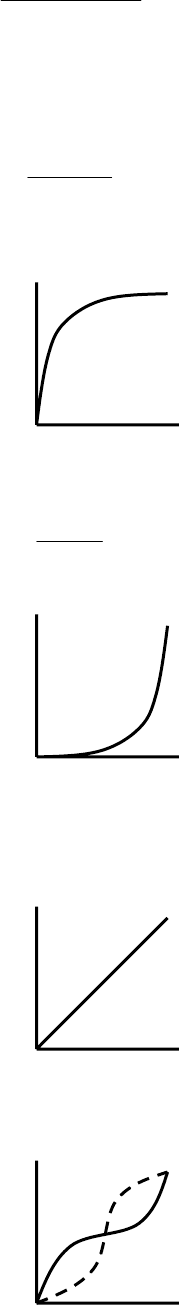
3) Цилиндрическая пора, открытая с двух сторон:
Рис. 8.27. Схема адсорбции на сквозных цилиндрических порах.
адсорбция: вначале на стенках, затем конденсация на цилиндрической
поверхности;
Рис. 8.28. Схема десорбции на сквозных цилиндрических порах.
десорбция – со сферической поверхности.
сф 0
2
exp
m
PP
rRT
σ
⎛⎞
=⋅ −
⎜⎟
⎝⎠
v
(8.62)
цил.0
exp
m
PP
rRT
σ
⎛⎞
=⋅ −
⎜⎟
⎝⎠
v
(8.63)
P
сф.
< P
цил
, процесс – гистерезисный:
Рис. 8.29. Изотерма адсорбции и десорбции на сквозных цилиндрических
порах.
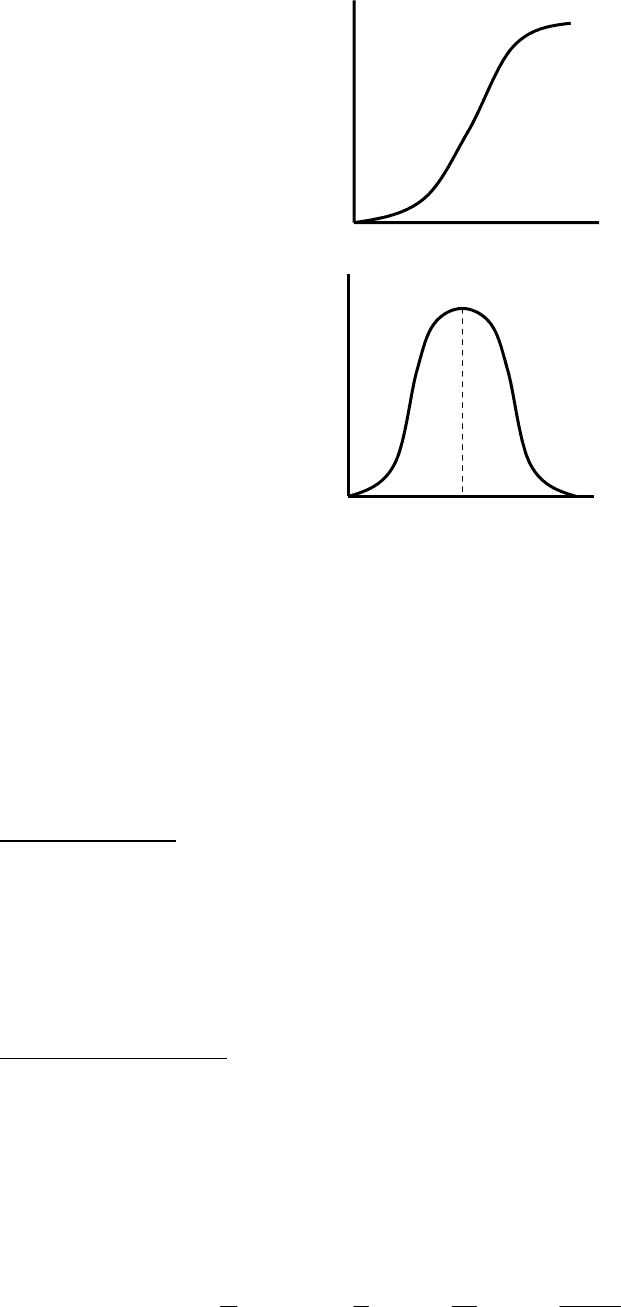
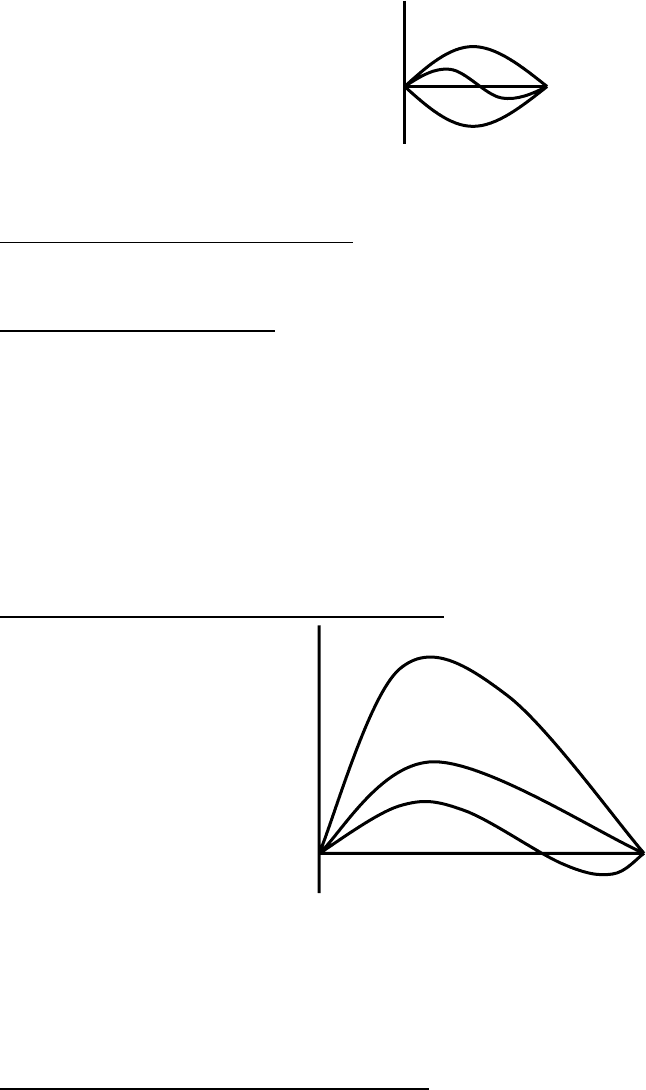
4) Реальный адсорбент с различным радиусом пор.
Рис. 8.30. Изотерма адсорбции и десорбции на реальном пористом адсорбенте.
Петля имеет наклон. Т. к. при десорбции мениск – сферический, поэтому
по ветви десорбции по уравнению Томпсона можно вычислить радиус пор.
P
x
P
сф
P
цил
P
x
114
Рис. 8.31. Интегральная кривая распределения пор по радиусам.
Рис. 8.32. Дифференциальная кривая распределения пор по радиусам.
При этом рассчитанный эффективный радиус является суммой радиуса
пор и толщины слоя адсорбата на непористом адсорбенте: r
эф.
= r
пор
+ l.
Гистерезис может быть вызван гистерезисом смачивания (наличие газов
на поверхности). Поэтому если петля сохраняется при повторении адсорбции,
то можно говорить о гистерезисе капиллярной конденсации.
Типы адсорбентов
I. Непористые.
1) S
уд
≤ 10 м
2
/г – осадки, размолотые вещества;
2) S
уд
= 100 м
2
/г:
а. сажа (при неполном сгорании органических веществ);
б. белая сажа (неполное сгорание кремнийорганических веществ);
в. аэросилы (SiHal
4
+ H
2
O
(пар)
→ SiO
2
+ 4HHal)
II. Тонкопористые.
S
уд
= 1000 м
2
/г:
1) Корпускулярная структура. Построены из частиц коллоидного размера –
ксерогели.
гл
2
уд
4 NrS π= , (8.64)
N
гл
– число глобул в 1 г.
Объем 1 г агента:
вав
удудгл
3
1
633
4
−
=⋅=⋅=π=
d
S
D
S
r
NrV (8.65)
r
э
ф
.
V
по
р
r
э
ф
.
ΔV/Δr
наиб.
вероятн.
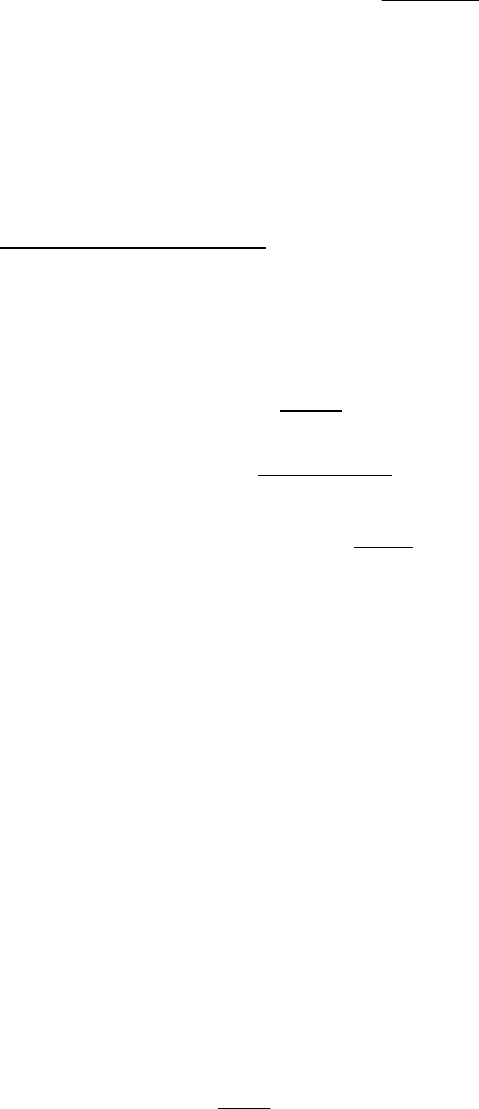
115
вав
уд
6
−
⋅
=
dD
S (8.66)
Например:
SiO
2
, d = 2,2 г/см
3
, при S
уд
= 100 и 800 м
2
/г, D = 300 и 40 Å.
2) Губчатая структура скелета.
Образуется при действии газов, паров на непористые.
Активирование углей.
1. C + 800°C → удаление смол, структура не изменяется.
2. Экстракция растворителем → –//–.
3. C + CO
2
→ 2CO; C + O
2
→ CO
2
; C + H
2
O → CO + H
2
⇒ структура пор
изменяется.
Для адсорбции газов
уголь должен иметь широкие каналы и узкие
ультрапоры.
Для адсорбции красителей
– широкие, легкодоступные поры.
Пористость:
%100⋅
δ
δ
−
=Π
d
(8.67)
d – плотность непористого адсорбента, δ – плотность пористого.
Пористость определяют пикнометрически. Пикнометр представляет
собой стеклянный сосуд (колбочку со шлифованным горлышком и притертой
пробочкой), имеет метку и надпись о вместимости (число мл). Предварительно,
однако, определяется точный объем пикнометра.
1. Навеску активированного угля в пикнометре заливают водой и
термостатируют сутки для полного
заполнения пор;
2. Доводят до метки;
3. Взвешивают и по разности масс определяют массу воды и, соответственно,
объем воды;
4. По разнице объема пикнометра и объема воды находится объем угля.
5. Через массу и объем находим плотность угля;
6. Аналогично с углем с запарафинированными порами находим δ и пористость
– П.
Фролов в своем
учебнике [2] приводит другое определение пористости:
ТТструктуревпустотдоля==Π
общ
пор
V
V
(8.68)
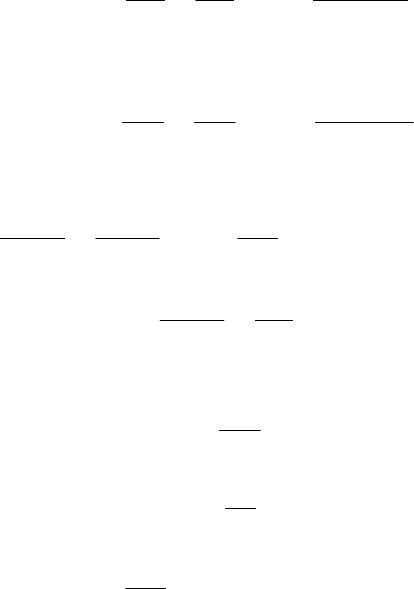
116
9. АДСОРБЦИЯ НА ГРАНИЦЕ ТВЕРДОЕ ТЕЛО – РАСТВОР
НЕЭЛЕКТРОЛИТА
Особенности адсорбции на границе твердое тело – раствор
неэлектролита:
1. несколько компонентов конкурируют за место на поверхности;
2. на поверхности нет свободных мест;
3. время адсорбции из растворов больше чем из газов.
При равновесии:
11
μ=μ
a
(9.1)
22
μ=μ
a
(9.1а)
– химические потенциалы компонентов на поверхности и в растворе равны.
11
0
111
0
1
lnln γ+μ=γ+μ xRTxRT
aaa
(9.2)
x – молярная доля, γ – коэффициент активности
22
0
222
0
2
lnln γ+μ=γ+μ xRTxRT
aaa
(9.3)
Из (9.2):
⎟
⎟
⎠
⎞
⎜
⎜
⎝
⎛
μ−μ
−
γ
γ
=
RTx
x
a
a
a
0
1
0
1
1
1
1
1
exp (9.4)
Из (9.3):
⎟
⎟
⎠
⎞
⎜
⎜
⎝
⎛
μ−μ
−
γ
γ
=
RTx
x
a
a
a
0
2
0
2
2
2
2
2
exp (9.5)
Поделим выражение (9.5) на (9.4):
()
(
){}
⎥
⎦
⎤
⎢
⎣
⎡
μ−μ−μ−μ−
γγ
γγ
=
0
1
0
1
0
2
0
2
12
12
12
12
1
exp
aa
a
a
a
a
RTxx
xx
KK
K
K
xx
xx
s
aa
a
==
γ
12
12
, (9.6)
где
a
a
a
K=
γ
γ
1
2
; (9.7)
γ
=
γ
γ
K
1
2
; (9.8)
(
)( ){}
saa
K
RT
=
⎥
⎦
⎤
⎢
⎣
⎡
μ−μ−μ−μ−
0
1
0
1
0
2
0
2
1
exp (9.9)
Т. к. сумма молярных долей обоих компонентов равняется единице, то:
21
1 xx −= , (9.10)
21
1
aa
xx −= (9.11)
подставим в (9.6):
117
()
2
2
2
11 xK
Kx
x
a
−+
= (9.12)
Проанализируем:
1. При x
2
→ 0, x
a2
= Kx
2
; при x
2
→ 1, x
a2
→ 1;
2. K >> 1, K
s
> 1 (адсорбат 2 адсорбируется лучше чем 1), K
γ
/K
a
= 1:
2
2
2
1 Kx
Kx
x
a
+
= (9.13)
– Лэнгмюровская зависимость:
Рис. 9.1. Изотерма адсорбции (адсорбат 2 адсорбируется лучше чем адсорбат 1).
3. K << 1, K
s
< 1 (адсорбат 1 адсорбируется лучше чем 2), K
γ
/K
a
= 1:
2
2
2
1 x
Kx
x
a
−
= (9.14)
Рис. 9.2. Изотерма адсорбции (адсорбат 1 адсорбируется лучше чем адсорбат 2).
4. K = 1, K
s
= 1, K
γ
/K
a
= 1:
22
xx
a
=
(9.15)
Рис. 9.3. Изотерма адсорбции (адсорбционный азеотроп).
5. K
s
= 1, K
γ
≠ K
a
:
Рис. 9.4. Изотерма адсорбции (есть точка азеотропа).
x
2
x
a2
x
2
x
a2
x
2
x
a2
x
2
x
a2
1
2
118
В координатах адсорбция – мольная доля, для рассмотренных выше
случаев зависимости будут выглядеть следующим образом:
Рис. 9.5. Изотермы адсорбции на границе жидкость – твердое тело.
Зависимость от температуры.
С увеличением температуры, адсорбция уменьшается.
Влияние растворителя.
1. Чем больше теплота смачивания, тем худшей средой является растворитель;
2. Правило выравнивания полярностей: адсорбция идет в сторону
выравнивания полярностей фаз и тем сильнее, чем больше первоначальная
разность полярностей поверхности и среды.
ε
среды
> ε
адсорбата
> ε
поверхности
или
ε
среды
< ε
адсорбата
< ε
поверхности
Зависимость от природы адсорбента.
Рис. 9.6. Адсорбция бензола:
1 – на гидроксилированном силикагеле;
2 – на дегидроксилированном силикагеле;
3 – на графитированной саже.
Зависимость от природы адсорбата.
На начальном участке при малых концентрациях для гомологического
ряда также действует правило Дюкло-Траубе (рис. 9.7).
x
2
Г
3
2
5
0
Г
1
2
3
119
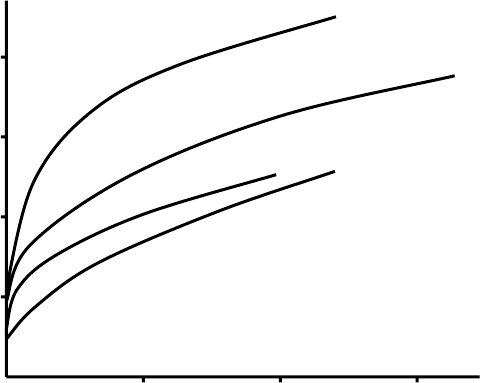
Рис. 9.7. Адсорбция жирных кислот на угле из водного раствора:
1 – муравьиная; 2 – уксусная; 3 – пропионовая; 4 – масляная.
0 0,5 1 1,5
1
2
3
4
Г
С
1
2
3
4

120
10. АДСОРБЦИЯ ЭЛЕКТРОЛИТОВ
Особенности адсорбции электролитов.
1. Образование ДЭС:
• потенциалопределяющие ионы – ионы адсорбированные на поверхности;
• противоионы – ионы в растворе, нейтрализующие заряд
потенциалообразующих, притягиваются под действием электростатических
сил.
Рис. 10.1. Двойной электрический слой.
2. Адсорбция специфична. В первую очередь адсорбируются изоморфные
кристаллической решетке ионы, достраивающие ее и дающие
нерастворимое соединение.
3. Адсорбция увеличивается с увеличением валентности иона.
4. Адсорбция
увеличивается с уменьшением радиуса гидратированного иона.
5. Ионы одной валентности по способности к адсорбции расположены в ряды
адсорбции Гофмейстера (лиотропные ряды):
Li
+
< Na
+
< K
+
< Rb
+
< Cs
+
;
6. Ряд анионов:
Cl
–
< Br
–
< NO
3
–
< J
–
< CNS
–
;
7. Протекает обменная адсорбция: ион раствора ↔ ион поверхности
В природе чаще встречаются отрицательно заряженные поверхности,
например, взвеси глины.
10.1. Строение двойного электрического слоя
Теории отличаются толкованием структуры слоя противоионов.
Теория Гельмгольца-Перрена (1879 г.)
Противоионы расположены от поверхности на одном расстоянии:
Рис. 10.2. Строение ДЭС согласно теории Гельмгольца-Перрена.
– Плоский конденсатор, характеризуется линейным падением потенциала;
+
+
+
+
–
–
–
–
+
+
+
+
–
–
–
–
x
ϕ
0
δ
