Киреев П.С. Физика полупроводников
Подождите немного. Документ загружается.


что совпадает с (23.4). Из (23.29) следует, что энергия электронов
должна быть проквантована для каждой зоны в соответствии с выра-
жением (23.26): _ „ " .
-Пщ(п-{-^ = Е{к
г
, ft, со
0
). (23.30)
Е = Е
п
2т*
еВ л ι г»
, п = 0, 1, 2,
Вез поля
На рис. 34 наглядно изображено превращение квазинепрерывного
спектра энергий в дискретный. Квантова-
ние энергии приводит
>с
целому ряду магнето-
осцилляционных явлений: магнетооптическо-
му поглощению, осцилляции магнитной вос-
приимчивости, осцилляции магнетосопротив-
ления и др. Эффекты квантования энергии
могут быть заметны при условии, что рас-
стояния между уровнями энергии превы-
шают энергию kT, в противном случае
функция распределения электронов по со-
стояниям остается квазинепрерывной:
Влоле В?
V7--J
(7/2)ficoc
γζ
(5/2) f) ω с
U/
(3/2)ГЮ)с
\п=0 (1/2)№
с
Г
и
. Ш* —
(23.31)
Подставляя значения констант е> U
y
k, m, получим
1,6 -^r£.10~
20
> 1,38-10"
16
7\
Рис. 34. Группировка ква-
зинепрерывного спектра
энергии в дисркетные
уровни Ландау
(23.32)
или
В (Гс) > — Γ· 10
4
.
4
m
Если Τ = 4,2° (жидкий гелий), то
й(Гс)>42 000(^),
(23.33)
т. е. 5>42000Гс при -^-=1;
В> 4,2 кГс при ^1 = 0,1. -
Очевидно, что для наблюдения квантования энергии в магнитном
поле с использованием пол£й в десятки килогауссов необходимы
температуры жидкого гелия.
Резюме § 23
При наложении магнитного поля на кристалл характер движения
электрона меняется: электрон движется вдоль поля со скоростью
n(Kz
~
KQz)
(23.1 ρ)
и
вращается в плоскости, перпендикулярной полю.
5
* 131

2. Частота вращения ω
0
, называемая циклотронной частотой,
определяется индукцией В магнитного поля и эффективной массой щ*\
(д
0
= еВ/т*. (23.2р)
3. Энергия электрона, соответствующая вращательному движению,
квантована, в результате чего в окрестности экстремума
E = E
0
+^ + fl(*o(n+Y)=E(K
2
, η, ω
0
). (23.3ρ)
4. Гамильтониан свободного электрона в магнитном поле можно
получить из выражения для кинетической энергии, которая зависит
от импульса р, если ввести обобщенный импульс
Р = р +
еА,
(23.4р)
которому соответствует оператор
—
ihV.
5. Квантование энергии электрона в магнитном поле лежит в
основе ряда магнетоосцилляционных явлений.
6. Полупроводник, находящийся в магнитном поле с индукцией
5, может поглощать энергию излучения с частотой щ = еВ/т*. Это
явление носит название циклотронного, или диамагнитного, резо-
нанса. Электрон, поглотив квант энергии йсо
0
, переходит на более
высокий уровень Ландау.
§ 24. ПРИНЦИП ПАУЛИ. ПОНЯТИЕ МЕТАЛЛА,
ПОЛУПРОВОДНИКА И ДИЭЛЕКТРИКА
Состояние классической частицы характеризуется набором шести
физических величин, например (х, у, г, р
ХУ
р
у
, p
z
). Если не учиты-
вать спин, то состояние квантовой частицы описывается тремя вели-
чинами, например (л:, у, г), (р
х
, р
у
, р
г
) или (£, Αί
2
, М
г
). Более
точное описание должно в любом наборе содержать четвертую вели-
чину—проекцию спина на некоторое направление, обычно на ось
z
t
—
s
z
. Таким образом, полный набор, необходимый для описания
квантовых состояний, состоит из четырех физических величин (L
lt
L
2
,
L
3
, s
2
). Выбор трех физических величин (L{
f
L
2
, L
3
) определяется
обычно видом квантовой системы. В атоме наиболее употребителен
набор из энергии Ε, модуля орбитального момента |М| и проекции
орбитального момента М
г
. Обычно эти величины выражаются через
соответствующие квантовые числа η> I и т/. Для описания состояний
электрона в кристалле наиболее удобно использовать набор из про-
екций квазиимпульса (Р
х
, Р
у
, Р
г
) или волнового вектора (к
х
, к
у
,
и проекции спина s
z
.
Напомним формулировку принципа Паули: при измерении физи-
ческих величин (L
lt
L
2
, L
3i
s
g
)
9
входящих в полный набор, каждый
полный набор может быть получен не более чем один раз. В более
простой формулировке принцип Паули гласит: в любом состоянии
с полным набором (Ь
ъ
L
2
, L
3
, s
2
) может находиться не более одного
132

электрона. Применительно к кристаллу это означает, что в состоя-
нии (к
ХУ
к
у
, к
г
, s
z
) может находиться не более одного электрона.
Если учесть, что s
z
принимает лишь два значения+1/2 и —1/2, то
можно сказать, что в состоянии {к
Х9
к
у
, κ
ζ
) может быть не более
двух электронов. Набор {к
х
, к
у
> к
2
) определяет величину энергии Ε (к)
поэтому, согласно принципу Паули, на данном энергетическом
уровне может быть ограниченное число электронов.
Найдем число возможных состояний в зоне. Если кристалл имеет
вид параллелепипеда с длиной ребер Ы
г
а
ъ
N
2f
a
2
N
3
a
3>
где
Л^
—число
атомов вдоль /-го ребра, то полное число атомов в кристалле равно
Νι·Ν2·Ν
3
= Ν; i-ая проекция вектора к принимает следующие зна-
чения:
-5L. я.-О· -+- 1· +2·
Ν
*~
ι
.
Ν
ι . (ол\\
di Nt ' — — A···— 2 ' ~>
число различных значений κι равно N
it
Полное число различных сос-
тояний в зоне Бриллюэна равно. Νχ- Ν
2
· N
3
= N,~m. е. равно числу
атомов в кристалле. Это означает, что в простой {невырожденной)
энергетической зоне и соответствующей ей зоне. Бриллюэна имеется 2N
состояний и в ней может быть не более 2N электронов. Если зона
g-кратно вырождена, то в ней может быть 2Ng электронов. Этот
результат означает сохранение числа состояний при образовании
кристалла из атомов. Действительно, пусть зона образована из
^-кратно вырожденного уровня. В свободном атоме на нем может
быть 2g электронов. Если кристалл образован из N свободных ато-
мов, то у них имеется 2Ng состояний.
4
Таким образом, число конеч-
ных состояний {в кристалле) равно числу исходных состояний {в ато-
мах).
Если в некоторой зоне нет ни одного электрона, то при наложе-
нии внешнего электрического поля эта зона никакого вклада
в проводимасть внести не может. Точно такой же разультат
справедлив и для зоны, в которой все состояния заняты электронами.
Действительно, электрон под действием внешнего поля переходит
на соседние энергетические уровни. Но это возможно только в том
случае, если соседние уровни свободны. Если же все состояния за-
няты, то переходы электронов в другие состояния согласно прин-
ципу Паули не возможны и, следовательно, электрическое поле не
может создать направленного движения такой совокупности элек-
тронов. Электроны могут стать электронами проводимости только
в том случае, если они находятся в незаполненной зоне. Этот простой
вывод является основой для классификации веществ по классам
проводимости.
К проводникам относятся вещества, имеющие при любой темпе-
ратуре не целиком заполненные зоны. К непроводникам относятся
6
Щества, имеющие некоторое число целиком занятых зон
t
а их сво-
бодные зоны отделены от заполненных энергетическим зазором или
запрещенной зоной. Непроводники могут быть полупроводниками или
133

диэлектриками. Деление*непроводников на полупроводники и диэлек-
трики условно. К полупроводникам относят вещества, для которых
ширина запрещенной зоны, отделяющей самую верхнюю из заполненных
(она называется валентной)
от самой нижней из свобод-
ных зон (она называется зо-
ной проводимости), не более
2
—
3 эВ. К диэлектрикам
относят вещества, ширина
запрещенной зоны которых
не менее 2
—
3 эВ. На рис. 35
дана энергетическая схема
металла (а), полупровод-
ника (б) и диэлектрика (в).
Рассмотрим в качестве при-
мера проводимость некото-
рых веществ с точки зрения
расположения их зон.
Щелочные элементы. Щелочные элементы имеют один валентный
электрон, находящийся в ^-состоянии. Остальные электроны зани-
мают заполненные оболочки (или подоболочки). Для определенности
в качестве примера рассмотрим натрий Na. Он имеет 11 электронов,
состояние которых записывается следующим образом: (Is
2
) (2s
2
) (2ρ
6
) 3s.
Видим, что первая Is- и вторая 2s- и 2р-оболочки заняты. В 35-оболочке
находится один электрон. При образовании кристалла уровни ато-
мо в расщепляются в зоны, как это условно изображено на рис. 23.
Приписывая зонам значки тех уровней, из которых они образовались,
можем сказать, что зоны Is, 2s, 2ρ заполнены целиком, так как в них на-
ходятся 2Ν, 2N и 6N электронов при 2N-, 2N- и бЛЛсостояний.
В зоне же 3s находятся N электронов при 2N возможных состоя-
ний. Таким образом, валентная зона, т. е. зона валетных элек-
тронов щелочных металлов, занята наполовину, половина зоны сво-
бодна. Щелочные элементы образуют хорошо проводящие кристаллы,
они являются металлами.
Щелочноземельные элементы. Щелочноземельные элементы имеют
два валентных электрона, находящихся в ns-состоянии. Например,'
для Mg(ls
2
) (2s
2
) (2р
6
) (3s
2
). Если зоны образуются для Mg таким же
образом, как и для Na, то Mg должен быть изолятором, поскольку
3s-30Ha целиком заполнена. Однако известно, что элементы второй
группы являются хорошими металлами. Это можно объяснить, если
предположить, что 3s- и Зр-зоны частично или полностью перекры-
ваются, в результате чего электроны верхних уровней
ЗБ-ЗОНЫ
зани-
мают нижние уровни Зр-зоны.
Электроны s-зоны, принимающие участие в создании проводимости,
занимают зону почти целиком, благодаря чему некоторые из них
находятся в состояниях, в которых их эффективная масса отрица-
тельна, вследствие чего они должны двигаться во внешних полях
как частицы с положительным зарядом. Это проявляется в том,
АЕ
0
<г-ЗэВ
а)
5)
в)
Рис. 35. Зоны энергии металла (а), полупро-
водника (б) и диэлектрика (в)
134

что для многих из них коэффициент Холла больше нуля, в то время
как для металлов с электронной проводимостью он должен быть
меньше нуля.
Элементы третьей группы. Металлические свойства элементов
третьей группы объясняются легко. Поскольку они имеют три валент-
ных электрона, только один из которых находится в /гр-состоянии, то
при образовании кристалла пр-зона будет заполнена на. 1/6.
Элементы четвертой группы. Элементы четвертой группы имеют
четыре валентных электрона, находящихся в состояниях (ns
2
)np
2
.
Если бы при образовании кристалла характер вырождения зон сов-
падал с характером вырождения исходных атомных уровней, то
элементы четвертой группы должны были бы быть металлами,
поскольку валентная р-зона, содержащая два электрона на атом,
должна быть заполнена на 1/3, Однако такие элементы, как герма-
ний и кремний, являются классическими полупроводниками, алмаз —
диэлектриком, а в некоторых случаях он выступает как полупро-
водник, а
—
Sn-полупроводник. Причина этого заключается в том,
что при образовании кристалла происходит частичное снятие выро-
ждения р-зоны. р-Зона расщепляется на две зоны —верхняя дву-
кратно вырождена, нижняя невырождена (без учета спинового выро-
ждения), при этом нижняя р-зона сливается с s-зоной, в результате
чего при некоторых расстояниях между атомами из двух зон
—
s и
р
—
образуются две зоны —верхняя образована из р-уровня, она
двукратно вырождена, нижняя образована из s-уровня и р-уровня,
и в верхней, и в нижней зонах содержится тем самым по 4N состоя-
ний, благодаря чему нижняя зона оказывается заполненной цели-
ком, а верхняя
—
полностью свободна. Таким же образом ведут
себя зоны при образовании кремния, германия, олова, только ширина
запрещенной зоны для них меньше. -
Аналогично можно объяснить полупроводниковые или диэлектри-
ческие свойства других простых веществ.
Из приведенных примеров видно, что для объяснения металли-
ческих свойств веществ необходимо предположить, что в некоторой
зоне число электронов меньше числа состояний. Это может быть
обусловлено или первоначальным неравенством числа исходных состоя-
ний и числа валентных электронов, или перекрытием зон, обеспечи-
вающим, излишек состояний по сравнению с числом валентных элек-
тронов. Для образования неметалла необходима такая комбинация
зон, чтобы число состояний и число элементов в них были одинако-
выми. Простейшим способом выполнения этого условия является
образование вещества вида А* В
8
-*, например A
111
B
v
. Общее
число валентных электронов на каждую пару атомов равно восьми.
Если зоны элементов А и В не перекрываются между собой, то
в
s-и р-зонах одного из них (или s —одного и р —другого) как раз
содержится восемь состояний на два атома. Рассмотрим в качестве
примера А1Р. Алюминий имеет 13 электронов, находящихся в состоя-
ниях (ls
2
)(2s
2
)(2p
6
)(3s
2
)3p
2
Р1/2, фосфор имеет 15 электронов, рас-
пределенных следующим образом по состояниям: (Is
2
) (2s
2
) (2ρ
6
) (3s
2
)
135
3p
34
S
3
/2. Здесь через
2
Рι/
2
и
4
S3/2 указаны основные состояния
атомов. В частности, отсюда видно, что единичные орбитальные
моменты трех р-электронов дают суммарный момент, равный нулю,
а спины всех трех р-электронов параллельны + 2S
Z
=1 +2
·
у
==
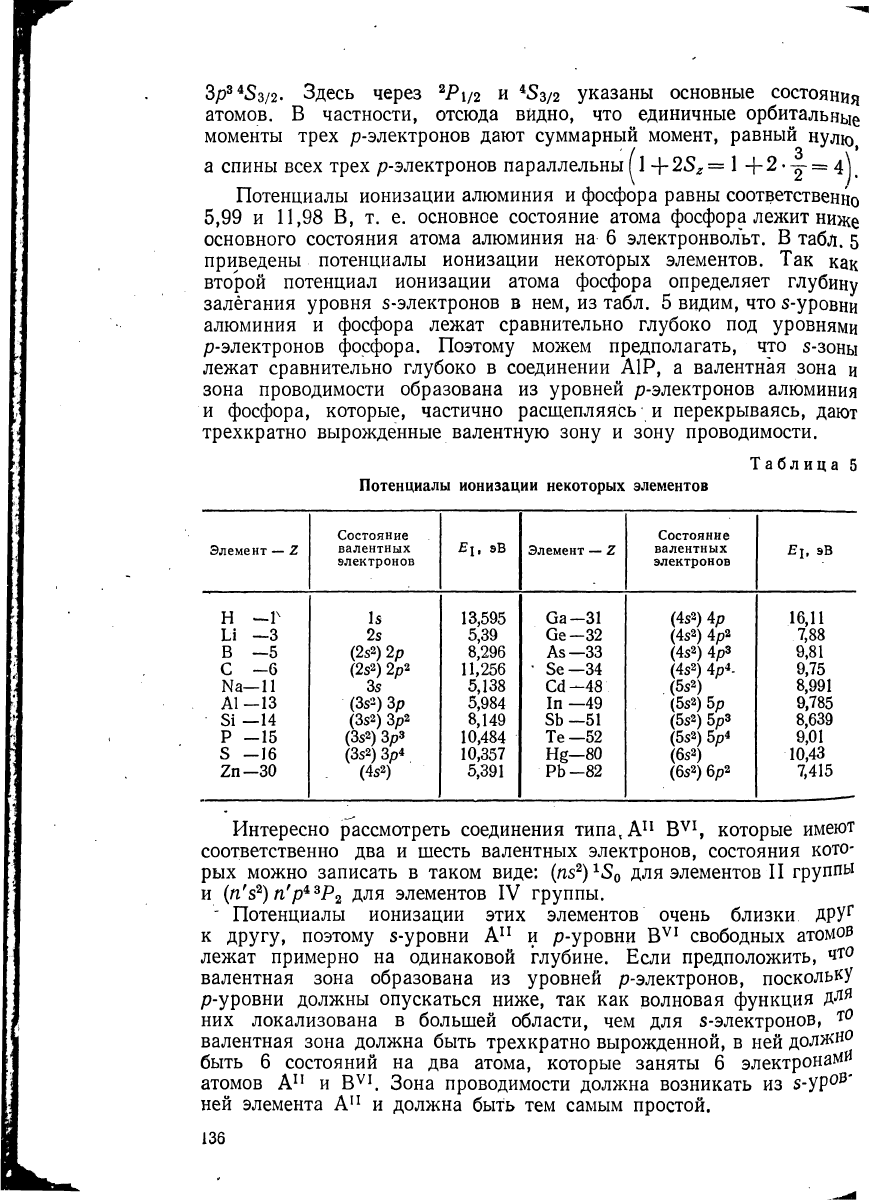
Потенциалы ионизации алюминия и фосфора равны соответственно
5,99 и 11,98 В, т. е. основное состояние атома фосфора лежит ниже
основного состояния атома алюминия на 6 электронвольт. В табл. 5
приведены потенциалы ионизации некоторых элементов. Так как
второй потенциал ионизации атома фосфора определяет глубину
залегания уровня s-электронов в нем, из табл. 5 видим, что s-уровни
алюминия и фосфора лежат сравнительно глубоко под уровнями
р-электронов фосфора. Поэтому можем предполагать, что s-зоны
лежат сравнительно глубоко в соединении А1Р, а валентная зона и
зона проводимости образована из уровней р-электронов алюминия
и фосфора, которые, частично расщепляясь и перекрываясь, дают
трехкратно вырожденные валентную зону и зону проводимости.
Таблица 5
Потенциалы ионизации некоторых элементов
Элемент — Ζ
Состояние
валентных
электронов
E
LT
эв
Элемент — Ζ
Состояние
валентных
электронов
E\, эВ
Η
Is
13,595
Ga —31
(4s2) 4p
16,11
Li —3
2s
5,39
Gs —32
(4s
2
) 4p2
7,88
В —5
(2s
2
) 2ρ
8,296 As—33
(4s
2
) 4p
3
9,81
С -6
(2s2) 2p2
11,256 ' Se—34 (4s2) 4p4.
9,75
Na—11
3s
5,138
Cd
—48
(5s2)
8,991
А1
—13
(3s3) 3ρ
5,984
In —49
(5s
2
) 5p
9,785
Si —14
(3s2) 3p2
8,149 Sb —51
(5s2) 5p
3
8,639
Ρ -15
(3s2) 3p
3
10,484
Те —52 (5s
2
) 5p
4
9,01
S -16
(3s2) 3p4
10,357
Hg—80 (6s
2
)
10,43
Zn-30
(4s2)
5,391
Pb —82 (6s
2
) 6p
2
7,415
Интересно рассмотреть соединения типа, A
11
B
VI
, которые имеют
соответственно два и шесть валентных электронов, состояния кото-
рых можно записать в таком виде: (ns
2
)
1
S
0
для элементов II группы
и (ti's
2
) п'р*
3
Р
2
для элементов IV группы.
" Потенциалы ионизации этих элементов очень близки ДРУ
Г
к другу, поэтому s-уровни А
11
и р-уровни B
VI
свободных атомов
лежат примерно на одинаковой глубине. Если предположить, что
валентная зона образована из уровней р-электронов, поскольку
р-уровни должны опускаться ниже, так как волновая функция Д
лЯ
них локализована в большей области, чем для s-электронов,
г
°
валентная зона должна быть трехкратно вырожденной, в ней должно
быть 6 состояний на два атома, которые заняты 6 электронам**
атомов А
11
и B
VI
. Зона проводимости должна возникать из s-yp°
B
*
ней элемента А
11
и должна быть тем самым простой.
136
Τ я б
л и ц
а б
Величины запрещенных
зон (в эВ)
Тип
соединений
Вещество
Ширина
запрещенной
зоны
Тип
соединений
Вещество
Ширина
запрещенной
зоны
Простые
ве-
щества
Si
Ge
Se
Те
ct-Sn
1,10
0,68
2,1
0,34
0,08
СаТе
MgSe
MgTe
ZnO
ZnS
ZnSe
4,3
5.6
4.7
3,2
3,7
2,6
KSb
K
3
Sb
CsSb
Cs
3
Bi
0,9
Ы
0,8
0,5
ZnTe
SrO
SrS
SrSe
2,1
5,8
4,8
4,6
4,0
2,4
1,7.
I—VI
Cu
2
0
Ag
2
S
2,0
0,9
SrTe
CdS
CdSe
2,1
5,8
4,8
4,6
4,0
2,4
1,7.
I—VII
CuBr
Agl
2,9
2,8
CdTe
BaO
BaS
BaSe
BaTe
HgS -
«красная»
HgSe
HgTe
*
1,5·
4,2
4,0
3,7
3,4
2,0
0
0
II—IV
Mg
2
Si
Mg
2
Ge
Mn
2
Sn
,
Ca
a
Si
Ca
5
Sn
Ca
2
Pb
0,7
0,6
0,3
1,9
0,9
0,46
CdTe
BaO
BaS
BaSe
BaTe
HgS -
«красная»
HgSe
HgTe
*
1,5·
4,2
4,0
3,7
3,4
2,0
0
0
II—V
Zn
3
P
2
CdSb
1,15
0,50
IV—VI
Ti0
2
Sn0
2
SnS
PbO
PbS
PbSe
PbTe
3,0
4,3
1,3
2,3
0,40 -
0,25
0,31
III—V
AlAs
AlSb
GaN
GaP
GaAs
GaSb
2.4
1.5
3,4 ,
2.24
1,4
0,67
1.25
0,33
0,18
Ti0
2
Sn0
2
SnS
PbO
PbS
PbSe
PbTe
3,0
4,3
1,3
2,3
0,40 -
0,25
0,31
InP
InAs
InSb
2.4
1.5
3,4 ,
2.24
1,4
0,67
1.25
0,33
0,18
V-VI
As
2
Se
3
Sb
2
0
3
Sb
2
S
3
1,7
4,2
1,7
III—VI
A1A
AI2S3
Al
2
Se
3
Al
2
Te
3
GaSe
Ga
2
Se
3
GaTe
>5
4,1
3,1
2,5
2,0
1,9
1,5
Sb
2
Se.
3
Sb
2
Te
3
Bi
2
0
3
Bi
2
Te
3
1,2
0,3
3,2
0,15
A1A
AI2S3
Al
2
Se
3
Al
2
Te
3
GaSe
Ga
2
Se
3
GaTe
>5
4,1
3,1
2,5
2,0
1,9
1,5
VI-VI
Te0
2
1,5
'
ΤΛ
- —
InSe
In
2
Se
3
In
2
Te
3
1,2
1,2
1,0
Другие
соединения
ZiiGeP
a
ZnSnP
2
CdGeP
2
2,2
2,1
1,8
•V-IV
SiC
2,3 (куб)
2,9
(гекс)
CdSnP
2
ZnIn
2
Se
7-nTn
To
1.5
2.6
1
A
"-VI
CaS
CaSe
5,4
5,0
Ζ/Πΐπ
2
1
e
4
CdIn
2
Te
4
HgIn
2
Se
4
0,9
0,6
137

Аналогичным образом можно проводить анализ характера запол-
нения зон в других соединениях. Для этого необходимо учитывать
структуру электронных оболочек атомов, образующих данное сое-
динение. Однако такой анализ дает возможность лишь'качественного
суждени я об общих закономерностях, например, изменения ширины
запрещенной зоны при изменении состава.
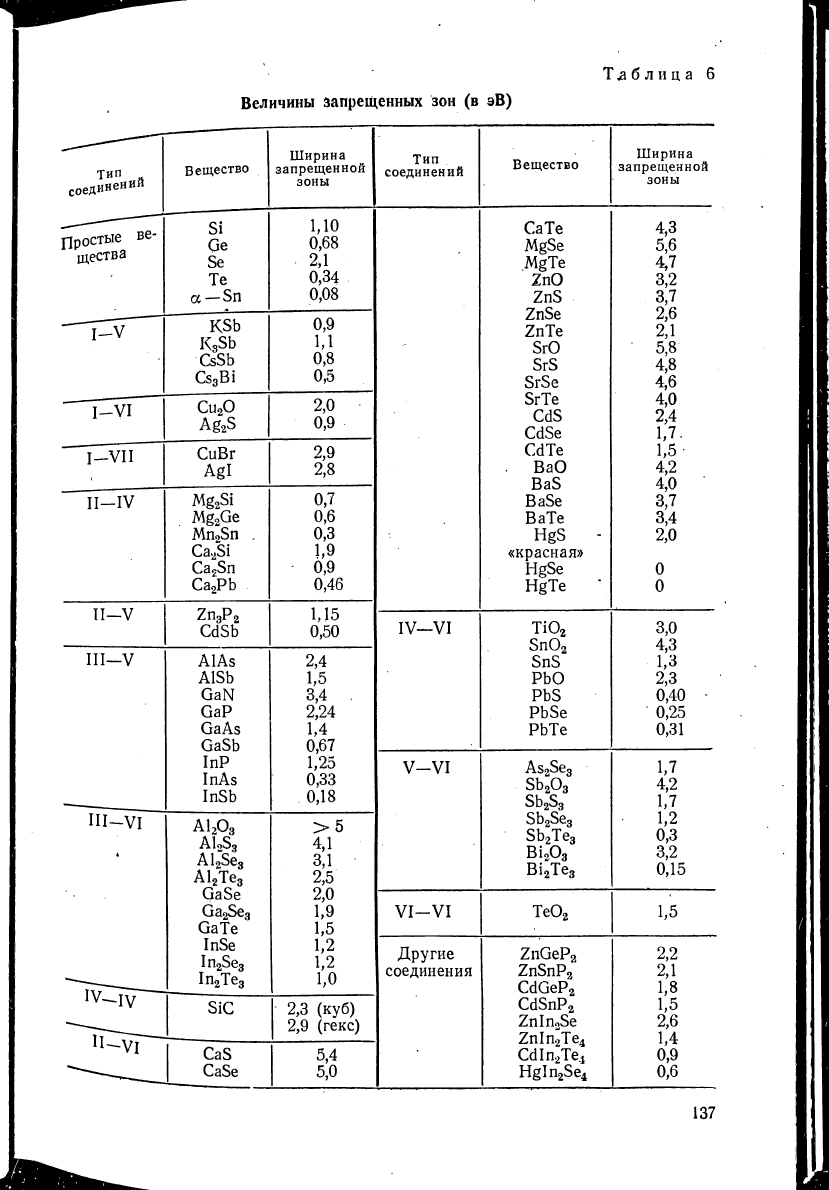
Для объяснения большинства физических свойств полупроводни-
ков необходимо знать ширину запрещенной зоны АЕ
0
, которая
.отделяет валентную зону от зоны проводимости. В табл. 6 приведены
экспериментальные данные о величине запрещенной зоны некоторых
полупроводников.
Резюме § 24
1. Число состояний в зоне равно числу исходных состояний
в атомах, из которых образован кристалл.
2. В каждой простой зоне может быть не более 2N электронов,
если Ν
—
число атомов в кристалле.
3. К металлам относятся вещества, имеющие незаполненные зоны
энергии. Наличие свободных состояний может быть обусловлено
или тем, что число возможных состояний больше числа электронов,
или тем, что перекрываются заполненные и свободные зоны.
4. К непроводникам относятся вещества, у которых имеется
некоторое число целиком заполненных и целиком свободных зон.
Самую верхнюю из заполненных зон называют валентной зоной,
самую нижнюю из свободных зон называют зоной проводимости.
Основную роль для протекания большинства физических процессов
играет запрещенная зона, отделяющая валентную зону от зоны
проводимости. К полупроводникам относятся вещества, для которых
запрещенная зона имеет величину порядка 2—3 эВ. Вещества
с большей шириной запрещенной зоны относятся к диэлектрикам.
§ 25. ОСНОВНЫЕ ХАРАКТЕРИСТИКИ ДЫРКИ
Рассматривая модельные представления о проводимости, мы
ввели понятие дырочной проводимости как дефектной проводимости,
обусловленной отсутствием некоторых электронов в связях. С точки
зрения зонной теории дырочная проводимость обусловлена электро-
нами почти заполненной зоны, т. е. электронами валентной зоны,
в которой имеется некоторое число свободных состояний. Если обо-
значить концентрацию свободных состояний через р, то ρ можно
считать концентрацией дырок. Другими словами, с точки зрения
статистики дырку можно определить как свободное, незанятое
электроном состояние Ε (к). Однако динамические характеристики
дырки этими простейшими понятиями не определяются. Их можно
ввести, воспользовавшись понятием зон Бриллюэна.
138

Рассмотрим
вначале
зону
Бриллюэна,
в которой занято неболь-
шое число η состояний в окрестности Ρ = 0. Предположим для про-
стоты, что занятые состояния отделены от свободных [резкой грани-
цей (рис. 36, а). Под действием внешнего поля Ε'все состояния
сместятся на некоторую величину ΔΡ:
ΔΡ ег Ет, (25.1)
где τ —среднее время свободного пробега электронов. Так как
величина ΔΡ не зависит от начального состояния Р/(0), то каждое
занятое состояние смещается в зоне Бриллюэна на одну и ту же
величину, что равносильно смещению занятых состояний как одного
целого (рис. 36, б):
Pi(t) = Pi(0)+e-Ex (*>τ). (25.2)
Суммарный квазиимпульс Ρ ς
всех электронов равен
1=1 4=1
=
пе~
Ετ = пР,
сру
(25.3)
так как
£Р/(0) = 0 (25.4)
Рис. 36. Смещение электронов в почти
свободной зоне Бриллюэна под дей-
ствием электрического поля
ί =
ι
в силу симметрии области занятых состояний, так что каждому
состоянию Р,- (0) соответствует состояние —Р/(0). Состоянию Р/ соот-
ветствует скорость электрона
ν,· (Р/) = dE/dPi = P//m*
h =
e~Vi
= e~-Pi/m*.
и элементарный ток
Полный ток
η η
J=
Σ
=
2 = ^™ττΕ=<Γημ
Λ
Ε,
t =
l
μ
Λ
= £"τ/ηι*
t =
l
где
(25.5)
(25.6)
(25.7)
(25.8)
есть подвижность электронов.
Если рассматривать зону Бриллюэна, соответствующую единич-
ному кристаллу, то η
—
концентрация электронов, a J
—
плотность
тока, поэтому β~ημ
η
=^σ есть удельная электрическая проводимость.
Рассмотрим теперь ток, создаваемый почти заполненной зоной,
в которой имеется Ν' занятых и ρ свободных состояний в окрест-
ности к
==
0 (Е (0) = Ε max) (рис. 37, а). Под действием внешнего поля Ε
все состояния сместятся на одну и ту же величину ΔΡ = е~Ет и
Pi (0 = Pi (0) + е- Ετ.
J 39

Однако суммарный квазиимпульс не будет равен N'er Ετ, как
это могло бы показаться при определении Р
2
как суммы
Это связано с тем, что в результате смещения каждого занятого
состояния на величину е~Ег вся совокупность Ν' состояний сме-
щается на ег Ετ. Вместе с занятыми состояниями на величину
смещаются и свободные состояния.
В результате перемещения занятых состояний как целого часть
состояний из первой зоны переходит во вторую зону, а в первой
зоне появляется ряд дополнительных свободных состояний (рис. 37, б).
Однако все состояния второй зоны необходимо перевести в первую
зону добавлением к Р
г
подходящего вектора 2лйЬ, вследствие чего
занятые состояния будут определяться так, как это указано на
рис. 37, в. Но в таком случае Ρς не будет равно N'e~Ex. Чтобы
Я
DP
ш
Ш/А
Шт
ж
Κχ
Q 6} 6)
Рис. 37. Смещение электронов в почти заполненной зоне
Бриллюэна под-действием электрического поля
найти Р
2
, необходимо учесть свойство зон Бриллюэна для запол-
ненной зоны:
2 Р, = 0, (25.9)
i =
l
поэтому
Ν'
Ρ
Σ
t =
l
Ρς=Σ
ρ
.·=
-Σ -ре-Ετ.
ί=1
(25.10)
Таким образом, благодаря периодичности состояний в простран^
стве квазиимпульса суммарный квазиимпульс Р^ совокупности N
электронов смещается не вдоль силы е~Е, а против силы, т. е»
в направлении — (е-Е)=е
+
Е. Средний квазиимпульс
»ср
-
N
i
'"Ж '
Средняя скорость
(25.11)
v
cp
= P
cp
/m*. (25.12)
Но так как p<^N' F&N , то Р
ср
находится вблизи к = 0и поэтому
т*<0. Ток, создаваемый Ν' связанными электронами, равен
(25.13)
140
