Фёршт Э. Структура и механизм действия ферментов
Подождите немного. Документ загружается.

ТЕОРИИ
ФЕРМЕНТАТИВНОГО
КАТАЛИЗА
301
Еще более поразительный эффект наблюдается при связыва-
нии
лактона(Ш) с р-1М-ацетил-Е)-глюкозаминидазой. Константа
диссоциации комплекса равна
5-10~
7
М, что в
4000
раз меньше
Км для пиранозидного субстрата (2-10~
3
М) [9].
б. Пролинрацемаза
При
рацемизации пролина(У1) хиральный атом углерода
должен на некоторой стадии стать тригональным. В соответ-
ствии с этим соединения VII и VIII связываются в 160 раз
прочнее пролина [10, 11].
ОС
А
VI VII
VIII
в.
Цитидиндезаминаза
Константа диссоциации тетрагидроуридина (IX) примерно в
10 000 раз меньше констант связывания продуктов реакции —
уридина(Х) и аммиака. Вероятно, тетрагидроуридин напоми-
нает промежуточное тетраэдрическое соединение XI [12].
X
|
НО
NH,
N
oN
R R
IX X
г.
Анализ
результатов
связывания
аналогов
переходного
состояния субстрата
Аналоги переходного состояния субстрата, которые были
синтезированы до настоящего времени, позволили проанализи-
ровать ту часть каталитического процесса, которая связана с
различием в комплементарности фермента переходному состоя-
нию субстрата и исходному
субстрату.
В приведенных выше
четырех примерах аналоги переходного состояния связываются
в
10
2
—10"
раз прочнее самих субстратов. Это свидетельствует об
эволюции ферментов в сторону структурной комплементарности

302
ГЛАВА
10
переходному состоянию субстрата, а также показывает, что
величина
k
ca
t может возрастать в
10
2
—10
4
раз за счет увеличе-
ния
/См. Принимая во внимание, что эти синтетические аналоги
могли быть весьма далеки по структуре от переходного состоя-
ния,
которое они моделировали, энергетический выигрыш от
увеличения комплементарности между переходным состоянием
субстрата и ферментом можно оценить по крайней мере в
20 кДж-моль-
1
(5 ккал-моль-
1
). В гл. 12
будет
показано, что в
центре связывания карбонильного кислорода субстрата серино-
вой
протеазы недостает одной водородной связи. Эта связь
образуется во время реакции при образовании переходного со-
стояния,
и подобное увеличение комплементарности дает
выиг-
рыш в энергии 20—25 кДж-моль-
1
(5—6 ккал-моль"
1
).
д.
Возможные
ошибки
при
интерпретации
данных,
полученных
при
использовании
аналогов
переходного
состояния субстрата
Изучение комплементарности фермента переходному состоя-
нию
субстрата с использованием аналогов переходного состоя-
ния
субстрата может быть осложнено наличием «лишних» свя-
зей
с группами, введенными в молекулу аналога. В гл. 9 было
показано,
что связывание небольшой группы дает существенный
вклад в энергию связывания, когда в процесс вовлекается спе-
цифический
для этой группы центр связывания. Например,
вклад метиленовой группы в энергию связывания может состав-
лять 12 кДж-моль-
1
(3 ккал-моль-
1
), а вклад гидроксильной
группы за счет образования водородной связи — 25 кДж-моль"
1
(6 ккал-моль-
1
). Даже если специфические центры связывания
не
затрагиваются, большой энергетический вклад
могут
дать
гидрофобные эффекты: замена в фенильном кольце ацетильной
группы на атом С1 приводит к 50-кратному увеличению прочно-
сти связывания этого кольца в гидрофобном кармане химотрип-
сина
[13].
Затруднения при интерпретации данных (обусловленные хе-
латным эффектом) возникают и в тех случаях, когда использу-
ются аналоги переходных состояний для мультисубстратных ре-
акций.
Как отмечалось в предыдущей главе, полидентатные
лиганды (например, ЭДТА) в отличие от монодентатных прочно
связывают ионы металлов. Это различие в свойствах обусловле-
но
энтропийным фактором; связывание шести монодентатных
лигандов приводит к потере шести наборов поступательных и
вращательных степеней свободы. То же самое относится и к
связыванию ферментом «мультисубстратных» или «мультипро-
дуктных»
аналогов. Если А и В присоединяются к ферменту
независимо
и рядом
друг
с другом и процесс характеризуется
энергией
связывания Гиббса х и у килоджоулей соответственно,
ТЕОРИИ
ФЕРМЕНТАТИВНОГО
КАТАЛИЗА
303
а комплекс А — В связывается с ферментом аналогичным обра-
зом,
то свободная энергия связывания
будет
равна
AG
3S
s = x + y + S,
(10.11)
где S — отрицательная величина, поскольку связывание А — В
сопровождается потерей только одного набора степеней свободы
в отличие от связывания А и В, когда теряется два набора. Даже
если не принимать во внимание эффекты подобного рода, свя-
зывание мультисубстратного аналога должно быть очень проч-
ным
за счет комплементарности фермнета переходному состоя-
нию субстрата. Например, соединение XII связывается аспартат-
карбамоилтрансферазой очень прочно:
K<uss
=
2,7-10~
8
М.
Однако это значение равно просто произведению констант дис-
социации
комплексов фермента с сукцинатом и карбамоилфос-
фатом (9- Ю-
4
X
2,7-10-
5
М.-
2
), которые близки по
структуре
к
составным частям соединения XII, имитирующего переходное
состояние реакции [14].
СН
2
-СН
^NH^
^CH.POf
Аспартат
Б.
Эволюция фермента в сторону увеличения
максимальной скорости реакции:
сильное связывание переходного состояния
субстрата — слабое связывание самого субстрата
В предыдущем разделе было показано, что ферменты эво-
люционировали в сторону более сильного связывания переход-
ных состояний субстратов, а не самих субстратов. Ниже
будет

304
ГЛАВА
10
показано,
что слабое
связывание
субстратов
является каталити*
чески выгодным.
Хотя
комплементарность фермента переходному состоянию
субстрата
максимизирует
k
C
at/K.M.,
это не
означает,
что
макси-
мальной является
и
суммарная скорость реакции. Дело
в том,
что максимальная скорость реакции
при
данной концентрации
субстрата
зависит
от
величин
&
C
at
и Км как
таковых,
а не от их
Таблица
10.3
Характер изменения параметров /С
м
и k
cat
в
результате эволюции фермента,
протекающей при постоянстве значений
*
cat
/K
M
И [S]a>
ю-
в
ю-
ю-
10-
10-
ю-
1
1
=
Ю
6
м-
1
с"',
fc
cat
,
с-1
1
10
ю
2
10
3
ю
4
ю
5
10
е
[S]
=
10"
3
M)
Скорость
б)>
с-1
1
9
90
500
909
990
999
а
> Умозрительные процессы:
а)
фермент эволюци-
онирует
в
сторону обеспечения комплементарности
пе-
реходному состоянию
субстрата
и
максимально высо-
кого значения отношения *cat/^M;
")
П
РИ сохранении
максимально высокого значения *
C
at/^M Фермент эво-
люционирует
в
сторону увеличения Кд\. Значения
ве-
личин fe
C
at/^M
и
IS]
выбраны произвольно.
б) Число молей продукта, образующихся
на
моль
фермента
в 1 с.
отношения.
В
табл.
10.3
приведены значения скорости, рассчи-
танные
для
различных значений
&
ca
t
и /См при
постоянном
отношении
kcax/KtA.
Из
этой таблицы видно,
что
максимальные
скорости достигаются
при
/См
>
[S],
т.е. при
высоких значениях
Км.
Таким образом, ферменты должны эволюционировать
в
сторону слабого связывания субстратов.
I.
Принцип
максимизации
Км. при
постоянном
k
cat
/Км
И
Этот принцип опровергает широко распространенное мнение,
что необходимым условием протекания ферментативной реакции
является наличие сильного связывания фермента
с
субстратом
ТЕОРИИ
ФЕРМЕНТАТИВНОГО
КАТАЛИЗА
305
или низкое значение Км- Рассмотрим еще два довода в пользу
важности для катализа высоких значений Км- Физические при-
чины этого фактора иллюстрируются графически.
а. Графическая
иллюстрация
важности
для катализа
высоких
значений
Км
Предположим, что концентрация субстрата больше Км для
данной реакции (рис. 10.3, А). Фермент-субстратный комплекс
Рис.
10.3. Два случая эволюции фермента. Переходные состояния субстрата
связываются с ферментом одинаково хорошо, но в случае А сам субстрат
связывается прочно, тогда как в случае Б в результате эволюции фермента —
слабо (концентрация субстрата в обоих случаях одинакова). А. Энергия
активации
равна ДО^ + ДО; имеет место процесс ES -> ES*. 5. Энергия ак-
тивации равна ДО^; имеет место процесс Е + S
-»•
ES*. (Изменения энергии
Гиббса относятся к реальным концентрациям субстрата, а не к стандартным
условиям, когда исходные концентрации равны 1 М.)
находится в более низком энергетическом состоянии, чем сво-
бодный фермент и
субстрат,
а энергия активации равна
AGf + AG.
ЕСЛИ
же /См > [S] (рис. 10.3,5), то энергия комплек-
са ES
будет
выше энергии Е -f- S, а энергия активации меньше
AG?.
Если Км низка, это означает, что фермент-субстратный комп-
лекс находится в термодинамической яме и в
ходе
реакции
необходимо преодолеть энергетический барьер. При высокой Км
комплекс поднят на «ступеньку термодинамической лестницы».
б.
Алгебраическая
иллюстрация
В гл. 3 было показано, что уравнение Михаэлиса — Ментен
можно представить в удобной форме, позволяющей связать

306
ГЛАВА
10
скорость реакции с концентрацией свободного фермента [Е]:
a =
[E][S]fe
cat
/tf
M
.
(10.12)
Исходя из уравнения (10.12), процесс эволюции ферментов,
направленный
на увеличение скорости катализируемых ими ре-
акций,
можно умозрительно разделить на два этапа:
1. Максимизация fe
ca
t//(M за счет повышения комплементар-
ности
фермента переходному состоянию субстрата.
2. Максимизация [Е] за счет повышения Дм, направленная на
то,
чтобы в свободном состоянии находилось максимально
возможное количество фермента.
Для эволюции ферментов характерно увеличение /С
м
с после-
дующим увеличением fecat. Скорость изменения этих параметров
быстро уменьшается по мере увеличения /См До значений, боль-
ших [S]. При
/CM
=
[S]
половина фермента находится в свобод-
ном
состоянии, поэтому, согласно уравнению (10.11), скорость
равна половине максимальной. При
/CM
=
5[S]
В свободном
состоянии
находится 5/6 молекул фермента, поэтому скорость
реакции
составляет 83% максимальной. Любое дальнейшее уве-
личение /См
даст
лишь незначительное увеличение скорости.
Насколько
сильно возрастет /См— зависит от структурного
различия
между
субстратом и его переходным состоянием.
В пределе любое увеличение Дм должно компенсироваться ос-
лаблением связывания переходного состояния. Наиболее сложен
этот процесс в
случае
крупных метаболитов, присутствующих в
высокой
концентрации.
в.
Исключения
из
принципа
максимизации
Км —
контроль
активности
ферментов,
участвующих
в
регуляции
скорости
метаболических
процессов
Все приведенные выше доводы в пользу увеличения /См мол-
чаливо подразумевали, что при этом максимизируется скорость
реакции.
Хотя для большинства ферментов это действительно
так, иногда на первый план выступают
регуляторные
функции
фермента, а не обеспечение высокой скорости реакции. Все ме-
таболические процессы регулируются. Регуляция обычно осуще-
ствляется с помощью контроля активности ряда ключевых фер*
ментов.
Активность этих ферментов, как правило, регулируется
путем изменения /См соответствующих субстратов через алло-
стерическое воздействие на них. Эти /См для ключевых фермен-
тов относятся к регуляции, и к ним не всегда применимы поло-
жения,
рассмотренные в предыдущем разделе.
Иногда
для первого фермента метаболического пути может
оказаться выгодным низкое значение /См- Это обеспечивает

ТЕОРИИ
ФЕРМЕНТАТИВНОГО КАТАЛИЗА 307
контроль скорости поступления
субстрата
в метаболический
путь, предотвращает его перегрузку и накопление ракционно-
способных промежуточных соединений. Например, в
случае
гек-
сокиназы,
первого фермента гликолиза, /См для глюкозы равно
0,1 мМ,
тогда
как концентрация этого соединения в эритроцитах
человека составляет ~5 мМ. Десятикратное увеличение или
уменьшение концентрации глюкозы почти не изменяет скорость
гликолиза.
2. Экспериментально определяемые значения К,
м
В гл. 9 было показано, что энергия связывания
субстрата
с
ферментом потенциально является очень большой величиной,
однако экспериментально определяемые значения /См обычно
сравнительно высоки. Разительным примером в этом отношении
является связывание
NAD+.
Этот большой по размерам
субстрат
содержит два остатка рибозы, остатки аденина и никотинамй-
да и пирофосфат. Если бы реализовалась вся потенциальная
энергия
связывания указанных групп, то константа диссоциации
могла бы быть величиной порядка 10~
20
М. И действительно,
константа диссоциации для связывания первой молекулы NAD+
тетрамерной глицеральдегид-3-фосфат—дегидрогеназой оказа-
лась меньше Ю-
11
М, что
свидетельствует
о чрезвычайно высо-
кой
прочности связывания [15]. Однако обычно /См и константы
диссоциации комплексов NAD+ с дегидрогеназами оказываются
равными 0,1—1 мМ. Еще более впечатляющим является тот
факт, что константа диссоциации комплекса АТР и миозина
равна Ю-
13
М [16], в то время как обычно /См для АТР равна
0,1—10
мМ.
Во многих
случаях
сопоставить /См с физиологическими кон-
центрациями
субстратов
не представляется возможным, по-
скольку эти концентрации неизвестны. Одним из ферментов, для
которых такое сопоставление возможно, является карбоангид-
раза, так как концентрация в крови двуокиси
углерода
и бикар-
боната измеряется довольно просто. В физиологических услови-
ях этот фермент насыщается каждым из указанных
субстратов
приблизительно только на 6 % и /См для двуокиси
углерода
слишком высока, чтобы ее можно было измерить [17].
а.
Концентрации
субстратов
и
значения
Км. для
гликолиза
Процесс гликолиза изучен достаточно хорошо. Исследованы
свойства гликолитических ферментов, определены концентрации
метаболитов для клеток
трех
различных типов (мозга, эритро-
цитов и мышц). Данные для нерегуляторных гликолнтических
308
ГЛАВА
10
Таблица 10.4
Концентрации
ряда
метаболитов
и
зчачения
АГ
М
для
некоторых
гликолитических ферментов
а)
Фермент
Источник
Субстрат
Концентра-
ция
суб-
страта,
мкМ
130
450
ПО
200
32
3
50
18
3
50
3
3
600
2000
<
1
1500
118
60
600
40
60
4,5
7
23
138
116
51
2900
0,01
п)
33
170
220
50
Км-
мкМ
210
700
120
12
100
1000
2000
350
460
870
44
70
46
9
70
1100
1200
350
240
5000
33
70
200
600
140
59
8400
10
р)
150
37
190
190
V
s1
Глюкозофосфат-
изомераза
Альдолаза
Триозофосфатизо-
мераза
Глицеральдегид-
фосфатде-
гидрогеназа
Фосфоглицерат-
киназа
Фосфоглицерому-
таза
Енолаза
Пируваткиназа
м
Лактатдегидро-
геназа
Глицерофосфатде-
гндрогеназа
Мозг
Мышца
б>
Мозг
Мышца
в
'
Эритроциты
г)
Мышца
А)
Мозг
Мышца
е
'
Мозг
Эритроциты
а)
Мышца
и
*
Мозг
Мышца
к
'
Мозг
Мышца
л
'
Эритроциты
в
*
Мозг
Эритроциты
о)
Мышь
Мышца
G6P
G6P
F6P
FDP
FDP
G3P
DHAP
G3P
G3P
DHAP
G3P
G3P
NAD
Pi
1.3DPG
ADP
3PG
3PG
ADP
3PG
3PG
2PG
2PG
PEP
ADP
Pyr
Pyr
Lac
NADH
NAD
GlyP
GlyP
T>
DHAP
1,6
1,6
1,1
0,06
3,1
333
40
19
153
17
15
23
0,08
>10
ж)
>9
0,05
9,3
200
0,6
6
83
7
10
9
4,4
1,2
1,2
2,9
100
4,6
0,22
0,9
3,8

ТЕОРИИ
ФЕРМЕНТАТИВНОГО
КАТАЛИЗА
309
Продолжение
а
) Сокращения;
G6P
— глюкозо-6-фосфат; F6P — фруктозо-6-фосфат;
FDP
— фруктозо-
1,6-дифосфат;
G3P
— глицеральдегид-3-фосфат; DHAP—диоксиацетонфосфат; Р| — орто-
фосфат;
1.3DPG— 1,3-дифосфоглицерат; 3PG—3-фосфоглицерат; 2PG—2-фосфоглицерат;
PEP
— фосфоенолпируват; Руг — пируват; Lac—лактат; (все D-caxapa); GlyP — L-глицеро-
фосфат.
Данные о концентрации ферментов и метаболитов в мозге мыши взяты из работы
Lowry
О. Н., Passonneau J. V. J. biol. Chem., 239, 31 (1964); данные о концентрации мета-
болитов в эритроцитах человека взяты из работы Minakaml S., Saito Т., Suzuki С,
Yoshlkawa
H. Blochem. blophys. Res. Commun., 17, 748 (1964); данные о концентрации
ферментов в эритроцитах человека взяты из работы, указанной ниже; данные о концен-
трации
метаболитов в диафрагме крысы взяты из работ Newsholme E. A., Randle
P.
J. Biochem. J., 80, 655 (1961); Hohorst H. J., Relm M., Bartels H. Biochem. biophys. Res.
Commun.,
7, 137 (1962); данные о концентрации ферментов из скелетной мышцы кролика
взяты из работы, указанной ниже. Концентрация метаболитов рассчитана исходя из того,
что содержание воды в клетках мозга равно 60%, а в эритроцитах—70%. Никаких попра-
вок
на компартментализацию клеток мышц и мозга не делалось, однако суммарные
концентрации
метаболитов обычно близки к концентрациям в цитозоле [Greenbaum A. L.,
Gumaa
К. A., McLean P. Archs Biochem. Biophys., 143, 617 (1971)]. Значения всех величин
для мозга мыши получены немедленно после декапитации животного. Использование
максимальных величин не приводило к существенным изменениям результатов.
б
> Zalltls J.,
Oliver
I. T. Biochem. J., 102, 753 (1967).
E
> Rutter W. J. Fed. Proc, 23, 1248 (1964); Spolter P. D., Adelman R. С Weinhouse S. J.
biol.
Chem., 240, 1327 (1965).
r
> Schneider A. S., Valentine W. N., Hattori M., Helns H. L. New Engl. J. Med., 272,
229 (1965).
A*
Burton P. M.,
Waley
S. G. Biochem. biophys. Acta, 151, 714 (1968).
e
> Oguchl M.,
Gerth
E., Fitzgerald В., Park J. H. J. biol. Chem., 248, 5571 (1973).
ж
) Значение К порядка 6 мМ для Р относится к высоким концентрациям GAP при
накоплении
ацилфермента. При низких концентрациях GAP К неизмеримо высока [Наг-
rigan Р. }., Trentham D. R. Biochem. J., 143, 353 (1974)].
Примечание:
в случае G3P и DHAP
наиболее вероятными субстратами соответствующих реакций являются
негидратирован-
ные формы указанных соединений. Хотя в таблице приведенные концентрации субстратов
представляют собой суммарные концентрации гидратированных и негидратированных
форм,
в отношении
К
„/IS] числитель и знаменатель завышены в одно и то же число
раз [Trentham D. R., McMurray С. Н., Pogson С. 1. Biochem. J., 114, 19 (1969); Roynolds S. J.,
Yates
D. W., Pogson С I. Biochem. J., 122, 285 (1971)].
*)
Yoshida
A,, Watanabe S. J. biol. Chem., 247, 440 (1972).
и)
Rao D. R., Oesper P. Biochem. J,, 81, 405 (1961).
K
>
Cowglll
R. W., Plzer L. I. J. biol. Chem., 223, 885 (1956); Grisolla S., Cleland W. W.
Biochemistry, 7, 1115 (1968).
л
>
Wold
F.. Barker R. Biochim. biophys. Acta, 88, 475 (1964).
м
' Вопрос о том, является ли этот фермент регуляторным, остается пока открытым;
концентрация
PEP в любом случае значительно ниже К„. Приведенные данные относятся
к
случаю, когда [FDP]=500 мкМ и выполняется механизм Михаэлиса—Ментен. В отсут-
ствие FDP кинетическая кривая имеет S-образную форму и К
0;5
=650 мкМ.
н
) Staal S. E. J., Koster J. F., Kamp H., vanMllllgan — BoersmaL.,
Veeger
С Biochim.
biophys. Acta. 227, 86 (1971).
°) Nisselbaum J. S., Bodansky O. J. biol. Chem., 238, 969 (1963).
п)
Рассчитана из отношения [Лактат]/[Пируват] в предположении, что концентрации
NAD
и NADH равновесные. Константа равновесия равна
1,И-10~
4
;
Veech
R. L.,
Eggles-
ton
L. V., Krebs H. A. Biochem. J., 115, 609 (1969).
P)
Rapoport S.
Essay
in Biochemistry, 4, 69 (1969).
c
> Fondy T. P., Levin L., Sollohub S. J., Ross С R. J. biol. Chem., 243, 3148 (1968).
T
> Denton R. M.,
Yorke
R. E., Randle P. J. Biochem. J., 100, 407, (1966).
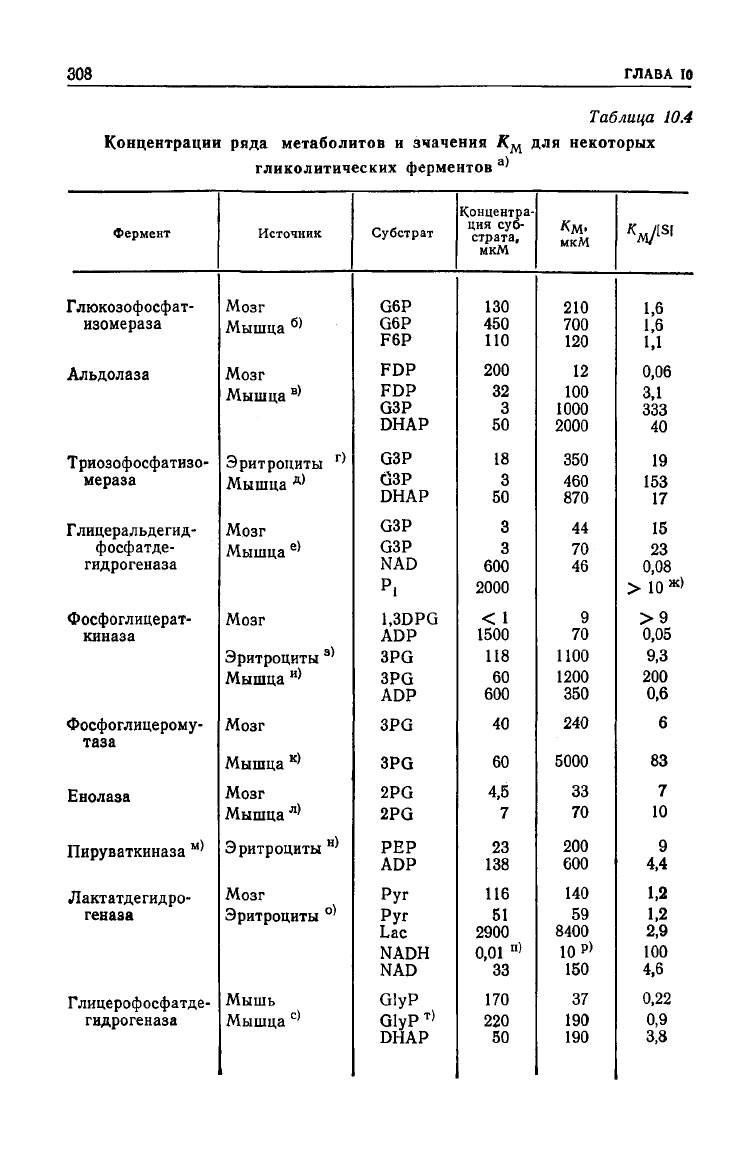
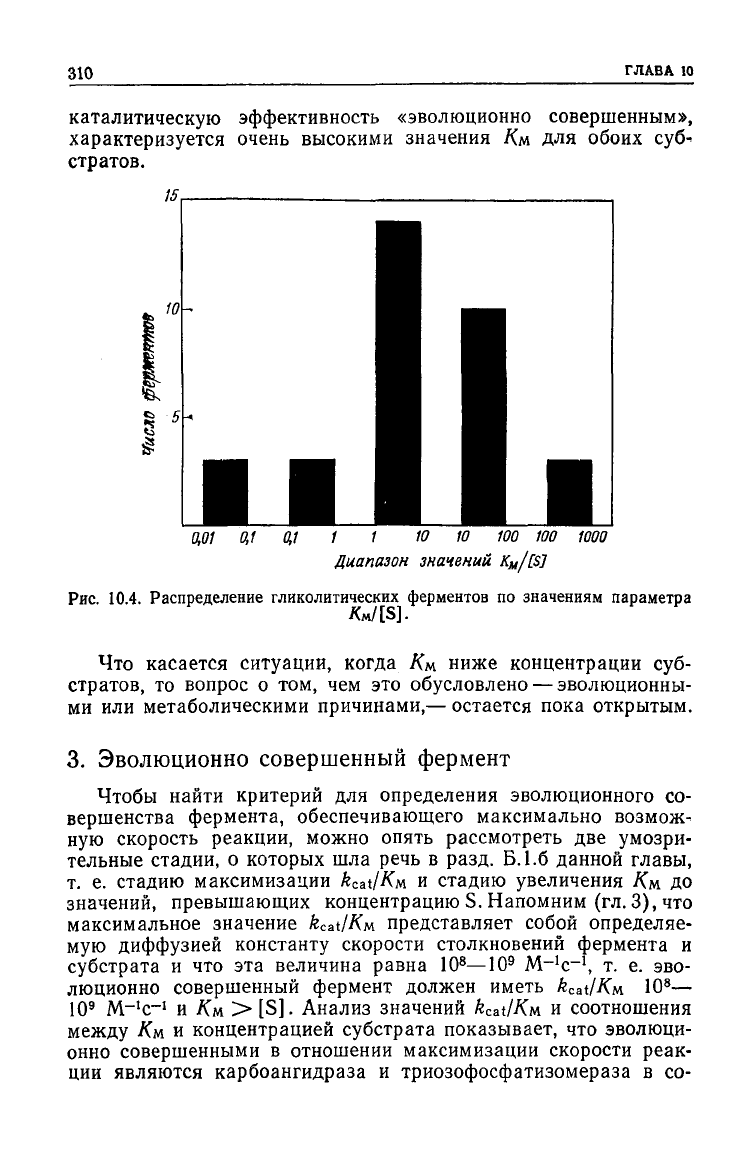
ферментов приведены в табл. 10.4 и на рис. 10.4. Из представ-
ленной
гистограммы видно, что Дм чаще всего превышает кон-
центрацию субстрата в 1—10 и в
10—100
раз. Особого внимания
среди указанных ферментов заслуживает триозофосфатизоме-
раза. Этот хорошо изученный фермент, названный за
свою
310
ГЛАВА
10
каталитическую эффективность «эволюционно совершенным»,
характеризуется очень высокими значения /См для обоих
суб*
стратов.
15
г
10
0,01 0,1 0,1 1 1 10 10 100 100 1000
Диапазон
значений
K
M
/[S]
Рис.
10.4. Распределение гликолитических ферментов по значениям параметра
Kn/[S].
Что касается ситуации, когда Км ниже концентрации суб-
стратов, то вопрос о том, чем это обусловлено — эволюционны-
ми
или метаболическими причинами,— остается пока открытым.
3. Эволюционно совершенный фермент
Чтобы найти критерий для определения эволюционного со-
вершенства фермента, обеспечивающего максимально возмож-
ную скорость реакции, можно опять рассмотреть две умозри-
тельные стадии, о которых шла речь в разд. Б. 1.6 данной главы,
т. е. стадию максимизации &
C
at//CM и стадию увеличения Км. до
значений,
превышающих концентрацию S. Напомним (гл. 3), что
максимальное значение fccat/Дм представляет собой определяе-
мую диффузией константу скорости столкновений фермента и
субстрата
и что эта величина равна
10
8
—10
9
М-'с"
1
, т. е. эво-
люционно совершенный фермент должен иметь &
ca
t//CM Ю
8
—
10
9
Мг'с-
1
и /См >[S]. Анализ значений
kcat/Кк
и соотношения
между
/См и концентрацией
субстрата
показывает, что эволюци-
онно
совершенными в отношении максимизации скорости реак-
ции
являются карбоангидраза и триозофосфатизомераза в со-
