Фёршт Э. Структура и механизм действия ферментов
Подождите немного. Документ загружается.


ЭНЕРГИЯ
ФЕРМЕНТ-СУБСТРАТНОГО ВЗАИМОДЕЙСТВИЯ 291
«правильных» комплексов, мы можем твердо сказать, что при-
сутствие
неспаренных
водородных связей и ионов в «неправиль-
ных»
комплексах значительно уменьшает энергию их диссоциа-
ции.
Эксперименты с аминоацил-тРНК—синтетазами показали,
что утрата образующей водородную связь гидроксильной
группы в случае фенилаланина приводит к тому, что прочность
его связывания с тирозил-тРНК—синтетазой становится по
крайней
мере на 25 кДж-моль-
1
(6 ккал-моль-
1
) ниже, чем для
тирозина. Аналогичным образом разрыв солевого мостика меж-
ду а-аммонийным ионом субстрата и ферментом уменьшает
прочность связывания приблизительно на 17 кДж-моль-
1
(4 ккал-моль-
1
). Эти результаты можно экстраполировать на
случай взаимодействия соприкасающихся поверхностей белков.
Например,
замещение аргинина в соевом ингибиторе трипсина
фенилаланином,
который, попадая в специфический карман
трипсина, образует ионную связь с погруженным в белковую
глобулу
аспартатом, уменьшает энергию связывания на
13 кДж-моль-
1
(3,1 ккал-моль-
1
) [31]. Далее установлено, что
панкреатический ингибитор трипсина связывается с химотрип-
сином,
однако в этом случае энергия связывания на
25 кДж-моль-
1
(6 ккал-моль-
1
) меньше, чем при связывании с
трипсином [32, 33]. Это различие отражает главным образом тот
факт, что положительно заряженная боковая цепь лизина по-
гружается в гидрофобный карман химотрипсина.
СПИСОК
ЛИТЕРАТУРЫ
1.
Ewing
G. £., Acct. Chem. Res., 8, 185 (1975).
2. Warshel A., Levitt M.
t
J. Molec. Biol., 103, 227 (1976).
3.
Levitt M., Lifson S., личное сообщение.
4.
Hagler
А. Т., Lifson S., Huler E., In: Peptides, polypeptides, and proteins
(eds.
Blout E. R., Bovey F. A.,
Goodman
M., Lotan N.),
John
Wiley
&
Sons,
p. 35 (1974).
5.
Hagler
А. Т., Huler E., Lifson S., J. Am. chem. Soc, 96, 5319 (1974).
6.
Johansson
A., Kollman P.,
Rothenberg
S., McKelvey J., J. Am. chem. Soc,
96, 3794 (1974).
7. Kauzmann W., Adv.
Prot.
Chem.,
14, 1 (1959).
8.
Klapper
M. H., Progr. Bioorg.
Chem.,
2, 55 (1973).
9.
Fujita
Т., Iwasa J., Hansch C, J. Am. chem. Soc., 86, 5175 (1964).
10. Leo A., Hansch C, Elkins D.,
Chem.
Revs., 71, 525 (1971).
11.
Hermann R. В., J. phys.
Chem.,
76, 2754 (1972).
12. Harris M. J., Higuchi Т., Rytting J. H., J. phys.
Chem.,
77, 2694 (1973).
13.
Reynolds J. A.,
Gilbert
D. В., Tanford C,
Proc.
natn.
Acad. Sci., U. S. A.,
71,
2925 (1974).
14.
Chothia
C,
Nature,
Lond., 248, 338 (1974).
15.
Owens
S. L, Bell F. E., J. biol.
Chem.,
245, 5515 (1970).
16. Santi D. V., Репа V. A., J. med.
Chem.,
16, 273 (1973).
17. Mulivor R.,
Rappaport
H. P., J. molec. Biol., 76, 123 (1973).
18.
Knowles
1. R., J. theoret bioy., 9, 213 (1965).
19.
Доровская
В. И.,
Варфоломеев
С. Д., Казанская И. Ф.,
Клесов
Л, А.,
Мартинек К-, FEBS Letts., 23, 122 (1972),

292
ГЛАВА
9
20.
FastrezJ.,
Fersht
A. R., Biochemistry, 12, 1067 (1973).
21.
Fersht
A. R., J. molec. Biol., 64, 497 (1972).
22. Perutz M. F.,
Nature,
Lond., 228, 726 (1970).
23.
Page
M. I., Biochem. biophys. Res. Comm, 72, 456 (1976).
24. Jencks W. P., Adv. Enzymol., 43, 219 (1975).
25.
Eisinger
J.,
Feuer
В., Yamane Т.,
Nature
New Biology, Lond., 231, 126
(1971).
26.
Pongs
0., Bald R.,
Reinwald
E., Eur. J. Biochem., 32, 117 (1973).
27.
Eisinger
J.,
Gross
N., Biochemistry, 14, 4031 (1975).
28.
Jencks W. P., Catalysis in chemistry and enzymology, McGraw-Hill Book
Co.,
pp. 351, 399 (1969).
29.
Chothia
C, Janin J.,
Nature,
Lond., 256, 705 (1975).
30. Janin J.,
Chothia
C, J. molec. Biol., 100, 197 (1976).
31.
Laskowski M., Jr., личное сообщение.
32.
Quast
U.,
Engel
J., Heumann H.,
Krause
G., Steffen E., Biochemistry, 13,
2512 (1974).
33.
Vincent J.-P., Peron-Renner M., Pudles J., Lazdunski M., Biochemistry, 13,
4205 (1974).
ДОПОЛНИТЕЛЬНАЯ
ЛИТЕРАТУРА
Jencks W. P., Catalysis in chemistry and enzymology, McGraw-Hill Book Co
(1969), Chapters 6—9.
Jencks W. P., Binding energy, specificity, and enzymic catalysis — the Circe
effect, Adv. Enzymol., 43, 219—410 (1975),

10
Глава
КОМПЛЕМЕНТАРНОСТЬ
МЕЖДУ ФЕРМЕНТОМ
И
СУБСТРАТОМ И ТЕОРИИ
ФЕРМЕНТАТИВНОГО
КАТАЛИЗА
А.
Использование
энергии
связывания
фермента
с
субстратом
в катализе
Как
было показано в гл. 2, высокая каталитическая актив-
ность многих ферментов обусловливается в значительной мере
факторами
энтропийной природы, участием в катализе кислых и
основных групп фермента и электростатическими эффектами.
Важнейшей особенностью ферментов является также их специ-
фичность
в отношении субстратов и высокая энергия связыва-
ния.
В 1930 г. Холдейн высказал предположение, что эта энергия
используется для деформации субстрата до структуры продук-
тов [1], и теоретиками были рассмотрены различные способы
использования
энергии связывания для понижения энергии ак-
тивации
стадии химического превращения субстрата.
Особенно полезна при анализе возможных механизмов фер-
ментативного катализа теория переходного состояния. Мы при-
меним
этот
подход
к простому механизму Михаэлиса — Ментен
(для которого
KM.
= KS; СМ. ГЛ. 3), с тем чтобы увидеть, как
энергия
связывания автоматически уменьшает энергию актива-
ции
перехода, определяемого кажущейся константой скорости
второго порядка fecat/^м, и как часть этой энергии используется
для уменьшения энергии активации стадии химического превра>
щения
субстрата с константой скорости k
ca
t [2].
1. Энергия связывания понижает энергию активации
перехода с константой скорости
&
C
at/K
M
ft
cat
ES -^ Продукты,
(10.1)
ES*.
(Ю.2)
Напомним
(гл. 3), что константа скорости для взаимодей-
ствия свободного фермента со свободным субстратом с образо»
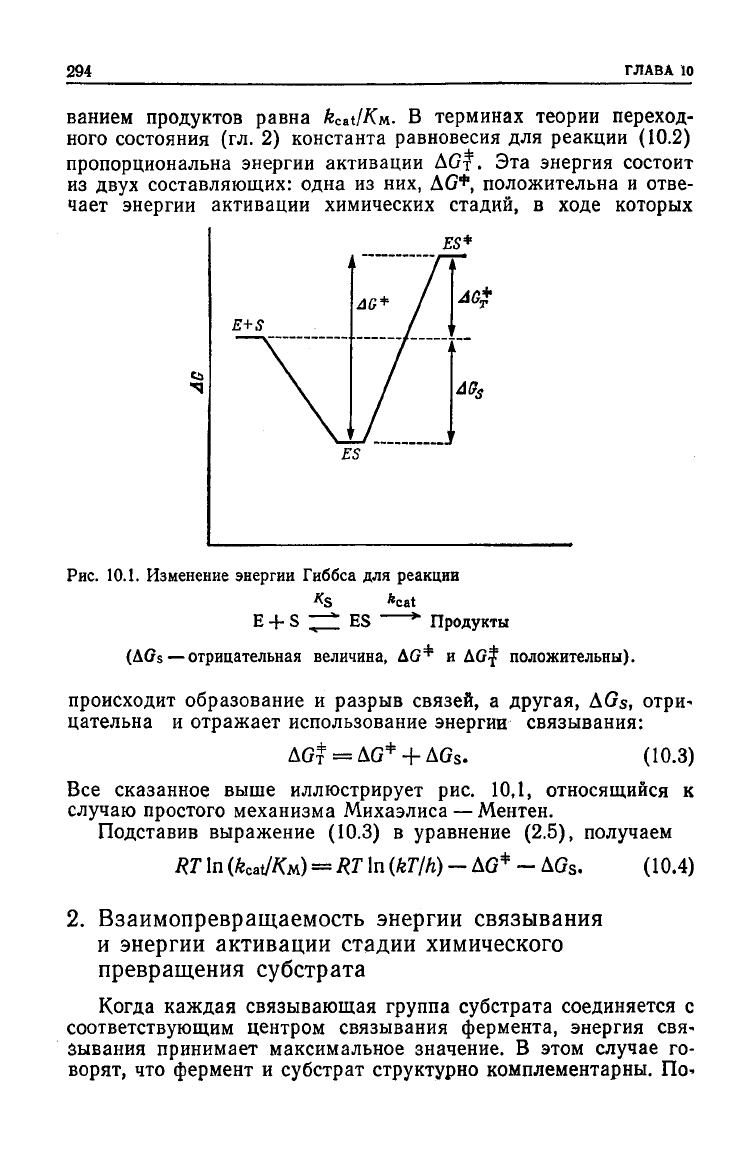
294
ГЛАВА
10
ванием
продуктов равна fccat/Км. В терминах теории переход-
ного состояния (гл. 2) константа равновесия для реакции
(10.2)
пропорциональна
энергии активации AG*. Эта энергия состоит
из
двух
составляющих: одна из них, AG+, положительна и отве-
чает энергии активации химических стадий, в
ходе
которых
E+S
v
E
AG*
1
J
S
E
7
s*
AG*
Щ
Рис.
10.1. Изменение энергии Гиббса для реакции
E + S ^^ ES *" Продукты
— отрицательная величина, AG* и LG% положительны).
происходит образование и разрыв связей, а другая, AGs, отри*
цательна и отражает использование энергии связывания:
AG?
= AG*
AGs.
(10.3)
Все сказанное выше иллюстрирует рис. 10,1, относящийся к
случаю
простого механизма Михаэлиса — Ментен.
Подставив выражение
(10.3)
в уравнение (2.5), получаем
RT
In (Acat/Км) = RT In
(kT/h)
- AG* - AGs.
(10.4)
2. Взаимопревращаемость энергии связывания
и
энергии активации стадии химического
превращения
субстрата
Когда каждая связывающая группа субстрата соединяется с
соответствующим центром связывания фермента, энергия свя-
зывания
принимает максимальное значение. В этом
случае
го-
ворят, что фермент и
субстрат
структурно комплементарны. По-

ТЕОРИИ
ФЕРМЕНТАТИВНОГО КАТАЛИЗА
295
скольку структура субстрата изменяется
в
ходе
реакции
— сна-
чала образуется переходное состояние,
а
затем продукты
—
структура
недеформированного
фермента может быть компле-
ментарна только одной форме субстрата. Можно показать,
что
для фермента каталитически выгодно быть комплементарным
переходному состоянию субстрата
1
, а не
исходному
субстрату.
В этом случае увеличение энергии связывания
по
мере прибли-
жения
структуры субстрата
к
структуре переходного состояния
уменьшает энергию активации стадии химического превраще-
ния.
И
наоборот, если фермент комплементарен исходному
суб-
страту, уменьшение энергии связывания
при
образовании пере-
ходного состояния
будет
увеличивать энергию активации хими-
ческой стадии.
В следующем разделе
мы
обсудим вопрос
о
комплементар-
ности
фермента переходному состоянию субстрата, используя
подразделение энергий активации
на две
составляющие, одна
из
которых отвечает стадии химического превращения,
а
другая
равна изменению энергии связывания
в
ходе
реакции.
3. Комплементарность фермента
переходному состоянию
субстрата
означает,
что ^
са{
/Лм имеет максимальное значение
Идея
комплементарности
при
фермент-субстратном взаимо-
действии принадлежит Фишеру, воплотившему
ее в
своей
зна-
менитой
модели «замка
и
ключа»
[3]. В
современной термино-
логии
это
означает комплементарность между ферментом
и суб-
стратом.
В
настоящее время отдают предпочтение концепции
комплементарности фермента переходному состоянию, введен-
ной
Холдейном
[1] и
развитой Полингом
[4].
а. Комплементарность фермента исходному субстрату
Допустим,
что
максимальная внутренняя свободная энергия
связывания
равна
АОь. В
рассматриваемом случае
она
реализу-
ется
в
исходном фермент-субстратном комплексе, обеспечивая
прочное связывание;
Км.
—
константа диссоциации фермент-суб-
стратного комплекса
—
будет
мала. Образование переходного
состояния,
сопровождающееся изменением геометрии субстрата
и
ухудшением соответствия, приведет
к
уменьшению энергии
связывания
и,
следовательно,
к
уменьшению
£
ca
t.
Если увели-
1
Речь
идет
о
дополнительных нековалентных взаимодействиях
между
реагентами
в
переходном состоянии реакции
(см.,
например,
И. В.
Березин,
К- Мартинек «Основы физической химии ферментативного катализа»,
М.,
Высшая школа,
1977, стр.
42—47,
72). —
Прим.
ред.
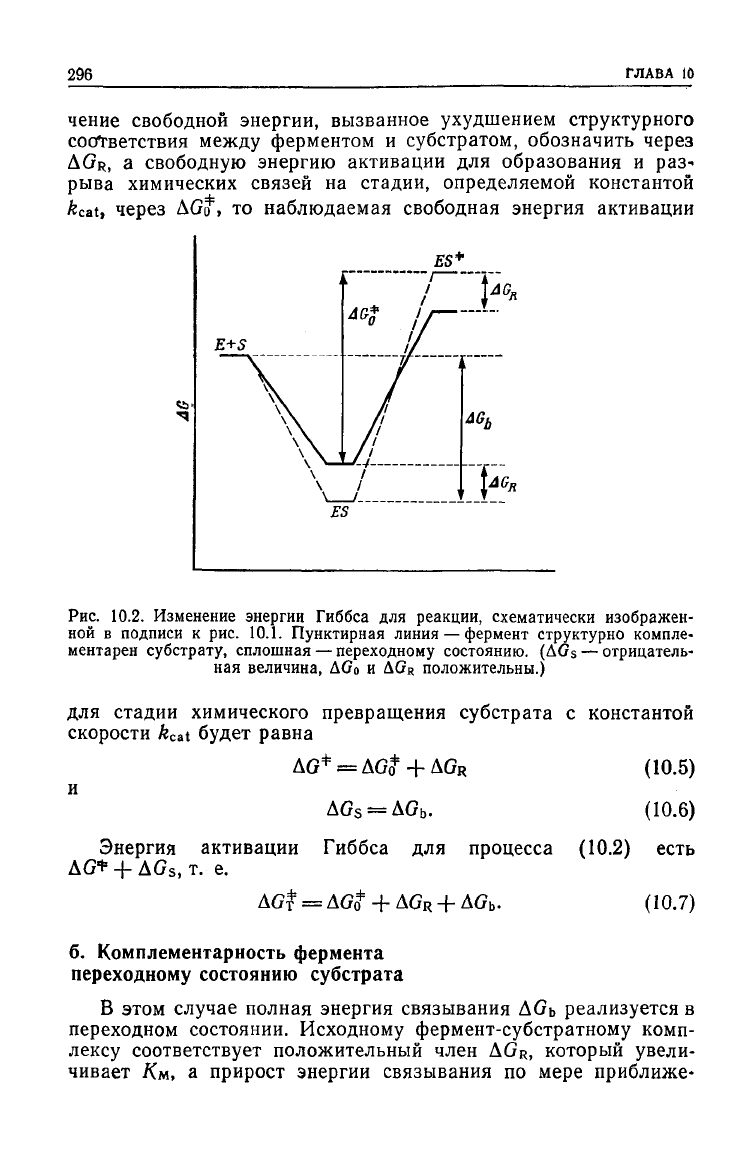
296
ГЛАВА 10
чение
свободной энергии, вызванное ухудшением структурного
соответствия между ферментом
и
субстратом, обозначить через
AGR,
а
свободную энергию активации
для
образования
и раз-
рыва химических связей
на
стадии, определяемой константой
&cat, через
AGjf. то
наблюдаемая свободная энергия активации
£+5
Рис.
10.2.
Изменение энергии Гиббса
для
реакции, схематически изображен-
ной
в
подписи
к рис. 10.1.
Пунктирная линия
—
фермент структурно компле-
ментарен
субстрату,
сплошная
—
переходному состоянию.
(AG
S
—
отрицатель-
ная
величина,
AGo и AG
R
положительны.)
для стадии химического превращения субстрата
с
константой
скорости
&cat
будет
равна
(10.5)
(10.6)
AG
S
— AG
b
.
Энергия
активации Гиббса
для
процесса (10.2) есть
f
+ AGs, т. е.
AG?
=
AGo*
+ AG
R
+ AG
b
.
(10.7)
б.
Комплементарность
фермента
переходному
состоянию
субстрата
В этом случае полная энергия связывания
AGb
реализуется
в
переходном состоянии. Исходному фермент-субстратному комп-
лексу соответствует положительный член AGR, который увели-
чивает
/См, а
прирост энергии связывания
по
мере приближе-

ТЕОРИИ
ФЕРМЕНТАТИВНОГО
КАТАЛИЗА
297
ния
к переходному состоянию увеличивает
A!
ca
t-
Таким обра-
зом,
AG* = AG
0
*-AG
R
(10.8)
AGs = AG
b
+ AG
R
.
(10.9)
И
опять энергия активации Гиббса для перехода, характеризую-
щегося константой
kcat/Км.,
определяется выражением
AG? — AG
+
+ AG
S
,
т. е.
AG
T
=
= AG
0
* + AGb,
(10.10)
и
AG
R
ИЗ
выражения исключается.
Сравнение
уравнений
(10.7)
и
(10.10)
показывает, что, когда
фермент комплементарен переходному состоянию субстрата, а
не
самому
субстрату,
kcat/Км
возрастает в
exp(AG
R
/RT)
раз.
Следует
отметить, что k
ca
t/KiA не зависит от взаимодействий
в
исходном фермент-субстратном комплексе, поскольку член
AGR
не
входит
в соответствующие уравнения.
4. Экспериментальные данные об использовании
энергии
связывания в катализе и комплементарности
фермента переходному состоянию субстрата
а. Энергия связывания
Наиболее четкие данные об использовании энергии связыва-
ния
в катализе получены при кинетических исследованиях сери-
новых протеаз. Напомним (гл. 1), что эти ферменты имеют ряд
«подцентров» для связывания аминокислотных остатков поли-
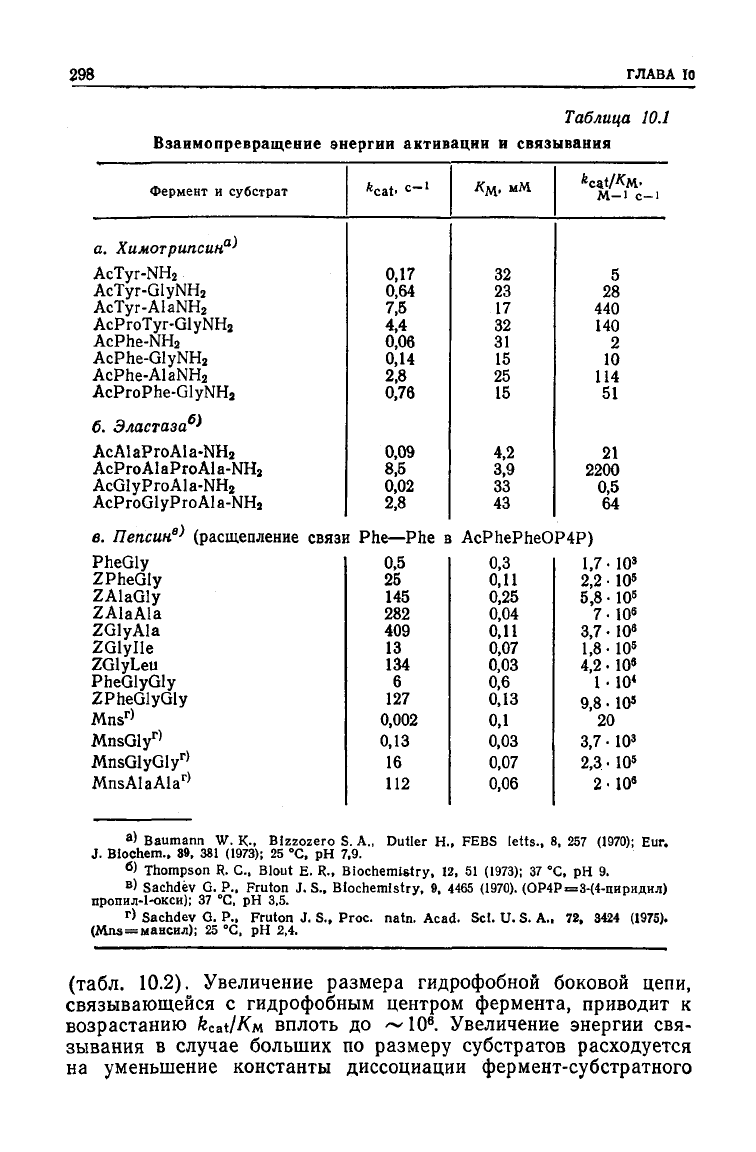
пептидных субстратов. Из табл. 10.1 видно, что, когда большие
по
размеру группы занимают в химотрипсине центр связывания
уходящей группы, их энергия связывания используется для уве-
личения
kcat/K/A.
К увеличению
kcat/Км.
приводит и удлинение
полипептидной
цепи субстратов эластазы. Интересно отметить,
что в приведенных примерах энергия связывания добавочных
групп не понижает /См, т. е. используется не для связывания
субстрата, а для увеличения
k
ca
t.
Аналогичная ситуация наблюдается и для пепсина. Из табл.
10.1 видно, что Км для гидролиза широкого круга субстратов
равна ~0,1 мМ. И опять добавочная энергия связывания групп
больших по размеру субстратов используется для увеличения
fecat, а не для уменьшения Км- Таким образом, чем больше по
размерам
субстрат,
тем выше значение
kcat/Кн-
Очень интересные данные получены при исследовании ката-
лизируемого химотрипсином гидролиза синтетических эфиров
298
ГЛАВА
10
Таблица
10.1
Взаимопревращение
энергии
активации
и
связывания
Фермент
и
субстрат
а.
Химотрипсин")
AcTyr-NH
2
AcTyr-GlyNH
2
AcTyr-AlaNH
2
AcProTyr-GlyNHj
AcPhe-NH
2
AcPhe-GlyNH
2
AcPhe-AlaNH
2
AcProPhe-GlyNHj
б. Эластаза
6
*
AcAlaProAla-NH
2
AcProAlaProAla-NH
2
AcGlyProAla-NH
2
AcProGlyProAla-NH
2
*cat. c-
1
0,17
0,64
7,6
4,4
0,06
0,14
2,8
0,76
0,09
8,6
0,02
2,8
K
M
. MM
32
23
17
32
31
15
25
15
4,2
3,9
33
43
*ca.t/*M-
M-l c-i
5
28
440
140
2
10
114
51
21
2200
0,5
64
в.
Пепсин^
(расщепление связи Phe—Phe в AcPhePheOP4P)
PheGly
ZPheGly
ZAlaGly
ZAlaAla
ZGlyAla
ZGlylle
ZGlyLeu
PheGlyGly
ZPheGlyGly
Mns
r)
MnsGly
r)
MnsGlyGly
r)
MnsAlaAla
r)
0,5
26
145
282
409
13
134
6
127
0,002
0,13
16
112
0,3
0,11
0,25
0,04
0,11
0,07
0,03
0,6
0,13
0,1
0,03
0,07
0,06
1,7-10
3
2,2 • 10
s
5,8 • 10
s
7-10
s
3,7 • 10
е
1,8- 10
s
4,2 • 10*
l-10<
9,8 - 10
s
20
3,7 -10
3
2,3-10
5
2-10
е
a
>
Baumann
W. K..
Blzzozero
S. A.,
Dutler
H.,
FEBS letts.,
8, 257
(1970);
Eur.
J.
Biochem..
89, 381
(1973);
25 °C, pH 7,9.
6
) Thompson
R. C,
Blout
E. R.,
Biochemistry,
12, 51
(1973);
37 °C, pH 9.
B
>
Sachdev G.
P.,
Fruton
J. S.,
Biochemistry,
9,
4465
(1970). (ОР4Р=3-(4-циридил)
пропил-1-окси);
37 "С, рН 3,5.
г
>
Sachdev
О. P..
Fruton
J. S.,
Ргос. natn. Acad.
Set. U. S. A.. 72,
3424 (1975).
(Мпз=мансил);
25 °C, pH 2,4.
(табл. 10.2). Увеличение размера гидрофобной боковой цепи,
связывающейся с гидрофобным центром фермента, приводит к
возрастанию
fecat/Лм
вплоть до ~ 10
е
. Увеличение энергии свя-
зывания
в
случае
больших по размеру
субстратов
расходуется
на
уменьшение константы диссоциации фермент-субстратного

ТЕОРИИ
ФЕРМЕНТАТИВНОГО
КАТАЛИЗА
299
Таблица
103
Кинетические
параметры
гидролиза химотрипсином
метиловых
эфиров
#-ацетиламинокислот
а)
(Е
+
RCO
2
Me
^t
E.RCO
2
Me
-Д.
RCO-E
-Д. Е +
RCO
2
H)
Аминокислота
Gly
But
NVal
NLeu
Phe
Tyr
6
»
*a, с-
1
0,49
8,8
35,6
103
796
5000
*..
с-
1
0,14
1,7
5,93
19
111
200
K
s
, мм
3380
417
100
34
7,6
17
ft
cat/*M>
м-
1
<=-'
0,13
21
360
3- 10
s
1-10»
3-10»
а-Химотрипсин,
25 °C, pH 7,8 (данные табл. 7.8).
Этиловый эфир.
комплекса и увеличение констант скорости ацилирования и де-
ацилирования.
В разд. Б данной главы
будет
показано, каким образом
расходование энергии связывания на увеличение
&
C
at,
а не на
уменьшение /См приводит к повышению скорости реакции.
б.
Комплементарность
фермента
переходному
состоянию
субстрата
Прямое
указание на комплементарность фермента переход-
ному состоянию субстрата было получено при рентгеноструктур-
ном
анализе сериновых протеаз и лизоцима (разд. В.4 данной
главы и гл. 1), а также при исследовании связывания аналогов
переходного состояния. Этот подход был предложен Полингом в
40-х
годах,
но оценен по достоинству лишь недавно [4].
5. Аналоги переходного
состояния
субстрата: зонды
для
исследования комплементарности [б, 6]
Зная
механизм органической реакции, можно получить
представление о структуре переходного состояния ферментатив-
ной
реакции, синтезировать соединения, близкие к переходному
состоянию субстрата, и сравнить присоединение к ферменту этих
соединений с присоединением исходного субстрата.
а.
Лизоцим
и
глюкозидаза
Лизоцим катализирует гидролиз полисахаридного компо-
нента клеточной стенки растений и синтетических полимеров,
800
ГЛАВА
10
структурные
единицы которых, N-ацетилглюкозамин
(NAG),
соединены
друг
с
другом
р (1—4)-связями (см. гл. 1). Исходя из
результатов
исследования неферментативных реакций, можно
ожидать, что в
ходе
гидролиза образуется карбоний-ион, в
котором глюкопиранозное кольцо, имеющее форму кресла, из-
меняет свою конформацию, прнимая форму софы (см. гл. 1).
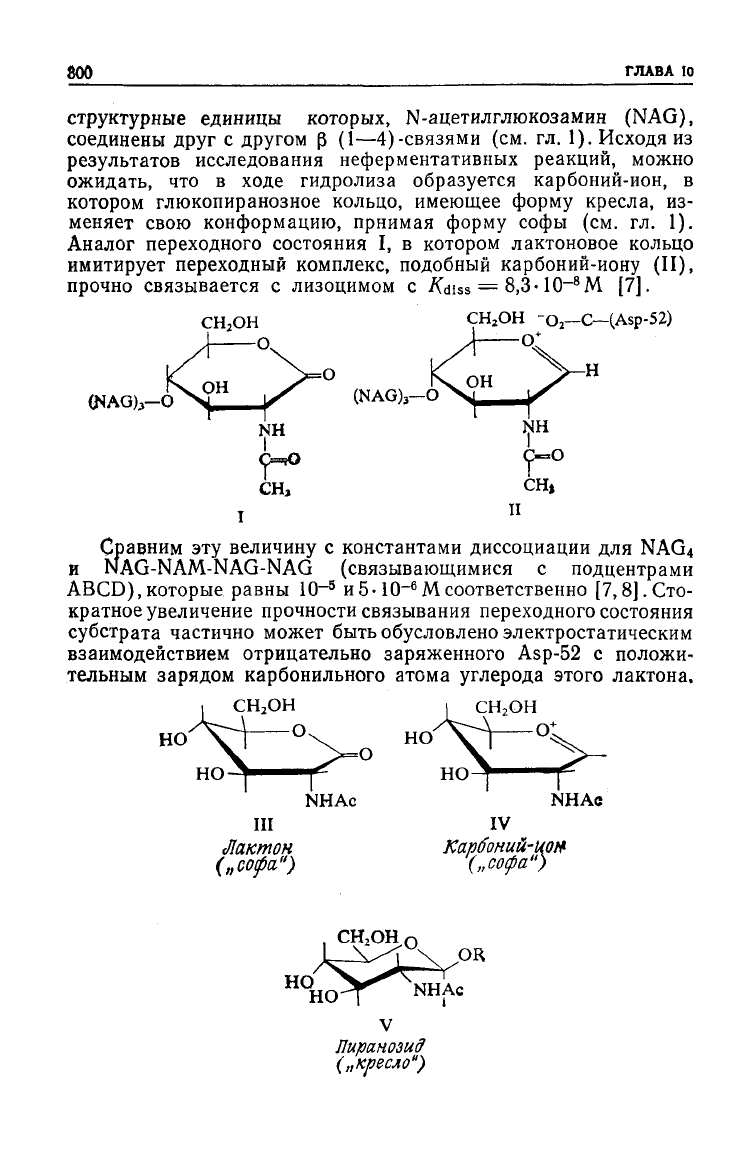
Аналог
переходного состояния I, в котором лактоновое кольцо
имитирует переходный комплекс, подобный карбоний-иону (II),
прочно связывается с лизоцимом с
/Cdiss
= 8,3- 10~
8
М [7].
,он
(МАО)д-О
СН
2
ОН
-Q
2
-C-(Asp-52)
(NAG)
NH
сн,
I
Сравним эту величину с константами диссоциации для NAG
4
и
NAG-NAM-NAG-NAG (связывающимися с подцентрами
ABCD),которые равны 10"
5
и5- 10~
6
Мсоответственно [7,8].Сто-
кратное увеличение прочности связывания переходного состояния
субстрата
частично может быть обусловлено электростатическим
взаимодействием отрицательно заряженного
Asp-52
с положи-
тельным зарядом карбонильного атома
углерода
этого лактона,
СН
2
ОН
СН
2
ОН
но
но
но
NHAc
NHAc
III
Лактон
(„софа")
IV
Карбоний-цон
(„софа
1
*)
HQ
СН
2
ОН
О
НО
NHAc
i
V
Пиранозид
(„кресло")
