Фёршт Э. Структура и механизм действия ферментов
Подождите немного. Документ загружается.


КООПЕРАТИВНОЕ
СВЯЗЫВАНИЕ ЛИГАНДОВ 261
геназе из мышц кролика характеризуется следующим увеличе-
нием
констант диссоциации: 10-", Ю-
9
,
3-10~
7
и 3- Ю-
5
М [14, 15].
Аналогичные изменения сродства обнаружены при исследовании
бактериального фермента. Подобный антагонизм в связывании
молекул известен под названием отрицательная кооператив-
ность (или антикооперативность).
Отрицательную кооперативность нельзя объяснить, исходя из
модели Моно и др., согласно которой присоединение первой
молекулы лиганда только стабилизирует состояние с высоким
сродством и не способно увеличить концентрацию Т-формы.
Теория
Кошланда и др. объясняет отрицательную кооператив-
ность тем, что присоединение лиганда к одному центру вызывает
конформационное
изменение, которое передается на вакантную
субъединицу (допущение в). Таким образом, отрицательная ко-
оперативность является отличительным признаком механизма
Кошланда
и др.
Ситуация,
аналогичная отрицательной кооперативности, воз-
никает
тогда,
когда из In центров молекулы фермента реагиру-
ют (быстро) только п центров (реакционная способность поло-
вины
связывающих центров; half-of-the
sites
reactivity). Обна-
ружить это явление удается с помощью данных по предстацио-
нарной
кинетике. Показательным примером такого фермента
может служить тирозил-тРНК—синтетаза: образование одного
моля
связанного с ферментом тирозиладенилата происходит с
константой
скорости 18 с~\
тогда
как второй центр реагирует в
10
4
раз медленнее [12, 16].
Рассматриваемое явление не вписывается в рамки простой
теории Моно и др., поскольку центры связывания неэквивалент-
ны,
и тем самым симметрия нарушена.
В этой связи необходимо отметить следующее. Возможность
выявления
случая реакционной способности половины связыва-
ющих центров зависит от того, известна ли концентрация цент-
ров связывания на ферменте, что в свою очередь зависит от
точности определения концентрации белка и чистоты препарата.
Негомогенный
препарат, содержащий молекулы, обладающие
разным
сродством к лиганду,
дает
кривую связывания такого
же вида, как и в
случае
отрицательной кооперативности, что
может привести к ошибочному выводу о наличии взаимодей-
ствия
между
субъединицами. Еще одна ситуация, которую
можно ошибочно интерпретировать как случай реакционной
способности половины связывающих центров, имеет место в ре-
акциях,
катализируемых лактатдегидрогеназой, и обсуждается
в
гл. 12: из-за неблагоприятной константы равновесия
между
E.NAD+.Lac
и E.NADH.Pyr не происходит полного накопления
ферментсодержащего промежуточного соединения E.NADH.Pyr
[схема (12.9)].

202
ГЛАВА
8
Таблица
8.2
Ферменты, у которых реакционной способностью
обладает
только половина активных центров
Фермент
Ацетоацетатдекарбокси-
лаза
Альдолаза
Аминоацил-тРНК—син-
тетазы (некоторые)
Цитидинтрифосфатсинте-
таза
Глицеральдегид-3-фос-
фат—дегидрогеназа
Аспартат-карбамоил-
трансфераза
Глутаминсинтетаза
Реакция
Инактивация
активного
центра лизина
«Парциальная» реакция
с фруктозо-6-фосфатом
Двухфазное
образование
аминоациладенилата
Необратимая инактивация
(анализ стехиометрии)
Реакция
с нефизиологи-
ческими субстратами.
В реакции с физиологи-
ческими
субстратами
уча-
ствуют
все центры
Связывание СТР
Связывание карбамилфос-
фата
Необратимое ингибирова-
ние
Число
субъединиц
12
2
2
4
4
6
(регулят.)
6 (каталит.)
8
Источник
данных
а
>
1
2
3
4
5
5
6
)
1
—Schmidt
D. E., Jr.,
Westhelmer
F. H.,
Biochemistry,
10, 1249
(1971)
и
литература,
приведенная
в
этой Статье.
2—Tsolas
О.,
Horecker
В. L.,
Archs Biochem. Biophys.,
173, 577
(1976).
3—Mulvey
R. S.,
Fersht
A. R.,
Biochemistry,
15, 243
(1976).
4—Levitzkl
A.,
Stallcup
W. В.,
Koshland
D. E., Jr.,
Biochemistry,
10, 3371
(1971).
Б—Seydoux
F.,
Malhotra
O. P.,
Bernhard
S. A.,
Crit. Revs Biochem.,
227
(1974).
6—Tate
S. S.,
Meister
A.,
Proc. natn. Acad.
Sci., USA, 68, 781
(1971).
Г. Количественный анализ кооперативности
1. Уравнение Хилла; коэффициент Хилла —
мера кооперативности [17]
Рассмотрим
случай
полностью кооперативного связывания;
молекула фермента имеет л связывающих центров и лиганд
присоединяется одновременно ко всем центрам.
(8.1)
(8.2)
E + rtS ^=±: ES
n
.
Константа диссоциации имеет следующий вид:
lES
n
]
•
КООПЕРАТИВНОЕ СВЯЗЫВАНИЕ ЛИГАНДОВ
263
Степень
насыщения У есть
\-Y =
[ES
n
]
[Е]о'
[Е]
[Е
о
]
-
(8.3)
(8.4)
(8.5)
Аналогичное уравнение, называемое уравнением Хилла,
(8.6)
Из
уравнений (8.2) и (8.4) получаем
удовлетворительно описывает связывание лигандов аллостери-
ческими
белками в интервале от 10 до 90% насыщения. За
333
99
/о
/о
о
о
о
о
о
о
о
о
о
-1
-
-2-
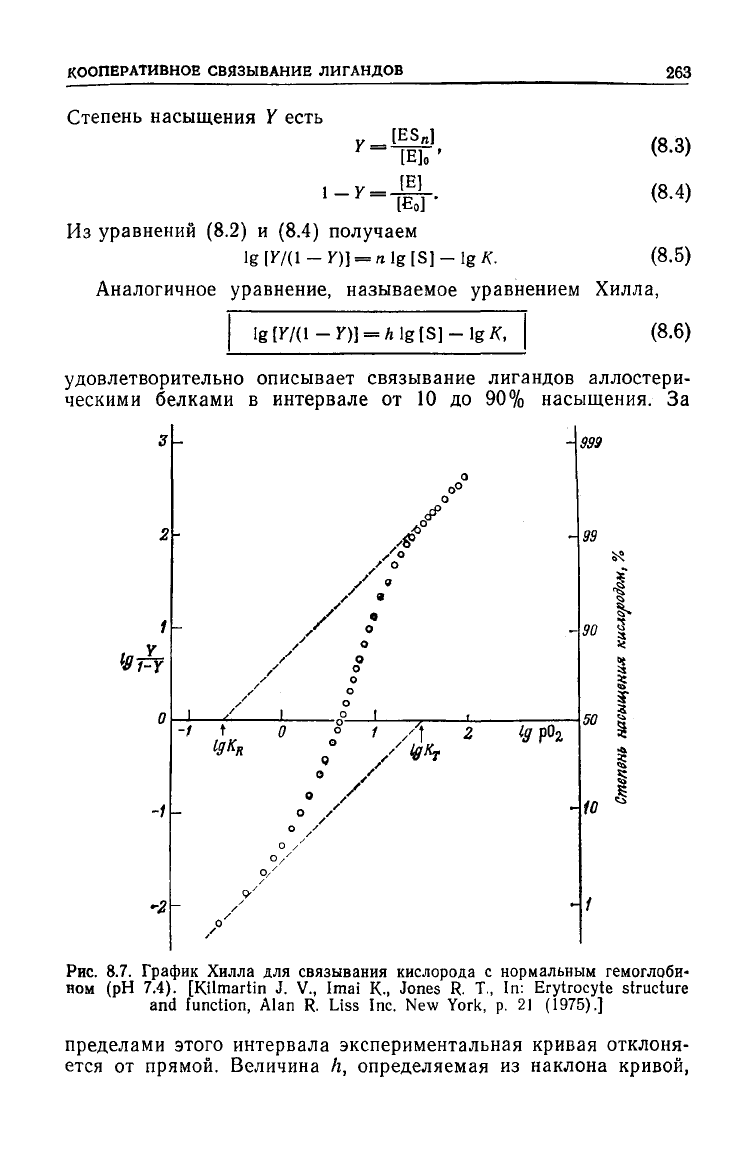
Рис.
8.7. График Хилла для связывания кислорода с нормальным гемоглоби-
ном
(рН 7.4). [Kilmartin J. V., Imai К., Jones R. Т., In: Erytrocyte structure
and
function,
Alan
R.
Liss
Inc. New
York,
p. 21
(1975).]
пределами этого интервала экспериментальная кривая отклоня-
ется от прямой. Величина А, определяемая из наклона кривой,
30
50
10
1
I
I

264
ГЛАВА
8
описываемой уравнением (8.6), в области полунасыщения (У =
=
0,5), известна под названием
коэффициент
Хилла
и является
мерой неоперативности. Чем выше h, тем сильнее кооператив-
ность. В пределе h равен числу центров связывания. Если h — 1,
то кооперативность
отсутствует;
при h > 1 имеет место поло-
жительная кооперативность, а при h < 1 — отрицательная.
Уравнение Хилла можно использовать при кинетических из-
мерениях, если вместо У подставить v:
lg
f/(^max
- О) = Л lg [S] — Ig AT. (8.7)
2. Кривая связывания для модели Моно и др. [4]
Пусть константа диссоциации лиганда для комплекса с
R-формой равна /CR, а для комплекса с Т-формой — /Ст. Обо-
значим отношение этих констант через с:
c
=
.K
R
/tf
T
.
(8.8)
R-состояние с х присоединенными молекулами лигандов обо-
значим через Ях, для Т-состояния введем аналогичное обозна-
чение 7
Х
. В таком
случае
аллостерическая константа L опреде-
ляется выражением
i
= [T]o/[Rb. (8.9)
Доля связанного с лигандом белка У рассчитывается из
уравнения материального балланса.
Следует
помнить о необхо-
димости введения «статистических множителей» в константы свя-
зывания.
Например, константа диссоциации' для первой присо-
единяющейся к гемоглобину молекулы О
2
равна /(т/4, поскольку
число центров, с которыми этот лиганд может связаться,
равно четырем, а отщепление осуществляется только от одного
центра. Аналогичным образом константа диссоциации для вто-
рой присоединяющейся молекулы
будет
равна 2/Ст/З, поскольку
имеется три центра, к которым она может присоединиться, но
после ее присоединения образуются два центра, от которых
молекула кислорода может отщепиться.
Величина У для белка, имеющего п центров, определяется
выражением
Y
([Ri] + 2[R»]+ ... + я IR»1) + ([Т.] + 2 [Т,] + ••• +п[Т
п
])
n([R
0
] + [Ri]+ ... +[R«) + [T.] + [T,]+ ...
+[Т„])
• 18.1UJ
Если перейти к параметрам L и с и ввести для
удобства
безразмерную концентрацию субстрата
o-[S]//r
R
,
(8.11)
1
Речь идет о макроскопической константе диссоциации
(следует
помнить,
что /CR И
КТ
— микроскопические константы диссоциации). —
Прим.
pea.
КООПЕРАТИВНОЕ
СВЯЗЫВАНИЕ ЛИГАНДОВ
265
то уравнение
(8.10)
преобразуется
к
виду
Lea
(1
+
са)"
+
'
+ а
(1
+а)"~'
Г
~
L
(1
+
са)"
+
(1
+ о)"
(8.12)
Согласно модели Моно
и др., ход
кривой насыщения
для
любого олигомерного белка, состоящего
из п
протомеров, опре-
деляется только тремя неизвестными параметрами
и
концентра-
цией
лиганда
[L, KR, KT И [S], из
которых
три
последние
величины связаны
с с и а, а
потому входят неявным образом
в
уравнение (8.12)].
Таблица
8.3
Аллостерические
константы для
некоторых
белков
Белок
Гемоглобин
Пируваткиназа
(дрожжи)
Глицеральде-
гид-3-фосфат-
дегидрогена-
за (дрожжи)
Лиганд
о
2
Фосфоенол-
пируват
NAD
+
Число
центров
связы-
вания
п
4
4
4
Коэффи-
циент
Хилла
h
2,8
2,8
2,3
L
3-Ю
5
9-10
зб)
60
с
0,01
0,01
б)
0,04
Источник
данных
а
)
1
2
3
а
'
1
—Edelstein
S. J.,
Nature, Lond.,
230, 224
(1971).
2—Haeckel
R.,
Hess
В.,
Lauterhorn
W.,
Wurster
K.-H.
Hoppe-Seyler'»
Z. physlol.
Chem.,
349, 699
(1968):
Bischofberger
H., Hess
В.,
Roschlau
P.,
ibid.,
ЗБ2,
1139(1971).
3 —Kirschner
K-
Qallego
E.,
Schuster
I.,
Goodall
D., J.
molec, Biol.,
58, 29
(1871V
*>)
По
оценкам автора.
В табл.
8.3
приведен
ряд
значений
L и с,
полученных
с
помощью
ЭВМ
путем описания экспериментальных кривых
свя-
зывания
для
некоторых белков уравнением (8.12). (Это, однако,
не
означает,
что
структурные изменения происходят
в
соответ-
ствии
с
моделью Моно
и др.—
модель Кошланда
и др.
предска-
зывает аналогичную кривую связывания;
см.
ниже.)
а. Зависимость коэффициента
Хилла
от
параметров
L и с [18]
Значение
h
можно рассчитать, проанализировав
с
помощью
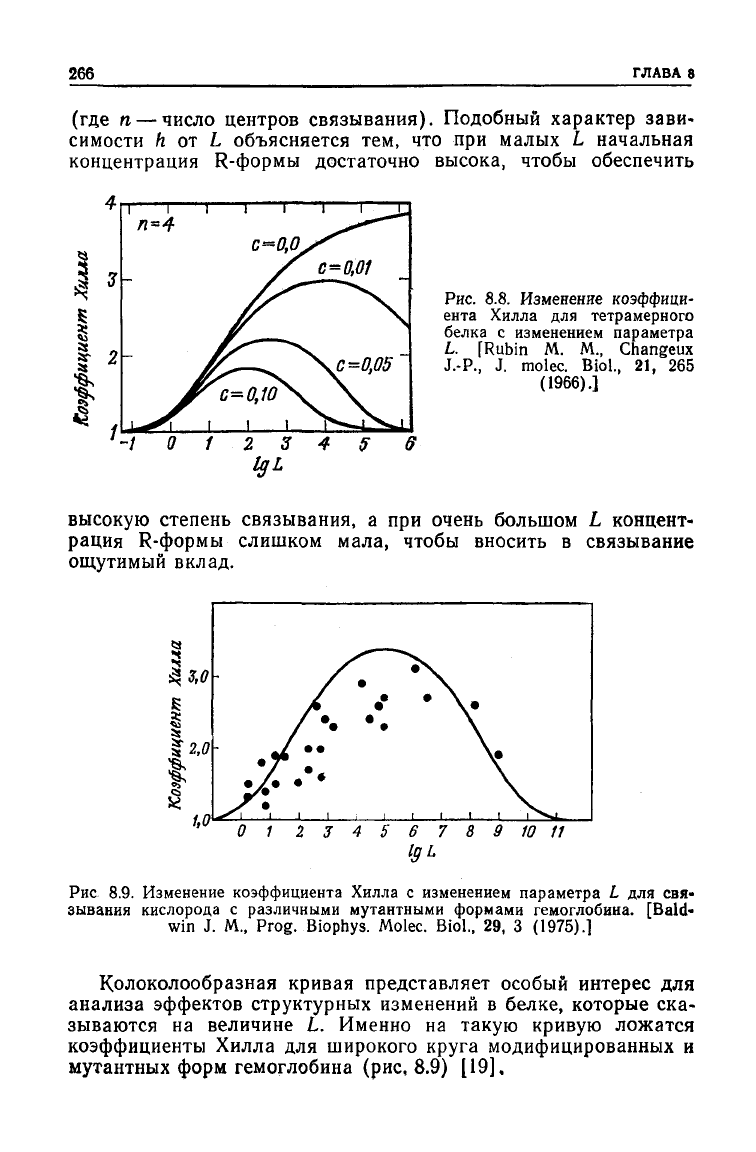
ЭВМ уравнение (8.12).Установлено,
что при
постоянном
с
зави-
симость
h от L
графически представляется колоколообразной
кривой
(рис. 8.8). h = 1,
когда
L
много больше
или
много
меньше
с, и
принимает максимальное значение, когда
L
= c-
n
'
2
(8.13)
266
ГЛАВА
8
(где п — число центров связывания). Подобный характер зави-
симости h от L объясняется тем, что при малых L начальная
концентрация
R-формы достаточно высока, чтобы обеспечить
Рис.
8.8. Изменение
коэффици-
ента Хилла для тетрамерного
белка с изменением параметра
L.
[Rubin M. M., Changeux
J.-P.,
J. molec. Biol., 21, 265
(1966).]
высокую степень связывания, а при очень большом L концент-
рация
R-формы слишком мала, чтобы вносить в связывание
ощутимый вклад.
Рис
8.9. Изменение коэффициента Хилла с изменением параметра L для свя-
зывания
кислорода с различными мутантными формами гемоглобина. [Bald-
win J. M., Prog. Biophys. Molec. Biol., 29, 3 (1975).!
Колоколообразная кривая представляет особый интерес для
анализа эффектов структурных изменений в белке, которые ска-
зываются на величине L. Именно на такую кривую ложатся
коэффициенты
Хилла для широкого круга модифицированных и
мутантных форм гемоглобина (рис, 8.9) [19].
КООПЕРАТИВНОЕ СВЯЗЫВАНИЕ ЛИГАНДОВ
267
3.
Кривая
связывания
для модели Кошланда и др.
В рамках модели Моно и др. выражение для У имеет простой
вид благодаря предположению, что имеется только две кон-
станты диссоциации. В модели Кошланда и др. каждому про-
межуточному состоянию соответствует своя константа диссоци-
ации,
поэтому простого общего выражения для Y не
существует.
Число параметров должно быть равно числу центров связы-
вания.
4. Обнаружение кооперативности и сопоставление
механизмов Моно и др. и Кошланда и др.
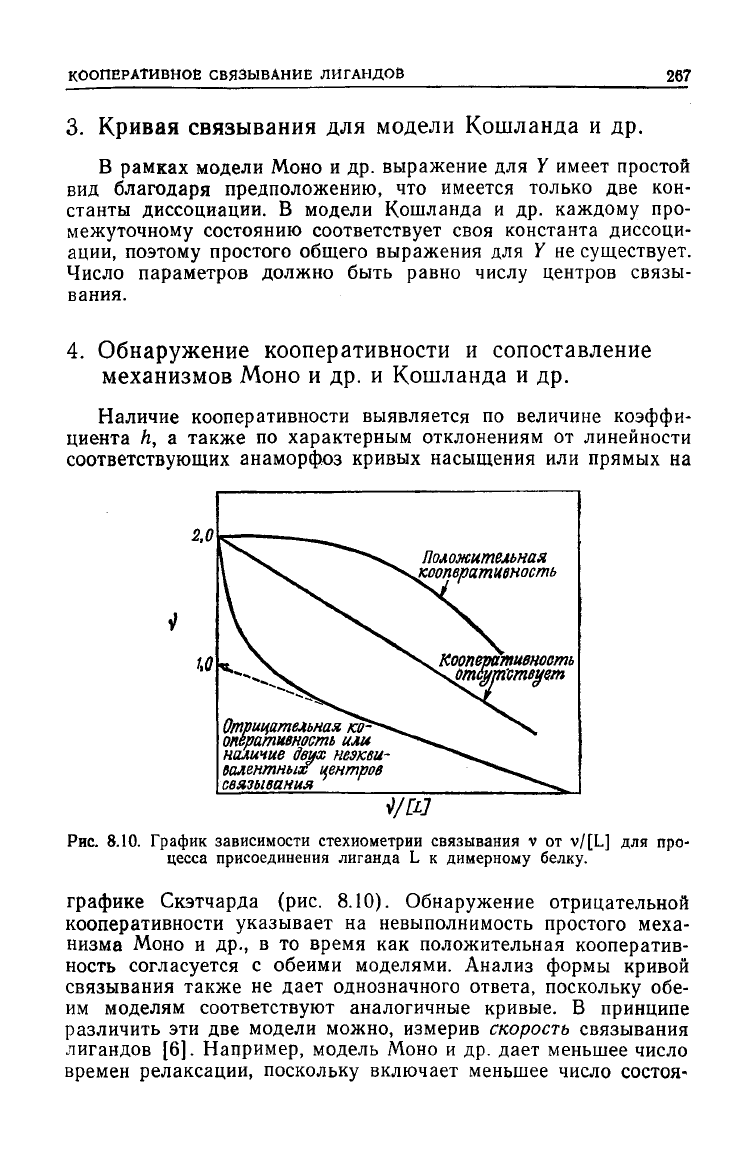
Наличие кооперативности выявляется по величине
коэффи-
циента h, а также по характерным отклонениям от линейности
соответствующих анаморфоз кривых насыщения или прямых на
Положительная
кооператчвность
тность
отсшствует
Отрицательная
ко*
оперативность
или
наличие
двух
неэкви-
валентных
центров
связывания
Рис.
8.10. График зависимости стехиометрии связывания v от v/[L] для про-
цесса присоединения лиганда L к димерному белку.
графике Скэтчарда (рис.
8.10).
Обнаружение отрицательной
кооперативности указывает на невыполнимость простого
меха-
низма
Моно и др., в то время как положительная кооператив-
ность согласуется с обеими моделями. Анализ формы кривой
связывания также не
дает
однозначного ответа, поскольку обе-
им
моделям соответствуют аналогичные кривые. В принципе
различить эти две модели можно, измерив
скорость
связывания
лигандов [6]. Например, модель Моно и др.
дает
меньшее число
времен релаксации, поскольку включает меньшее число состоя-

268
ГЛАВА
8
ний.
Этот
подход
был с
успехом
применен при исследовании
глицеральдегид-3-фосфат—дегидрогеназы дрожжей Киршнером
и
др. [20], которые показали, что связывание NAD+ происходит
в
соответствии с моделью Моно и др. В то же время исследова-
ние
связывания лигандов с гемоглобином указывает на суще-
ствование промежуточных состояний.
Выбор модели часто зависит от характера эксперимента. Ис-
следователи, изучающие, скажем, влияние
структурных
измене-
ний
в молекуле гемоглобина на сродство кислорода и
коэффи-
циент
Хилла,
предпочитают пользоваться моделью Моно и др.,
поскольку она является по своей природе структурной. Эта
модель позволяет легко предсказать характер связывания ли-
ганда и интерпретировать экспериментальные данные. Исполь-
зование ее для нахождения коэффициента
Хилла
и анализа ре-
зультатов
исследования
равновесных
процессов
дает
очень хоро-
шие
результаты.
Ученые, занимающиеся кинетическими исследо-
ваниями,
предпочитают модель Кошланда и др., поскольку
кинетические
параметры более чувствительны к существованию
промежуточных состояний. В теории Кошланда и др. больше
параметров и больше возможностей для подгонки.
Д.
Молекулярный
механизм
кооперативного
связывания
для
гемоглобина
[3]
1. Физиологическое значение
кооперативного связывания кислорода
Положительная кооперативность не предназначена для уве-
личения
сродства гемоглобина к кислороду; константа связыва-
ния
кислорода свободными цепями гемоглобина значительно
выше константы связывания первого моля кислорода дезоксиге-
моглобином и приблизительно равна константе связывания кис-
лорода оксигемоглобином. Положительная кооперативность
обеспечивает резкое изменение степени сродства в очень узком
диапазоне давлений кислорода. Это позволяет гемоглобину на-
сытиться кислородом в легких и затем высвободить примерно
60% его в тканях. Процесс насыщения может осуществляться в
довольно узком диапазоне давлений, что обусловлено крутизной
графика
зависимости степени насыщения от давления кислорода
в
области 50%-ного насыщения. Кривая, описываемая простым
уравнением Михаэлиса — Ментен, гораздо более пологая. (Ко-
эффициент
Хилла
является мерой крутизны кривой насыщения в
точке, отвечающей 50% насыщения; для сигмоидной кривой,
отвечающей связыванию гемоглобина, h ~ 3, а для гиперболы
КООПЕРАТИВНОЕ
СВЯЗЫВАНИЕ ЛИГАНДОВ
269
2. Стереохимический механизм оксигенации
гемоглобина
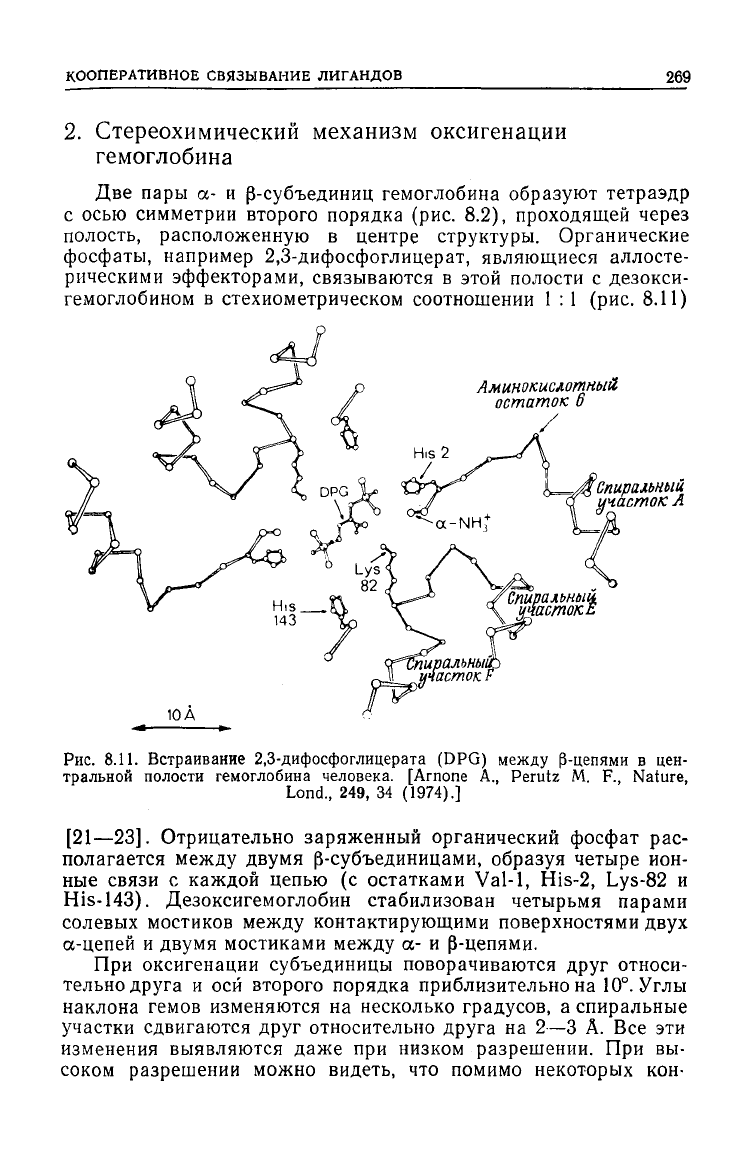
Две пары а- и р-субъединиц гемоглобина образуют тетраэдр
с осью симметрии второго порядка (рис. 8.2), проходящей через
полость, расположенную в центре структуры. Органические
фосфаты,
например 2,3-дифосфоглицерат, являющиеся аллосте-
рическими
эффекторами, связываются в этой полости с дезокси-
гемоглобином в стехиометрическом соотношении 1 : 1 (рис. 8.11)
Аминокислотный
остаток
о
Рис.
8.11. Встраивание 2,3-дифосфоглицерата (DPG) между р-цепями в цен-
тральной
полости гемоглобина человека. [Arnone A., Perutz M. F.,
Nature,
Lond.,
249, 34 (1974).]
[21—23]. Отрицательно заряженный органический фосфат рас-
полагается
между
двумя р-субъединицами, образуя четыре ион-
ные
связи с каждой цепью (с остатками
Val-1,
His-2,
Lys-82
и
His-143). Дезоксигемоглобин стабилизован четырьмя парами
солевых мостиков
между
контактирующими поверхностями
двух
а-цепей и двумя мостиками
между
ос- и р-цепями.
При
оксигенации субъединицы поворачиваются
друг
относи-
тельно
друга
и оси второго порядка приблизительно на 10°.
Углы
наклона
гемов изменяются на несколько градусов, а спиральные
участки сдвигаются
друг
относительно
друга
на 2—3 А. Все эти
изменения
выявляются
даже
при низком разрешении. При вы-
соком
разрешении можно видеть, что помимо некоторых кон-
270
ГЛАВА
8
формационных
изменений в субъединицах происходит разрыв
солевых мостиков
между
всеми субъединицами. Кроме того,
а-аминогруппы Val-1 каждой р-цепи в центральной полости
расходятся на 4 А,
тогда
как сама полость сужается, выталки-
вая
присоединившийся органический фосфат. Происходит также
уменьшение площади гидрофобной поверхности, вдоль которой
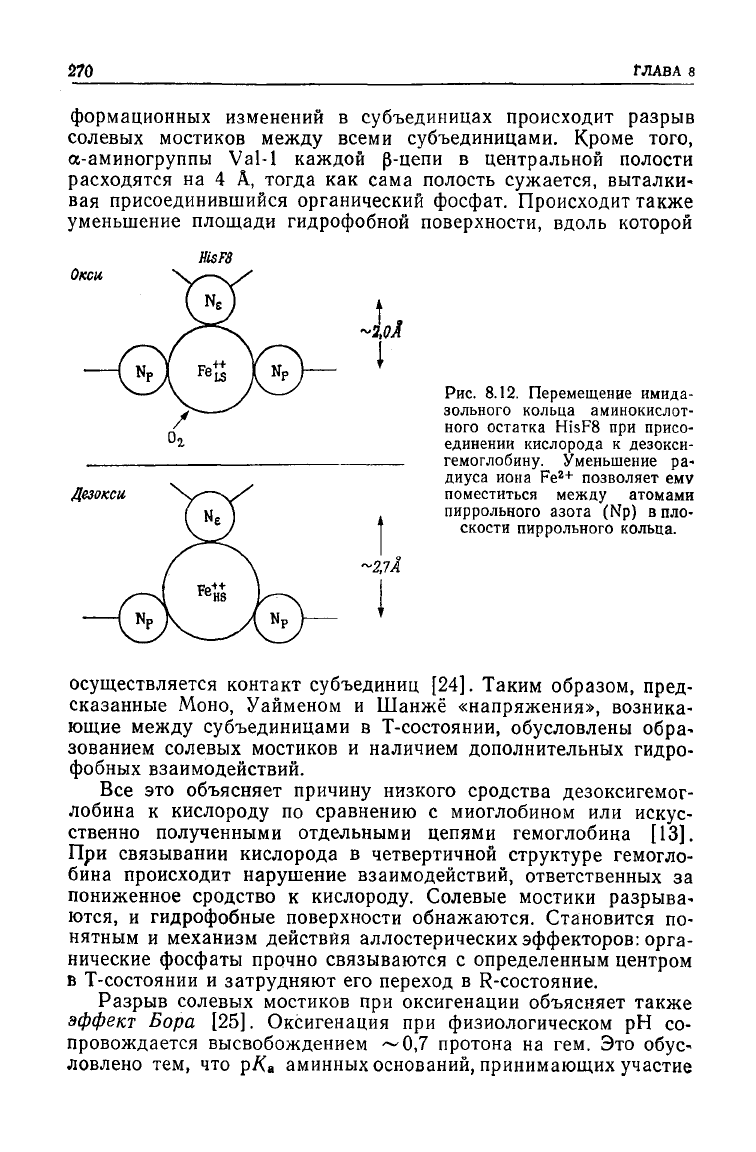
Окси
HisF8
Дезокси,
X
~2,7А
Рис.
8.12. Перемещение имида-
зольного кольца аминокислот-
ного остатка HisF8 при присо-
единении
кислорода к дезокси-
гемоглобину. Уменьшение ра-
диуса
иона
Fe
2+
позволяет ему
поместиться
между
атомами
пиррольного азота (Np) в пло-
скости пиррольного кольца.
осуществляется контакт субъединиц [24]. Таким образом, пред-
сказанные
Моно, Уайменом и Шанжё «напряжения», возника-
ющие
между
субъединицами в Т-состоянии, обусловлены обра*
зованием солевых мостиков и наличием дополнительных гидро-
фобных взаимодействий.
Все это объясняет причину низкого сродства дезоксигемог-
лобина к кислороду по сравнению с миоглобином или искус-
ственно полученными отдельными цепями гемоглобина [13].
При
связывании кислорода в четвертичной
структуре
гемогло-
бина
происходит нарушение взаимодействий, ответственных за
пониженное
сродство к кислороду. Солевые мостики разрыва-
ются, и гидрофобные поверхности обнажаются. Становится по-
нятным
и механизм действия аллостерических эффекторов: орга-
нические
фосфаты прочно связываются с определенным центром
в
Т-состоянии и затрудняют его переход в R-состояние.
Разрыв
солевых мостиков при оксигенации объясняет также
аффект
Бора
[25]. Оксигенация при физиологическом рН со-
провождается высвобождением ~0,7 протона на гем. Это обус-
ловлено тем, что р/Са аминных оснований, принимающих участие
