Фёршт Э. Структура и механизм действия ферментов
Подождите немного. Документ загружается.


ЭНЕРГИЯ
ФЕРМЕНТ-СУБСТРАТНОГО ВЗАИМОДЕЙСТВИЯ 281
Энергия
образования полости в воде близка к общему изме-
нению
энергии при образовании гидрофобной связи и является
движущей силой при распределении соединения
между
двумя
фазами.
Б.
Энергия связывания субстратов с ферментами
Исходя из простых физических оценок, приведенных в по-
следнем разделе, оценить вклад энергии водородных, электро-
статических и гидрофобных связей и полную энергию связыва-
ния
субстрата с ферментом очень трудно. Основная причина
этих затруднений состоит в том, что процесс связывания пред*
ставляет собой реакцию
обмена:
субстрат
«обменивает» свою
сольватную водную оболочку на связывающий центр фермента.
Суммарная энергия связывания представляет собой разность
между
энергиями связывания этого субстрата с водой и с фер-
ментом. Расчет суммарной энергии образования водородных
связей
затрудняется тем, что обычно в водном растворе суб-
страт, так же как и фермент, образует с молекулами воды
водородные связи. Образование водородных связей в фермент-
субстратном комплексе сопровождается вытеснением связанных
водородными связями молекул воды. Следовательно, при этом
суммарное число водородных связей не увеличивается.
/
Н
в...н-o +s-o;
=f=fc
E-S +
OW)),.
(9.3)
Но
при образовании внутримолекулярных связей в фермент-
субстратном комплексе происходит увеличение энтропии. Энер-
гия
отдельной водородной связи складывается из
двух
состав-
ляющих: энергетической, способствующей связыванию, и энтро-
пийной,
препятствующей этому процессу, поскольку из
двух
молекул образуется одна (гл. 2, разд. Б.4, а также данная глава,
разд. В). Однако если
субстрат
так или иначе фиксирован в
фермент-субстратном комплексе, то в дальнейшем при образо-
вании
внутримолекулярных водородных связей никакой потери
энтропии
не происходит. Другими словами, потеря энтропии
должна «оплачиваться» только один раз. Образование внутри-
молекулярных водородных связей является благоприятным из-
за увеличения энтропии при высвобождении связанных молекул
воды. Грубая оценка показывает, что на каждый моль высво-
бождающейся воды энтропия возрастает приблизительно на
40 Дж-град-
1
(10 кал-град-
1
).
Определение энергии ионных связей затруднено вследствие
сольватации в растворе ионов,
участвующих
в образовании этих

282
ГЛАВА
*
связей. Энергии сольватации очень высоки; так, по оценкам
энергия
стабилизации иона —СО7 составляет ~270 кДж-моль"
1
(65 ккал-моль-
1
) [2]. Энергия ионной связи сильно зависит
также от диэлектрической проницаемости среды. Помимо всего
прочего, образование ионной связи в глубине структуры являет-
ся
энтропийно выгодным, поскольку при этом высвобождается
сольватированная вода [уравнение (9.4)]:
E-NH
3
+
(H
2
O)
m
+
(H
2
O)
n
-O
2
C-S
*=±
E-NH
3
+
--O
2
C-S.
(9.4)
(n + m) H
2
0
Определение энергии гидрофобных связей, образующихся
при
присоединении лиганда к белку, затрудняется тем обстоя-
тельством, что оценки, полученные из опытов по распределению
вещества
между
органическими растворителями и водой, в
этом
случае
являются не вполне применимыми. Перенос раство-
ренного вещества из водной фазы в органический растворитель
мысленно можно разделить на следующие стадии: а) образо-
вание полости в растворителе; б) перенос растворенного веще-
ства в эту полость; в) ликвидация полости в водной фазе. Пе-
ренос гидрофобного субстрата в гидрофобную область фермента
сопровождается заполнением уже
существующей
полости и,
возможно, переносом воды из этой полости в водную фазу.
Вклад различных факторов в энергию связывания фермента
с субстратом можно оценить из исследований самих фермента-
тивных реакций, а не только модельных систем.
1. Оценка увеличения энергии связывания
из
кинетических данных
Один из способов оценки вклада заместителя R в
субстрате
R—S в связывание состоит в сравнении констант диссоциации
комплексов R—S и Н—S с ферментом. Однако, как
будет
пока-
зано в следующей главе, энергия связывания больших по раз-
меру субстратов при этом часто недооценивается, поскольку
обычно энергия связывания идет на уменьшение энергии акти-
вации,
а не на увеличение /См. Гораздо лучше сравнивать значе-
ния
параметров fecat/Лм для
двух
субстратов. При этом учиты-
вается как энергия активации, так и энергия связывания и
устраняются недостатки, которые свойственны
методу,
основан-
ному на сравнении только констант диссоциации. Из уравнений
(10.2)
и
(10.10)
следует,
что
ln
(W*M)
=
ln
(кт
1^
~
(
А
°о
Ф
+
А
°ь).
(9.5)

ЭНЕРГИЯ
ФЕРМЕНТ-СУБСТРАТНОГО ВЗАИМОДЕЙСТВИЯ 283
где kT/h — константа при данной температуре, AG* — внутрен-
няя
энергия активации, обусловленная электронными эффекта-
ми,
которые связаны с образованием и разрывом связи, AGb —
внутренняя энергия связывания
субстрата
с ферментом. В слу-
чае
сходных
субстратов
различием в AG* можно иногда
пренебречь или внести
соответствующую
поправку, сравнив ре-
акционные
способности этих
субстратов
в неферментативных ре*
акциях.
2. Оценка энергий связывания малых групп в
случае
аминоацил-тРНК—синтетазы
Функция
аминоацил-тРНК—синтетаз состоит в выборе оп-
ределенной аминокислоты среди
других
аминокислот и меньших
по
размеру конкурирующих соединений (гл. 11). В основе отбо-
ра нужной аминокислоты лежит, вероятно, то обстоятельство,
что ее энергия связывания выше, чем энергия связывания
всех
других
присутствующих
соединений. Эти различия в энергии
связывания специфического
субстрата
и меньшего по размеру
конкурирующего соединения можно определить из сравнения
kcat/KiA
для реакции обмена Пирофосфат
=г±
АТР (гл. 7).
а.
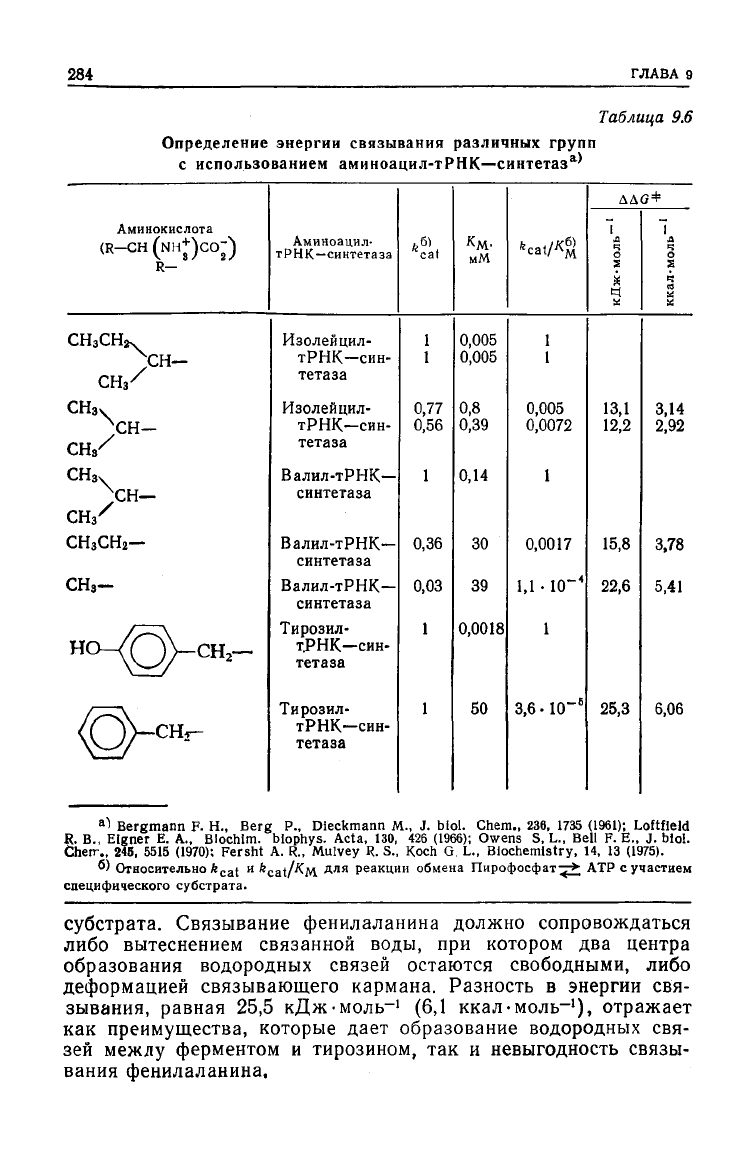
Алкильные
группы
Из
данных табл. 9.6, сравнив энергию связывания изолейци-
на
и валина с изолейцил-тРНК—синтетазой и валина и
а-аминомасляной кислоты с валил-тРНК—синтетазой, можно
видеть, что дополнительная метиленовая группа в большем по
размеру
субстрате
вносит в энергию связывания вклад порядка
12—КэкДж-моль-
1
(3—3,8ккал-моль~'). Это значительно боль-
ше величины 2,85 кДж-моль"
1
(0,68 ккал-моль-
1
) для переноса
метиленовой группы из воды в н-октанол. Сравнение соответ-
ствующих
величин для валина и аланина показывает, что раз-
ность в энергиях связывания изопропильной и метильной групп
составляет 22,6 кДж-моль-
1
(5,41 ккал-моль~'), а разность
энер-
гий переноса этих групп из воды в н-октанол составляет
4,6 кДж-моль"
1
(1,1 ккал-моль-
1
). Таким образом, энергия гид-
рофобного связывания с ферментом в пять раз превышает
энер-
гию переноса из одной фазы в
другую.
б.
Образование
водородных
связей
Тирозил-тРНК—синтетаза связывает тирозин по крайней
мере в
28000
раз прочнее, чем фенилаланин. Возможно, в этом
белке имеются центры связывания, которые присоединяют или
фенольный гидроксил тирозина, или
молекулу
воды в
отсутствие
284
ГЛАВА
9
Таблица
9.6
Определение энергии связывания различных групп
с использованием аминоацил-тРНК—синтетаз
а
'
Аминокислота
(R-CH
(NH+)CO-)
ТУ
1ч—
СН
3
СН;к
^СН—
СНз
ч
;сн-
СНз'
СНз
ч
сНз
>н-
СН3СН2—
СНз—
Он-
Аминоацил-
тРНК—синтетаза
Изолейцил-
тРНК-син-
тетаза
Изолейцил-
тРНК—син-
тетаза
Валил-тРНК—
синтетаза
Валил-тРНК—
синтетаза
Валил-тРНК—
синтетаза
Тирозил-
тРНК-син-
тетаза
Тирозил-
тРНК—син-
тетаза
ьб)
*cat
1
1
0,77
0,56
1
0,36
0,03
1
1
мМ
0,005
0,005
0,8
0,39
0,14
30
39
0,0018
50
1
1
0,005
0,0072
1
0,0017
1,1 -10~
4
1
3,6-10~
6
ддо*
моль
к
13,1
12,2
15,8
22,6
25,3
МОЛЬ
к
3,14
2,92
3,78
5,41
6,06
a
l
Bergmann
F. H.,
Berg
P., Dleckmann M., J. Ыо1. Chem., 236, 1735 (1961);
Loftfleld
R. В.,
Elgner
E. A., Blochlm. blophys. Acta, 130, 426 (1966); Owens S, L.,
Bell
F. E., J. biol.
Chetr., 245, 5515 (1970): Fersht A. R., Mulvey R. S., Koch G L., Biochemistry, 14, 13 (1975).
б
) Относительно ft
ca
( и ft
ca
t/^M
для
Реакции обмена Пирофосфат^* АТР с участием
специфического субстрата.
субстрата. Связывание фенилаланина должно сопровождаться
либо вытеснением связанной воды, при котором два центра
образования
водородных связей остаются свободными, либо
деформацией связывающего кармана. Разность в энергии свя-
зывания,
равная 25,5 кДж-моль-' (6,1 ккал-моль-
1
), отражает
как
преимущества, которые дает образование водородных свя-
зей
межлу ферментом и тирозином, так и невыгодность связы-
вания
фенилаланина.

ЭНЕРГИЯ
ФЕРМЕНТ-СУБСТРАТНОГО
ВЗАИМОДЕЙСТВИЯ
285
в.
Ионные
связи
Сравнение констант связывания различных дезаминирован-
ных аминокислот и соответствующих аминокислот с аминоа-
иил-тРНК—синтетазой позволяет получить нижний предел для
значения
энергии связывания иона аммония [15—17].
Из
схем
(9.6), (9.7), (9.8) видно, что вклад —ЫНз-группы
в энергию связывания составляет около 17 кДж-моль~'
(4 ккал-моль"
1
). Возможно, это обусловлено образованием ион-
ной
связи с карбоксилат-ионом фермента.
СНз СО, СН
3
\
/ \
СНСН
по
сравнению
с
СНСН
2
СО
2
,
СН,
NH
3
+
СН
3
ДДО/,
= 18,8
к4жммь'(4,5
ккал-мшу')
(9.6)
COi
PhCH
2
CH
no
сравнению
о
PhCH
2
CH
2
CO
2
,
NH3
(9.7)
CGI
НО
(С))
СИ
2
СН
по
сравнению
сИО (СУ)
СН
2
СН
2
СО1,
(9.8)
3,
Оценка
полной
энергии
связывания
на
примере химотрипсина
Аминоацил-тРНК — синтетазы обладают исключительно вы-
сокой
специфичностью. Энергии связывания, полученные для
этих ферментов, имеют, вероятно, максимальные из
всех
прин-
ципиально возможных значений. Несколько более низкие значе-
ния
получаются в
случае
химотрипсина — фермента, обладаю-
щего широкой специфичностью.
286
ГЛАВА
9
«с*
6
5
4
3
2
1
0
-/<
-
_
-
-
-
i
/
/tAla
I
'"fHjO
-*• Н-Октанол)
2
3
I
I
Phe
/
/
Л
NLeu
•
' Wai
/
•"But
1111
-
—
-
-
8
8
4
2
0
0,5
1,0
1,5
Л
2,0
2,5
Рис.
9.2.
Соотношение
между
гидрофобностью
боковой цепи аминокис-
лоты
и
параметром
kcat/Kn
Для катализируе-
мого химотрипсином гид-
ролиза метиловых
эфи-
ров Ы-ацетил-Ь-амино-
кислот [16]. Энергия вы-
ражена
в
ккал-моль-
1
.
г
-2,0
-2,5
-3,0
\,
л-МеО
-
-
Наклон
1-OH
3
CO
N
н*
-VI
1
1 1
л-МеО
\тм-С1
\
t 1 ] 1 1 1 1 1
1
\
Рис.
9.3. Корреляция
ме-
жду константами диссо:
циации
для
замещенных
форманилидов
и
значе-
ниями
я
для распределе-
ния
между
н-октанолом
и
водой.
-0,5
0 0,5
1,0

ЭНЕРГИЯ
ФЕРМЕНТ-СУБСТРАТНОГО ВЗАИМОДЕЙСТВИЯ 287
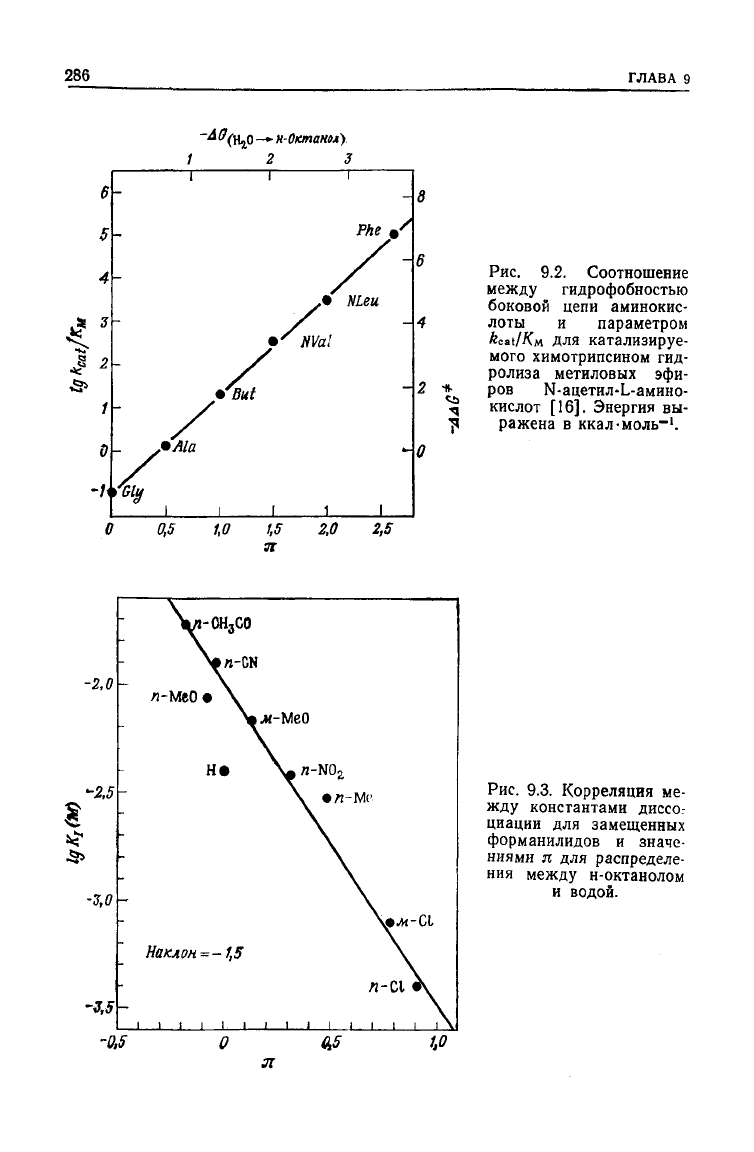
а.
Алкильные
группы
Параметр
kcat/Км.
для катализируемого химотрипсином
гидролиза серии эфиров с общей формулой R—
—CH(NHAc)CO
2
Me
(где R— неразветвленная алкильная цепь)
возрастает при увеличении гидрофобности этой цепи [18].
Уменьшение энергии активации в 2,2 раза превышает свободную
энергию переноса алкильных групп из воды в н-октанол
(рис.
9.2) [19]. По-видимому, связывающий карман в 2,2 раза
более гидрофобен, чем н-октанол.
Константы ингибирования для ряда замещенных формани-
лидов возрастают при увеличении гидрофобности. График зави-
симости логарифмов констант ингибирования от п представляет
собой прямую с наклоном —1,5 [20]. Это еще раз показывает,
что активный центр химотрипсина более гидрофобен, чем
н-октанол (рис. 9.3).
б. Ионная
связь
Каталитически активная форма химотрипсина стабилизиро-
вана ионной связью
между
а-ЫНз-группой Не-16 и —СОг-груп-
пой
Asp-194.
Эта форма находится в равновесии с
другой
фор-
мой,
в которой а-ЫНз-группа является свободной и находится в
водном окружении. Измерение констант равновесия
между
ука-
занными
формами при высоком значения рН, когда аминогруп-
па депротонирована, и при низком рН, когда она находится в
—ЫНз-форме,
показало, что энергия стабилизации активной
формы ионной связью составляет 12,1 кДж-моль-
1
(2,9 ккалХ
X моль-
1
) [21]. Эта ионная связь находится внутри белковой
глобулы,
ионные же связи на поверхности гемоглобина имеют
более низкую энергию стабилизации [22].
4. Почему ферменты более гидрофобны,
чем органические растворители
Одна из причин более высокой гидрофобности химотрипсина
по
сравнению с н-октанолом указывалась ранее. Связывающий
карман в химотрипсине сохраняется и в
отсутствие
субстрата,
в
то время как полость образуется в органическом растворителе
лишь при перенесении соединения из водной фазы. Более того, в
кармане находится примерно 16 молекул воды. Следовательно,
образование гидрофобной связи с химотрипсином эквивалентно
образованию
двух
«нормальных»
гидрофобных связей, посколь-
ку имеются две энергетически невыгодные водно-гидрофобных
поверхности раздела: одна для
субстрата
и одна для связанной
с ферментом воды.
288
ГЛАВА
9
Прочному связыванию метиленовых групп изолейцил- и ва-
лил-тРНК—синтетазами способствует еще один фактор. В том
случае, когда валин занимает центр связывания изолей-
цил-тРНК—синтетазы,
в образующемся комплексе остается не-
заполненная
полость, которая была бы занята добавочной ме-
тиленовой группой изолейцина в
случае
его присоединения к
ферменту. Ранее указывалось, что энергия дисперсионного вза-
имодействия метиленовой группы в кристаллическом углеводо-
роде составляет 8,4 кДж-моль"
1
(2 ккал-моль-
1
). Поскольку
плотность упаковки белков такая же, как и плотность упаковки
кристаллов [23], наличие полости добавляет к энергии гидро-
фобной
связи метиленовой группы еще 8,4 кДж-моль"
1
.
5. Заключение
Константа диссоциации фермент-субстратного комплекса от-
ражает термодинамическую стабильность субстрата, связанного
с ферментом, по
отношению
к стабильности субстрата в свобод-
ном
состоянии в растворе. Она зависит от соотношения
между
прочностью водородных связей в фермент-субстратном комп-
лексе и прочностью водородных связей, образуемых каждым иа
Таблица
9.7
Энергии
связывания
для
различных
групп
субстратов
Группа
—СНг—
НО—
(две
водородные
связи)
—NH+-
•
-~О
2
С—
—СН
2
—
—СН
2
—СН
2
—
—(СН
2
)
3
—
—(СН„)
4
—
PhCH—
б)
Фермент
Аминоацил-тРНК—
синтетаза
а
'
»
»
Химотрипсин
»
Вклад
в
CD
общую
энергию
язывания
кДж-моль~'
15
25
17
8
16
23
29
34
ккал-моль
'
3,5
в
4
2
3,8
5,6
6,8
8,2
Приведена максимальная величина.
Относительно атома водорода.

ЭНЕРГИЯ
ФЕРМЕНТ-СУБСТРАТНОГО ВЗАИМОДЕЙСТВИЯ 289
компонентов
с молекулами воды, от соотношения
между
ста-
бильностью солевых мостиков в комплексе и прочностью соль-
ватной оболочки отдельных ионов, от соотношения
между
энер-
гией дисперсионного взаимодействия фермента с субстратом и
энергией
взаимодействия компонентов комплекса с водой, а
также от гидрофобного связывания. Эти различия в энергии
(табл. 9.7), если их просуммировать по всей молекуле,
могут
оказаться весьма существенными. Интересно, что образование
водородных, ионных и гидрофобных связей сопровождается
увеличением энтропии из-за высвобождения связанных с белком
молекул воды.
Абсолютная
энергия взаимодействия
между
ферментом и
субстратом зависит от дисперсионных сил и абсолютной энергии
водородных и ионных связей. Наиболее прочными из этих связей
являются водородные и ионные. Поскольку они, кроме того,
стабилизируют образование заряда в переходном состоянии, их
роль в катализе особенно велика.
В. Энтропия и связывание [24]
В водном растворе спаривание одиночных комплементарных
оснований
(например, А и U) практически не происходит из-за
связывания
этих оснований с молекулами воды. Однако триплет
оснований
прочно связывается с комплементарным антикодоном
тРНК-
Триплет UUC присоединяется к
тРНК
РЬе
с константой
связывания
2-10
3
М-'
[25,26]. Две молекулы
тРНК
с комплемен-
тарными антикодонами связываются еще более прочно: кон-
станта связывания
между
тРНК.
РЬе
и тРНК?
1
"равна
2-10
7
М-
1
[27].
Обусловлено это фактором энтропийной природы. При
связывании
одиночных оснований А и U энергия системы
уменьшается за счет комплементарного спаривания и увеличи-
вается за счет разрыва водородных связей
между
основаниями
и
молекулами воды. Энтропия системы, с одной стороны, умень-
шается, поскольку эти основания теряют часть поступательных
и
вращательных степеней свободы, а с
другой
стороны, увели-
чивается за счет высвобождения связанных молекул воды. При
связывании
комплементарной пары триплетов высвобождается в
три раза больше молекул воды, прежде связанных водородными
связями,
однако энтропия системы все же уменьшается за счет
потери одного набора поступательных и вращательных степеней
свободы. Эта ситуация очень напоминает рассмотренный нами
ранее случай с внутримолекулярной и аналогичной ей межмоле-
кулярной
реакциями (гл. 2, разд. Б.4. г). Из всего сказанного
можно сделать вывод, что, хотя отдельные водородные связи в
растворе слабы, если их число достаточно велико, связывание
может быть очень прочным.

290
ГЛАВА
9
Аналогичным образом связывание димера X—Y ферментом
может быть значительно более прочным, чем связывание моно-
меров X и Y, поскольку димер теряет только один набор
посту-
пательной и вращательной степеней свободы.
Это явление давно известно в неорганической химии под
названием
хелатного
эффекта.
Значение его можно проиллюст-
рировать на примере, взятом из этой области, когда несколько
или
все шесть молекул воды, связанные координационными
связями
с ионом
Ni
2+
,
замещаются аммиаком и полиаминами.
Из
табл. 9.8 видно, что по мере увеличения числа аминогрупп
происходит огромное увеличение констант связывания лигандов.
Таблица
9.8
Хелатный
эффект при
л,„„
Шз
H
2
N
(CH
2
)
2
NH
2
H
2
N
(CH
2
)
2
NH
(CH
2
)
2
NH,
H
2
N
(CH
2
)
2
NH (CH
2
)
2
NH
(CH
2
)
2
NH
2
(H
2
N
(CH
2
)
2
NH
(CH
2
)
2
)
2
NH
связывании
Ni
2+
с
Ki
468
2-10
7
6-
10
10
2-10
14
3-10
17
Сонстанты
K
2
132
1-
10
6
1
- 10
8
аминами
а)
ассоциации,
M
—1
Кз
41
2-10
4
K<
12
#5
4
0,8
a
>
The
Chemical
Society
(London)
Special
Publications
17 and 25
(1964,
1971).
Г. Белок-белковое взаимодействие
Соприкасающиеся
поверхности в олигомерных белках (на-
пример,
в гемоглобине), а также в комплексах белок — белок
(например,
в комплексе трипсина с трипсиновым ингибитором),
хорошо подогнаны и прилегают
друг
к
другу
достаточно плотно.
Все водородные и ионные связи спарены. Другими словами,
поверхности комплементарны
друг
другу.
По-видимому, на этом
основано
взаимное распознавание белков.
Хотя
мнения относительно вклада энергии водородных и
ионных
связей в
суммарную
энергию стабилизации оелок-бел-
ковых комплексов расходятся и высказывалось предположение,
что многие константы ассоциации всецело определяются гидро-
фобным
связыванием, нет никакого сомнения, что водородным
связям
и электростатическим взаимодействиям принадлежит
важная роль в специфичности белковых взаимодействий [28—
30].
Даже
оставив в стороне вопрос о величине положительного
вклада водородных и ионных связей в энергию стабилизации
