Фёршт Э. Структура и механизм действия ферментов
Подождите немного. Документ загружается.

ХИМИЧЕСКИЙ
КАТАЛИЗ
91
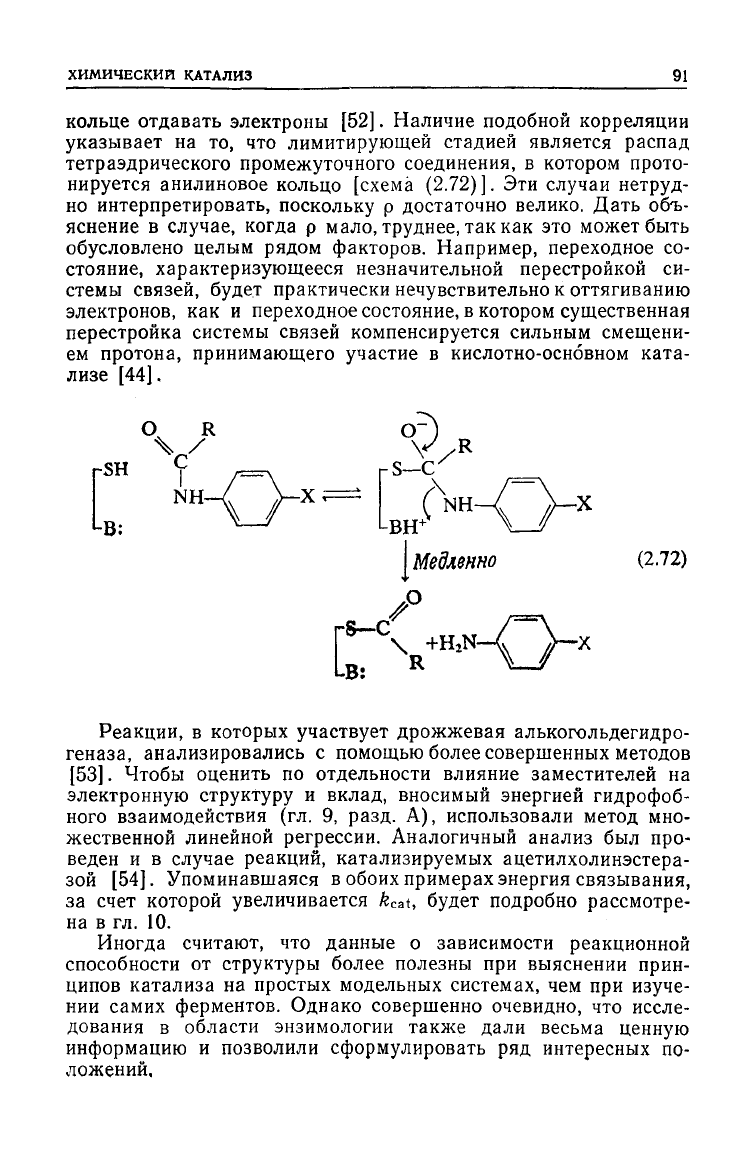
кольце отдавать электроны [52]. Наличие подобной корреляции
указывает на то, что лимитирующей стадией является распад
тетраэдрического промежуточного соединения, в котором прото-
нируется анилиновое кольцо [схема (2.72)]. Эти случаи нетруд-
но
интерпретировать, поскольку р достаточно велико. Дать объ-
яснение
в случае, когда р мало, труднее, так как это может быть
обусловлено целым рядом факторов. Например, переходное со-
стояние,
характеризующееся незначительной перестройкой си-
стемы связей,
будет
практически нечувствительно к оттягиванию
электронов, как и переходное состояние, в котором существенная
перестройка системы связей компенсируется сильным смещени-
ем протона, принимающего участие в кислотно-основном ката-
лизе [44].
rS—С
(NH
L
BH
+
Медленно
(2.72)
Реакции,
в которых
участвует
дрожжевая алькогольдегидро-
геназа, анализировались с помощью более совершенных методов
[53]. Чтобы оценить по отдельности влияние заместителей на
электронную
структуру
и вклад, вносимый энергией гидрофоб-
ного взаимодействия (гл. 9, разд. А), использовали метод мно-
жественной линейной регрессии. Аналогичный анализ был про-
веден и в
случае
реакций, катализируемых ацетилхолинэстера-
зой [54]. Упоминавшаяся в обоих примерах энергия связывания,
за счет которой увеличивается
k
ca
t,
будет
подробно рассмотре-
на
в гл. 10.
Иногда считают, что данные о зависимости реакционной
способности от структуры более полезны при выяснении
прин-
ципов
катализа на простых модельных системах, чем при изуче-
нии
самих ферментов. Однако совершенно очевидно, что иссле-
дования в области энзимологии также дали весьма ценную
информацию и позволили сформулировать ряд интересных по-
ложений.

92
ГЛАВА
2
Д.
Принцип
детального
равновесия
Принцип
детального равновесия используется в термодина-
мике для того, чтобы установить ограничения, налагаемые на
вероятность переходов
между
различными квантовыми или
другими состояниями. Этот принцип применим также и к хими-
ческим ферментативным реакциям, если рассматривать каждое
промежуточное соединение или конформацию как «состояние».
Принцип
детального равновесия
требует,
чтобы переходы
между
двумя любыми состояниями в равновесии происходили с равной
частотой в прямом и обратном направлениях [55]. Это означает,
что процесс А-»-В точно уравновешен процессом В-»-А и, таким
образом, равновесие не может поддерживаться за счет цикли-
ческого процесса, при котором в одном направлении идет реак-
ция
А
-*-
В, а в противоположном В
->•
С -> А. В
другой
форму-
лировке, более удобной для кинетических исследований, этот
принцип
гласит, что в равновесии прямая реакция протекает по
пути, в точности противоположному пути протекания обратной
реакции.
Другими словами, переходные состояния для прямой и
обратной реакций идентичны. Это справедливо также для
(нецепных) реакций в стационарном состоянии [56].
Принцип
детального равновесия особенно полезен при выяс-
нении
природы переходного состояния прямой реакции исходя
из
данных о переходном состоянии для обратной реакции. На-
пример, поскольку атака уксусной кислоты этанолом при низких
рН
осуществляется по механизму общего основного катализа,
обратная реакция должна протекать с отщеплением этоксид-
иона
от тетраэдрического промежуточного соединения с по-
мощью общего кислотного катализа [уравнение (2.73)].
9°
Р°
СНз-С
—
СН
3
-С
(2
.
73
)
Et-oTbH
Et-сЬ
°
Н
Jrl
Н
Общий
_
общий
основный
кислотный
катализ катализ
Аналогичным образом, так как гс-нитрофенол ионизируется
при
рН > 7, атака n-нитрофенолом карбонильного соединения
не может ускоряться с помощью общего основного катализа:
«-нитрофенолят-ион, несущий отрицательный заряд, является
более сильным нуклеофилом и присутствует в более высокой

ХИМИЧЕСКИЙ
КАТАЛИЗ
93
концентрации,
чем
n-нитрофенол. Следовательно, этот ион непо-
средственно атакует карбонильное соединение
и,
согласно прин-
ципу детального равновесия, отщепление га-нитрофенолят-иона
от тетраэдрического промежуточного соединения является нека-
тализируемым процессом [уравнение (2.74)].
(2.74)
НекатаШируемая
Некатализируемое
атака
отщепление
Аналогичные соображения используются
и для
того, чтобы
показать,
что
атака эфиров тиолами осуществляется без помощи
общего основного катализа,
т. е.
имеет место прямая атака
тио-
лят-иона
даже
при рН
меньшем,
чем р/С
а
тиола
на 10
единиц,
когда доля молекул, находящихся
в
ионизированном состоянии,
равна всего
10~
10
[44].
Прежде
чем
делать вывод
о том,
каков механизм реакции,
необходимо удостовериться,
что он
удовлетворяет принципу
де-
тального равновесия. Время
от
времени появляются сообщения,
в которых этот принцип при обсуждении механизма нарушается,
поскольку
на
предлагаемых
схемах
обратная реакция идет
по
иному пути,
чем
прямая
при тех же
условиях проведения экспе-
римента.
Е. Принцип кинетической эквивалентности
При
анализе рН-зависимости скорости химических реакций
возникает неопределенность,
от
которой нельзя избавиться
и
которая известна
как принцип
кинетической
эквивалентности.
Когда
из
уравнения скорости реакции
следует,
например,
что
скорость реакции пропорциональна концентрации кислоты
НА,
это означает,
что
весь заряд ионов,
на
которые диссоциирует
кислота, присущ
и
переходному состоянию,
т. е. либо это
недис-
социированная кислота,
либо два
иона,
Н+ и А~.
Аналогичным
образом, если скорость реакции пропорциональна концентрации
А~,
то
переходное состояние содержит либо
А~, либо НА и
ОН~.
Формально этот принцип можно проиллюстрировать следую-
щим образом.
Преобразовав уравнение
для
ионизации кислоты, получаем
tf
a
.
(2.75)

94
ГЛАВА
2
Концентрация
кислоты связана с концентрацией сопряженного
ей основания и протона. В связи с этим ответить на вопрос, что
представляет собой переходное состояние реакции, зависящей от
концентрации
НА,— недиссоциированную кислоту или комбина-
цию протона с сопряженным основанием,— невозможно. Анало-
гичным образом, поскольку концентрация основной формы свя-
зана с концентрацией гидроксил-иона и кислоты с помощью
уравнения
[A-] [HA][OH-]K
a
/K
w
(2.76)
(где /Cw — ионное произведение воды), отличить реакцию, иду-
щую с образованием А~, от реакции с образованием НА и ОН~,
исходя из данных о концентрационной зависимости скорости
реакции,
невозможно. В этом состоит принцип кинетической эк-
вивалентности. Например,
двум
приведенным ниже механизмам
обобщенного основного катализа
соответствуют
одинаковые
уравнения скорости реакции:
О
О
с
сн
3
с
Продукты
(2.77)
СНзС
Продукты
OEt
Для реакции
(2.77)
Для реакции
(2.78)
о
= ЫА"][Эфир].
о
= £2 [НА] [ОН"] [Эфир]
=
*2[А-][Эфир].
(2.78)
(2.79)
(2.80)
(2.81)
(2.82)
Уравнения
(2.79)
и
(2.82)
эквивалентны, и эти два механиз-
ма невозможно различить, анализируя концентрационную или
рН-зависимости скорости реакции. Данные механизмы нельзя
различить и по знаку коэффициента Брёнстеда р при варьиро-
вании
р/(а катализатора. Интуитивно это ясно, поскольку обе
реакции
сопровождаются делокализацией отрицательного заря-
да в переходном состоянии, но данный вывод можно обосновать
и
математически. Механизму
(2.77)
соответствует
положитель-

ХИМИЧЕСКИЙ
КАТАЛИЗ 95
ное значение коэффициента р, поскольку, чем сильнее основание,
тем эффективнее
будет
катализ. Механизму
(2.78)
также со-
ответствует
положительное значение р, так как, хотя общему
кислотному компоненту соответствует отрицательное значение (5,
наличие члена 1//С
а
в уравнении
(2.81)
означает, что к \gv
следует
прибавить слагаемое
1-рДа,
с избытком компенсирую-
щее тот небольшой по значению отрицательный коэффициент р,
который соответствует химической стадии.
Кинетически
эквивалентные механизмы можно различить в
том единственном случае, когда один из них включает «невоз-
можную»
стадию, например когда константа скорости реакции
второго порядка превышает то предельное значение, которое
характерно для реакции, лимитируемой диффузией, либо когда
в
результате
расчета получается отрицательная энергия актива-
ции
[скажем, в
случае
гидролиза аспирина; схема
(2.78)]
[12].
Ж.
Кинетические изотопные эффекты [57]
Иногда информацию о глубине протекания и природе стадий
образования и разрыва связей в переходном состоянии удается
получить, изучая влияние изотопного замещения на скорости
реакций.
Эти эффекты можно разделить на два класса в зави*
симости от положения замещенных атомов.
1. Первичные изотопные эффекты
Первичный изотопный эффект наблюдается при расщеплении
связи у замещенного атома. Например, часто связь С—О рас-
щепляется в несколько раз медленнее связи С—Н. Менее за-
метное уменьшение скорости (на несколько процентов) обнару-
живается иногда при замещении
14
N на
15
N или
16
О на
18
О.
Степень изменения скорости позволяет судить о степени разры-
ва связи в переходном состоянии.
Для анализа изотопных эффектов проще всего сопоставить
ферментативную реакцию с простой модельной системой, хими-
ческие свойства которой изучены другими методами. В этом
разделе нас интересуют в первую очередь эмпирические резуль-
таты модельных экспериментов, однако рассмотрение теорети-
ческих основ этих эффектов (даже в упрощенном виде) весьма
полезно для понимания их природы. На рис. 2.8 представлена
характерная зависимость энергии связи
между
атомами углеро-
да и водорода от расстояния
между
этими атомами. Точно такая
же зависимость имеет место и для атомов
углерода
и дейтерия,
поскольку форма кривой определяется орбитальными электро-
нами.
Согласно квантовой теории, самый низкий энергетический
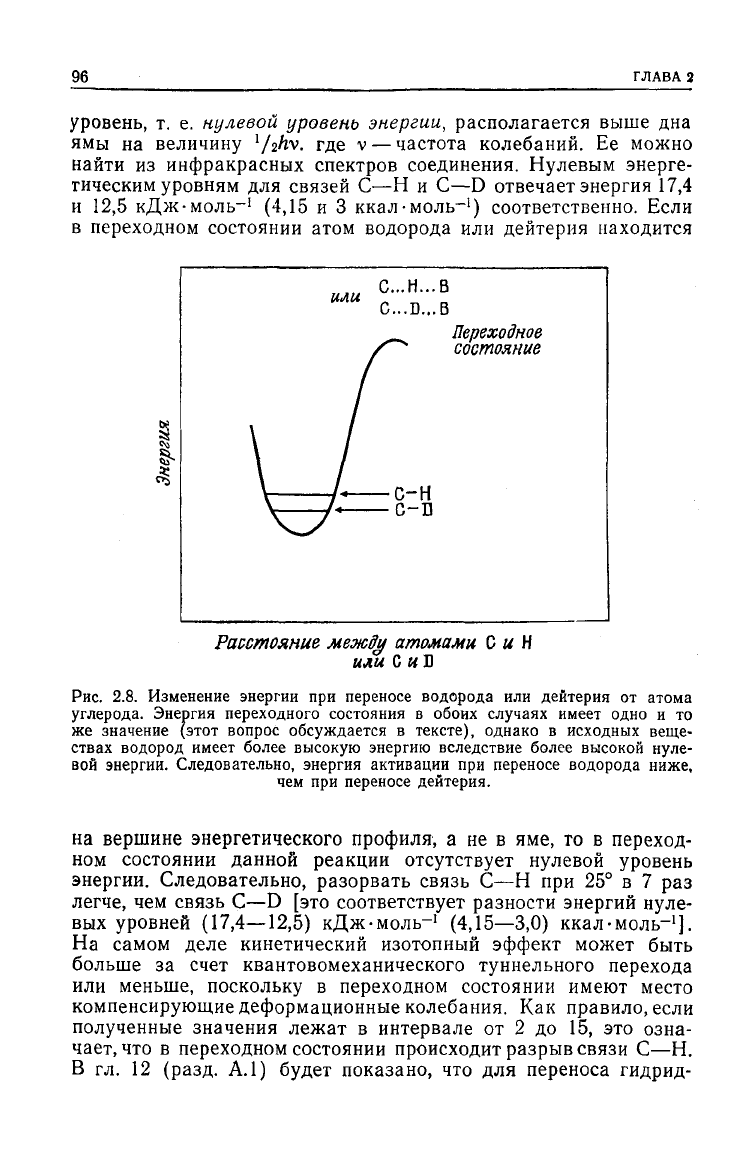
96
ГЛАВА
2
уровень,
т. е. нулевой уровень энергии,
располагается выше
дна
ямы
на
величину
'/г^. где v —
частота колебаний.
Ее
можно
найти
из
инфракрасных спектров соединения. Нулевым энерге-
тическим уровням
для
связей С-—Н
и С—D
отвечает энергия
17,4
и
12,5
кДж-моль-
1
(4,15 и 3
ккал-моль-
1
) соответственно. Если
в переходном состоянии атом водорода
или
дейтерия находится
или
С...Н...В
C...D...B
Переходное
состояние
Расстояние
между атомами, С
и
Н
или
С
и
D
Рис.
2.8.
Изменение
энергии
при
переносе водорода
или
дейтерия
от
атома
углерода. Энергия переходного состояния
в
обоих случаях имеет одно
и то
же
значение (этот вопрос обсуждается
в
тексте), однако
в
исходных веще-
ствах водород имеет более высокую энергию вследствие более высокой нуле-
вой
энергии.
Следовательно,
энергия
активации
при
переносе водорода
ниже,
чем
при переносе дейтерия.
на
вершине энергетического профиля,
а не в яме, то в
переход-
ном
состоянии данной реакции
отсутствует
нулевой уровень
энергии.
Следовательно, разорвать связь
С—Н при 25° в 7 раз
легче,
чем
связь С—D
[это
соответствует
разности энергий нуле-
вых уровней
(17,4—12,5)
кДж-моль-
1
(4,15—3,0)
ккал-моль-
1
].
На
самом
деле
кинетический изотопный эффект может быть
больше
за
счет квантовомеханического туннельного перехода
или меньше, поскольку
в
переходном состоянии имеют место
компенсирующие деформационные колебания.
Как
правило, если
полученные значения лежат
в
интервале
от 2 до 15, это
озна-
чает,
что в
переходном состоянии происходит разрыв связи С—Н.
В
гл. 12
(разд.
АЛ)
будет
показано,
что для
переноса гидрид-

ХИМИЧЕСКИЙ
КАТАЛИЗ
97
иона
между
субстратом
и
NAD+
в
реакциях, катализируемых
алкогольдегидрогеназой, отношение
кн/ko
равно
3—5.
Кинетические изотопные эффекты
с
применением кислорода
и
азота использовались
для
выяснения природы лимитирующей
стадии
в
реакциях, катализируемых химотрипсином
и
папаином.
Для катализируемого
щелочью
или
общим основанием гидроли-
за метилформиата [НС(=О)
16
-
18
ОСН
3
]
в
модельной системе
от-
ношение k
l6O
/k
lso
=
1,01. В
случае
гидразинолиза,
где
лимити-
рующей
стадией является распад тетраэдрического
промежу-
точного соединения, величина изотопного эффекта равна
1,062.
Н—С
\
ОМе
JO
Н—С
\
H,NNH,
ОМе
НО
ОМе
н-с
+
/
\ .-
H
2
NNH
2
ОМе
(2.83)
ПС
(2.84)
ПС
Эти
величины можно сравнить
с
величиной
1,052 для
случая
отсутствия нулевого энергетического уровня
в
переходном
со-
стоянии
[58].
Кинетические изотопные эффекты, обнаруженные
при
гидролизе эфирных субстратов, катализируемом химотрип-
сином,
близки
к
эффектам, характерным
для
гидролиза метил-
формиата,
катализируемого общим основанием
[59]. Это
озна-
чает,
что
лимитирующей стадией является, по-видимому, обра-
зование
тетраэдрического промежуточного соединения. Катали-
зируемый папаином гидролиз бензоил-Ь-аргининамида характе-
ризуется кинетическим изотопным эффектом (
14
N/
15
N) около
1,024,
что
близко
к
верхнему пределу (1,01
—1,025)
для
расщеп-
ления
связи
С—N [60],
найденному
в
модельных опытах. Этот
факт
означает,
что в
переходном состоянии связь
С—N в
значи-
тельной
мере расщеплена
и
скорее всего объясняется
тем, что
лимитирующей стадией является распад тетраэдрического
про-
межуточного соединения
(гл. 12,
разд.
Б.2).
Кинетический
изотопный эффект
для
атомов азота (1,006—
1,01),
наблюдаемый
при
катализируемом химотрипсином гидро-
лизе
амида ацилтриптофана, авторы работы
[61]
рассматривали
как
доказательство того,
что в
лимитирующую стадию вносит
вклад
как
образование,
так и
разрушение тетраэдрического
промежуточного соединения.
98
ГЛАВА
2
2. Вторичные изотопные эффекты
Вторичные изотопные эффекты наблюдаются при расщепле-
нии
связи
между
атомами,
соседними
с замещенным на
другой
изотоп атомом. Эти эффекты обусловлены изменением гибриди-
зации
изотопа, а не расщеплением связи. По-видимому, наибо-
лее известным примером вторичного изотопного эффекта в фер-
ментативных реакциях является замещение водорода на дейте-
рий
или тритий при
С-1-атоме
субстратов
лизоцима (гл. 12,
разд. Д). В
ходе
этой реакции образуется карбоний-ион, а гиб-
ридизация атома С-1 меняется от sp
3
к sp
2
. Для модельных ре-
акций
k
H
/kD= 1,14, что близко к величине 1,11 для фермента-
тивной реакции [62, 63]
>
/С
+
—D
(2.85)
/ \
R D
3. Изотопные эффекты, обусловленные растворителем
Изотопные эффекты, обусловленные растворителем, прояв-
ляются при сравнении скоростей реакций в Н
2
О и D
2
O. Обычно
эти
эффекты связаны с переносом протона
между
электроотри-
цательными атомами,
сопровождающим
образование и разрыв
связи
между
более тяжелыми атомами в таких реакциях, как
(2.86)
Изотопные эффекты, обусловленные растворителем, по свое-
му происхождению отличаются от изотопных эффектов, сопро-
вождающих расщепление связи С—Н, и их природа до конца не
ясна.
Перенос протона происходит гораздо быстрее, чем образо-
вание и разрыв связи, и в
ходе
реакции протон, вероятно, нахо-
дится на дне потенциальной ямы. Исчезновение нулевого энер-

ХИМИЧЕСКИЙ
КАТАЛИЗ 99
гетического уровня (как это имеет место при переносе протона
от атома
углерода,
в котором сам разрыв связи С—Н протекает
медленно) в этом
случае
не происходит. Определенный вклад в
экспериментально
наблюдаемый изотопный эффект, обуслов-
ленный
растворителем,
могут
вносить сольватация реагентов и
вторичные изотопные эффекты, вызванные заменой в реагентах
водорода на дейтерий.
Рассматриваемые изотопные эффекты являются весьма цен-
ным
инструментом исследования простых химических реакций,
хотя величины этих эффектов
могут
сильно варьировать. Напри-
мер,
установлено, что для реакций типа (2.86), катализируемых
по
механизму общего основного катализа, отношение k
H
/k
D
рав-
но
~2,
тогда
как для нуклеофильной атаки эфира оно близко
к
1. Изотопные эффекты в ферментативных реакциях
труднее
интерпретировать, поскольку в молекуле белка слишком много
протонов,
которые способны обмениваться на атомы дейтерия
[64].
Кроме того, при замене растворителя может слегка изме-
ниться
структура
белка.
3. Стереохимия [65]
Представление о том, что ферменты обладают специфично-
стью только к одному из
двух
оптически активных изомеров
субстрата, не менее старо, чем сама стереохимия. Пастер, гени-
альный химик и биохимик, сообщил в 1858 г., что он обнаружил
дрожжи, сбраживающие правовращающую винную кислоту и не
способные сбраживать левовращающую. Ранние исследования
протеаз показали, что гидролизуются производные только L-, но
не
D-аминокислот.
со
2
н
со
2
н
С
С
(2.87)
H
2
N'
^ СНз Н
3
С V NH
2
v-аланин
тз-аланин
Соединение
является оптически активным, если оно не может
быть совмещено со своим зеркальным отображением, т. е. со
своим энантиомером. Такое соединение поворачивает плоскость
поляризации
плоскополяризованного света. Чтобы проверить,
совмещается ли данное соединение со своим зеркальным ото-
бражением, надо просто установить, обладает ли оно плоско-
стью или центром симметрии. Наличие подобной симметрии оз-

100
ГЛАВА
2
начает,
что
данное соединение оптически неактивно,
и
наоборот.
Как
и в
случае
многих органических молекул, представляющих
биологический интерес, оптическая активность аминокислот
обусловлена присутствием асимметричного атома
углерода
с
четырьмя различными заместителями. Сейчас такой
тип
угле-
родного атома носит название
хиральный
центр. Углеродный
атом
с
двумя одинаковыми заместителями (CR
2
R'R") называ-
ется
прохиральным.
Хотя соединение такого типа
и не
обладает
оптической активностью (поскольку атом
углерода
связан
с
двумя одинаковыми группами и, следовательно, имеет плоскость
симметрии),
оно
может стать таковым
при
замещении одной
из
R-групп
другой
группой (отличной
от R' и R").
Лет
40—50
назад отмечалось,
что для
распознавания
фер-
ментом хирального атома
углерода
по
крайней мере
три
груп-
пы
из
числа окружающих этот атом групп должны связаться
с ферментом (теория трехточечного присоединения)
[66].
Если
фермент связывается только
с
двумя группами,
то две
другие
можно поменять местами,
не
повлияв
на
связывание
[схема 2.88)].
(2.88)
Причина
стереоспецифичности протеаз (ферментов,
на
которых
были выполнены ранние стереохимические эксперименты)
сразу
же
становится понятной
при
анализе
их
кристалличе-
ской
структуры
(гл. 1 и 12).
Производные D-аминокислот
от-
личаются
от
производных L-аминокислот
тем, что
Н-атом
и
боковая
цепь, присоединенные
к
хиральному атому
углерода,
поменялись
в них
местами. Связывание D-производных невоз-
можно из-за стерических затруднений
при
контактировании
фермента
и
боковой цепи аминокислоты, место которой
в
L-производных обычно занимает Н-атом.
О
(2.89)
