Эйхгорн Г. (ред.) Неорганическая биохимия. Том 1
Подождите немного. Документ загружается.


Структура и стереохимия координационных соединений.
63
5.1. Конфигурационные изомеры
Возможны два .класса конфигурационных изомеров — диасте-
юмеры и оптические изомеры.. Диастереомеры имеют различные
язичеекие и химические свойства и, по крайней мере теоретиче-
:и, могут быть разделены путем фракционированной кристалли-
1ции или хроматографии или обнаружены в смеси физическими
етодами (например, спектроскопия в ультрафиолетовой или ви-
1мой области, ЯМР на
1
H,
19
F,
13
C, рентгеноэлектронная спектро-
сопия, электронно-эмиссионная спектроскопия). Они представля-
т различные геометрические формы одной и той же молекулы
могут существовать в виде нескольких изомеров. Оптические
зомеры отличаются только тем, что они являются несовмещае-
ыми зеркальными изображениями одной и той же молекулы; их
редельное число равно двум. Обычно их называют энантиомера-
и или энантиомерными формами, а иногда катоптромерами.
5.1.1. Диастереомеры
а) Геометрические изомеры. Геометрическая изомерия являет-
я следствием различного пространственного распределения донор-
ых атомов или хелатных колец вокруг центрального атома ме-
алла. Ее часто обнаруживают в квадратно-плоскостных или ок-
аэдрических комплексах, но она возможна и для других типов
юмплексов. Классические примеры представляют квадратно-
[лоскостные комплексы Pt(II), Pd(II) (LXI и LXII) и октаэдри-
Cl-
-NH
3
;pd-
H
3
N- -Cl
H
3
N-
-Cl
,Pd
H
3
N
-Cl
LXI, транс ( D
2h
)
LXII.nuc (C
2il
)
Cl
H
3
N-4 NH
3
/ \
/ ,Со' /
H
3
N L--NH
3
NH
3
H
3
N — -f NH
3
/ ,Со' /
H
3
N ]-- — Cl
Cl
IW, транс (D
4h
)
Cl
LXIV, цис (C
2u
)
ческие комплексы Cr(III) и Co(III) (LXIII и LXIV). Эти метал-
лы, так же как Ru(II), Rh(III), Cu(II), Ni(II), имеют много гео-
64
Глава 1
метрических изомеров различной степени сложности. Эти изо-ме]
обычно можно различить путем изучения их спектров (см. выш
и разделить химическими методами. В качестве других пример-
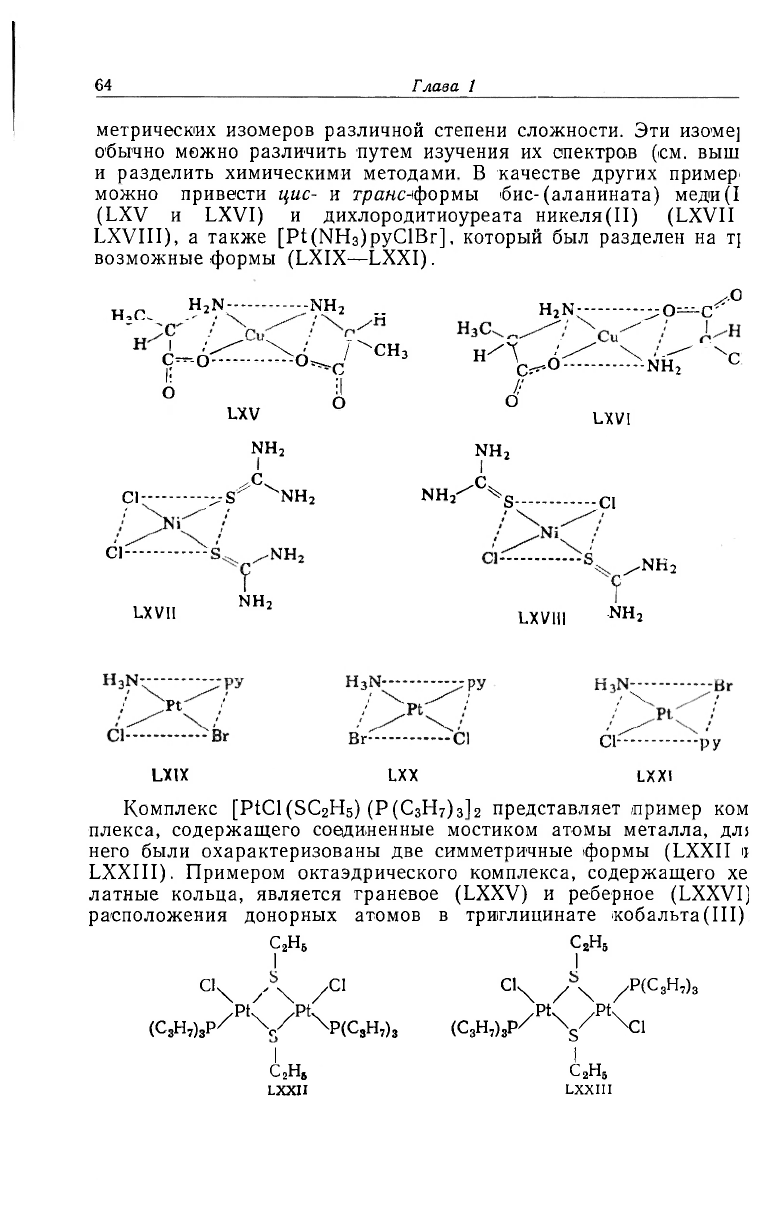
можно привести цис- и транс-формы бис-(аланината) меди(1
(LXV и LXVI) и дихлородитиоуреата никеля(II) (LXVII
LXVIII), а также [Pt(NH
3
)pyClBr], который был разделен на т{
возможные формы (LXIX—LXXI).
H
г
H
2
N-- -NH
2
H
2
N -^о—С^'
0
K--V
3 Н
V-O^--NbC
с
о S i
LXV LXVI
NH
2
NH
2
S-
c
^ /C
v
Cl-- -->-S' NH
2
NH
2
^ ^
s С1
01
/NH
2
LXVII
N
"
2
UXV1
„ NH
2
LXlX LXX LXXI
Комплекс [PtCl(SC
2
H
5
) (P(C
3
H
7
)
3
J
2
представляет пример ком
плекса, содержащего соединенные мостиком атомы металла, дл!
него были охарактеризованы две симметричные формы (LXXII а
LXXIII). Примером октаэдрического комплекса, содержащего хе
латные кольца, является граневое (LXXV) и реберное (LXXVI]
расположения донорных атомов в триглицинате кобальта(III)
C
2
H
6
C
2
H
5
I I
Cl
4
• ч^ /Cl Ci
x
^
х
/P(C
3
H
7
)
3
/Pt
4
/Pt
x
/Pt
4
/Pt
4
(C
3
H
7
)
3
P/ \/
x
P(C
3
H
7
)
3
(C
3
H
7
)
3
P/ \/
4
Cl
I I
C
2
H
5
C
2
H
5
LXXII LXXIII
Структура и стереохимия координационных соединений.
65
C
2
H
6
Cl
\ /\ ,
Pt
4
,Pt,
/P(C
3
H
7
)
3
Cl/
4
Z
x
P(C
3
H
7
)
3
C
2
H
b
LXXIV
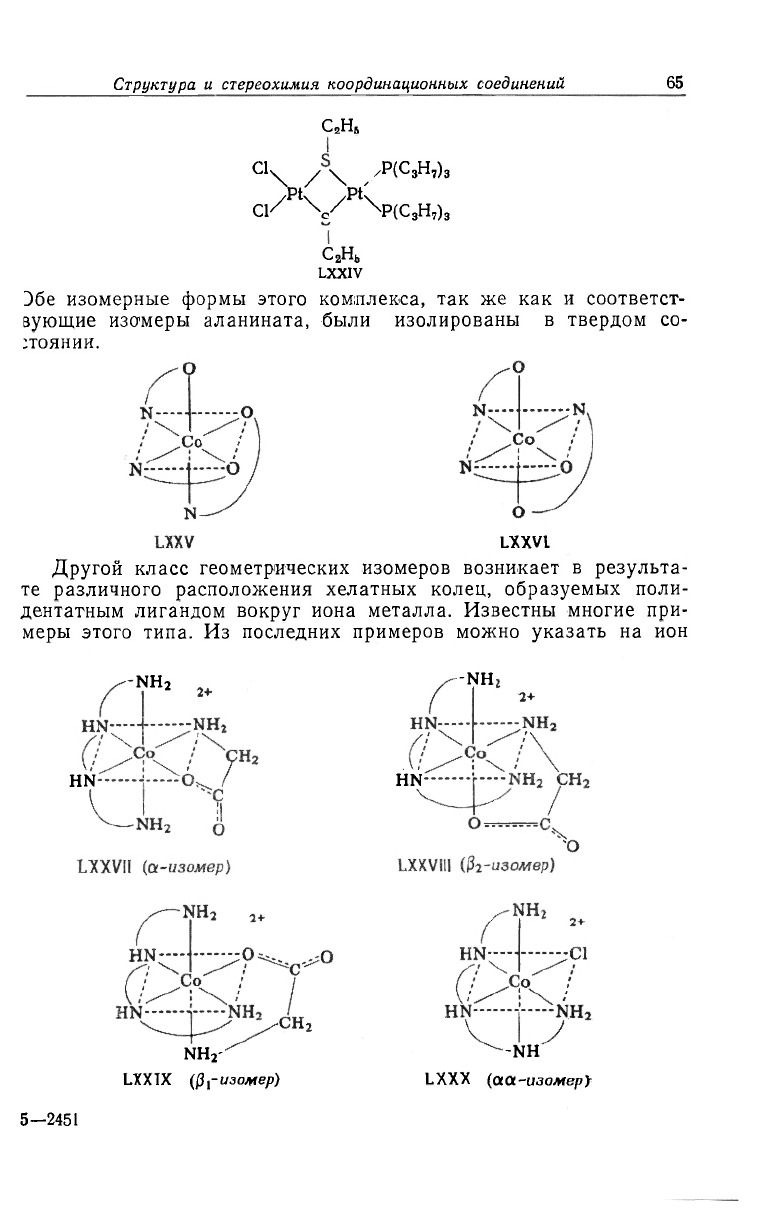
D6e изомерные формы этого комплекса, так же как и соответст-
вующие изомеры аланината, были изолированы в твердом со-
стоянии.
LXXVl
Другой класс геометрических изомеров возникает в результа-
те различного расположения хелатных колец, образуемых поли-
дентатным лигандом вокруг иона металла. Известны многие при-
меры этого типа. Из последних примеров можно указать на ион
-NH
2
HN
-NH
NH
2
-
LXXIX Ц}
г
изомер)
HN
-NH
LXXX (аа-изомерУ
5—2451
66
i лава 2
NHj
NH
1
LXXXI (аР-изомер)
MU
LXXXIl ф-транс-изомер)
HN
NH
2
^
LXXX111 ((3/3-ИЗОМЕР)
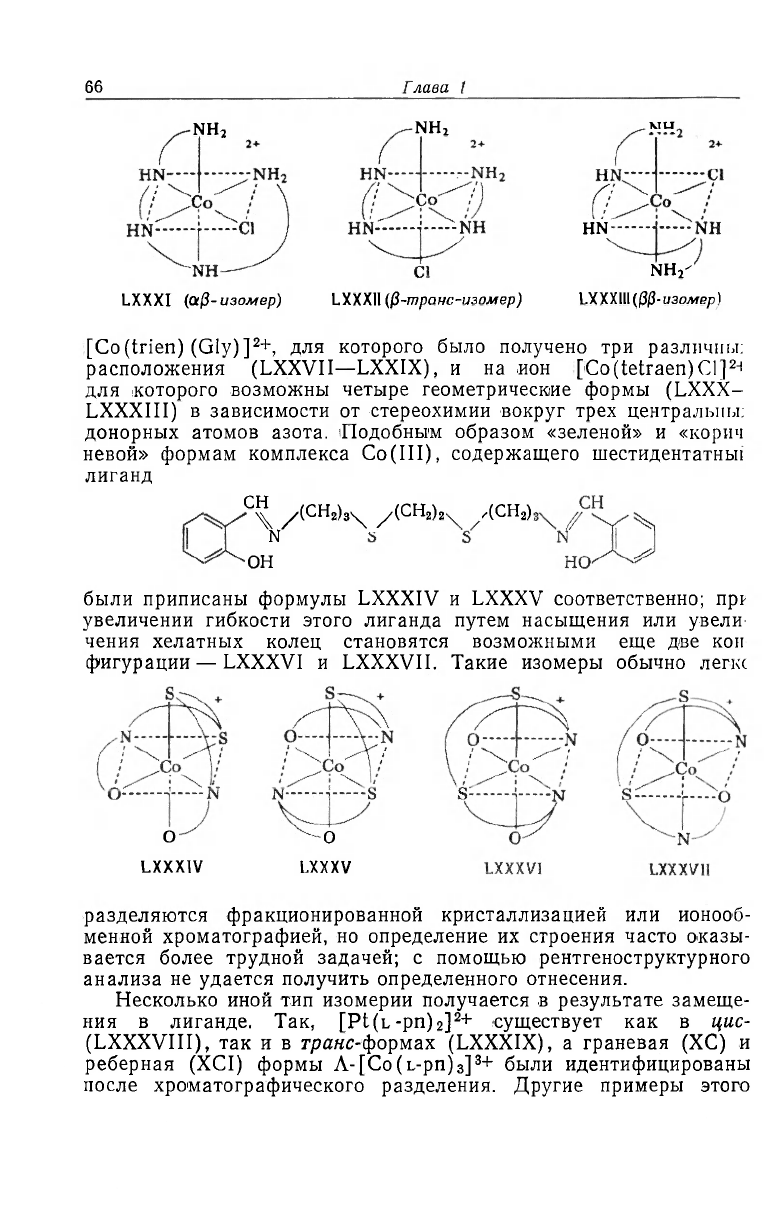
[Со(trien) (Gly)]
2
+, для которого было получено три различны:
расположения (LXXVII—LXXIX), и на ион [Co(tetraen)Cl]
24
для которого возможны четыре геометрические формы (LXXX-
LXXXIII) в зависимости от стереохимии вокруг трех центральны;
донорных атомов азота. Подобным образом «зеленой» и «корич
невой» формам комплекса Co(III), содержащего шестидентатньп
лиганд
CH
V
он
(CH
2
)
8
V
4
/(CH
2
)
2
,(CH
2
)
были приписаны формулы LXXXIV и LXXXV соответственно; прг
увеличении гибкости этого лиганда путем насыщения или увели-
чения хелатных колец становятся возможными еще две кои
фигурации — LXXXVI и LXXXVII. Такие изомеры обычно легкс
о
LXXXlV
О
LXXXV
разделяются фракционированной кристаллизацией или ионооб-
менной хроматографией, но определение их строения часто оказы-
вается более трудной задачей; с помощью рентгеноструктурного
анализа не удается получить определенного отнесения.
Несколько иной тип изомерии получается в результате замеще-
ния в лиганде. Так, [Pt (ь -рп)
2
]
2
+ существует как в цис-
(LXXXVIII), так и в гранс-формах (LXXXIX), а граневая (XC) и
реберная (XCI) формы А-[Со(ь-рп)
3
]
3
+ были идентифицированы
после хроматографичеекого разделения. Другие примеры этого

Структура и стереохимия координационных соединений. 67
па представляют различные хелаты несимметрично замещенно-
адетилацетона, например [Со (tfa)
3
] (tfa = трифторацетилаце-
„ ;Г
7*
;N
V
,Pt'
H
3
C
X 4
N
/LH
H С
LXXXVII1
LXXXIX
T
r
N-
H
3
C^
n
Xo
-Ж
T
N
N-
^ ^CH
3
n
^-ch
3
N
Со / J
N -J N^
V 1
-N
CH,
XC
CH
3
XCI
он). Такие комплексы, содержащие несимметричные хелаты, ока-
ались полезными при изучении механизма инверсии на асиммет-
ичных атомах металла.
Следующий класс изомеров, весьма сходных с описанными в
[редыдущем параграфе, — это соединения, в которых ориентация
[ротона может привести к конфигурационным эффектам. Так, ион
Co(dien) (en)Cl]
2-
может существовать в двух выделенных в ин-
дивидуальном состоянии геометрических формах (XCII и XCIII),
1 р
2
-[Со (trien) (Gly)]
2
+ на катионообменной смоле дауэкс был'
разделен на две формы — XCIV и XCV.
XCII XCIII
Более сложный пример представляет изомерия [Co(tetraen)Cl]
2
+,
для которого возможно четыре расположения (XCVI—XCIX), за-

68
i лава 2
висящие от конфигурации вокруг двух атомов вторичного азот
соединяющих хелатные кольца, расположенные в той же плоскост
В последних соединениях возникает также асимметрия на ато!
азота, но это явление будет обсуждено более детально
разд. 5.1.2,6. В качестве других примеров изомерии этого тш
приведем комплексы с насыщенными соединениями, содержат,
ми донорные атомы P и As и образующими мостиковые хелатнь
кольца в одной и той же координационной плоскости.
Для приведенных выше примеров при наличии атома N в щ
лочных растворах, где происходит быстрый обмен протона NI
легко достигается равновесие, но в кислых растворах изомер
устойчивы, и во многих случаях их легко разделить и отличи'
(с помощью спектроскопии в видимой области или ПМР-спектр
скопии).
/ 2+
NH
2
^N "NH
2
NH
2
NH
XCIV
XCV XCVI
. XCVlI XCVIlI XCIX
б) Структурные изомеры. Сюда относятся изомеры, которы
образуются в результате изомерии связей, возникающей при на
личии альтернативных способов координации одного и того ж^
лиганда, и изомерии лигандов, которые сами отличаются по струк
туре.
Существует много случаев изомерии связей для монодентат
ных лигандов, содержащих два различных донорных атома (а<м
фифилы). Так, M-ONO (нитрито) и M-NOO (нитро), М—SCI^
(тиоцианато) и M—NCS (изотиоцианато), M—OCN (цианато) \
М—NCO (изоцианато), M—CN (циано) и M—NC (изоциано) пред
ставляют классические примеры из химии Co(III). Подобным обра

Структура и стереохимия координационных соединений.
69
эм ион [Co(NH
3
)
5
(Gly)]
2+
существует в виде двух форм: со
зязью через атом азота (С) и через атом кислорода (Cl). Ацет-
мид в [Co(NH
3
)5(acam) ]
3+
также может присоединяться через
гом О (CII) и через атом N (CIII); в этом случае различная
оординация требует перестановки протона.
[(NH
3
)
6
Co-NH
2
CH
2
CO
2
]
2
+ [(NH
3
)
6
CO-OCCH
2
NH
2
]
2
+
в
CH
3
I
(NH
3
)
6
Co-OC-NH
2
си
О
Ql
CH
3
(NH
3
)
6
Co-NH=C-OH.
CIII
В качестве примеров бидентатных лигандов можно указать на
!зомеры хелатированного амида глицина, координированного по
!тому азота или кислорода, который найден в [Co(en)
2
(glyam)]
3+
(CIV и CV) (для последнего р/С
а
енольного протона равен при-
мерно 0,4), а также на своеобразный комплекс CVI, в котором
тредполагают наличие двух хелатных колец различного размера
в одном и том же лиганде.
H
2
N-
-NH
2
H
2
N-
;NH
2
^Co
CH
2
/
:0=С
\
NH
2
NH
2
CIV
?' /
СНЗ
H
3
CC-C=N^ HN=C
NH
2
H
2
N;
I
H
2
N-
,Co
-NH
2
CV
^NH
2
'7
4
CH
2
- .*
/
NH-С
ОН
H
3
C"
/
Nl
X //
C=NH O-N
^p-COCH
3
CVI
Лигандные изомеры также довольно многочисленны, так как
они просто образуются из совершенно различных лигандов, име-
ющих одинаковый химический состав. Классическими примерами
являются комплексы с 1,2-диаминопропаном (рп) и триэтиленди-
амином (tn), как в комплексах [Pt(tn)
2
]
2
+ (CVII) и [Pt(pn)
2
]
2
+

70 i лава 2
(CVIII) соответственно, и с M-NCCH
3
(метилцианид)
M—CNCH
3
(метилизоцианид).
Оптические изомеры возникают в том случае, когда молекул
и ее зеркальное изображение несовместимы друг с другом. Гово
рят, что такая молекула диссимметрична, и диссимметрия возни
кает во всех случаях, когда молекула не имеет ни центра симмет
рии, ни плоскости симметрии, ни зеркально-поворотной оси сим
метрии*. Таким образом, оптически активные формы всегда имею'
асимметричную структуру, но они могут иметь некоторые элемен
ты симметрии, главным образом поворотные оси второго, третьей
или четвертого порядка.
Оптические эффекты в координационных соединениях по ю
происхождению удобно классифицировать на три группы: а) воз
никающие из геометрического расположения лигандных групг
вокруг металла (конфигурационные эффекты), б) обусловленньк
асимметрией лиганда или его донорных атомов, существовавшей
или возникшей вследствие координации (вицинальные эффекты),
и в) происходящие из конформационных свойств координирован-
ного лиганда. Так как оптическая активность, возникающая из
конформационных эффектов, является следствием различных уг-
лов поворота вокруг связанных пар атомов, то она будет рассмот-
рена в разд. 5.2.
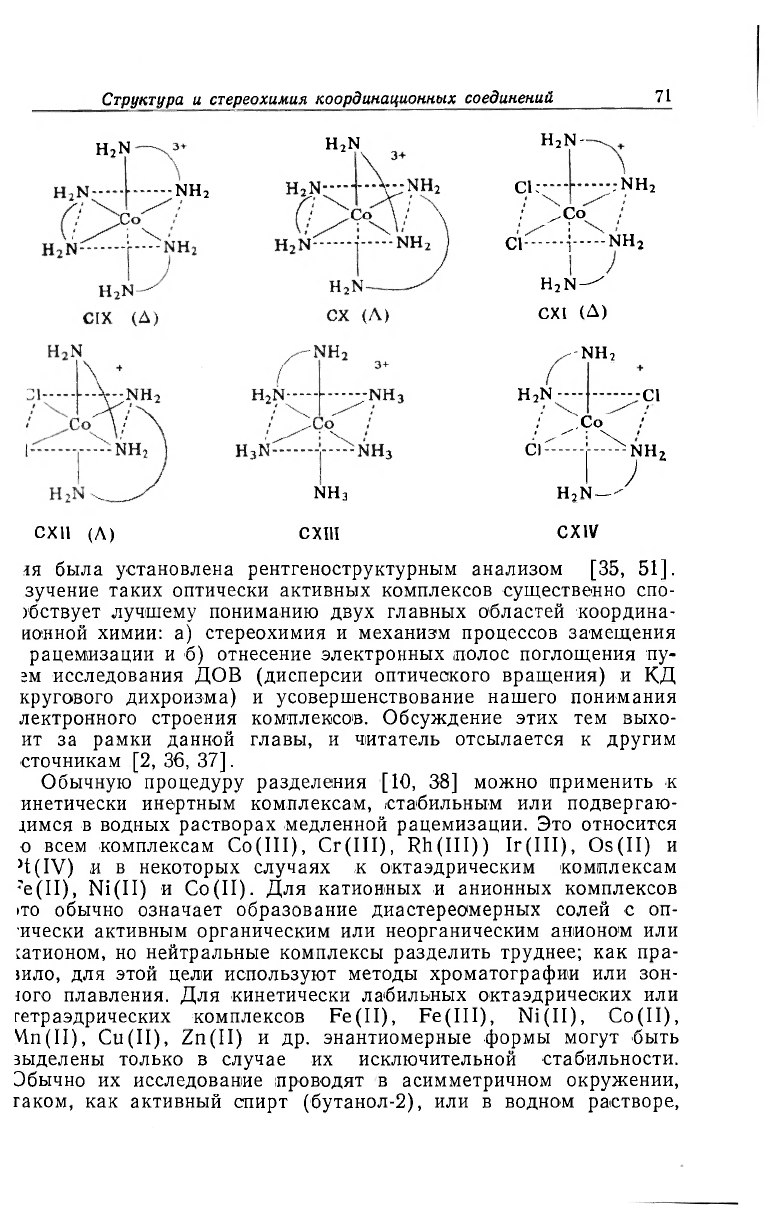
а) Конфигурационные энантиомеры. Впервые их существова-
ние наглядно показал Вернер с целью защиты своей теории коор-
динации. Так, он доказал октаэдрическую геометрию [Со(еп)
3
]
3
+
и цис-[Со(еп)
2
С1
2
]+ путем их разделения на энантиомерные фор-
мы (CIX, CX) и (CXI, CXII) соответственно, но ионы
[Со(en) (NH
3
)
4
]
3
+ (CXIII) и гране-[Со(еп)
2
С1
2
]+ (CXIV), имеющие
плоскость симметрии, неспособны разделяться.
Со времен Вернера были разделены многие комплексы, в част-
ности комплексы Co(III) и Cr(III), а их абсолютная конфигура-
* Так как центр симметрии (I) эквивалентен зеркально-поворотной оси вто-
рого порядка (S
2
), а плоскость симметрии (а) можно рассматривать как элемент
симметрии S
1
, то можно дать следующее более краткое определение диссимметрии:
«если молекула не имеет зеркально-поворотных осей S
n
с
2•
CVII
CVIlI
5.1.2. Оптические изомеры
Структура и стереохимия координационных соединений.
71
H
2
N
H
2
N
NH
2
H
2
N-
Cl;
.NH
2
: ,,Со
Cl i--NH
2
H
2
N-^
CXI (Д)
-NH
2
H
2
N-
CXll (Л)
NH
3
CXIlI
Cl
/ ,
Со
/
Cl I-^NH
2
I J
H
2
N—
CXlV
ля была установлена рентгеноструктурным анализом [35, 51].
зучение таких оптически активных комплексов существенно спо-
>бствует лучшему пониманию двух главных областей координа-
иояной химии: а) стереохимия и механизм процессов замещения
рацемизации и б) отнесение электронных полос поглощения пу-
гм исследования ДОВ (дисперсии оптического вращения) и КД
кругового дихроизма) и усовершенствование нашего понимания
лектронного строения комплексов. Обсуждение этих тем выхо-
ит за рамки данной главы, и читатель отсылается к другим
сточникам [2, 36, 37].
Обычную процедуру разделения [10, 38] можно применить к
инетически инертным комплексам, стабильным или подвергаю-
димся в водных растворах медленной рацемизации. Это относится
о всем комплексам Co(III), Cr(III), Rh(III)) Ir(III), Os(II) и
H(IV) и в некоторых случаях к октаэдрическим комплексам
:
e(II), Ni(II) и Co(II). Для катионных и анионных комплексов
!то обычно означает образование диастереомерных солей с оп-
•ически активным органическим или неорганическим анионом или
сатионом, но нейтральные комплексы разделить труднее; как пра-
шло, для этой цели используют методы хроматографии или зон-
юго плавления. Для кинетически лабильных октаэдричеоких или
гетраэдрических комплексов Fe(II), Fe(III), Ni(II), Co(II),
Чп(П), Cu(II), Zn(II) и др. энантиомерные формы могут быть
зыделены только в случае их исключительной стабильности.
Эбычно их исследование проводят в асимметричном окружении,
гаком, как активный спирт (бутанол-2), или в водном растворе,
72
i лава 2
содержащем добавленную асимметричную соль (аммоний-й
бромкамфорсульфонат, натрийантимонил-с?-тартрат, цинхон
стрихнин и т. п.). Такие эффекты «конфигурационной активное
возникают вследствие различий в активности энантиомер!:
форм в асимметричном окружении.
Ни один из тетраэдрических комплексов типа M(ABCD), i
делирующих классическую химию углерода, не был разделен
оптические изомеры, так как, во-первых, их трудно синтезирова
а во-вторых, они, по-видимому, слишком лабильны для того, ч'
бы их можно было изучать обычными !методами. Были разделе
некоторые тетраэдричесюие комплексы типа M(А—В)
2
, наприм
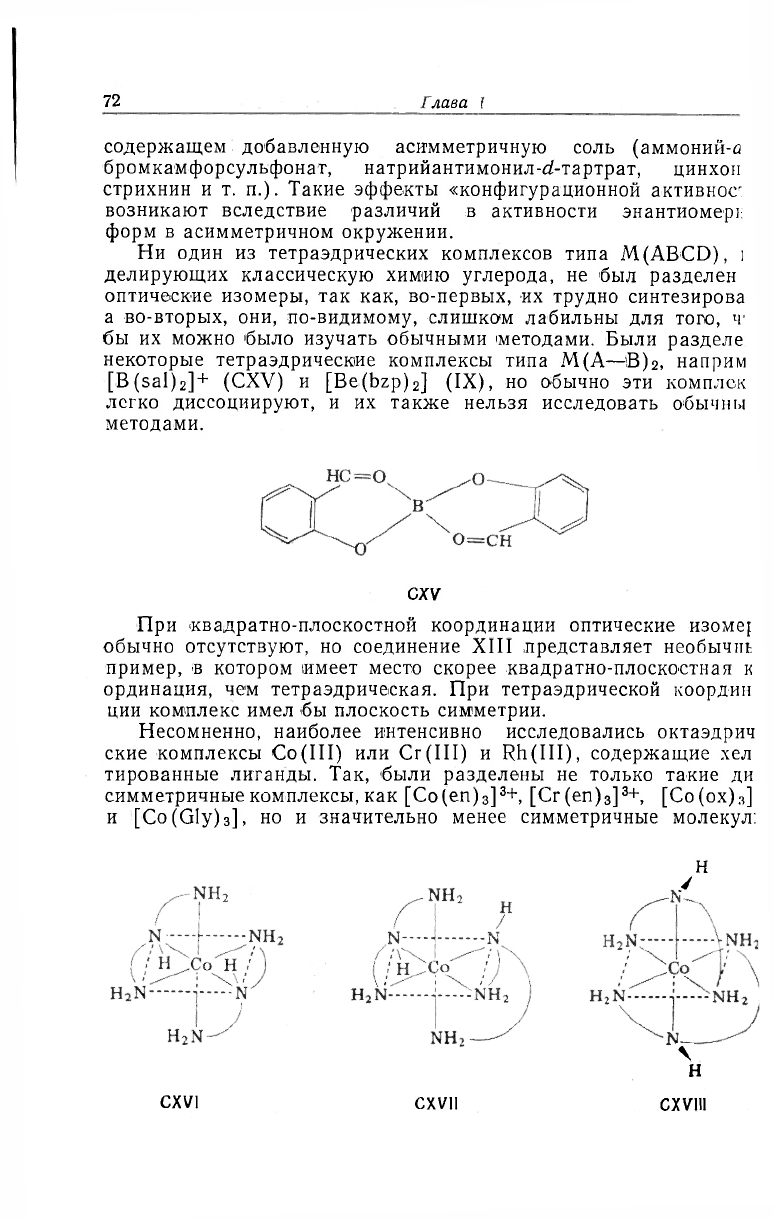
[B(Sal)
2
]
+
(CXV) и [Be(bzp)
2
] (IX), но обычно эти комплек
легко диссоциируют, и их также нельзя исследовать обычны
методами.
При квадратно-плоскостной координации оптические изомер
обычно отсутствуют, но соединение XIII представляет необычнь
пример, -в котором имеет место скорее квадратно-плоскостная к
ординация, чем тетраэдрическая. При тетраэдрической коордип
ции комплекс имел бы плоскость симметрии.
Несомненно, наиболее интенсивно исследовались октаэдрич
ские комплексы Co(III) или Cr(III) и Rh(III), содержащие хел
тированные литанды. Так, были разделены не только такие ди
симметричные комплексы, как [Co(en)
3
]
3
+, [Сг(еп)
3
]
3
+, [Со(ох)
3
]
и [Co(Gly)
3
], но и значительно менее симметричные молекул:
CXV
H
у
V
H
CXVI
CXVII
CXVIII
