Эйхгорн Г. (ред.) Неорганическая биохимия. Том 1
Подождите немного. Документ загружается.


Структура и стереохимия координационных соединений.
43
Таблица 1.8
Состояние
экисления
З^-Электронная
конфигурация
Координа-
ционное число
Геометрия
Примеры
(/)
d
10
2 Линейная
[Cu(NH
3
)
2
]+, Cu
2
O
4
Тетраэдр
[Cu(CN)
4
]
3
", CuI
Щ)
d
8
4 Тетраэдр
(искажен-
ный)
Cs[CuCl
4
],
Cu(N-C
3
H
7
Salen)
2
5
Тригональная
бипирамида
Квадратная
пирамида
[Cu(dipy)
2
I]+
[CU(DMGH)
2
]
2
4 Плоский квад-
рат
CuO
1
[Cu(py)
4
]
2
+
6
Октаэдр (иска-
женный)
[СиЭДТА]
2-
, [Cu(H
2
O)
6
]
2
+
швость комплексов Cu(I) и Cu(II) сильно зависит от природы
тигандов, и равновесие 2 Cu(I)^Cu(O) +Cu(II) может быть сме-
нено в любом направлении в зависимости от условий. В водных
растворах Cu
+
неустойчива, но ее можно стабилизировать с по-
мощью мягких поляризующихся лигандов (CN
_
, I
-
, R
2
S) или пу-
тем образования очень малорастворимых комплексов — CuCN,
CuCl*.
В водных растворах изучена и описана главным образом хи-
мия соединений Cu(II). Существует большое разнообразие кон-
фигураций — от плоского квадрата до октаэдра; их все можно
рассматривать как октаэдры с различной степенью удлинения
двух связей, находящихся в транслположении (искажение вслед-
ствие эффекта Яна—Теллера); комплексы с четко выраженной
октаэдрической симметрией Oh, как и следовало ожидать, не об-
наружены.
Комплексы Cu(II) в кристаллическом состоянии иногда, а пеп-
тидные комплексы обычно имеют геометрию квадратной пирами-
ды (координационное число 5) (гл. 4). По-видимому, в кристал-
лическом состоянии Cu(II) может образовывать большое разно-
образие структур, соответствующих координационным числам 4,
5 и 6, точная геометрия которых определяется конформациями
лигандов и требованиями решетки; в растворе, по-видимому, пре-
обладает конфигурация искаженного октаэдра.
* CuCN и CuCl можно рассматривать и как простые соли меди(1).—
Прим. ред.

44
Глава 1
3.9. Цинк (табл. 1.9)
Известны только гидратированный ион Zn
2
+ и комплексы Zn (1
Так как Zn
2
+ имеет полностью заполненную З^-оболочку (d
1
то эффекты кристаллического поля отсутствуют. Таким образе
стереохимия комплекса определяется только электростатически
или ковалентными силами связывания и размерами лиганда. E
лее всего распространена тетраэдрическая структура, за нею cj
дует октаэдричеекая и известно несколько примеров комплексе
имеющих геометрию тригональной бипирамиды и квадратной п
рамиды.
Таблица
Координационное
число
Геометрия
Примеры
4
Тетраэдр
[Zn(CN)
4
]
2
-, [Zn(NH
3
)
4
]
2
+
5
Искаженная тригональ- [Zn(acac)
2
H
2
0]
ная бипирамида или [Zn(terpy)Cl
2
]
квадратная пирамида
6
Октаэдр
[Zn(H
2
O)
0
]
2
+, [Zn(NH
3
)
6
]
2
+
3.10. Молибден и вольфрам (табл. 1.10)
~0,0В
+
0,15В
Mo
3+
*• MoO
2
, W
3+
WO
2
(кислый раствор)
Химические свойства Mo и W очень сходны, но значителык
отличаются от свойств Cr; для них важны состояние окисленш
IV, V и VI, в то время как состояние окисления II практическ!
неизвестно. Для обоих элементов характерно большое разнообра
зие геометрических конфигураций комплексов, причем имеете?
много примеров комплексов с координационными числами больше
шести; например, [Mo(CN)
8
]
4-
, [Mo(CN)S]
3-
(искаженный тре-
угольный додекаэдр); полимерные окислы, сульфиды. Дискретный
[MoO
4
]
2-
существует в сильнощелочных растворах, а при подкис-
лении образуются разнообразные изополимолибдаты или изополи-
вольфраматы. Для этих соединений характерны октаэдричеекая
координация металла с атомами кислорода и различные типы об-
щих углов или ребер. Относительно редки комплексы в состоянии
окисления III, а для Mo и W в состояниях окисления IV, V и
VI известны главным образом анионные комплексы.
Структура и стереохимия координационных соединений.
45
Таблица 1.10
Состояние
окисления
Зс(-Электронная
конфигурация
Координа-
ционное число
Геометрия
Примеры
fo>(0)
V(O)
ds
6
Октаэдр
Mo(CO)
6
, Mo(Ciiphos)
3
Ло(1)
V(I)
d.
5
—
«Сэндвичевая»
связь
[(C
6
H
6
)
2
Mo]+
[я-С
5
Н
5
Мо(СО)
3
]
2
Ho(II)
W(II)
d
1
4
Тетраэдр (?)
Mo(OCOCH
3
)
2
Ho(III)
d
3
6
Октаэдр
[Mo(SCN)
6
]
3
", [WCi
6
]
3
"
W(III)
8
Додекаэдр
[Mo(CN)
7
(H
2
O)]""
Mo(IV) d
2
6
Октаэдр
[Mo(SCN)
6
]
2
-
W(IV)
8
Додекаэдр
[Mo(CN)
8
]
4-
Mo(V)
W(V)
d
1
5
Тригональная
бипирамида
MoCl
5
6 Октаэдр [WF
6
]", [MoOF
6
]
2-
8
Додекаэдр
[Mo(CN)
8
]
3
-, [W(CN)
8
]
3
-
Mo(VI)
d°
4
Тетраэдр
[MoO
4
]
2
", [WO
4
]
2
"
W(VI) 6
Октаэдр
WCl
6
, MoF
6
, MoO
6
, WO
6
(В поликислотах)
4. ФАКТОРЫ, ВЛИЯЮЩИЕ НА КООРДИНАЦИОННОЕ ЧИСЛО
И СТЕРЕОХИМИЮ
4.1. Эффекты ионов металлов
Ионы металлов на основании их способности к образованию
химических связей можно разделить на два довольно отчетливых
класса: 1) ионы щелочных (Li+, Na+, К+, Rb+, Cs+) и щелочно-
земельных* (Be
2
+, Mg
2
+, Ca
2
+, Sr
2
+, Ba
2
+) металлов, 2) ионы пе-
реходных металлов, особенно металлов первого переходного ряда
(Ti
2
+, V
2
+, VO
2
+, Cr
2
+, Cr
3
+, Mn
2
+, Fe
2
+, Fe
3
+, Co
2
+, Ni
2
+, Cu
2
+,
Zn
2
+X.
4.1.1. Ионы щелочных и щелочноземельных металлов
Эти металлы характеризуются высокой электроположитель-
ностью и, за исключением Be
2
+, который в виде дискретных ионов
неизвестен ни в кристаллическом состоянии, ни в растворе**, су-
* Бериллий вряд ли даже условно можно отнести к щелочноземельным ме-
таллам. — Прим. ред.
** Mg
2
+, а также в некоторой степени Li+ вследствие их малых размеров
проявляют сильные поляризующие свойства, и связи в их соединениях имеют
частично ковалентный характер.

46 Глава 1
ществуют в их кристаллических соединениях как отдельные ион
(ионные решетки), а в растворе — как дискретные гидратирова
ные ионы M+ или M
2
+. Составные части комплекса удерживаютс
вместе почти исключительно электростатическим взаимодействие
между противоположно заряженными ионами или ион-диполям;
а так как ионы имеют электронную конфигурацию инертного г*
о
а
*
0
а
S
1
3*.
Li
+
Na
+
K
+
Rb
+
Cs
+
Be
2+
Mg
2+
Ca
2+
Sr
2+
Ba
2+
N =
-
Усиление
ионного характера
за, то они сферически симметричны с точки зрения возможности
образования ими химических связей. Максимальные координаци-
онные числа (N) часто можно вычислить, предположив плотную
упаковку лигандов на поверхности иона металла и используя сле-
дующее 'выражение:
2л / d \
а
/ 1_
(3)
1/2 \ г ) (l-
r
y8d4
где d — расстояние металл—лиганд, г — вандерваальсов радиус
лиганда. Предполагается, что присоединенные лиганды имеют
правильную стереохимию, которая определяется только энергией
межлигандного отталкивания, т. е. что не существует стерических
требований самих ионов металлов, и в этом заключается их глав-
ное отличие от переходных металлов. Это означает, что меньшие
по размеру катионы (Li+, Na+, К+ и Be
2
+), по-видимому, сущест-
вуют в водном растворе как тетраэдрические ионы M(H
ii
O)
4
,
в случае К+ это было подтверждено методом рассеяния рентгенов-
ских лучей. Однако, так как эти ионы очень малы, они имеют на
своей поверхности высокую плотность заряда, и приобретает зна-
чение вторичная сольватация. Так, щелочные металлы Li+, Na+,
К+ имеют большие эффективные радиусы гидратации (табл. 1.11).
При этом для Litq он больше, чем для Cst
q
.
Найденное для Cst
q
число гидратации около 10, вероятно, це-
ликом относится к первой гидратной оболочке, вторичная гидра-
тация не имеет значения. Небольшие высокозаряженные ионы
щелочноземельных металлов приобретают .в водном растворе вы-

Структура и стереохимия координационных соединений. 47
Таблица 1.11
Ион
Кристаллохимический
о
радиус , А
Радиус гидратации
о
(оцененный), А
Ион
Кристаллохимический
о
радиус, А
.1+ 0,60 3,40 Be
2
+ 0,34
Ja+
0,95
2,76
Mg
2
+
0,65
С+
1,33 2,32
Ca
3
+
0,94
?ь+
1,48
2,28 Sr
2
+
1,1
Zs+
1,69
2,28 Ba-+
1,3
а
3десь даны кристаллохимические радиусы по Л. Полингу; существует также часто при-
меняемая система кристаллохямических радиусов по Б. Гольшмидту. — Прим. ред.
сокое координационное число за счет прямого контакта катион —
анион. Так, Mg
2
+, хотя и имеет меньший ионный радиус, чем Na+,
существует в водном растворе в виде [Mg(H
2
O)
6
]
2
+. Однако сла-
боэлектроположительный ион Be
2
+, существующий в виде тетра-
эдрического [Be(H
2
O)
4
]
2
+, проявляет большую кислотность по
сравнению с другими акватированными двухвалентными и однова-
лентными ионами, и молекулы воды в нем прочно связаны; так,
например, [Be(H
2
O)
4
JCl
2
не теряет воду над P
2
Os-
Для кристаллического состояния имеют большое значение упа-
ковочные эффекты. Состояние с наиболее низкой энергией соот-
ветствует балансу между максимальным координационным чис-
лом, вычисленным по приведенному выше уравнению, и упаковоч-
ными силами, возникающими в результате упаковки в кристалл
повторяющихся структурных единиц. Для щелочных металлов в
ионных кристаллах это приводит к кубической 8-1Кратной коорди-
нации, если отношение радиусов аниона и катиона (г~/г+) мень-
ше 1,37 (структура CsCl), октаэдрической 6-кратной координации,
если г~/г+ меньше 2,44 (структура NaCl), и тетраэдрической
4-кратной координации, если г~/г+ меньше 4,4 (структура ZnS).
Твердые соединения ионного типа с иной стехиометрией, напри-
мер M
2
X, имеют иные структуры решеток.
Химия водных растворов этих металлов почти исключительно
относится к ионам Maq или M aq. Известно существование в вод-
ных растворах нескольких простых комплексов, содержащих дру-
гие лиганды (интересное исключение см. в гл. 6), а металлоор-
ганические соединения Na и К являются, по существу, ионными
и сильно гидролизуются водой. Только органические производные
Li+ и Mg
2
+ (чрезвычайно полезные как источник R+ в препаратив-
ной органической химии) имеют ковалентный характер и раство-
ряются в углеводородах и других неполярных растворителях. Бы-
ло показано, что реактив Гриньяра RMgX содержит тетраэдриче-
48 Глава 1
еки координированный Mg в кристаллах C
6
H
5
MgBr-2 (C
2
H
5
)
2
O
подобное строение имеет Na(acac)
2
(XXXIV). Таким образом,
1
BO
дородные связи с координированными молекулами воды и разме]
CHJ
x
^CH
3
Z
0
-
c
I
H
2
C Na ;сн
C=O O-C
4
Сн/
4
CH
3
XXXIV
гидратированного катиона —- важные черты в биологической функ-
ции Nat
q
и Ktq-
Из щелочноземельных металлов только Be
2
+ и в некоторой сте-
пени Mg
2
+ функционируют как достаточно сильные акцепторы
электронов, образуя довольно слабые ковалентные комплексы.
Благодаря малым размерам иона Be
2
+ и отсутствию стереохими-
ческих требований, обусловленных электронным строением, пред-
почтительное координационное число равно 4 с тетраэдрическим
расположением лигандов, например BeFl и Ве(асас)
2
(XXXV).
CH
3
CH
3
C-O O-C
\ /
HC' Be 'CH
Vv. / \ .''/
с-о о-с
/ \
CH
3
CH
3
XXXV
Однако если важна стереохимия лиганда, как, например, в пор-
фириновых ядрах, то образуются другие структуры, например
структура плоского квадрата в Mg(II)-хлорофилле (гл. 29,
рис. 29.1). Известен также октаэдрический комплекс
[Mg(NH
3
)
6
JCl
2
, «о он легко гидролизуется в воде. Из ионов дру-
гих щелочноземельных металлов только Ca
2
+ проявляет тенден-
цию к образованию комплексных соединений, координируя пред-
почтительно карбоксилатные лиганды. Так, октаэдрический ион
[СаЭДТА]
2-
имеет практическое значение (как «умягчитель» во-
ды), а связывание Ca
2
+ и Mg
2
+ фосфатными группами АТФ и
АДФ играет важную роль в процессе переноса энергии в биоло-
гических системах*.
* В последнее время большое значение в химии, биологии и даже в промыш-
ленности приобретает распространение комплексов этих металлов с макроцикличе-
скими лигандами (см. также гл. 6). — Прим. ред.
Структура и стереохимия координационных соединений.
49
4.1.2. Ионы переходных металлов
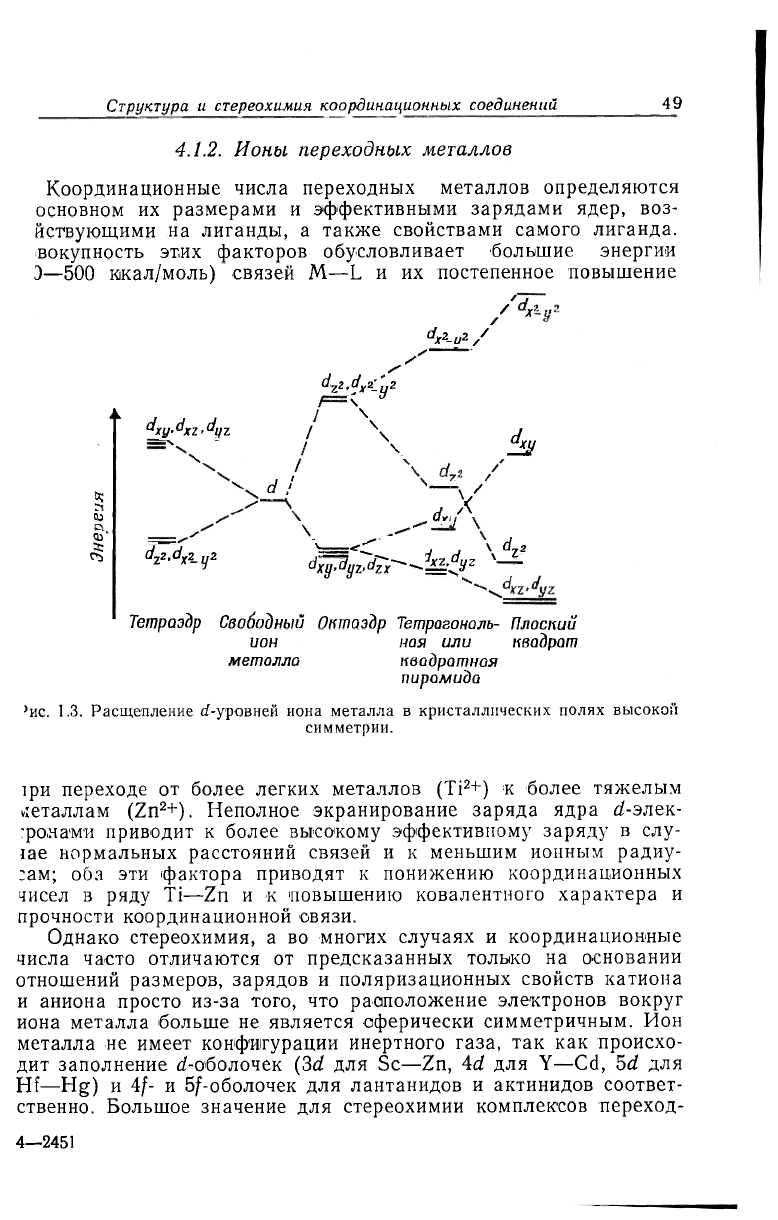
Координационные числа переходных металлов определяются
основном их размерами и эффективными зарядами ядер, воз-
йствующими на лиганды, а также свойствами самого лиганда.
вокупность этих факторов обусловливает большие энергии
Э—500 икал/моль) связей M—L и их постепенное повышение
/
d
X
2
-U
2
/
CU
QJ
*
СП
/
2,U
y
2~
n
2
\
d
z* J*'-у
d
xy- d
X
z ,dy
Z
\
/
\
d !
\
d
Z
2
-
d
X
2
-Ij
2
\ ^n
ТУ
\r=<rzS J , \ d
z
2
d
Tpyz.dTx^^^H
2 4
Тетраэдр Свободный Октаэдр Тетрагональ- Плоений
ион ноя или квадрат
металла квадратная
пирамида
}
ис. 1.3. Расщепление d-уровней иона металла в кристаллических полях высокой
симметрии.
]ри переходе от более легких металлов (Ti
2
+) к более тяжелым
металлам (Zn
2
+). Неполное экранирование заряда ядра d-элек-
'рола'М'И приводит к более высокому эффективному заряду в слу-
iae нормальных расстояний связей и к меньшим ионным радиу-
:ам; оба эти фактора приводят к понижению координационных
чисел в ряду Ti—Zn и к повышению ковалентного характера и
прочности координационной связи.
Однако стереохимия, а во многих случаях и координационные
числа часто отличаются от предсказанных только на основании
отношений размеров, зарядов и поляризационных свойств катиона
и аниона просто из-за того, что расположение электронов вокруг
иона металла больше не является сферически симметричным. Ион
металла не имеет конфигурации инертного газа, так как происхо-
дит заполнение d-оболочек {3d для Sc—Zn, 4d для Y—Cd, 5d для
Hf—Hg) и 4f- и 5[-оболочек для лантанидов и актинидов соответ-
ственно. Большое значение для стереохимии комплексов переход-
4—2451
50
Глава 1
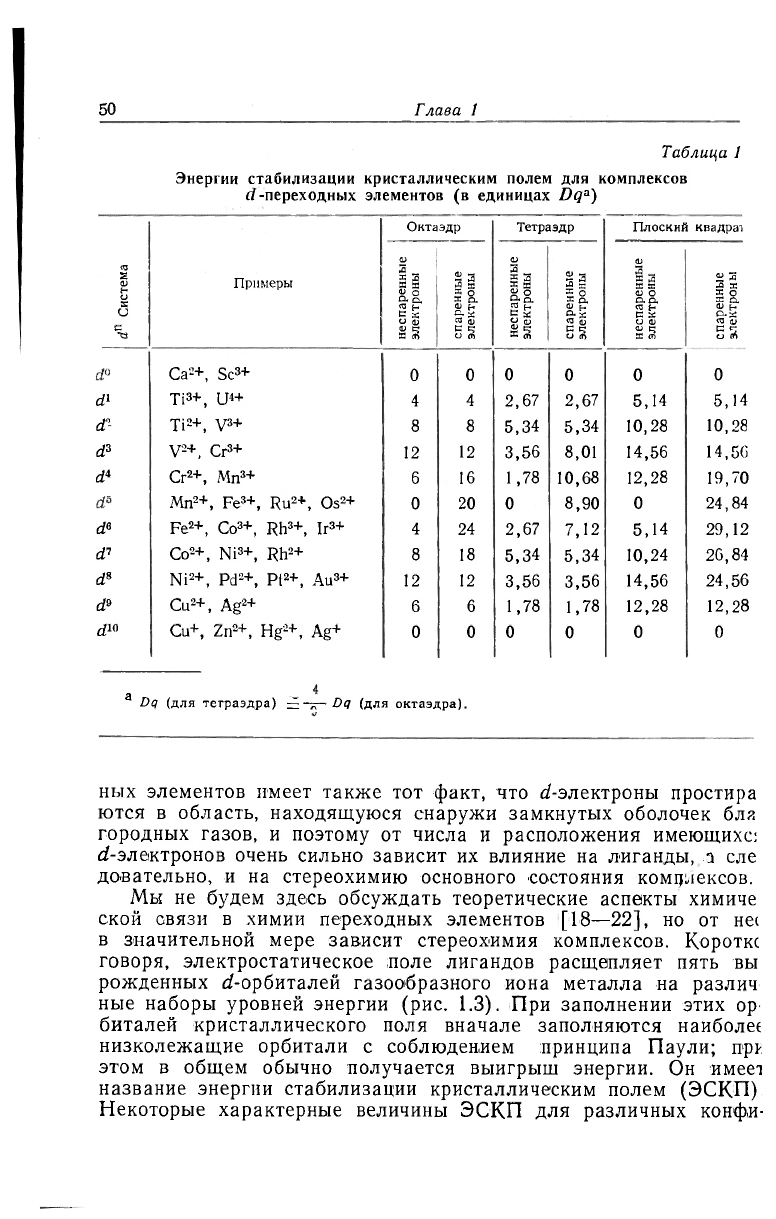
Таблица 1
Энергии стабилизации кристаллическим полем для комплексов
d -переходных элементов (в единицах Dq
a
)
d
n
Система
Примеры
Октаэдр
Тетраэдр Плоский квадрат
d
n
Система
Примеры
не
спаренные
электроны
спаренные
электроны
неспаренные
электроны
спаренные
электроны
неспаренные
электроны
спаренные
электроны
Ca
2
+, Sc
3
+
0 0
0
0
0
0
d\
Ti
3
+, U
4
+
4
4 2,67 2,67 5,14
5,14
d"
Ti
2
+, V
3
+
8
8 5,34
5,34 10,28
10,28
d
3
V
2
+, Cr
3
+
12
12
3,56
8,01 14,56
14,56
d
i
Cr
2
+, Mn
3
+
6 16 1,78 10,68
12,28
19,70
Mn
2
+, Fe
3
+, Ru
2
+, Os
2
+
0
20 0 8,90
0 24,84
d<> Fe
2
+, Co
3
+, Rh
3
+, Ir
3
+
4 24
2,67 7,12
5,14
29,12
di Co
2
+, Ni
3
+, Rh
2
+
8 18 5,34
5,34
10,24 20,84
d
8
Ni
2
+, Pd
2
+, Pt
2
+, Au
3
+
12
12
3,56
3,56
14,56
24,56
d
9
Cu
2
+, Ag
2
+
6
6 1,78 1,78 12,28
12,28
d
1(1
Cu+, Zn
2
+, Hg
2
+, Ag+
0 0
0
0
0
0
а
Dq (для тетраэдра) Dq (для октаэдра).
ных элементов имеет также тот факт, что ^-электроны простира
ются в область, находящуюся снаружи замкнутых оболочек бла
городных газов, и поэтому от числа и расположения имеющихс:
d-электронов очень сильно зависит их влияние на лиганды, а еле
донательно, и на стереохимию основного состояния комплексов.
Мы не будем здесь обсуждать теоретические аспекты химиче
ской связи в химии переходных элементов [18—22], но от не(
в значительной мере зависит стереохимия комплексов. Короткс
говоря, электростатическое поле лигандов расщепляет пять вы
рожденных d-орбиталей газообразного иона металла на различ
ные наборы уровней энергии (рис. 1.3). При заполнении этих ор
биталей кристаллического поля вначале заполняются наиболее
низколежащие орбитали с соблюдением принципа Паули; npi
этом в общем обычно получается выигрыш энергии. Он имеет
название энергии стабилизации кристаллическим полем (ЭСКП)
Некоторые характерные величины ЭСКП для различных конфи-
Структура и стереохимия координационных соединений
51
)аций приведены в табл. 1.12*. Учитывая энергии соогветствую-
[X орбиталей лигандов и допуская, что орбитали металла и ли-
гдов могут взаимодействовать при условии близости их энергий
соответствия по симметрии, можно сделать поправку на пере-
определение электронов между металлом и лигандами, т. е. на
валентное связывание. Величина ЭСКП, имеющая порядок
—50 ккал/моль, невелика по сравнению с общей энергией связи,
!еющей порядок 300—3000 ккал/моль, но стереохимия комплек-
в во многих случаях определяется такими эффектами.
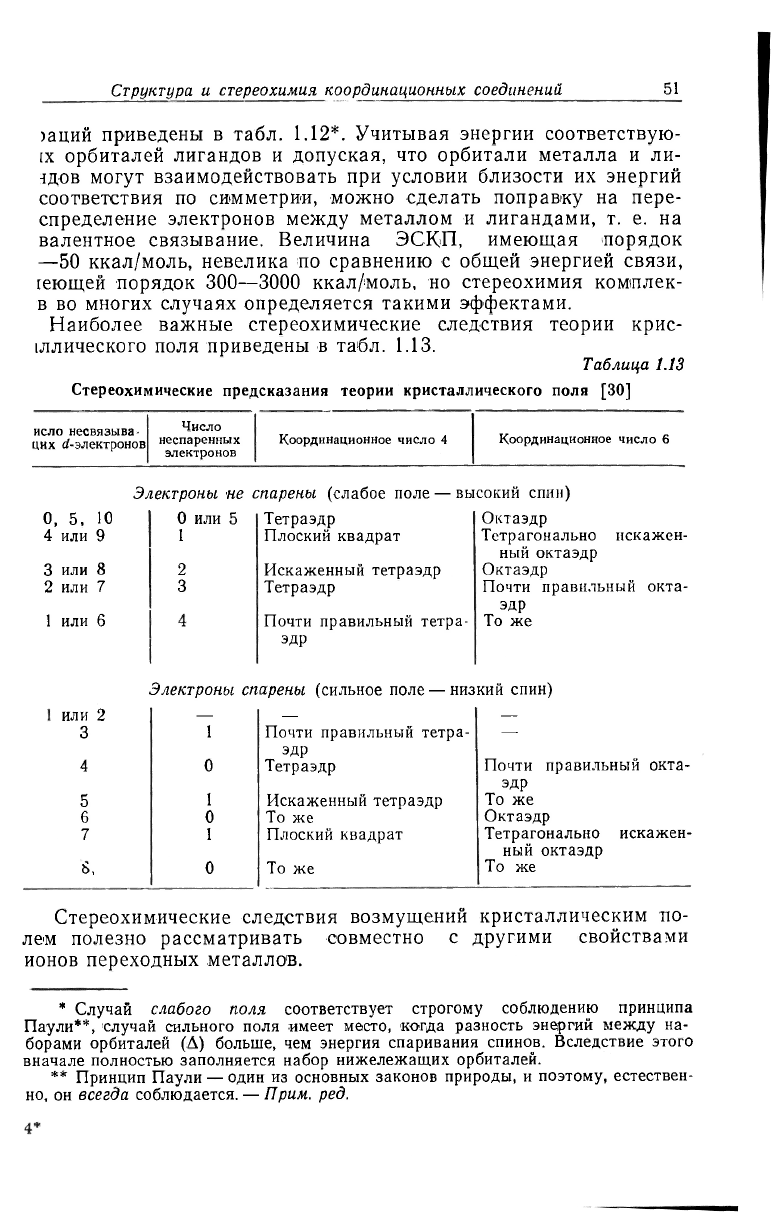
Наиболее важные стереохимические следствия теории крис-
(ллического поля приведены в табл. 1.13.
Таблица 1.13
Стереохимические предсказания теории кристаллического поля [30]
исло несвязыва
них d-электронов
Число
неспаренных
электронов
Координационное число 4
Координационное число 6
Электроны не спарены (слабое поле — высокий спин)
О, 5, Ю
4 или 9
3 или 8
2 или 7
1 или 6
0 или 5
1
2
3
Тетраэдр
Плоский квадрат
Искаженный тетраэдр
Тетраэдр
Почти правильный тетра-
эдр
Октаэдр
Тетрагонально искажен-
ный октаэдр
Октаэдр
Почти правильный окта-
эдр
То же
Электроны спарены (сильное поле — низкий спин)
или 2
— — •—
3
1
Почти правильный тетра- —
эдр
Почти правильный окта-
4 0 Тетраэдр
Почти правильный окта-
эдр
5
1
Искаженный тетраэдр
То же
6
0 То же
Октаэдр
7 1 Плоский квадрат
Тетрагонально искажен-
ный октаэдр
S, 0
То же
То же
Стереохимические следствия возмущений кристаллическим по-
лем полезно рассматривать совместно с другими свойствами
ионов переходных металлов.
* Случай слабого поля соответствует строгому соблюдению принципа
Паули**, случай сильного поля имеет место, когда разность энергий между на-
борами орбиталей (А) больше, чем энергия спаривания спинов. Вследствие этого
вначале полностью заполняется набор нижележащих орбиталей.
** Принцип Паули — один из основных законов природы, и поэтому, естествен-
но, он всегда соблюдается. — Прим. ред.
XXIX

52
Глава 1
а) Устойчивость состояний (степеней) окисления*. Для э
ментов первой половины первого переходного ряда, от Sc до ^
существуют все максимальные степени окисления: Sc(Il
Ti(IV)**, V(V), Cr(VI) и Mn(VII) (курсивом отмечены наибо;
устойчивые и распространенные). Однако из-за неполного эк]
нирования ядер d-электронами низшие состояния окисления ч
степенно становятся более распространенными. Так, Cr(VI)
Mn(VII) существуют только в виде окислов и оксо-анио»
Cr(III)—единственное состояние окисления, имеющее значен
вводном растворе; Mn(II) и Mn(III) примерно одинаково важь
Fe(II) несколько более распространен, чем Fe(III), a Co(II)
более, чем Co(III) (который распространен только в комплекс;
где он находится в низкоспиновом состоянии); единственное на.
ное состояние окисления никеля — Ni(II), для меди распростр
иены как Cu(II), так и Cu(I), но двухвалентное состояние име
большее значение; цинк встречается только в виде Zn(II), име.
щего конфигурацию d
10
.
б) Особенности комплекса, зависящие от природы иона мета
ла. В общем комплексы металлов, находящиеся в начале ряд
имеют ионный характер (Sc
2
+, Ti
2
+, V
2
+), в то время как компле
сы металлов, стоящих в конце ряда (Cu
2
+, Ni
2
+), более ковален
ны, особенно комплексы с поляризующимися лигандами (О, S)**
Такое изменение характера связи происходит .вследствие повьш
ния эффективного заряда ядра при переходе вдоль ряда. Одна!
более ковалентная связь не обязательно означает повышенную у
тойчивость. Во втором и третьем переходных рядах элементов ст>
пень ковалентности также заметно повышается по аналогично
причине, но здесь обычно она вызывает также повышение кит
тической устойчивости.
Стереохимические выводы теории кристаллического поля моя-
но суммировать следующим образом.
1. Легкие переходные металлы предпочитают более высоки
координационные числа, а более тяжелые — более низкие кос;:
динационные числа. Так, комплексы ионо-в d
0
—d
6
имеют преиму
щественно октаэдрическую координацию, в то время как иош
d
7
[Co(II), Rh(II)], d
s
[Ni(II), Pd(II), Pt(II)] и d
9
[Cu(II)
Au(III)] предпочитают квадратно-плоскостные структуры. Эт(
особенно очевидно для второго и третьего рядов переходных эле
ментов, где спаривание электронов редко имеет место (низкоспи
новые комплексы).
* В русской тер-минологии термины «степень окисления» и «состояние
окисления» равнозначны.—Прим. ред.
** В оригинале Mn(IV), по-видимому, опечатка. — Прим. ред.
*** Большинство лигандов с допорными атомами кислорода поляризуется
слабо. — Прим. ред.
