Эйхгорн Г. (ред.) Неорганическая биохимия. Том 1
Подождите немного. Документ загружается.


Структура и стереохимия координационных соединений.
23
ш месяц, и это число быстро растет. Точность этих исследова-
й также находится на высоком уровне. Для точного определе-
я структуры координационного соединения в растворе в настоя-
ге время не существует какого-либо прямого метода, однако
кие методы, как ЯМР (в частности, на ядрах
1
H,
19
F,
31
P,
13
C)
ЭПР (парамагнитные комплексы), часто дают надежные ре-
льтаты, а такие непрямые методы, как электронные спектры, ди-
)льные моменты, магнитные моменты и измерение молекулярной
ассы, интенсивно используются для предсказания структуры. HH-
е мы приведем краткое общее обсуждение координационных
1сел и стереохимии координационных соединений. Возможно,
го одной из наиболее отличительных черт современной координа-
ионной химии является то, что численное превосходство структур
координационными числами 4 и 6 серьезно поколеблено и что
необычные» координационные числа (5, 7, 8) становятся все бо-
ее обычными.
2.1. Координационное число 2
Координационное число 2 не очень распространено, и оно
)бычно характерно только для комплексов Cu(I), Ag(I), Au(I)
1 Hg(II). Из двух возможных конфигураций — линейной (Dooh)
I угловой (C
2u
) —найдена только линейная форма, как полагают,
i3-3a того, что она обеспечивает минимум лиганд-лигандного от-
талкивания. В качестве типичных примеров можно привести
[CuCl
2
]
-
, [AuCl
2
]
-
и [Hg(CN)
2
]. Из примеров, представляющих
больший биохимический интерес, можно указать на [Ag(NH
3
)
2
]+,
Ag(Gly), Ag(Gly)-0,5Н
2
0 И Ag(Gly-Gly) (гл. 4, формулы III, IV
и XI). В последних структурах Ag(I) прочно связывается с ами-
но- и карбоксильной группами глицина, но очень слабо с карбо-
нильным кислородом глицилглицина. По-видимому, и с другими
аминокислотами и пептидами Ag(I), Cu(I) и Au(I) будут свя-
зываться подобным образом.
Иногда необычные лигаяды координируются с образованием
необычных конфигураций, например:
(CH
3
)
3
Si
4
/Si(CH
3
)
3
Со— N(
(CH
3
)
3
Si/1 ^Si(CH
3
)
3
IV
но это происходит довольно редко. Однако такие случаи показы-
вают, что ионы металлов даже в обычных состояниях окисления
могут иметь необычные координационные свойства.
2.2. Координационное число 3
Это координационное число встречается очень редко, за ис-
ключением молекул, содержащих относительно _ электроотрица-
тельные центральные атомы, например BF
3
, NO
3
(плоский тре-

24
Глава 1
угольник); NH
3
, ClO
3
(тригональная пирамида). Так, К
2
[СиС
и Cs
2
[HgCl
3
] содержат бесконечные цепи тетраэдров MCl
4
, в
время как галогениды MCl
3
(M = Cr, Fe, Mn, V) кристаллизуют
в решетках, содержащих ионы металлов в октаэдрическом окр
жении. Комплекс Cs[CuCl
3
] состоит из бесконечных цепей —Cl
-CuCl
2
—Cl—CuCl
2
—Cl— с 4-кратной координацией иона мета
ла, a AuCl
3
— димер, содержащий две плоские частицы AuCl
4
с
единенные общей гранью. Наиболее простые комплексы металл!
состава MX
2
или MX
3
в растворе либо легко диссоциируют, ли(
образуют частицы MX
2
(H
2
O)
4
или MX
3
(H
2
O)
3
, либо существуй
в виде полиэдров координационных чисел 4 или 6. Трис-(гексам
тилдисилиламинато) железо (III) (V) и анион HgIV
(CH
3
)
3
S(HgI
3
) (VI) представляют примеры соединений, имеюни
симметрию, близкую к плоскому равностороннему треугол!
нику (D
3h
). Плоская Т-геометрия (C
2v
) обнаружена в катион
(CH
3
)
3
Se+ (VII).
[(CH
3
)
3
SiJ
2
N
4
/NfSi(CH
3
)
3
^
2
Fe
NISi(CH
3
)
3
J
2
V
CH
3
-Se-CH
3
I
CH
3
VII
N /
1
Hg
VI
2.3. Координационное число 4
2.3.1. Тетраэдр
Эту геометрическую конфигурацию имеют многие комплексы.
'Она обычна для координационных соединений непереходных эле-
ментов, для которых их устойчивость может быть частично объяс-
нена использованием ковалентных я/^-гибридных орбиталей
металла, а частично тем фактом, что при тетраэдрическом располо-
жении лигандов возникают наименьшие стерические и электро-
статические напряжения по сравнению со всеми другими способа-
ми расположения лигандов, возможными при координационном
числе 4. Так, Na(I) в жидком аммиаке существует в виде
[Na(NH
3
)
4
]+, а исследования методом рассеяния рентгеновских
лучей показывают, что первичное координационное число K(I)
в водном растворе равно четырем; комплексы B(III), Be(II),
-Zn(II), Cd(II) и Hg(II) состава MX
4
(X = F, Cl, CN) имеют тет-

Структура и стереохимия координационных соединений.
25
эдрическое строение, так же как многие комплексы Be(II) и
g(ll) с бидентатными лигандами.
2
CH
2
OH
H
2
C-S S-CH о—с^
СьН$
HC' V ICH
_ / \ //
к
HC-S S-CH
2
^C-O O-C^
I HO
2
C^
U
CO
2
H
CH
2
OH
Ш к
Тетраэдрическое строение бис-(бензоилпирувато) бериллия (II)
IX) было установлено путем его разделения на оптические фор-
ы. Для тетраэдрических !комплексов в принципе возможны толь-
о оптические и невозможны геометрические изомеры. Однако
абильность лигандных групп в противоположность инертности
вязей углерода препятствует разделению на оптические изомеры
юбого тетраэдр ического комплекса, содержащего четыре различ-
ые монодентатные группы.
Тетраэдрические комплексы ионов переходных металлов обыч-
0 устойчивы только при некоторых определенных условиях. Oco-
ое исключение представляют ионы [FeCl
4
]
2-
, [CoX
4
]
2-
(Х = С1, Br,
, NCS) и некоторые ионы [CoX
3
(H
2
O)]
-
; эти частицы сохраняют
водном растворе тетраэдрическую геометрию, хотя можно было
>ы ожидать их акватации с образованием октаэдричеоких ионов.
Тричина их устойчивости неизвестна*. Тетраэдрические анионы,
экие, как [CuX
4
]
2-
, [NiX
4
]
2-
, [VX
4
]
-
и [MnX
4
]
2-
(Х =
С1,
Br, 1),
:табилизируются в слабо координирующихся растворителях,
1 также в твердом состоянии объемистыми !катионами, например
(C
6
H
5
)
3
(CH
3
)P]+, [(C
6
H
5
)
4
As]+ и [(C
4
H
9
)
4
N]+. Ни один из них
ie сохраняет этой геометрии в координирующихся растворителях,
таких, как вода или спирты. Большинство тетраэдрических ком-
плексов— анионы или нейтральные молекулы, [MX
4
]
2-
, [MLX
3
]
-
или [ML
2
X
2
], где M — Со, Ni или Fe, L — нейтральный лиганд
(H
2
O, пиридин, POR
3
, AsOR
3
, PR
3
, AsR
3
, NR
3
), а X — анион, обыч-
но галогенид. Известны лишь очень немногие тетраэдрические
катионные комплексы, но Co(H
2
O)
4
"
1
" содержится в малых количе-
ствах в водном растворе в равновесии с Co(H
2
O)I
+
, а тетраэдри-
ческий [Co(NH
3
)
4
]
2
+ найден в [Co(NH
3
)
4
] (ReO
4
)
2
. Иногда би-
дентатные лиганды могут образовывать с Co(II), а иногда и
с Ni(II) тетраэдрические комплексы под влиянием объемистых
заместителей, например бис- (N-изопропилсалицилальдимина-
* В случае комплексов типа [CoX
4
]
2-
большую роль может играть стабили-
зация полем лигандов центрального иона с конфигурацией d
1
. — Прим. ред.
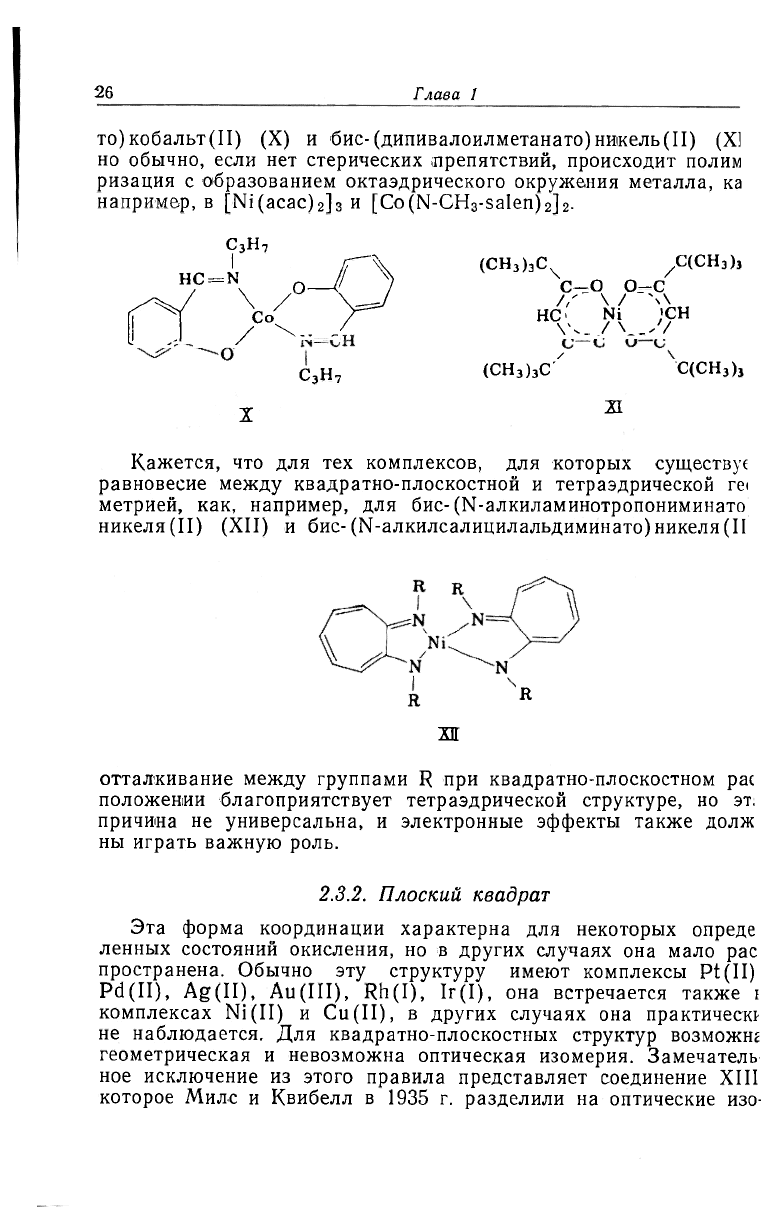
26
Глава 1
то)кобальт(П) (X) и бис-(дипивалоилметанато)никель(II) (Xi
но обычно, если нет стерических препятствий, происходит полим
ризация с образованием октаздрического окружения металла, ка
например, в [Ni(acac)
2
]
3
и [Co(N-CH
3
-Salen)
2
J
2
-
нс_Г
0
_Г\ <
сн
»'\
0 0
V
C<CHi
"
rf >< ^ < к >
C
3
H
7
(CH
3
)
3
C C(CH
3
)
1
Z ш
Кажется, что для тех комплексов, для которых существуе
равновесие между квадратно-плоскостной и тетраэдрической ге<
метрией, как, например, для бис-(N-алкиламинотропониминато
никеля(II) (XII) и бис-(N-алкилсалицилальдиминато)никеля(II
R
M
отталкивание между группами R при квадратно-плоскостном рас
положении благоприятствует тетраэдрической структуре, но эт,
причина не универсальна, и электронные эффекты также долж
ны играть важную роль.
2.3.2. Плоский квадрат
Эта форма координации характерна для некоторых опреде
ленных состояний окисления, но в других случаях она мало рас
пространена. Обычно эту структуру имеют комплексы Pt(II)
Pd(II), Ag(II), Au(III), Rh(I)
1
Ir(I), она встречается также i
комплексах Ni(II) и Cu(II), в других случаях она практичеста
не наблюдается. Для квадратно-плоскостных структур возможна
геометрическая и невозможна оптическая изомерия. Замечатель
ное исключение из этого правила представляет соединение XIII
которое Миле и Квибелл в 1935 г. разделили на оптические изо-
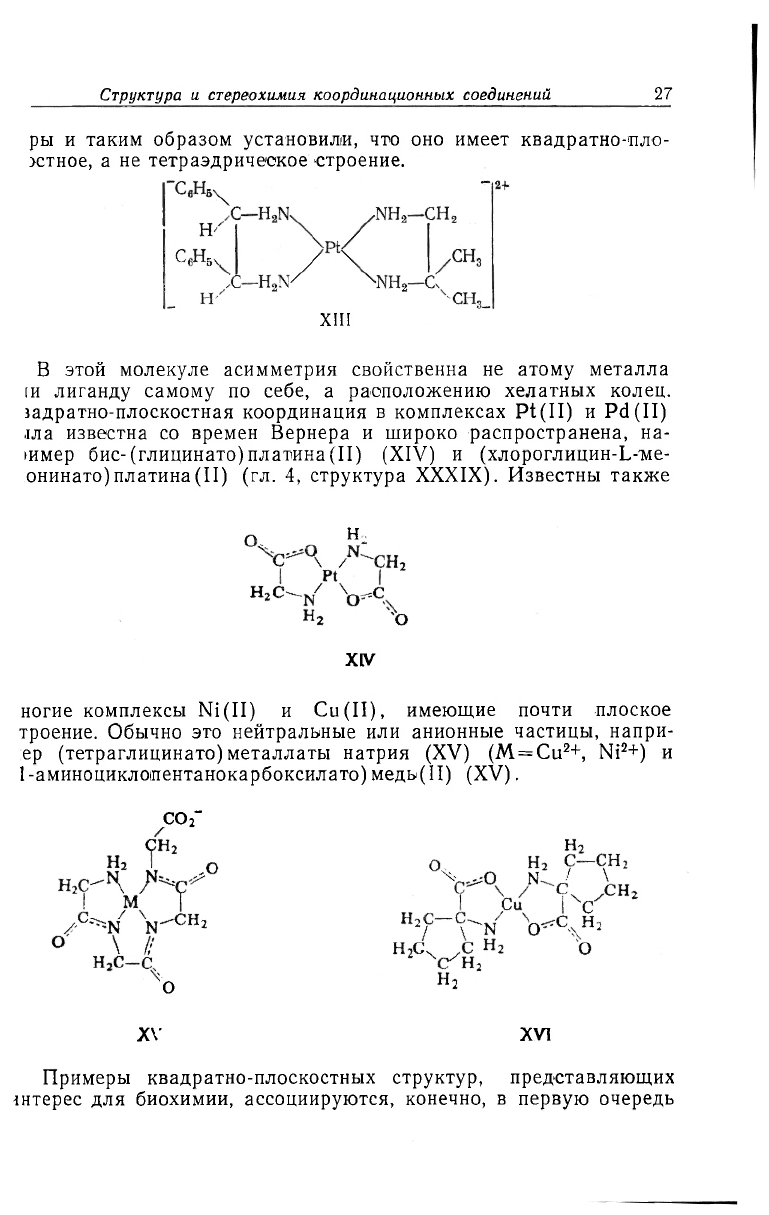
Структура и стереохимия координационных соединений.
27
ры и таким образом установили, что оно имеет квадратно-'пло-
>стное, а не тетраэдрическое строение.
В этой молекуле асимметрия свойственна не атому металла
[и лиганду самому по себе, а расположению хелатных колец,
задратно-плоскостная координация в комплексах Pt(II) и Pd(II)
.1ла известна со времен Вернера и широко распространена, на-
»имер бис-(глицинато)платина(II) (XIV) и (хлороглицин-Ь-ме-
онинато)платина(II) (гл. 4, структура XXXIX). Известны также
ногие комплексы Ni(II) и Cu(II), имеющие почти плоское
троение. Обычно это нейтральные или анионные частицы, напри-
ер (тетраглицинато) металлаты натрия (XV) (M = Cu
2
+, Ni
2
+) и
1-аминоциклопентанокарбоксилато)медь(П) (XV).
XIII
H
XlV
COf
о
XV
XVI
Примеры квадратно-плоскостных структур, представляющих
IHTEPEC для биохимии, ассоциируются, конечно, в первую очередь
28
Глава 1
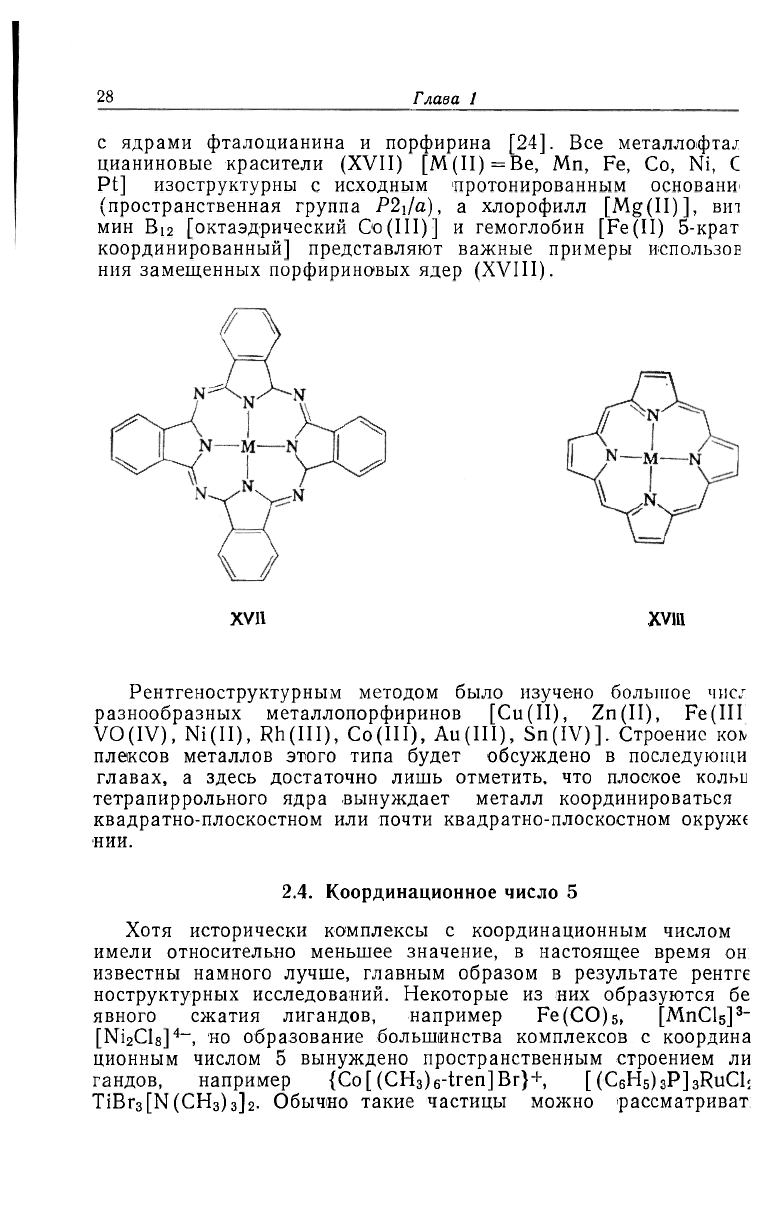
с ядрами фталоцианина и порфирина [24]. Все металлофта/
цианиновые красители (XVII) [M(II)=Be, Mn, Fe, Со, Ni, С
Pt] изоструктурны с исходным протонированным основанИ'
(пространственная группа P2Ja), а хлорофилл [Mg(II)], вит
мин Bi
2
[октаэдрический Oo(III)] и гемоглобин [Fe(II) 5-крат
координированный] представляют важные примеры ИСПОЛЬЗОЕ
ния замещенных порфириновых ядер (XVIII).
Рентгеноструктурным методом было изучено большое чис/
разнообразных металлопорфиринов [Cu(II), Zn(II), Fe (III
VO(IV), Ni(II), Rh(III), Co(III), Au(III), Sn(IV)]. Строение ко\
плексов металлов этого типа будет обсуждено в последующи
главах, а здесь достаточно лишь отметить, что плоское кольи
тетрапиррольного ядра вынуждает металл координироваться
квадратно-плоскостном или почти квадратно-плоскостном окружс
Хотя исторически комплексы с координационным числом
имели относительно меньшее значение, в настоящее время он
известны намного лучше, главным образом в результате рентге
ноструктурных исследований. Некоторые из них образуются бе
явного сжатия лигандов, например Fe (СО)
5,
[MnCls]
3-
[Ni
2
Cl
8
]
4-
, но образование большинства комплексов с координа
ционным числом 5 вынуждено пространственным строением ли
гандов, например {Со[ (CH
3
)
6
-tren] Br}+, [ (C
6
H
5
)
3
P]
3
RuCl
:
TiBr
3
[N (CH
3
)
3
J
2
. Обычно такие частицы можно рассматриват
XVIl
.XViLl
НИИ.
2.4. Координационное число 5
Структура и стереохимия координационных соединений.
29
CH
CH
3
XlX
XX
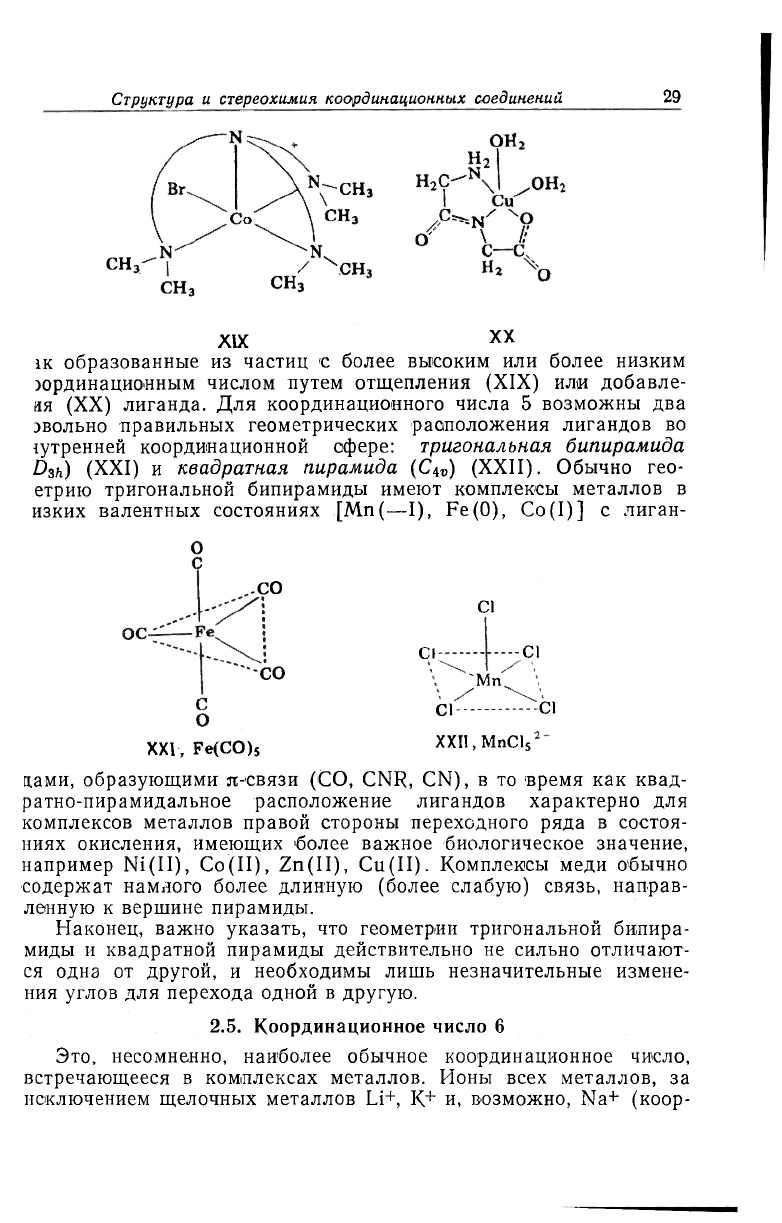
IK образованные из частиц с более высоким или более низким
хфдинационным числом путем отщепления (XIX) или добавле-
ия (XX) лиганда. Для координационного числа 5 возможны два
эвольно правильных геометрических расположения лигандов во
!утренней координационной сфере: тригональная бипирамида
D
3h
) (XXI) и квадратная пирамида (C
iv
) (XXII). Обычно гео-
етрию тригональной бипирамиды имеют комплексы металлов в
изких валентных состояниях [Mn(—I), Fe(O), Co(I)] с лиган-
.CO
-со
Cl
Cl-
-Cl
Cl-
"Mn
-Cl
XXl, Fe(CO)
5
XXII, MnCl
5
пами, образующими я-связи (СО, CNR, CN), в то время как квад-
ратно-пирамидальное расположение лигандов характерно для
комплексов металлов правой стороны переходного ряда в состоя-
ниях окисления, имеющих более важное биологическое значение,
например Ni(II), Co(II), Zn(II), Cu(II). Комплексы меди обычно
•содержат намного более длинную (более слабую) связь, направ-
ленную к вершине пирамиды.
Наконец, важно указать, что геометрии тригональной бипира-
миды и квадратной пирамиды действительно не сильно отличают-
ся одна от другой, и необходимы лишь незначительные измене-
ния углов для перехода одной в другую.
2.5. Координационное число 6
Это, несомненно, наиболее обычное координационное число,
встречающееся в комплексах металлов. Ионы всех металлов, за
исключением щелочных металлов Li+, K
+
и, возможно, Na+ (коор-
30
Гл'' -a /
динационное число 4), очень больших лантанидов (координацио
ное число 9) .1 ионов группы урана (>10) в водных раствор;
XXlU XXlV
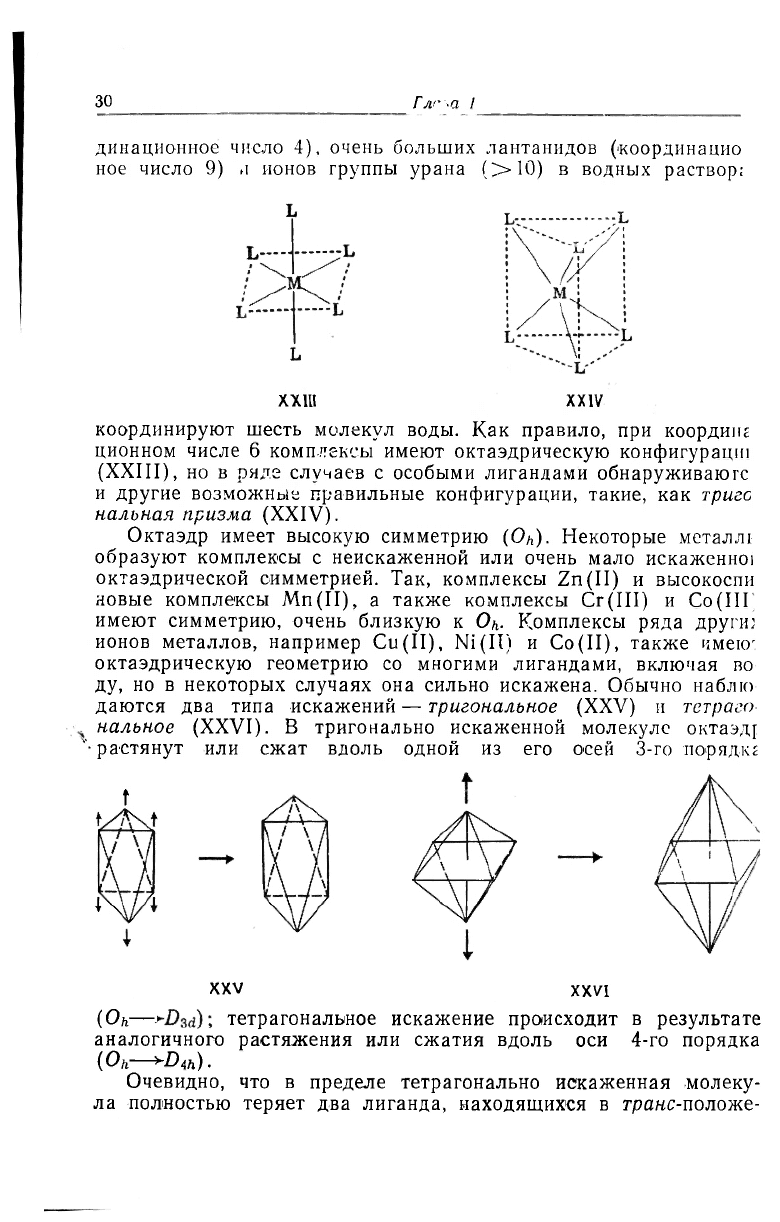
координируют шесть молекул воды. Как правило, при коордипг
ционном числе 6 комплексы имеют октаэдрическую конфигурацш
(XXIII), но в ряде случаев с особыми лигандами обнаруживают
и другие возможные правильные конфигурации, такие, как тригс
нальная призма (XXIV).
Октаэдр имеет высокую симметрию (О/,). Некоторые металл!
образуют комплексы с неискаженной или очень мало искаженно!
октаэдрической симметрией. Так, комплексы Zn(II) и высокоспи
новые комплексы Mn(II), а также комплексы Cr(III) и Со(Ш
имеют симметрию, очень близкую к Oh- Комплексы ряда други;
ионов металлов, например Cu(II), Ni(Il) и Co(II), также имею-
октаэдрическую геометрию со многими лигандами, включая во
ду, но в некоторых случаях она сильно искажена. Обычно наблю
даются два типа искажений — тригональное (XXV) и тетраго-
нальное (XXVI). В тригонально искаженной молекуле октаэдр
•растянут или сжат вдоль одной из его осей 3-го пор яд к г
t
XXV
XXVI
(Он—тетрагональное искажение происходит в результате
аналогичного растяжения или сжатия вдоль оси 4-го порядка
(O
h
-^D
4h
).
Очевидно, что в пределе тетрагонально искаженная молеку-
ла полностью теряет два лиганда, находящихся в транс-положе-
Структура и стереохимия координационных соединений
31
и, и приобретает координационное число 4 и геометрию пло-
эго квадрата. Октаэдрические комплексы могут проявлять как
^метрическую, так и оптическую изомерию, этот вопрос обсуж-
ется в разд. 5.
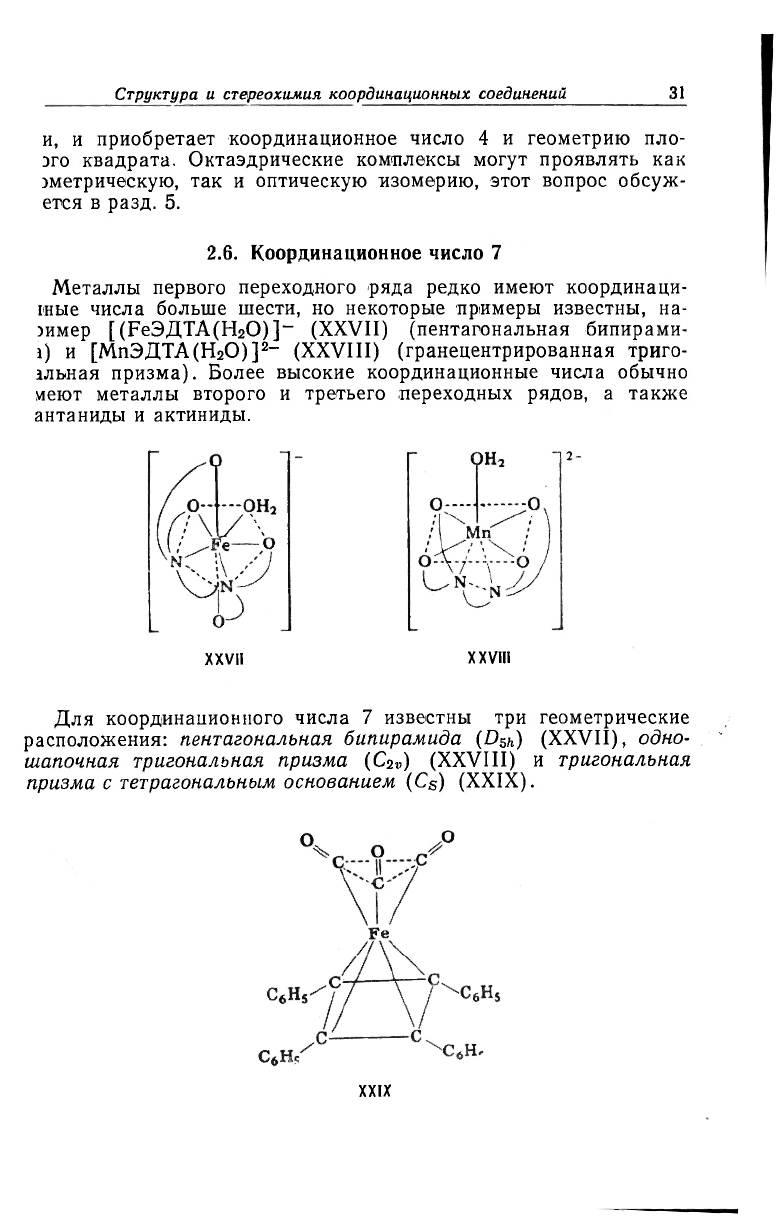
2.6. Координационное число 7
Металлы первого переходного ряда редко имеют координаци-
шые числа больше шести, но некоторые примеры известны, на-
эимер [(РеЭДТА(H
2
O)]
-
(XXVII) (пентагональная бипирами-
i) и [МпЭДТА(H
2
O)]
2-
(XXVIII) (гранецентрированная триго-
альная призма). Более высокие координационные числа обычно
меют металлы второго и третьего переходных рядов, а также
антаниды и актиниды.
XXVll XXVlIl
Для координационного числа 7 известны три геометрические
расположения: пентагональная бипирамида (D
5
h) (XXVII), одно-
шапочная тригональная призма (C
2ll
) (XXVIII) и тригональная
призма с тетрагональным основанием (C
s
) (XXlX).
XXIX
32
Глава 1
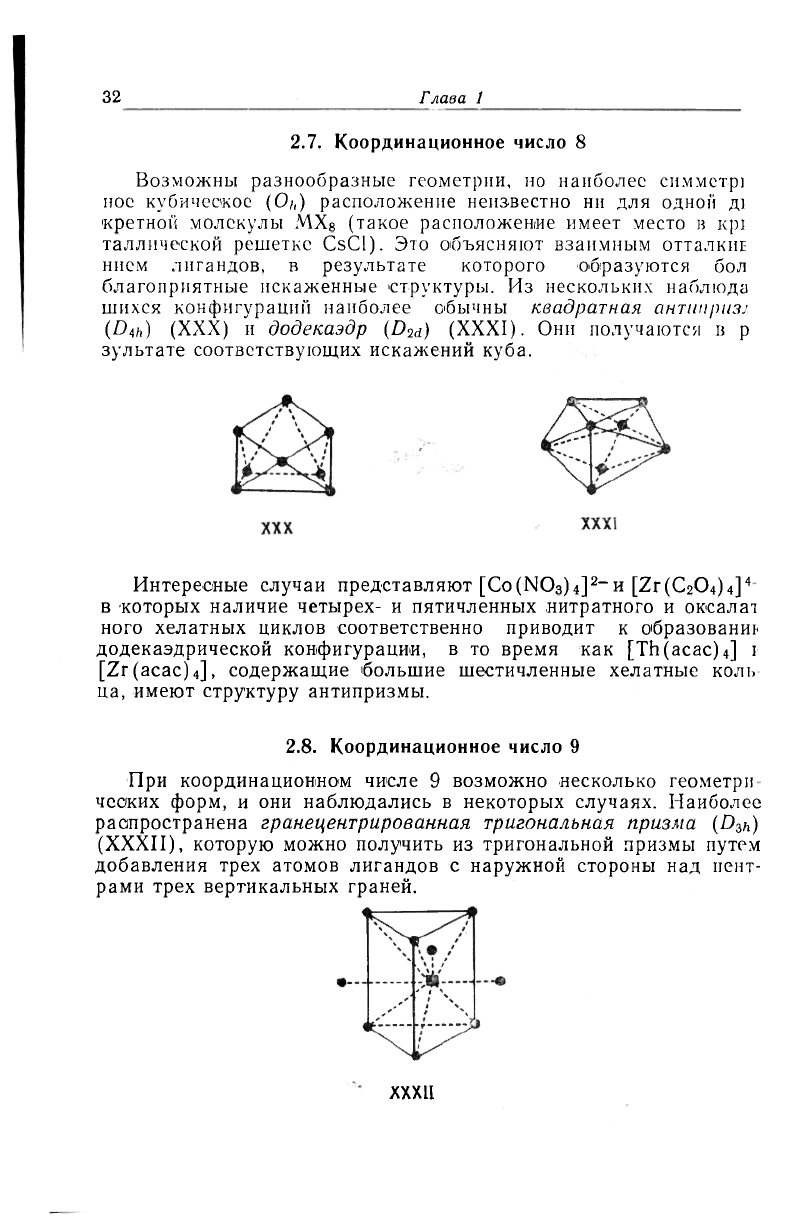
2.7. Координационное число 8
Возможны разнообразные геометрии, но наиболее симметр1
ное кубическое (О/,) расположение неизвестно ни для одной д)
кретной молекулы MX
8
(такое расположение имеет место в Kpi
таллической решетке CsCl). Это объясняют взаимным отталкиЕ
нием лигандов, в результате которого образуются бол
благоприятные искаженные структуры. Из нескольких наблюда
шихсх конфигураций наиболее обычны квадратная антиприз;
(D
4h
) (XXX) и додекаэдр (D
2d
) (XXXI). Они получаются в р
зультате соответствующих искажений куба.
Интересные случаи представляют [Co(NOs)
4
]
2-
H [Zr(C
2
O
4
)
4
]
4
в которых наличие четырех- и пятичленных ,нитратного и оксалат
ного хелатных циклов соответственно приводит к образование
додекаэдрической конфигурации, в то время как [Th(acac)
4
] г
[Zr(acac)
4
], содержащие большие шеетичленные хелатные коль
ца, имеют структуру антипризмы.
2.8. Координационное число 9
При координационном числе 9 возможно несколько геометри
чсоких форм, и они наблюдались в некоторых случаях. Наиболее
распространена гранецентрированная тригональная призма (D
3
h)
(XXXII), которую можно получить из тригональной призмы путем
добавления трех атомов лигандов с наружной стороны над цент-
рами трех вертикальных граней.
XXXlI
