Эйхгорн Г. (ред.) Неорганическая биохимия. Том 1
Подождите немного. Документ загружается.


ВВЕДЕНИЕ
Термин «бионеорганическая химия» впервые появился как на-
звание ряда недавно состоявшихся симпозиумов, а также как за-
главие нового научного журнала. Название настоящей моногра-
фии было задумано еще до появления «изомеров связи» (см.
гл. 1, разд. 5.1.1,6). Можно было бы последовать уже установив-
шейся тенденции, но вместо этого было решено сохранить пред-
полагавшееся ранее название этой книги. Одна из причин такого
решения заключалась в том, что существование двух названий
иллюстрирует различные ударения, которые биохимики и химики-
неорганики могут делать на различных составных частях этого
названия. Первые смотрят на неорганическую химию как на сред-
ство объяснения химического поведения комплексов металлов с
биологическими молекулами. Вторые рассматривают биохимию
как область, в которой могут найти подходящее применение их
открытия. Окончательный результат этих двух подходов, конечно,
один и тот же, аналогично тому как названия «изомеров связи»
имеют одно и то же значение. Однако исходная точка ученого
важна для определения того, что именно он должен узнать для
достижения своей цели, и поэтому для того, что он откроет на
этом пути.
Главное различие между химиками-неорганиками и биохими-
ками заключается в том, что первые обычно имеют дело с малы-
ми молекулами, которые иногда можно рассматривать как «моде-
ли» более сложных систем, которыми занимаются вторые. Фунда-
ментальный вопрос, с которым постоянно сталкиваются неоргани-
ческие биохимики, состоит в том, имеет ли смысл изучать модели,
если в наличии имеются «природные» вещества.
Для того чтобы ответить на этот вопрос, необходимо реалисти-
чески оценить методы, с помощью которых были выяснены био-
логические механизмы. Живая клетка так сложна, что ее функ-
ционирование можно понять только путем изолирования ее от-
дельных частей, причем всегда неизбежен риск, что изолированная
часть функционирует иначе, чем в клетке. Поэтому изолирован-
ные компоненты представляют «модели» этих компонентов в

14
Введение
клетке. Например, цитохром с in vitro в действительности npej
ставляет модель цитохрома с в клетке. Но весьма вероятно, чт
многие характеристики изолированного цитохрома с одинаковы
характеристиками клеточного цитохрома с. Действительно, поел
того как были выделены и изучены все другие молекулы, с коте
рыми связан цитохром с в клетке, стало понятно поведение цк
тохрома с в клетке.
Таким же образом неорганическое соединение, например про
стой порфириновый комплекс, который может принимать участи
в переносе электрона и, возможно, с тем же окислительным по
тенииалом, что и изолированный цитохром с, может служить мо
делью цитохрома с, в то время как механизм переноса электрон;
цитохромом с еще не понятен. Изучение простого порфириновоп:
комплекса может помочь пониманию изолированного цитохрома с
а исследование изолированного цитохрома с в свою очередь мо-
жет помочь пониманию клеточного цитохрома с. Имея в виду та-
кую перспективу, можно полагать, что модели могут быть полез-
ны на всех уровнях. Конечно, при исследовании моделей необхо-
димо помнить об ограничении, которое представляет аксиому: мо-
дель системы не является самой системой. Химики-неорганики,
так же как и биохимики, могут внести положительный вклад,
если будут помнить об этом ограничении, и отрицательный вклад,
если они о нем забудут.
Хотя в данной работе основное внимание уделяется биологи-
ческим системам, в ней рассматриваются также многие модели,
иногда в отдельных главах, а иногда параллельно с природными
веществами, для конкуренции с которыми они предназначены.
Часто делаются корреляции, надеюсь — имея в виду приведенное
выше ограничение. Если существование неорганической биохимии
имеет какой-либо смысл, то такие корреляции должны приводить
к плодотворным результатам.
Тогда — в чем заключается важность этих результатов? В чем
состоит основная цель неорганической биохимии?
На эти вопросы можно ответить, рассмотрев пограничную об-
ласть этой части биологической науки. Существуют две цели
изучения биологической науки. Первая, как во всех открытиях, —
изучить явление, потому, что оно существует, понять, как устроены
вещи. Второе — добиться понимания нормальных и аномальных
процессов, происходящих в клетке, которое в конечном итоге
должно привести к победе над болезнью. Эти цели неорганиче-
ская биохимия разделяет с другими биологическими науками*.
Любознательность ученого и его желание быть причастным к дан-
* Неорганическая биохимия может иметь и другие прикладные аспекты,
в частности решение вопросов, связанных с сельскохозяйственным производством
Ii охраной от загрязнений окружающей среды. — Прим. ред.

Введение
15
зму вопросу в истории часто заставляют его руководствоваться
гими обеими целями.
В этой монографии не сделано никаких попыток дать перечень
рименений неорганической биохимии в медицине, частично из-за
эго, что мы считали такие попытки выходящими за рамки данной
ниги. Ранее были опубликованы обзоры, касающиеся фармако-
огических и пищевых аспектов координационной химии [1, 2].
'ем не менее во введении мы хотим привести некоторые примеры,
иллюстрирующие практическое следствие изучения неорганиче-
:кой биохимии.
Наиболее наглядное и широко распространенное использова-
ше комплексообразующих агентов в медицине — это выведение
!ежелательных ионов металлов из организма. Такие лиганды, как
этилендиаминтетрауксусная кислота, пеницилламин и т. п., ис-
пользуются при лечении заболеваний, связанных с избыточным
содержанием железа или меди (гл. 10), а также при борьбе с ток-
сичным влиянием проникших в организм ионов металлов [3—5].
Недавно было обнаружено, что применение пеницилламина
может привести к резкому понижению остроты восприятия вкуса
[6—8]. Однако этого не наблюдается при лечении болезни Виль-
сона, при которой происходит накопление ионов Cu(II) в организ-
ме (гл. 10). Была выдвинута гипотеза, что понижение остроты
восприятия вкуса обусловлено связыванием ионов меди в ком-
плекс и, следовательно, ионы меди каким-то образом принимают
участие в продуцировании вкусовых ощущений. Отсутствие пони-
жения остроты восприятия вкуса при болезни Вильсона обуслов-
лено столь высоким содержанием Cu
2
+, что применение пени-
цилламина не может превысить влияние Cu
2
+. Если эта гипотеза
правильна, то применение Cu(II) должно восстановить остроту
восприятия вкуса, потерянную в результате действия комплексо-
образующих агентов. Эксперименты показали, что ионы меди дей-
ствительно восстанавливают восприятие вкуса; более того, ионы
Zn(II) и Ni(II) действуют аналогичным образом и восстанавли-
вают чувство вкуса, потерянное вследствие лечения пенициллами-
ном или из-за болезни. Таким образом, ионы металлов, по-види-
мому, имеют отношение к продуцированию чувства вкуса [4].
Недавно было обнаружено, что некоторые комплексы платины
обладают потенциальной антиканцерогенной активностью [9].
Активными являются комплексы цис-[Pt
11
(NH
3
)
2
Cb], [Pt
u
enCl2],
цис- [Pt
11
(NH
3
)
2
Cl
4
] и [Pt
Iv
enCl
4
]*. С другой стороны,
[Pt
11
(NH
3
)
4
] Cl
2
и транс- [Pt
iv
(NH
3
)
2
Cl
4
] неактивны. Активность
в ингибировании развития опухоли коррелировалась с ингибиро-
ванием репликации ДНК [10] (гл. 34). Нет необходимости гово-
еп — этилендиамин.

16
Введение
р'ить, что эти биологические явления представляют несомненны
интерес для химиков-неоргаников.
Следует ожидать, что такие открытия, как применение ионе
металлов для восстановления восприятия вкуса или применени
комплексов металлов для рассасывания опухоли, должны стим>
лировать развитие неорганической биохимии.
СПИСОК ЛИТЕРАТУРЫ
1. Chaberek S., Martell A. E., Organic Sequestering Agents, Wiley, New York, 195£
p. 416.
2. Schulman A., Dwyer F. P., in F. P. Dwyer, D. P. Mellor (eds.), Chelatinf
Agents and Metal Chelates, Academic Press, New York, 1964, p. 383.
3. Seven M. J., Johnson L. A. (eds.), Metal Binding in Medicine, Lippincott, Phi
ladelphia, 1960.
4. Johnson L. A., Seven M. J. (eds.), Federation Proc., № 3, 20 (1961).
5. Gross F. (ed.), Iron Metabolism, Springer Verlag, Berlin, 1964.
6. Henkin R. I., Keiser H. R., Jaffe I. A., Sternlieb /., Scheinberg I. A., Lancet,
1967, 1268.
7. Henkin R. I., Bradley D. F., Proc. Natn. Acad. Sci. U. S., 62, 30 (1969).
8. Henkin R. I., Graziadei P. P. G., Bradley D. F., Ann. Internal Med., 71, 791
(1969).
9. Rosenberg B., van Camp L., Trosko J. E., Mansour V. H., Nature, 222, 385
(1969).
10. Harder H. C., Rosenberg B., Int. J. Cancer, 6, 207 (1970). Earlier references
can be found in this paper.

LCTb I
КООРДИНАЦИОННАЯ ХИМИЯ*
IABA 1
СТРУКТУРА И СТЕРЕОХИМИЯ
КООРДИНАЦИОННЫХ СОЕДИНЕНИЙ
Д. А. Букингем
Buckingham D. A., Research School of Chemistry, Australian
National University, Canberra, Australia
I. ВВЕДЕНИЕ
Знание структуры и стереохимии важно для всех отраслей хи-
1ии, так как позволяет лучше понять свойства химических со-
динений в основном состоянии, а в некоторых случаях — и в воз-
>ужденном состоянии. В неорганической координационной химии
акая информация имела огромное значение для развития теорий
соординационной связи, т. е. связи между донорным атомом или
щнорными атомами лиганда и атомом металла. Однако знание
структуры само по себе недостаточно для определения химической
:вязи, и в настоящее время эта область координационной химии
заходится на ранней стадии развития. Более результативным бы-
ло применение структурных исследований к реагентам, продуктам
и переходным состояниям химических реакций. В этой области
химической динамики структурные исследования сочетали с ки-
нетическими для того, чтобы понять механизмы химических ре-
акций, которых так много предложила неорганическая координа-
ционная химия. Такой подход особенно желателен по отношению
к предмету, рассматриваемому в этой книге, поскольку ионы ме-
таллов необходимы для многих биологических процессов, но ме-
ханизм их участия в большинстве случаев неизвестен. В данной
* Сокращения, использованные в этой главе: en — этилендиамин; рп—1,2-
диаминопропан; dien — диэтилентриамин; trien — триэтилентетрамин; tetraen —
тетраэтиленпентамин; асас — ацетилацетон; salen — салицилальэтилендиамин;
dpm-— дипивалоилметан; Gly — глицин; Gly-Gly — глицилглицин; ру — пиридин;
dipy — дипиридил; terpy — терпиридил; diars — диарсин; ЭДТА — этилендиамин-
тетрауксусная кислота; СН
3
-еп — метилэтилендиамин; tren — N(CH
2
CH
2
NH
2
)
3
;
urea — мочевина; ПДТА — пропилендиаминтетрауксусная кислота; ОЭДТА —
Ы'-(2-оксиэтил)этилендиамин-Ы^,№-триуксусная кислота; асагп — ацетамид;
glyam — глицинамид; sal — салицилальдегид; bzp — бензоилпируват; sarc — сар-
козинат; bdam — бутандиамин; tn — триметилендиамин; ох — оксалат; sar — сар-
козин; ditn — дитриметилендиамин.
2—2451

18
Глава 1
главе будут кратко рассмотрены некоторые классические понят!
развитые в неорганической координационной химии для описан
и обсуждения стереохимии неорганических комплексов, для TOI
чтобы эти принципы были ясны при чтении последующих глг
Во вступительной главе невозможно рассмотреть детально в
аспекты стереохимии неорганических комплексов, подробное )
изложение можно найти в учебниках [1—7, 53—55]. Поэтому м
намерены дать не полный обзор, а лишь иллюстрации к тс
общим понятиям, которые, как мы полагаем, должны быть нао
более полезны читателю этой книги: координационное число
геометрия, тип лиганда, факторы, влияющие на стереохимию ко>
плексов, и различные типы изомерии координационных соедит
ний. Стереохимические аспекты координационных соединенш
подобно другим областям неорганической химии, в настоящее Bpi
мя интенсивно развиваются, в частности, в том, что касается or
ределения структуры, конформационного анализа, изучения те[
модинамики и кинетики взаимопревращения структур. Здесь н
будет дано строгого обсуждения этих вопросов, за более подро
г
ной информацией читатель отсылается к работам [2, 8—17].
Атомы или группы атомов, окружающие центральный ато?
металла, называются лигандами, а атомы, йепосоедственно при
соединенные к металлу, называются донорньши атомами. Донор
ные атомы обычно менее электроотрицательны, чем металл*, в ре
зультате чего преобладающими чертами их взаимодействи;
являются электростатическое притяжение и некоторое перераспре
деление заряда к металлу (ковалентность). Лиганды — это обыч
но нейтральные или отрицательно заряженные молекулы. Ком
плексные соединения характеризуются сохранением их индиви-
дуальности в растворе, хотя возможна также заметная
диссоциация. Пространственное расположение лигандов вокруг
центрального иона называется конфигурацией комплекса, некото-
рые более детализированные аспекты стереохимии лиганда (без-
относительно к иону металла) обычно обсуждаются в терминах
конформаций лиганда. Общее число донорных атомов, присоеди-
ненных к центральному атому металла, называется координацион-
ным числом**. В это число включаются все донорные атомы, на-
ходящиеся от металла на расстоянии химической связи, хотя не-
которые из этих атомов могут располагаться дальше от металла,
чем другие, а некоторые из них смогут координироваться более чем
с одним атомом металла, как в кристаллах и полимерных коорди-
национных соединениях. Если известна стереохимия, то координа-
* Ошибка автора: донорные атомы (кислород, азот и др.) обычно более
электроотрицательны, чем атомы металлов. — Прим. ред.
** Это, конечно, слишком упрощенное определение, не затрагивающее, на-
пример, обширный класс я-комплексов. Следуя автору, пришлось бы приписать
атому хрома в Cr (C
e
H
6
)2 координационное число 12. — Прим. ред.

Структура и стереохимия координационных соединений
19
юнное число атома металла определяется однозначно, но стерео-
[мия определяется не только координационным числом. Оба
ойства зависят от природы связи металл—лиганд, но обсужде-
ie этого более фундаментального свойства выходит за пределы
шной главы [18—22]. Структура комплексного соединения оп-
зделяется однозначно, если известны координационное число ден-
тального атома металла, стереохимия и конформации присоеди-
енных к нему лигандов. В настоящее время такая детальная
нформация ограничена твердым состоянием (методы дифрак-
ии), о структуре лигандов в растворе известно мало.
Возможно, наиболее важным понятием, связанным с коорди-
ационными соединениями и контролирующим их, является льюи-
OiBCK а я кислотность иона металла. Это понятие будет расомотре-
о в гл. 2, а здесь достаточно сказать, что комплексы непереход-
;ых металлов (Na+, K
+
, Ca
2
+, Mg
2
+, Ba
2
+, Al
3
+) удерживаются
!месте с электростатическими силами* и их стереохимия опреде-
[яется почти исключительно размером лиганда и зарядом на ионе
металла. Устойчивости комплексных ионов изменяются парал-
гельно с основностью протонов лигандов, и эффективная роль
юна металла подобна таковой протона. Стереохимия комплексов
тереходных металлов более сложна, и в настоящее время не су-
ществует удовлетворительной эмпирической или теоретической
модели для детального описания всех аспектов их структуры или
даже стереохимии. Для многих из этих металлов ионная модель
усложняется тем, что их электронные облака не имеют сфериче-
ской формы (эффекты кристаллического поля), а также, что под-
разумевается в их названии, очень значительным отступлением от
ионного характера, связанным с переходом от ионной к ковалент-
ной связи. Для таких комплексов важна как нейтрализация за-
рядов, так и кислотность по Льюису, и для описания химической
связи в этих комплексах были развиты теория поля лигандов и
метод молекулярных орбиталей [2, 5].
2. КООРДИНАЦИОННОЕ ЧИСЛО И СТЕРЕОХИМИЯ
Начало развития структурной координационной химии относит-
ся к концу XVIII в. и связано с исследованиями двух замечатель-
ных химиков — датчанина С. М. Йоргенсена и швейцарца Альфре-
да Вернера. До этого времени было известно, что два или более
неорганических соединения могут соединяться в стехиометриче-
ских отношениях, образуя «комплексные соединения», но их обыч-
но писали как двойные соли, например ZnCl
2
-2CsCl, 2КС1-MgCl
2
,
Al
2
(SO
4
)
3
-K
2
SO
4
-24Н
2
0, Fe(CN)
2
-4KCN, A1F
3
-3KF, СоС1
2
-2КС1,
* В комплексах непереходных металлов (особенно Al
3
+, Be
2
+ и др.) боль-
шую роль играет также ковалеитная связь. — Прим. ред.
2*

20
Глава 1
хотя сегодня мы знаем, что формула некоторых из них долж
быть написана иначе, например K2C0CI4, ^HgF
4
, K
2
Fe(CN)
f
*
Вернер и Йоргенсен синтезировали сотни координационн
соединений, главным образом соединений Co(III), Pt(IV) и Pt(
с аминами, а также изучили их превращения, стег.г-чи i-юнизац
и наличие изомеров. В результате интенсивного соперничест
между этими двумя замечательными экспериментаторами бы.
быстро сформулированы структурные основы современной коо
динационной химии. Вернер в 1893 г. правильно объяснил CBI
результаты на основе понятий о первичной и вторичной валет
ности. Первичная валентность рассматривалась, в сущности, к;
нормальная электровалентность иона металла [например, 4 д.
Pt(IV), 2 для Pt(II) и 3 для Co(III)] и определяла общее WHCJ
отрицательных зарядов, которые должны быть привнесены пр
сутствующими анионами, в то время как вторичная валентное
обусловливала пространственное расположение связей вокр}
иона металла с образованием октаэдричеокой [Co(III), Pt(IV)
или квадратно-плоскостной [Pt(II)] геометрии. Вторичная валемг
ность теперь называется координационным числом.
Вернером были развиты следующие два наиболее важны
принципа: во-первых, каждому иону металла может быть nputii
сано только одно координационное число, которое удовлетворяем
ся присоединенными лигандами, и, во-вторых, эти координацией
ные места имеют определенное стерео химическое расположены
в пространстве. Эти две идеи имели исключительное значение дл.
развития стереохимических аспектов координационной химии. Таь
praseo- и ш'о/ео-формы CoCl
3
-4NH
3
были правильно отнесены i
транс- и цые-'изомерам [Со(NH
3
)
4
Cl
2
]Cl (группы внутри квадрат
ных скобок образуют октаэдрическую координационную сферу
а остающийся атом хлора удерживается электростатически
мн силами и может быть легко оттитрован, наприме[
[Co(NH
3
)
4
Cl
2
]
+
Cl
-
). На основе координационной теории Вернерг
удалось классифицировать все известные в то время данные с
комплексах металлов, а в последующие годы предположение Bep-
нера многократно подтверждалось рентгеноструктурными иссле-
дованиями. Однако в настоящее время известно, что их строгое
применение возможно не во всех случаях.
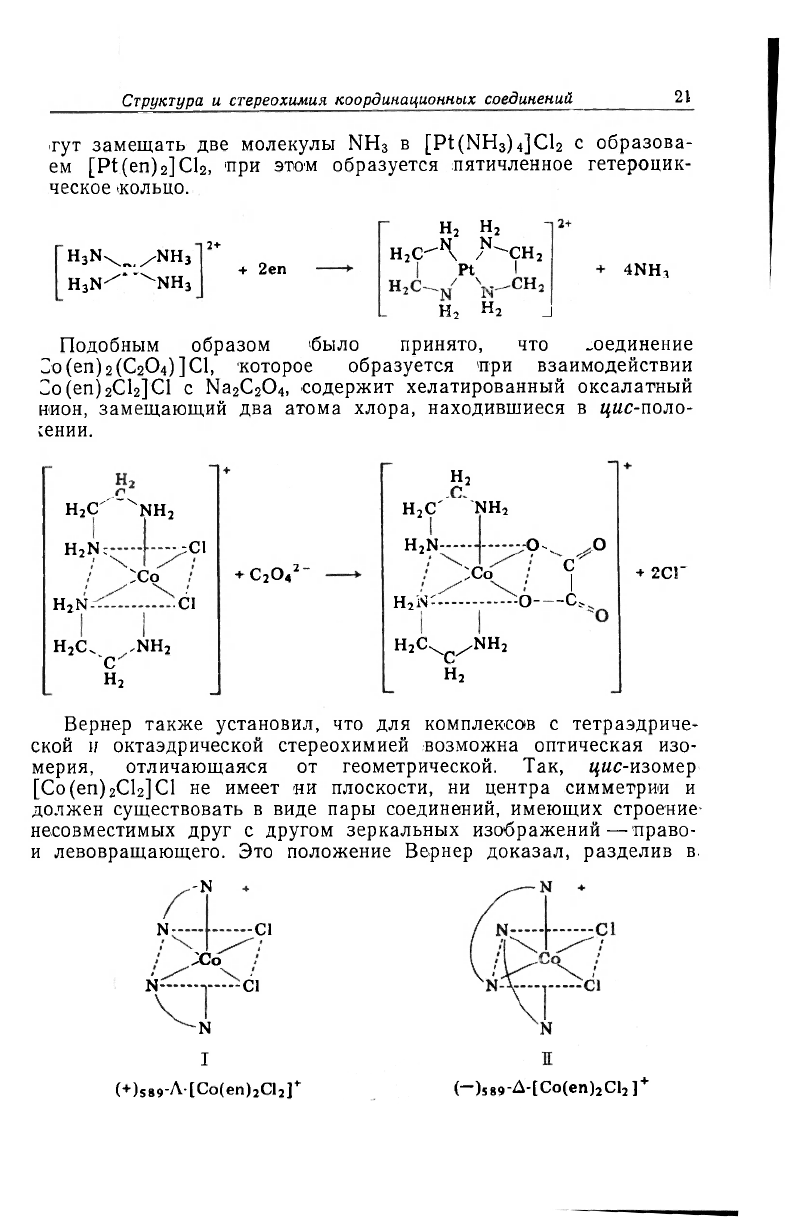
Вернером также были введены понятия хелатообразования
(или образование кольца) и оптической изомерии. Так, он обна-
ружил, что две функциональные аминные группы этилендиамина
* Часто невозможно отличить двойную соль и координационное соединение
по их поведению в водном растворе. Например, рентгеноструктурные данные
убедительно показывают, что в K
2
CoCl
4
четыре иона Cl
-
расположены вокруг
иона Co(II) по вершинам тетраэдра, но в воде этот комплекс быстро диссо-
циирует с образованием розового раствора иона [Co(H
2
O)
6
]
2+
, так что его пове-
дение в растворе сходно с поведением двойной соли.
Структура и стереохимия координационных соединений.
21
•гут замещать две молекулы NH
3
в [Pt(NH
3
)
4
JCl
2
с образова-
ем [Pt(en)
2
]Cl
2
, 'при этом образуется пятичленное гетероцик-
ческое окольцо.
H
3
N^ /NH
3
H
3
N^ ^NH
3
2+
+ 2еп
H
2
H
2
H
2
C
n
I /
n
^-CH
2
Pt I
H
2
Н
2 J
4NH,
Подобным образом было принято, что соединение
2o(en)
2
(C
2
O
4
)] Cl, которое образуется три взаимодействии
Со(еп)
2
С1
2
]С1 с Na
2
C
2
O
4
, содержит хелатированный оксалатный
вион, замещающий два атома хлора, находившиеся в цис-поло-
жении.
H
2
C' ^NH
2
H
2
N;
H
2
N-
H
2
C.
-Cl
;со
-Cl
,NH
2
с
H
2
+ C
2
O
4
2
H
2
H
2
C NH
1
H
2
N-
:.со
о- о
H
2
N
;
-O-
C
I
-С,
H
2
C
w
NH
2
v>
H
2
+ 2СГ
Вернер также установил, что для комплексов с тетраэдриче-
ской и октаэдрической стереохимией возможна оптическая изо-
мерия, отличающаяся от геометрической. Так, цис-изомер
[Со(еп)
2
С1
2
]С1 не имеет ни плоскости, ни центра симметрии и
должен существовать в виде пары соединений, имеющих строение-
несовместимых друг с другом зеркальных изображений — право-
и левовращающего. Это положение Вернер доказал, разделив в.
-N
N- -Cl
Xo
N
-Cl
N
I
(+)
589
-Л-[Со(еп)
2
С1
2
Г
(-)
589
-Д-[Со(еп)
2
С1
2
]
+

22
Глава 1
1911 г. с помощью d-бромкамфорсульфоната в качестве анис
оптические изомеры иона [Co(Bn)
2
NH
3
Cl]
2
+, а годом позже — т,
же ионов [Co(en)
2
Cl
2
]+, [Co(en)
2
(N0
2
)
2
]+и [Со(еп)
3
]
3
+.
Для того чтобы ответить на замечание Иоргенсена, что оп'
ческая активность этих комплексных ионов может быть обусл(
лена асимметрией окружения углеродных атомов, Вернер син-
зировал и разделил на оптические изомеры чисто неорганическ
комплексный ион(III)—для того времени значительный подв!
Точка зрения Вернера на координационное число и стерсох!
мию составляет основу современной координационной химии [1]
и для того, чтобы обсудить даже наиболее тонкие детали струк
туры комплексов металлов, необходимы лишь немногие дополни
тельные понятия. Большое число известных в настоящее врем!
комплексов и их разнообразие потребовали некоторых незначи
тельных изменений положений Вернера; наиболее существенно»
из них то, что для некоторых ионов металлов существуют более
чем одно координационное число и стереохимия. Так, для Cu(II)
возможны координационные числа 4, 5 и 6, а актиниды, такие
как U, могут иметь координационные числа от 5 до 20. Кроме то-
го, стереохимия определяется не только лигандом и ионом метал-
ла. Так, существует несколько комплексов Ni(II) с координацион-
ным числом 4, которые могут иметь тетраэдрическую или квад-
ратно-плоскостную структуру в зависимости от температуры и
(или) природы растворителя. Известно, что некоторые комплексы
Ni(II), Zn(II) и Co(II) могут иметь, в зависимости от экспери-
ментальных условий, тетраэдрическую, квадратно-плоскостную
или октаэдрическую геометрию.
Со времени Вернера было накоплено большое количество
структурных данных с целью определения координационных чи-
сел и более тонких деталей стереохимии. Не вызывающие сомне-
ний прямые данные о структуре в твердом состоянии получают
главным образом методом дифракции рентгеновских лучей, и эта
область координационной химии за последние десять лет получи-
ла огромное развитие; в литературе по неорганической химии
публикуется от 20 до 30 рептгеноструктурных исследований каж-
6 +
Со
Ж
