Эйхгорн Г. (ред.) Неорганическая биохимия. Том 1
Подождите немного. Документ загружается.


Киназы
673-
\це обязательным ионом металла может быть Mg, Mn, Ca или
Zo. Хотя раньше это и оспаривалось, однако теперь в результате
кинетических, термодинамических и ЯМР-исследований оконча-
тельно установлено, что металл связывается с ферментом не не-
тосредственно, а через нуклеотидный субстрат (тип I).
Больше всего работ выполнено с ферментом из мышц кро-
лика, который с хорошим выходом получается в кристаллическом
виде [65]. Он является димером с молекулярной массой 82 600 и,
по-видимому, образован из идентичных мономеров [66]. Диссо-
циация димера, наблюдаемая только в жестких денатурирующих
условиях, приводит к утрате активности и деструкции центра
связывания нуклеотида [62, 67]. Если же принять меры для за-
щиты сульфгидрильных групп, освобождающихся при денатура-
ции, то впоследствии удается восстановить в активном виде и
димерную форму. Считается, что глобула содержит два активных
центра (по одному на мономер), в которых имеется по одному
реакционноспособному остатку цистеина.
Выше уже рассматривались результаты кинетических исследо-
ваний фермента (разд. 2.2). Мы не будем обсуждать работы
группы Куби [66] и других лабораторий [68, 69], посвященные
белковой химии креатинкиназы. Основное внимание будет уделено
лишь тем сведениям, которые были получены методом магнит-
ного резонанса, а также при параллельных исследованиях.
В одной из первых работ Кон и Лей [34] использовали изме-
рения ЯМР и ЭПР для демонстрации образования комплекса
МпАДФ — фермент. Эти результаты были дополнены О'Суллива-
ном и Кон [35], которые, используя графический метод анализа
данных ЯМР, определили значения констант ассоциации фермен-
та с МпАДФ
-
и МпАТФ
2-
, хорошо согласующиеся с кинетиче-
скими результатами. Впоследствии благодаря использованию вы-
числительной техники в эти величины были внесены некоторые
поправки, не изменившие представления о наличии у фермента
двух активных центров [61, 70].
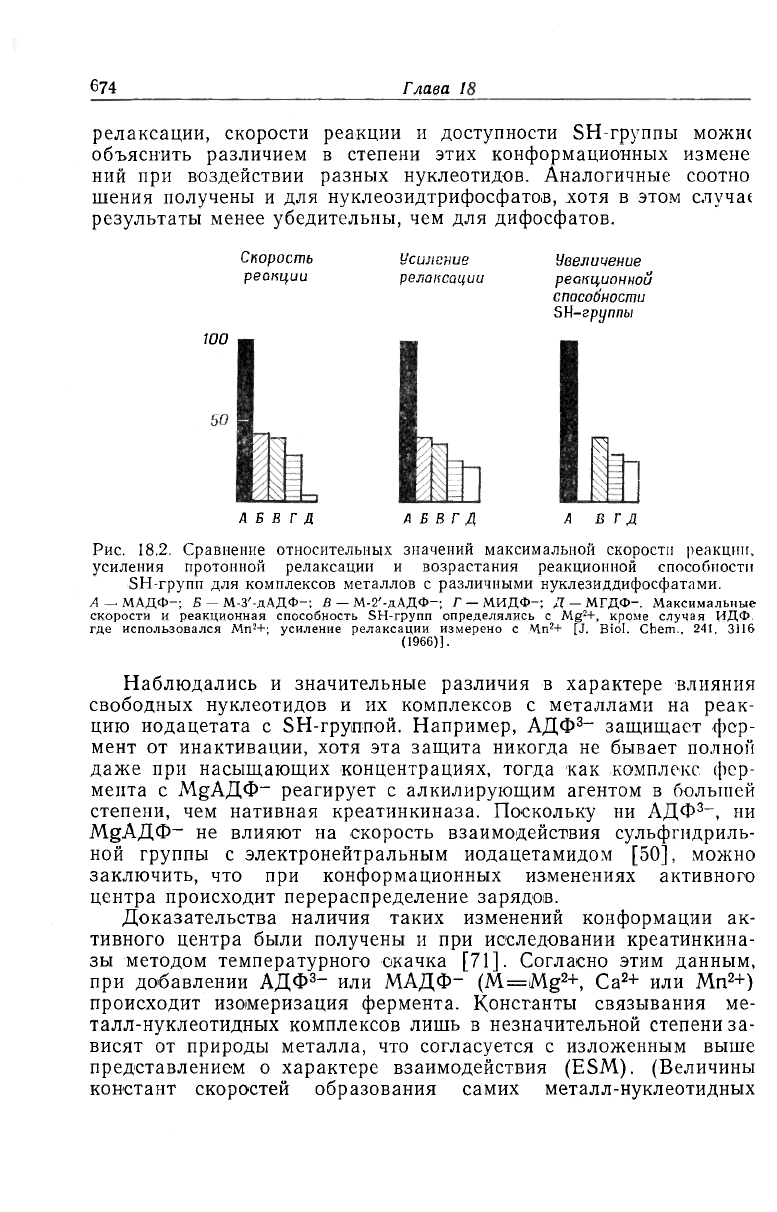
В работе [7] в качестве субстратов изучались различные
нуклеозиддифосфаты. Одновременно исследовалась способность
их марганцевых комплексов воздействовать на скорости релакса-
ции протонов воды. Были обнаружена строгая корреляция между
наблюдаемым усилением для соответствующего тройного комп-
лекса и способностью дифосфата участвовать в реакции в качест-
ве субстрата. Третья из исследованных в этой работе характери-
стик— способность металл-нуклеотидных комплексов влиять на
реакцию иодацетата с каталитической сульфгидрильной груп-
пой— подчиняется той же закономерности (рис. 18.2). Был сде-
лан вывод о том, что наблюдаемые явления — следствие конфор-
мационных изменений в активном центре фермента, индуцируе-
мых субстратами. Обнаруженные различия в усилении
'<674
Глава
17
релаксации, скорости реакции и доступности SH-группы можш
объяснить различием в степени этих конформационных измене
ний при воздействии разных нуклеотидов. Аналогичные соотно
шения получены и для нуклеозидтрифосфатов, хотя в этом случа(
результаты менее убедительны, чем для дифосфатов.
Скорость
реакции
Усиление
релаксации
Увеличение
реакционной
способности
SH-группы
100
И
А Б В Г Д А Б В Г Д
А В ГД
Рис. 18.2. Сравнение относительных значений максимальной скорости реакции,
усиления протонной релаксации и возрастания реакционной способности
SH-групп для комплексов металлов с различными нуклезиддифосфатами.
А — МАДФ-; Б — М-З'-дАДФ-; В — М-2'-дАДФ—, Г — МИДФ-; Д — МГДФ-. Максимальные
скорости и реакционная способность SH-групп определялись с Mg
1
+, кроме случая ИДФ.
где использовался Mn
2
+; усиление релаксации измерено с Mn
2
+ [J. Biol. Chem.. 241. 3116
(1966)].
Наблюдались и значительные различия в характере влияния
свободных нуклеотидов и их комплексов с металлами на реак-
цию иодацетата с SH-группой. Например, АДФ
3
~ защищает фер-
мент от инактивации, хотя эта защита никогда не бывает полной
даже при насыщающих концентрациях, тогда как комплекс фер-
мента с х\^АДФ
-
реагирует с алкилирующим агентом в большей
степени, чем нативная креатинкиназа. Поскольку ни АДФ
3
~, ни
MgAДф- не влияют на скорость взаимодействия сульфгндриль-
ной группы с электронейтральным иодацетамидом [50], можно
заключить, что при конформационных изменениях активного
центра происходит перераспределение зарядов.
Доказательства наличия таких изменений конформации ак-
тивного центра были получены и при исследовании креатинкина-
зы методом температурного окачка [71]. Согласно этим данным,
при добавлении АДФ
3-
или МАДФ- (M=Mg
2
+, Ca
2
+ или Mn
2
+)
происходит изомеризация фермента. Константы связывания ме-
талл-нуклеотидных комплексов лишь в незначительной степени за-
висят от природы металла, что согласуется с изложенным выше
представлением о характере взаимодействия (ESM). (Величины
констант скоростей образования самих металл-нуклеотидных
Киназы 675-
комплексов отличаются у разных металлов на несколько по-
рядков.)
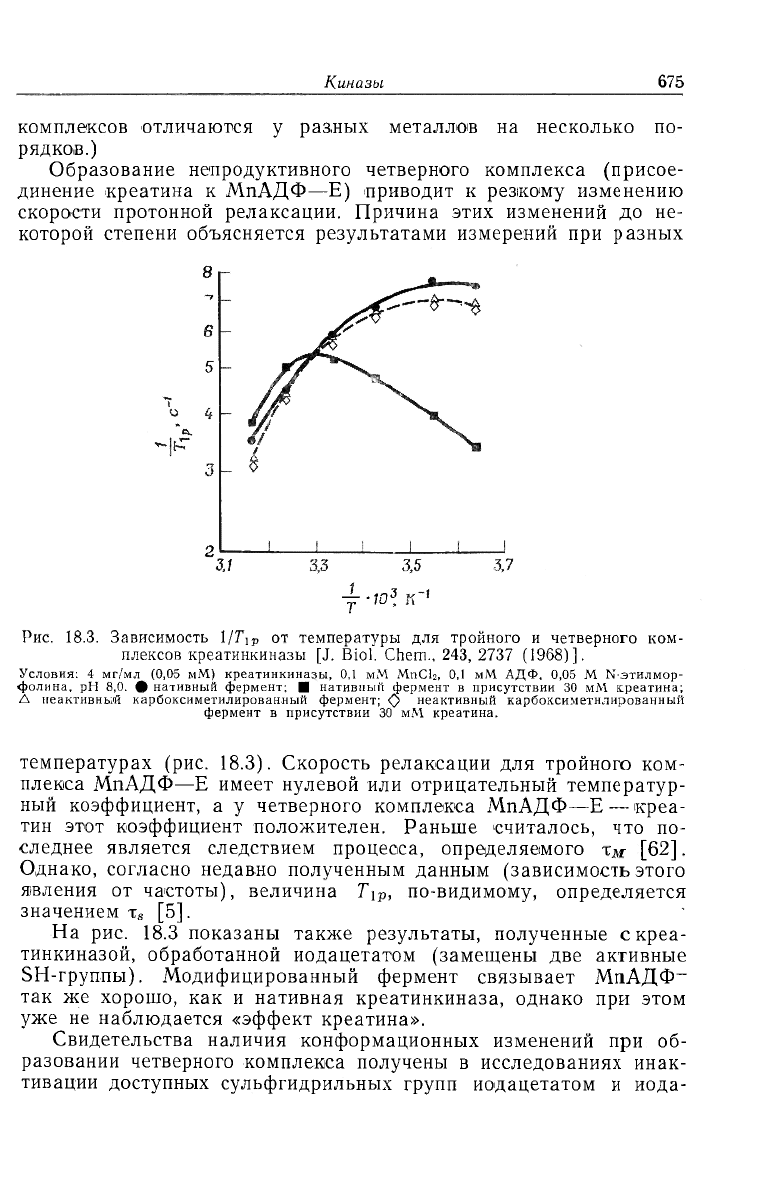
Образование непродуктивного четверного комплекса (присое-
динение креатина к МпАДФ—Е) приводит к резкому изменению
скорости протонной релаксации. Причина этих изменений до не-
которой степени объясняется результатами измерений при разных
у -ю
3
Рис. 18.3. Зависимость 1/Г
1р
от температуры для тройного и четверного ком-
плексов креатинкиназы [J. Biol. Chem., 243, 2737 (1968)].
Условия: 4 мг/мл (0,05 мМ) креатинкиназы, 0,1 мМ MnCb, 0,1 мМ АДФ, 0,05 M N-этилмор-
фолнна, рН 8,0. ф нативный фермент; Я нативпый фермент в присутствии 30 мМ креатина;
Л неактивный карбоксиметилирован.ный фермент; О неактивный карбоксиметнлированный
фермент в присутствии 30 мМ креатина.
температурах (рис. 18.3). Скорость релаксации для тройного ком-
плекса МпАДФ—E имеет нулевой или отрицательный температур-
ный коэффициент, а у четверного комплекса МпАДФ—E — креа-
тин этот коэффициент положителен. Раньше считалось, что по-
следнее является следствием процесса, определяемого х
ж
[62].
Однако, согласно недавно полученным данным (зависимость этого
явления от частоты), величина T
ip
, по-видимому, определяется
значением x
s
[5].
На рис. 18.3 показаны также результаты, полученные скреа-
тинкиназой, обработанной иодацетатом (замещены две активные
SH-группы). Модифицированный фермент связывает МпАДФ
-
так же хорошо, как и нативная креатинкиназа, однако при этом
уже не наблюдается «эффект креатина».
Свидетельства наличия конформационных изменений при об-
разовании четверного комплекса получены в исследованиях инак-
тивации доступных сульфгидрильных групп иодацетатом и иода-

674
Г лава
17
цетамидом [50] и чувствительности фермента к трипсину [51].
Некоторые сведения о природе этих изменений получены в на-
чальных работах со спин-меченой креатинкиназой.
Использование в качестве спиновых меток иминоксильных про-
изводных иодацетамида, стехиометрически реагирующих с сульф-
гидрилом, способствовало значительному увеличению количества
информации, получаемой резонансными методами [58]. Подобно
другим модификаторам SH-группы, иминоксильные производные
полностью инактивируют фермент из мышц кролика. Однако при
этом он еще сохраняет способность связывать нуклеотидные суб-
страты, хотя уже и не показывает «эффект креатина». Благода-
ря этому оказалось возможным использовать методы ЭПР и про-
тонного резонанса для определения констант диссоциации раз-
личных диамагнитных металлов (например, Mg
2
+, Ca
2
+) из их
тройных комплексов с ферментом. Выяснилось, что добавление
МАДФ
-
приводит к еще большей степени заторможенности ими-
ноксильного радикала, и так уже значительно заторможенного
вследствие присоединения к ферменту.
Два следующих примера демонстрируют возможности метода
парамагнитных зондов [70]. По уширению сигнала ЭПР от ими-
ноксильного радикала, наблюдавшемуся после добавления
МпАДф-, удалось определить расстояние между неспаренным
электроном метки и связанным ионом марганца. Оно составило
8—12 А (для МпАТФ на поверхности белка это расстояние равно
13—18 А). Аналогичные исследования были проведены с фермен-
том из сердца цыпленка, который после связывания иминоксиль-
ной метки еще сохраняет около 25% активности. Из наблюдений
за уширением линий протонов Н-8 и Н-2 в кольце связанного
аденина, происходящем при переходе от АДФ—E к МАДФ—Е,
а затем к МАДФ—E—креатин, было усгановно что адениповое
кольцо удаляется от сульфгидрильной группы.
Эти эксперименты пока еще имеют характер предварительных.
Тем не менее уже и по их результатам видно, какие широкие
возможности предоставляют для изучения активных центроЕ
киназ методы магнитного резонанса.
3.2. Аргининкиназа
Аргининкиназа катализирует обратимый перенос фосфориль-
ной группы от АТФ к ь-аргинину аналогично реакции креатин-
киназы [1]. Она широко распространена среди беспозвоночных
особенно у членистоногих. Ферменты, выделенные из некоторых
ракообразных, почти не отличаются друг от друга по физическим
свойствам. Аргининкиназа состоит из одной полипептидной цепи с
молекулярной массой около 40
ООО
(половина молекулярной массы
креатинкиназы) с одним каталитическим центром.

Киназы
677-
Подобно креатинкиназе аргининкиназа, по-видимому, подчи-
няется кинетике быстрого статистического равновесия. (Сообще-
ние [72] о том, что у фермента из Jasus verrauxi реакция имеет
механизм типа «пинг-понг», не содержало достаточно убеди-
тельных доказательств.) Это согласуется с ЯМР-данными, полу-
ченными с аргининкиназами из трех источников: Homarus vul-
garis, Homarus americanus и Panulirus Iongipes [73]. Все они
являются ферментами типа I с относительно высокими значе-
ниями е/ для комплексов МпАДФ—E и МпАТФ—Е. Хотя и
имеются некоторые количественные различия, однако характер
усиления релаксации одинаков во всех случаях, а константы
диссоциации комплексов марганца с нуклеотидами, определен-
ные по скоростям релаксации протонов, хорошо согласуются со
значениями, полученными из кинетических данных.
Эксперименты с различными Мп-нуклеотидами (АДФ,
2'-дАДФ и ИДФ) обнаружили такую же корреляцию между ej
и максимальной скоростью, как и для креатинкиназы. Между
этими ферментами наблюдается аналогия и в изменениях ско-
рости релаксации при образовании четверных комплексов
(МпАДФ—E—креатин и МпАДФ—Е—L-аргинин). С D'-аргини-
HO
i
M, который является либо слабым ингибитором, либо вообще
инертным по отношению к аргининкиназе, подобный эффект
не обнаружен.
На данной стадии исследований представляется, что арги-
нинкиназа и, вероятно, другие гуанидинкиназы [74, 75] имеют
механизм, подобный креатинкиназе. Гораздо меньшая молеку-
лярная масса аргининкиназы делает ее более удобной для изу-
чения методом сканирующей ЯМР-юпектроскопии.
3.3. Пируваткиназа
Пируваткиназа катализирует реакцию
M
2
+, M
+
АТФ
4-
+ пируват
t
АДФ
3-
+ фосфоенолпируват (1)
а также две нефизиологичеокие реакции — «фторкиназную» и
«гидроксиламинкиназную»:
HCOJ
АТФ
4
" + F
-
< АДФ
3
- + FPOl" (2)
HCOJ
АТФ
4
-+NH
2
OH < ' * АДФ
3
- + гидроксиламинфосфат (3)
Все эти реакции, по-видимому, происходят в одном и том же
центре фермента. Для всех них необходимо присутствие ионов
жак двух-, так и одновалентных металлов [76]. Ионами двух-
* Здесь et — то же, что и е
0
в гл. 14.

Глава 18
валентных металлов для реакций (1) и (2) могут быть Mg
2
+
или Mn
2
+, для реакции (3) — Zn
2
+, а одновалентных —
К+ >Rb+>NHT>Cs+>Nа+ [76, 77].
Наиболее подробные исследования проведены с ферментое
из мышц кролика — тетрамером с молекулярной массой 237 000
состоящим, по-видимому, из одинаковых субъединиц [78]. Име
ются некоторые расхождения в мнениях по поводу кинстическон
схемы [6, 79], однако представляется вероятным (главны*
образом на основании экспериментов со слабо диссоциирующие
ионом Ni
2
+ [80]), что тройной комплекс металл — фермент —
АДФ может образовываться как при взаимодействии АДФ
3-
с
ЕМ, так и непосредственно из фермента и МАДФ^ (пути 11 и
III на схеме в разд. 2.4). Было также обнаружено, что только
предварительная инкубация фермента с фосфоенолпируватом
(ФЕП), но не с МАДФ
-
приводит к увеличению скорости реак-
ции. Последнее свидетельствует об определенной упорядоченно-
сти в последовательности связывания субстратов. Фермент иг
дрожжей подчиняется тому же механизму, однако с существен-
ным отличием — фруктозодифосфат является аллостерическим
активатором [80].
Обе пируваткиназы (из мышц кролика и из дрожжей) ведут
себя как ферменты типа II. Наблюдается значительное усиление ре-
лаксации у комплексов фермента с марганцем при малых значе-
ниях для тройных комплексов. Результаты кинетических экспери-
ментов свидетельствуют о существовании структуры с металлом
в качестве мостика. О том же говорят данные резонансных ис-
следований. Лучше всего в этом убеждают результаты изучения
«фторкиназной» реакции, катализируемой ферментом [81], та*
как ядра фтора дают удобный для наблюдения спектр. Исследо-
вание влияние марганца, связанного с ферментом, на скоростн
релаксации 1/Т\ и I/T
2
ядер
19
F позволило рассчитать раостоянж
между атомами Mn и F. Эти расчеты хорошо согласуются с не
давним рентгеноструктурным анализом кристаллов CaFPO
3
[82]
и соответствуют мостиковым структурам
0
°п
IL / \ S
Е—Mn—О—P-F или E—Mn]
1 \/ V
О- о
Скорость обмена (\/х
м
) аниона FPO!
-
в координационную сфер?
иона марганца по порядку величины согласуется с кинетическим!
данными.
Различия в значениях е« для E—МпАДФ и E—МпАТФ соот
ветствуют различиям самих этих комплексов (потеря одной моле
кулы воды в последнем случае) [83]. По-видимому, Mn образуе-

Киназы 679-
связи с у-фосфатом АТФ (т. е. с фосфорильной группой, перено-
симой к ФЭП), а возможно, и с р-фосфатом АТФ и АДФ.Однако
хобавление ФЕП к E—Mn приводит к гораздо большим измене-
ниям в усилении релаксации, чем в тех случаях, когда это можно
объяснить простым замещением молекулы воды. Вероятно, свой
зклад в это явление вносят и конформационные изменения фер-
мента. Независимые доказательства наличия структурных преоб-
разований глобулы при добавлении различных субстратов и одно-
л двухвалентных активаторов получены также при спектроскопи-
ческих исследованиях в лаборатории Сьюлтера [52].
Кроме АДФ и АТФ пируваткиназа может превращать и дру-
гие нуклеотидные субстраты, но эта способность зависит от при-
эоды нуклеотида и от величины рН [9]. Пока неизвестно, еущест-
зует ли корреляция между максимальными скоростями и усиле-
нием релаксации для соответствующих комплексов, подобно
наблюдавшейся у креатинкиназы. Интересно, что предварительные
эксперименты свидетельствуют об обратной зависимости между
усилением релаксации комплекса E—M—ФЕП и природой при-
сутствующего иона одновалентного металла [77]. Чем слабее ион
Vl+ как активатор, тем значительнее усиление релаксации трой-
ного комплекса. Пока еще не ясно, в какой степени это является
следствием изменений в значениях е
г
и констант диссоциации
РЭП из комплекса [112]. Тем не менее подобные данные !свиде-
тельствуют о важной роли одновалентных ионов, которые, воз-
ложно, образуют центр связывания для карбоксильной группы
РЕП [77].
Дополнительные доказательства присутствия одновалентных
сатионов в каталитическом центре пируваткиназы получены в
!редварительных экспериментах с таллием [85]. Наиболее рас-
гространенный изотоп
205
Tl имеет спин '/г, что позволяет исполь-
ювать его для резонансных измерений. Результаты этих экспери-
лентов говорят о наличии в ферменте взаимодействия между Tl
I Mn. Следовательно, их центры связывания достаточно близки
фуг к другу.
3.4. Фосфоенолпируваткарбоксикиназа
(фосфопируваткарбоксилаза)
Подобно пируваткиназе и другим ферментам, превращающим
Е>ЕП [5], фосфоенолпируваткарбоксикиназа относится к типу II.
£е реакция очень похожа на реакцию пируваткиназы и пируват-
сарбоксилазы. Она подробно рассмотрена в гл. 14.
3.5. Аденилаткиназа
Реакция, катализируемая аденилаткиназой, может быть пред-
ставлена в виде [86]
МАТФ
2
- + АМФ
2
- Т—M АДФ" + АДФ
3
"

680
Г лава 18
где роль металла могут играть Mg, Mn, Ca или Со [36]. Специ-
фичность этого фермента к ионам металлов требует некоторых
пояснений. Первоначально сообщалось, что для обратной реак-
ции, катализируемой ферментом из мышц кролика, ион Ca
2+
не является активатором. Однако тот факт, что по данным ЯМР
аденилаткиназа относится к типу I, заставил более внимательно
изучить явление активации. При этом было обнаружено, что хотя
Ca+
2
— действительно слабый активатор при протекании реакции
в направлении образования АТФ (его эффективность в 10 раз
меньше, чем у Mg
2
+), он почти так же хорошо, как и Mg
2
+, акти-
вирует прямую реакцию [36]. Такое аномальное поведение каль-
ция пока остается не понятым, хотя и представляется заманчи-
вым объяснить его тем, что Ca
2
+ вступает в комплексы с АТФ и
АДФ и выходит из них примерно на два порядка быстрее, чем
Mg
2
+ или Mn
2
+. К сожалению, в литературе отсутствуют убеди-
тельные данные о подобных свойствах и других киназ.
Наиболее подробно изучена аденилаткиназа, выделенная иг
мышц кролика. Она построена из единственной полипептндног
цепи с молекулярной массой 21 ООО и имеет два активных центра
Низкая молекулярная масса делает ее удобной для измерени?
методом сканирующей ЯМР-спектроскопии. Предварительные
эксперименты [87] продемонстрировали наличие значительны?
сдвигов протонов Н-2 и Н-8 АТФ при связывании с ферментом
Как уже указывалось, этот фермент относится к типу I, т. е
Mn связывается с аденилаткиназой через АТФ. Первоначальнс
графический анализ результатов измерений протонного резонансе
привел к таким значениям усиления релаксации комплексг
МпАТФ—Е, которые превосходили даже теоретически возможны?
максимум (особенно при температурах 30—40
0
C) [5, 36]. Bno
следствии при обработке этих данных на ЭВМ [61] были полу
чены более реальные значения, аналогичные наблюдавшимся }
других ферментов (табл. 18.2). Согласно результатам машинногс
анализа, аденилаткиназа, скорее всего, имеет два центра связы
вания для МпАТФ
2-
.
Было найдено, что различные нуклеозидтрифосфаты действую:
как дополнительные субстраты для аденилаткиназы. Обнаружен*
и соответствующая корреляция между максимальными скоро
стями и усилением релаксации марганцевого комплекса [36]
Другими словами, и для этого фермента наблюдаются индуци
руемые субстратами изменения конформации, степень которы;
зависит от природы субстрата. Комплекс МпАДФ—E исследоват]
не удалось.
Аденилаткиназа имеет два реакционноспособных остатка ци
стина, и хотя они необходимы при проявлении каталитическо!
активности, в некоторых случаях оказалось возможным провеет!
их модифицирование без полной инактивации фермента. Так, ре

Киназы
681
Таблица 18.2
Усиление релаксации у различных комплексов марганца
е
а
относится к усилению релаксации бинарного комплекса М—S;
E
^ соответствует бинар-
ному комплексу Е—М, a £^ — тройному комплексу, содержащему фермент, металл и суб-
страт. Усиление релаксации для ионов Mn
2
+ в отсутствие комплексующего агента принято
за 1,0. Данные заимствованы из работ [35, 36, 57, 59, 72, 100]. В некоторых случаях они бы-
ли пересчитаны на ЭВМ [61].
Усиление релаксации
Комплекс
г
а
е
Ь
е
/
МПАДФ-
1,6
МпАТФ
2
-
1,7
Мп-пируваткиназа
33
АДФ—Мп-пируваткиназа
20
АТФ—Мп-пируваткиназа 13
Фосфоенолпируват—Мп-пируваткиназа
23
Мп-креатинкиназа 1,5
Мп-АДФ—креатинкиназа
20
Mn-АТФ—аденилаткиназа
13
Mn -дАТФ—аденилаткиназа
8
Мп-АДФ—аргининкиназа
45
Mn—фосфоенолпируваткарбоксикиназа 14
акция SH-группы с дитио-бие-нитробензойной кислотой (ДТНБ)
приводит к полной потере активности [88], но после реакции с
некоторыми органическими производными ртути, также взаимо-
действующими с сульфгидрилом, фермент еще сохраняет значи-
тельную часть каталитической активности [89]. По данным про-
тонной релаксации, МпАТФ
2-
связывается с аденилаткиназой,
модифицированной одним из таких соединений (с производным
меркурбензоата) [36], и не связывается при использования про-
изводных ДТНБ [88].
Милдван и Кон [5] считают, что роль металла-активатора со-
стоит в сближении лигандов для облегчения реакции. Можно
предположить, что использование сканирующей ЯМР-спектроско-
пии и спиновых меток приведет к более подробным сведениям об
активном центре.
3.6. Гексокиназа
Гексокиназа катализирует перенос фосфорильной группы от
АТФ к глюкозе. Наиболее подробно изучен дрожжевой фермент,
хотя некоторое внимание исследователи уделили и гексокиназс
44—2451

682
Г лава 18
мышц и мозга. Фермент обладает широкой специфичностью как к
нуклеотидным, так и к углеводным субстратам [90].
Гексокиназа, особенно дрожжевая, была объектом широких
кинетических исследований. При этом были получены как свиде-
тельства того, что имеет место упорядоченный механизм [91] с
определенной последовательностью связывания глюкозы и
М^АТФ
2-
, так и противоположные аргументы в пользу независи-
мого присоединения субстратов к свободному ферменту по типу
бы,строго статистического равновесия [92]. Подобное противоре-
чие еще раз подчеркивает, что на основании чисто кинетических
экспериментов очень трудно получить однозначный ответ о меха-
низме действия фермента.
Группа французских исследователей впоследствии представи-
ла ,результаты физико-химического изучения гаксокиназы, кото-
рые в некоторой степени подтверждают их гипотезу об упорядо-
ченном механизме. Им удалось показать, что фермент из дрож-
жей связывает глюкозу прочнее, чем А^АТФ
2-
[93]. Подробное
исследование ингибирования фермента позволило Kocoy и Роузу
[94] заключить, что при некоторых условиях (малые или уме-
ренные ингибирующие концентрации М§АДФ~) продукты реак-
ции выделяются в определенной последовательности — сначала
глюкозо-6-фосфат, а затем АДФ.
Первые результаты исследования протонной релаксации, вы-
полненные Кон [4], свидетельствуют о том, что гексокиназа от-
носится к типу I. Тем самым в какой-то степени поддержи-
вается представление об упорядоченном механиме. Оказалось, что
усиление релаксации МпАДФ- или МпАТФ
2-
наблюдается только
в присутствии глюкозы. Однако последнее можно объяснить и
тем, что комплекс Mn—нуклеотид может ферментом связываться
двояко: без глюкозы — со слабым усилением, в присутствии глю-
козы — с большим усилением [5]. Очевидно, для выяснения меха-
низма необходимы дальнейшие исследования.
3.7. З-Фосфоглицераткиназа
Этот фермент катализирует обратимый перенос фосфорильной
группы от АТФ к 3-фосфоглицерату. По данным широких кине-
тических исследований фермента из дрожжей его свойства пред-
ставляются очень похожими на свойства креатинкиназы [95].
Результаты измерений протонной релаксации свидетельствуют
о том, что 3-фосфоглицераткиназа относится к типу I [4]. Срав-
нительно небольшая молекулярная масса (45
ООО)
и простота
выделения из многих тканей позволяют надеяться, что этот фер-
мент будет удобным объектом в дальнейших физико-химических
исследованиях.
