Эйхгорн Г. (ред.) Неорганическая биохимия. Том 1
Подождите немного. Документ загружается.


Фосфатный перенос и его активация ионами металлов
643
согласуется с существованием сильных взаимодействий с кис-
лородными атомами фосфата в активном центре.
После фосфорилирования фермента происходит нуклеофильная
атака на образовавшееся промежуточное соединение. Нуклео-
филом может быть не только вода. Вильсон и др. [37] показали,
что ряд акцепторов фосфата, таких, как этаноламин и этилен-
гликоль, эффективно конкурирует с водой, даже если их кон-
центрация 1 M или меньше. Молекулы этих акцепторов содержат
Рис. 17.1. Модель активного центра щелочной фосфатазы.
а — фосфорилирование фермента; б —перенос фосфата на воду и другие нуклеэфилы.
ОН- или NH
2
-rpynny, находящуюся на расстоянии, не превышаю-
щем длины цепи из четырех углеродных атомов от акцептирую-
щей гидроксильной группы. Это структурное требование указы-
вает на существование у фермента центра связывания, несущего
положительный заряд и способствующего реакции с нуклеофилом.
Молекулы акцепторов, которые не удовлетворяют этому требова-
нию, оказываются неэффективными в экспериментах по переносу
[37], однако нет оснований полагать, что при достаточно высо-
кой концентрации они не смогли бы конкурировать с водой.
По-видимому, фермент не имеет специального центра для связы-
вания воды. Эти выводы из экспериментальных данных иллюст-
рируются схемой на рис. 17.1. Об участии металлов в придании
активному центру фермента стерической селективности свиде-
тельствует тот факт, что Cd
2
+ и Mn
2
+ облегчают фосфорилиро-
вание белка, но не последующий гидролиз промежуточного сое-
динения, тогда как Со
2
+, активность с которым составляет 12%
активности с Zn
E+
, делает трансферазные реакции невозможными.
Обсуждение механизма действия фосфатазы до сих пор не
касалось осложнения, связанного с существованием лишь одного
центра прочного присоединения фосфата при участии в катализе
двух ионов металла. Согласно аллостерической модели [76, 77],
связывание одной молекулы фосфата затрудняет связывание дру-
гой из-за возникающих дальнодействующих взаимодействий меж-
ду субъединицами. Альтернативный механизм [51] объясняет это
а
6
41*

'<644
Глава 17
тем, что основное место присоединения фосфата находится в
области контакта двух субъединиц. Предварительные данные
рентгенографического анализа [27, 28] свидетельствуют о том,
что кристаллы нативного фермента принадлежат к моноклинной
пространственной группе P3i21 с размерами ячейки а = 70,5 А,
6 =70,5 А, с= 155,6 А, |3= 120°. Элементарная ячейка содержит
три димерные молекулы, однако асимметрической единицей явля-
ется молекула мономера. Пары идентичных мономеров связаны
посредством оси вращения второго порядка. Если эти пары пред-
ставляют собой функциональные молекулы димеров, то единст-
венный центр связывания фосфата может находиться на оси сим-
метрии второго порядка. В результате появляется интересная
возможность того, что фосфат одновременно взаимодействует с
двумя ионами цинка и что эта неизвестная ранее структурная
особенность объясняет активацию производных фосфата при ну-
клеофильной атаке.
4. РОЛЬ ИОНОВ МЕТАЛЛА
Ввиду большого разнообразия ферментов, переносящих фос-
фат при участии ионов металлов, следует учитывать возможность
такого же разнообразия функций металла. Действительно, если
обратиться к сравнению эффективности различных металлов,
природы ингибиторов и концентрационных зависимостей актива-
ции и ингибирования, то можно увидеть, что специфические тре-
бования к металлам для различных ферментов неодинаковы.
Вполне возможно, что для каждого фермента характерен свой
механизм участия ионов металла в реакции. Тем не менее можно
попытаться найти некоторую объединяющую основу, базирую-
щуюся на фундаментальных законах химии.
4.1. Тройные комплексы ферментов с металлами
и субстратами
Активация фермента ионами металлов предполагает образова-
ние тройного комплекса фермент —ион металла — субстрат.
Можно представить несколько вариантов организации этого
комплекса, и все они встречаются в реальных системах. Схемы
координации, в которых связывающим мостиком служат лиганд
(Е—S—М), металл (Е—М—S) или фермент (S—Е—М), рас-
смотрены в гл. 14 и в исчерпывающем обзоре Милдвана [79].
4.2. Нейтрализация заряда
Наиболее очевидным свойством ионов металлов, которое
могло бы помочь в объяснении их роли при активации фосфат-
переносящих ферментов, является положительный заряд. Катио-

Фосфатный перенос и его активация ионами металлов
645
ны двухвалентных металлов сохраняют свой заряд в нейтральном
растворе и могут снимать отрицательный заряд кислородных
атомов фосфата, облегчая тем самым присоединение субстрата
к ферменту. Хорошо известно, что двухзарядные катионы обра-
зуют с производными фосфата сравнительно прочные комплексы
(хотя этот эффект часто не виден из-за образования осадка), осо-
бенно если они содержат ди- и трифосфатные группировки
[7, 87]. Кроме того, эти катионы сильно стабилизируют третич-
Рис. 17.2. Предполагаемый механизм реакции Zn
2+
-IlKA4- ImPO
3
—*• Zn
2
+-
(ПКА)Р0
3
+1т.
ную структуру транспортной РНК [88], вероятно, вследствии
взаимодействия с рибозофосфатным скелетом.
Модельная система, в которой нейтрализация заряда, по-види-
мому, играет важную роль, обнаружена Куперманом и Ллойдом
[89]. Они нашли, что Zn
2
+ катализирует перенос фосфорильной
группы от фосфорилимидазола к кислородному атому 2-пиридин-
карбальдоксима (ПКА), о комплексе которого с Zri
2
+ было из-
вестно, что он является эффективным нуклеофилом [90]. Реакция
описывается кинетикой с насыщением, что свидетельствует об
образовании тройного комплекса ПКА — Zn — фосфорилимида-
зол. Кривая рН-зависимости скорости реакции имеет колоколооб-
разную форму с максимумом при рН 6. В этих условиях комп-
лекс Zn
2
+ — КПА и фосфорилимидазол ионизованы. Полагают, что
роль иона цинка заключается в экранировании фосфатной группы,
в результате чего облегчается атака отрицательно заряженным
нуклеофилом (рис. 17.2). Величина эффекта очень большая, и в
оптимуме рН скорость этой реакции примерно в IO
4
раз превы-
шает скорость атаки фосфорилимидазола водой.
По похожему механизму, вероятно, протекает неферментатив-
ное фосфорилирование ортофосфата до пирофосфата под дейст-
вием АТФ, которое, как показал Ловенштейн [91], требует обяза-
тельного присутствия ионов двухвалентных металлов, предпочти-
тельнее всего Mn'
2
+, Cd
2
+ и Ca
2
+. В этом случае не наблюдается
эффекта насыщения при высокой концентрации реагентов, однако,
имея в виду низкую концентрацию фосфата в эксперименте,
можно заключить, что реакция в этих условиях протекает значи-
тельно быстрее гидролиза АТФ [92]. Необычные характеристики
этого процесса, а именно рН-оптимум 9, оптимальное соотношение
42—2451

'<646
Глава 17
концентраций АТФ и M'
2
+ около 0,6, показывают, что ее меха-
низм непрост.
Хотя в участии металлов в нейтрализации зарядов при фер-
ментативных реакциях переноса фосфата не приходится сомне-
ваться, можно отметить, что эта функция не обязательно выпол-
няется металлом. Белки содержат и другие заряженные центры,
не содержащие металл, — аминные и имидазольные группы, ко-
торые с успехом могут участвовать в связывании отрицательно
заряженных фосфатных групп. Многие ферменты, в том числе
некоторые из переносящих фосфат, работают в отсутствие метал-
лов, хотя их субстраты заряжены отрицательно.
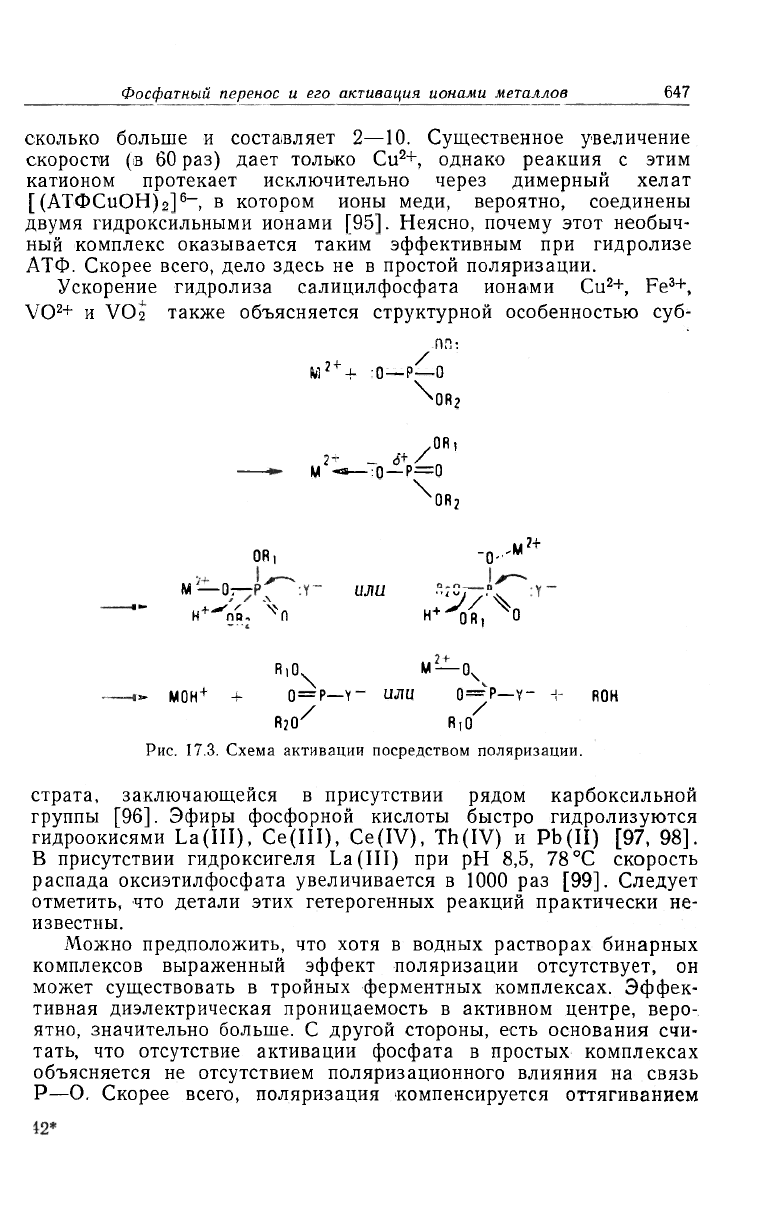
4.3. Поляризация
Можно ожидать, что, кроме нейтрализации заряда, ион ме-
талла, присоединенный производным фосфата через атом кисло-
рода, вызывает поляризацию соответствующих связей P—О. Рань-
ше при обсуждении роли металла в переносе фосфата функция
поляризации рассматривалась чаще всего. Ее идея заключается
в том, что, оттягивая электроны от атома кислорода, ион металла
ослабляет связь P—О и увеличивает положительный заряд на
атоме фосфора. Это должно облегчать и нуклеофильную атаку,
и разрыв связи Р—О. Иллюстрацией служит рис. 17.3 (см. также
т. 2, гл. 34).
Если бы поляризация играла важную роль в активации фос-
фата, то можно было бы ожидать, что ионы металлов сами по
себе ускоряют гидролиз производных фосфата, поскольку ком-
плексы с металлами образуются и в отсутствие ферментов. Одна-
ко это предположение не подтверждается. Хотя каталити-
ческая роль металлов в модельных системах и обнару-
живается [93]. эффекты вовсе не велики, если реагент не
имеет необычных структурных особенностей. Например, ионы
магния ускоряют гидролиз дианиона ацетилфосфата СН
3
СООРОГ
[94], однако всего ib 3 раза при концентрации металла 0,1 М.
Если предположить, что константа диссоциации комплекса
Mg(CH
3
COOPO
3
) не больше, чем комплекса Mg(HPO
4
) [7] (она
может быть меньше ввиду возможного участия кислородного
атома карбонильной группы в связывании), то оказывается, что
CH
3
COOPO
3
-
гидролизуется в комплексе с Mg
2
+ всего в 4—5 раз
быстрее, чем в свободном виде.
Влияние Mg
2
+ на гидролиз АТФ еще меньше [92], несмотря
на то что этот металл служит активатором большинства киназ.
При рН 9, т. е. когда молекула АТФ депротонирована, магний
ускоряет гидролиз в 2 раза, тогда как при рН 5, когда молекула
свободного АТФ присоединяет один протон, магний даже несколь-
ко ингибирует гидролиз. В случае Ca
2
+ и Mn
2
+ ускорение не-
Фосфатный перенос и его активация ионами металлов
647;
сколько больше и составляет 2—10. Существенное увеличение
скорости (iB 60 раз) дает только Cu
2
+, однако реакция с этим
катионом протекает исключительно через димерный хелат
[(ATOCUOH)
2
]
6-
, В котором ионы меди, вероятно, соединены
двумя гидроксильными ионами [95]. Неясно, почему этот необыч-
ный комплекс оказывается таким эффективным при гидролизе
АТФ. Скорее всего, дело здесь не в простой поляризации.
Ускорение гидролиза салицилфосфата ионами Cu
2
+, Fe
3
+,
VO
2
+ и VO
2
также объясняется структурной особенностью суб-
ПП:
/
M
2+
+ :Q—Р—О
4s
OR
2
У QR!
2+ _ <5+ /
M -а— Q-P=O
4x
OR
2
ORI -Q-
,M
2+
М— о,—UJIU
" H^oC \
RIO^ M-O
4
- MOH
+
4- O = P-Y
-
"ЛИ O=P-V- + RON
/ /
R
2
O
X
R
1
O
РИС. 17.3. Схема активации посредством поляризации.
страта, заключающейся в присутствии рядом карбоксильной
группы [96]. Эфиры фосфорной кислоты быстро гидролизуются
гидроокисями La(III), Ce(III), Ce(IV), Th(IV) и Pb(II) [97, 98].
В присутствии гидроксигеля La(III) при рН 8,5, 78
0
C скорость
распада оксиэтилфосфата увеличивается в 1000 раз [99]. Следует
отметить, что детали этих гетерогенных реакций практически не-
известны.
Можно предположить, что хотя в водных растворах бинарных
комплексов выраженный эффект поляризации отсутствует, он
может существовать в тройных ферментных комплексах. Эффек-
тивная диэлектрическая проницаемость в активном центре, веро-
ятно, значительно больше. С другой стороны, есть основания счи-
тать, что отсутствие активации фосфата в простых комплексах
объясняется не отсутствием поляризационного влияния на связь
P—О. Скорее всего, поляризация компенсируется оттягиванием

648
Г лава 17
атомом фосфора заряда от остальной части молекулы. Это свой-
ство атома фосфора строго вытекает из анализа колебательных
спектров производных фосфата и их комплексов с металлами,
проведенного Бринцингером и Хестором [100]. Оказывается, что
силовая константа для растяжения связи P—О уменьшается
только для атомов кислорода, связанных с ионом металла, а для
свободных атомов кислорода она увеличивается, в результате
чего средняя силовая константа связи P-O остается неизменной.
Похожим образом ведут себя другие оксианионы: сульфат, карбо-
нат и нитрат. Предполагается, что поляризация компенсируется
O
3
I
1,517
O-"H-O
4
-L®60_pL65LO
14
I
1,497
x
R
O
2
Рис. 17.4. Структура серилфосфата [19].
значительным образованием я-связей между атомами кислорода
и центральным атомом с использованием вакантных 2р-орбита-
лей атомов углерода и азота и Зй-орбиталей атомов фосфора и
серы. Электроны легко передаются от одного атома кислорода к
другому без большого изменения заряда центрального атома.
Структурные данные подтверждают такую точку зрения. Kpy-
икшанк [101] обнаружил, что средняя длина связи P—О в произ-
водных фосфата почти постоянна. Присоединение заместителя к
одному из кислородных атомов ортофосфата может существенно,
на 0,15 А, увеличить длину связи P—О, однако остальные связи
P—О укорачиваются таким образом, что средняя длина сохраня-
ется равной 1,54 А. Структура серилфосфата [102], показанная
на рис. 17.4, иллюстрирует этот эффект. Видно также, что влия-
ние протона на длину связи P—О вдвое меньше влияния остатка
аминокислоты. Эта закономерность является общей и, вероятно,
объясняется образованием в кристалле прочных межмолекуляр-
ных водородных связей [101]. Можно полагать, что она справед-
лива и в водных растворах, и на протонных центрах белков.
В солях, образуемых металлами с фосфатом и пирофосфатом
[105], значительное удлинение связей P—О под действием ме
таллов не происходит, однако все исследованные кристаллы этих
соединений представляют собой трехмерные ионные решетки, Е
,которых все кислородные атомы присоединены к ионам металла
и наоборот, в результате чего поляризационный эффект уничто-

Фосфатный перенос и его активация ионами металлов
649;
жается. По-видимому, до сих пор неизвестна структура ни одного
отдельного комплекса металл — фосфат.
Хотя образование комплекса с ионом металла обычно не уско-
ряет значительно гидролиз простых производных фосфата, с поли-
рибонуклеотидами дело обстоит иначе. В этих полимерах фосфо-
диэфирные связи быстро гидролизуются в присутствии некоторых
металлов, особенно Zn
2
+, с образованием монорибонуклеотидов,
которые не распадаются дальше до фосфата [106]. Атом фос-
фора фосфодиэфирной группы уже поляризован под действием
двух эфирных связей, и это может служить объяснением того, что
дополнительная поляризация при связывании иона металла не
может быть компенсирована оттягиванием электронов от кисло-
родных атомов (гл. 34).
Усиление нуклеофильных свойств воды представляется более
вероятной функцией ионов металлов по сравнению с активацией
фосфата посредством поляризации. У кислородного атома воды
нет богатых электронами заместителей, которые могли бы ком-
пенсировать поляризующее влияние металла, поэтому прочность
связей О—H координированной молекулы воды существенно
Рис. 17.5. Предполагаемый механизм гидролиза зарина (Р1=изопропил, R
2
=Me-
тил), ускоряемого [(AA)CuOH]+ (AA=хелатирующий диамин).
уменьшается и оказывается возможной ионизация молекулы.
Таким образом, ион металла способен образовать гидроксильный
ион или близкое к нему состояние при физиологических значе-
ниях рН. Хотя нуклеофильные свойства связанного иона гидро-
ксила, скорее всего, хуже, чем в свободном состоянии, они тем
не менее могут быть лучше, чем у воды. Более того, активность
связанного иона OH
-
может существенно увеличиваться благода-
ря его благоприятной для реакции ориентации. Этот эффект объ-
ясняет способность комплекса [Cu(AA)OH]+ (АА=хелатирую-
щий диамин) ускорять гидролиз метилизопропилфторфосфата
(зарина) [108]. Вероятно, ион меди взаимодействует с атомом
фгора во время атаки иона гидроксила на атом фосфора
(рис. 17.5). В некоторых хелатах связанный ион OH
-
активнее
свободного [108]. Быстрый гидролиз производных фосфата гид-
роксидами лантанидов также, вне всякого сомнения, объясняется
4.4. Активация воды
н
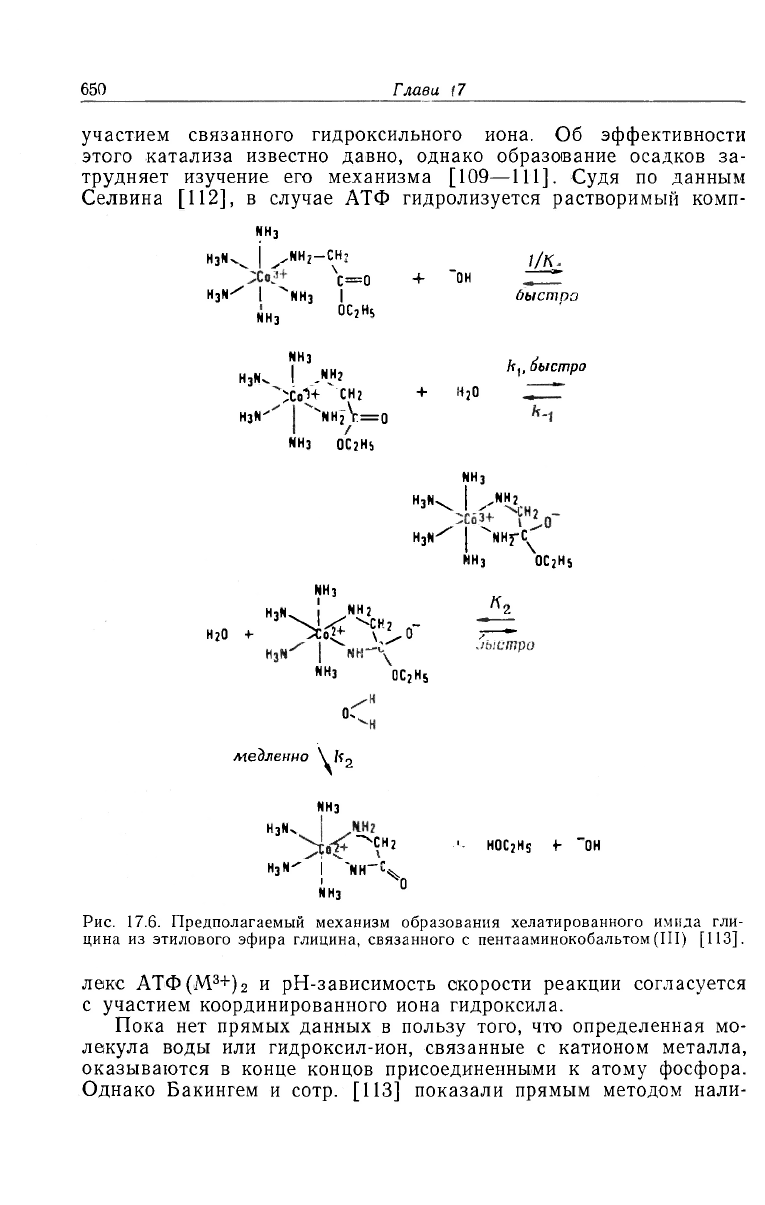
'<650
Глава 17
участием связанного гидроксильного иона. Об эффективности
этого катализа известно давно, однако образование осадков за-
трудняет изучение его механизма [109—111]. Судя по данным
Селвина [112], в случае АТФ гидролизуется растворимый комп-
NH
3
H
3
N^ I .NH
2
-CH:
t/K
\
=0
+ -он Zir
H
3
N^ NH
3
I быстра
NH
3
0c
^
NH
3
H
3
Ns. I .NH
2
;со"н сн
2
+ н
2
о
A
1
, быстро
H
3
N'
"NH
2
V=O
NH
3
OC
2
Hs
NH
3
H
3
N^ j .NH
2
H
3
N^ J NHfC
4
MH
3
OC
2
H
5
?
нз
к
H
3
N. .NH
2
"2
H
2
O
+
Ss^VV ^
N«3 OC
2
H
5
Os
медленно ^ft
2
NH
3
H
3
N>
^
4
CH
2
.. HOC
2
H
5
f "ОН
H
3
N NH-C
4
' 0
NH
3
U
Рис. 17.6. Предполагаемый механизм образования хелатированного имида гли-
цина из этилового эфира глицина, связанного с пентааминокобальтом (III) [113].
леке АТФ(М
3+
)
2
и рН-зависимость скорости реакции согласуется
с участием координированного иона гидроксила.
Пока нет прямых данных в пользу того, что определенная мо-
лекула воды или гидроксил-ион, связанные с катионом металла,
оказываются в конце концов присоединенными к атому фосфора.
Однако Бакингем и сотр. [113] показали прямым методом нали-

Фосфатный перенос и его активация ионами металлов 651;
чие нукле-офильных свойств у координированной молекулы ам-
миака. Если этилглицинат присоединен своим аминным концом к
комплексу [Со(NH
3
)S]
3
+, то продуктом его гидролиза в NaOH
оказывается хелатированный имид NH2CH2CH2CO1NH. Очевидно,
что для этого необходима атака одной из координированных мо-
лекул аммиака по карбонильному атому углерода. Предполагае-
мый механизм изображен на рис. 17.6. Трудно сомневаться в том,
что молекула воды может выполнять в гидролитических реакциях
похожую роль.
В ферментативных реакциях самые убедительные доказатель-
ства участия механизма с координированным ионом гидроксила
получены для карбоангидразы. По данным инфракрасной: спек-
троскопии, молекула субстрата (CO
2
) не связана с атомом цин-
ка, но расположена сравнительно близко от него, чтобы быть
атакованной координированным гидроксильным ионом [82]
(гл. 16, разд. 7). С этим механизмом согласуется зависимость
активности от рН и природы разнообразных ингибиторов [114,
115]. Селвин [112] предложил похожий механизм для АТФ-азы
митохондрий, участвующей в окислительном фосфорилировании.
Он основывался на сходстве рН-зависимостей ферментативной
реакции и упомянутого выше ускорения гидролиза АТФ ионами
лантанидов. Однако величина р/С
а
для АТФ-азной реакции (при-
мерно 7) была намного выше р/С
а
воды в комплексе с активирую-
щими двухзарядными ионами. Для наилучших активаторов
Mg
2
+, Со
2
+ и Zn
2
+ эта величина примерно равна соответственно
—-12, ~9 и ~9 [87]. Селвин [112] предполагает, что кислот-
ность комплексов может увеличиваться под влиянием положи-
тельно заряженных групп фермента, расположенных поблизости.
Надо признать, что расхождение в 5 единиц рН для Mg
2
+ слиш-
ком велико, чтобы его можно было объяснить таким образом
(необходимая для этого энергия электростатического взаимодей-
ствия должна составлять примерно 7 ккал/моль). Выше говори-
лось о том, что ионизация свободной молекулы воды предложена
в качестве объяснения перехода при рН 8,5, наблюдаемого для
Zn
l2
+-coдepжaщeй щелочной фосфатазы. При этом увеличение рН
приводило к уменьшению активности фермента. В силу этого
можно считать, что механизм с координированным гидроксиль-
ным ионом вряд ли играет существенную роль при ферментатив-
ном гидролизе фосфатов.
4.5. Стереохимические модели
Тот факт, что в бинарных комплексах с производными фосфа-
та ионы металлов лишь незначительно ускоряют гидролиз, пред-
полагает качественное различие во взаимном расположении ионов
металла и активируемой фосфатной группы в бинарном комплек-
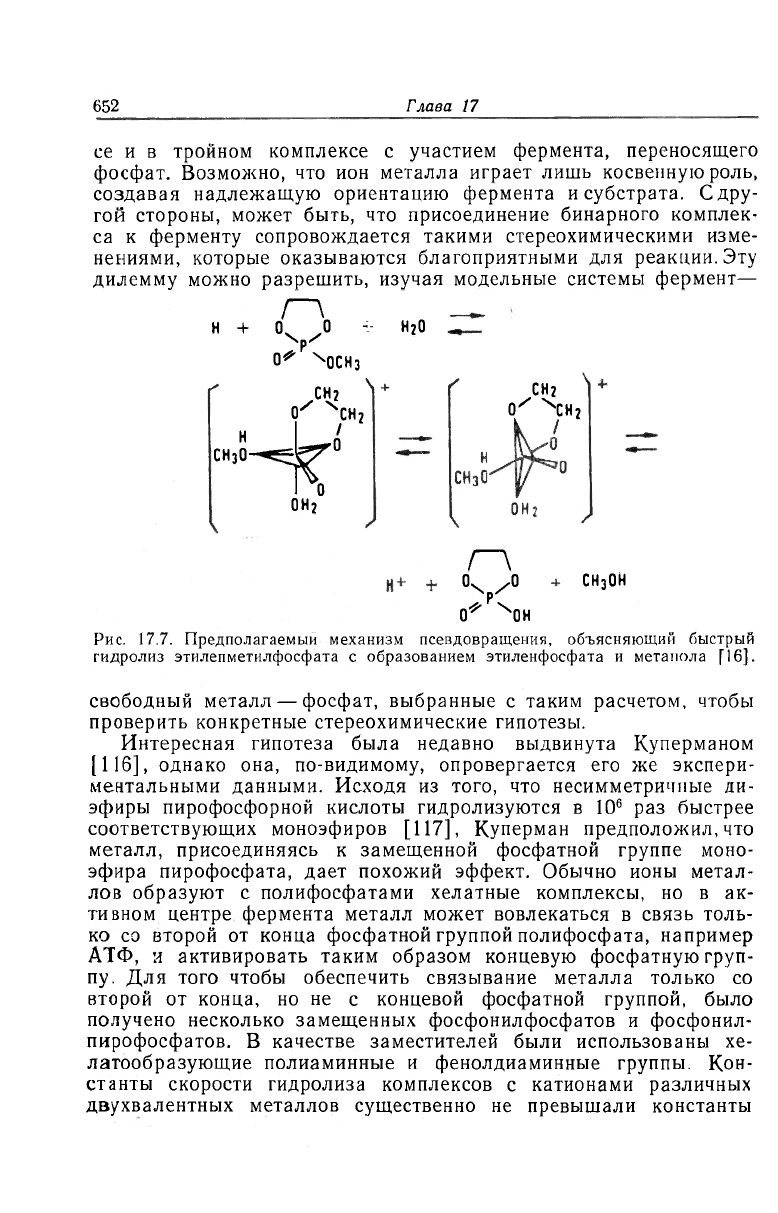
'<652
Глава 17
се и в тройном комплексе с участием фермента, переносящего
фосфат. Возможно, что ион металла играет лишь косвенную роль,
создавая надлежащую ориентацию фермента и субстрата. С дру-
гой стороны, может быть, что присоединение бинарного комплек-
са к ферменту сопровождается такими стереохимическими изме-
нениями, которые оказываются благоприятными для реакции. Эту
дилемму можно разрешить, изучая модельные системы фермент—
H +
н
CH
3
O
ГЛ
0
Np/
0
"
O^
P
^OCH
3
CH
2
O
X N
CH
2
^k
0
'
OH
2
H
2
O
CH
2
O
Y
"
4
CH
2
ГЛ
0
Xp/
0
0*
4
OH
CH
3
OH
Рис. 17.7. Предполагаемый механизм псевдовращения, объясняющий быстрый
гидролиз этилепметилфосфата с образованием этиленфосфата и метанола Г16].
свободный металл — фосфат, выбранные с таким расчетом, чтобы
проверить конкретные стереохимические гипотезы.
Интересная гипотеза была недавно выдвинута Куперманом
[116], однако она, по-видимому, опровергается его же экспери-
ментальными данными. Исходя из того, что несимметричные ли-
эфиры пирофосфорной кислоты гидролизуются в IO
6
раз быстрее
соответствующих моноэфиров [117], Куперман предположил, что
металл, присоединяясь к замещенной фосфатной группе моно-
эфира пирофосфата, дает похожий эффект. Обычно ионы метал-
лов образуют с полифосфатами хелатные комплексы, но в ак-
тивном центре фермента металл может вовлекаться в связь толь-
ко со второй от конца фосфатной группой полифосфата, например
АТФ, и активировать таким образом концевую фосфатную груп-
пу. Для того чтобы обеспечить связывание металла только со
второй от конца, но не с концевой фосфатной группой, было
получено несколько замещенных фосфонилфосфатов и фосфонил-
пирофосфатов. В качестве заместителей были использованы хе-
латообразующие полиаминные и фенолдиаминные группы. Кон-
станты скорости гидролиза комплексов с катионами различных
двухвалентных металлов существенно не превышали константы
