Эйхгорн Г. (ред.) Неорганическая биохимия. Том 1
Подождите немного. Документ загружается.


Киназы
663
2. ОБЩИЕ СВОЙСТВА КИНАЗ
2.1. Природа киназных реакций
Киназы осуществляют перенос фосфорильной группы —POfr
от АТФ. При этом образуется фоофорилированный продукт и
АДФ. Реакция, по-видимому, заключается в нуклеофильной атаке
на концевой атом фосфора в АТФ молекулой субстрата-акцепто-
ра [13]. Доказательства того, что разрывается именно концевая
связь О—Р, получены Коя [14] и Харрисоном с сотр. [15] при
изучении превращения соединений, содержащих
18
O, различными
киназами. По мнению Милдвана [16], это можно объяснить сле-
дующим образом. Если фосфатная группировка АТФ имеет те же
размеры, что и неорганический трифосфат, то концевая связь
О—P должна быть несколько длиннее (1,68 А), чем неконцевые
связи (1,61 А). Поэтому она легче разрывается. Проведенный не-
давно рентгеноструктурный анализ АТФ подтверждает это [17],
однако все подробности анализа ко времени завершения работы
над рукописью данной главы еще не были опубликованы.
Как правило, при киназной реакции осуществляется непо-
средственный перенос фосфорильной группы от донора к акцеп-
тору. Крейн [11] собрал доказательства того, что у многих киназ
не происходит промежуточное фосфорилирование фермента.
Исключение составляет реакция нуклеозиддифосфаткиназы, для
которой показано образование фосфофермента [18, 19].
2.2. Равновесие металл — субстрат
Как упоминалось выше, ионы металлов-активаторов образуют
комплексы с нуклеотидными субстратами. В некоторых случаях
комплексы образуются и с ненуклеотидными субстратами, но они
гораздо менее устойчивы и не очень существенны. Ниже рассмат-
риваются только адениновые нуклеотиды, АТФ и АДФ, поскольку
они лучше всего изучены. Однако все это относится и к другим
нуклеотидам, так как природа основания очень мало влияет на
величину р/(
а
фосфатных групп и на их способность связывать
ионы металлов [20, 21].
Значения р.К
а
концевых фосфатных групп у АТФ, АДФ и род-
ственных соединений лежат в интервале 6,7—7,0 [22—25]. Резуль-
таты отдельных измерений могут отличаться из-за различий
температуры, ионной силы, состава среды и т.д. [24, 25]. Так, при
рН значительно выше 7 в растворе находятся главным образом
АТФ
4-
и АДФ
3-
, имеющие 4 или 3 окси-аниона. В начале
50-х годов было установлено, что эти группы могут образовывать
комплексы с Mg
2
+ и другими катионами (включая одновалентные
43*

'<664
Глава
17
ионы Na
+
и K
+
[26]), хотя величины соответствующих констант
устойчивости были определены позже.
Критический обзор работ в этой области, выполненных до
1960 г., сделал Бок [27], который отметил неадекватность многих
экспериментов по определению констант устойчивости комплексов
металлов с нуклеотидами. Он также выдвинул положение о том,
что «исследования должны проводиться в растворах известной
ионной силы с нехелатирующими буферами и при таких концен-
трациях ионов металлов и фосфатов, которые позволяют добиться
наибольшей точности измерений и расчетов». В настоящее время
это положение в большинстве случаев выполняется и теперь на-
блюдается меньше расхождений в определяемых величинах.
Например, при рН 8,0 в нехелатирующем буфере и в отсутствие
мешающих ионов экспериментальные константы устойчивости для
MgATO
2
- лежат в интервале 5-10
4
—7-IO
4
M"
1
(lg/C = 4,?0—4,85),
а для MgAAO--OT 2-IO
3
до 4-IO
3
M-
1
(lg/C = 3,30-3,60).
Некоторое представление о сложности анализа подобных
систем с помощью классической потенциометрической техники
можно получить при рассмотрении системы равновесий между
АТФ и Mg
2
+:
P
K
ai P^a
2
НоАТФ
2
- НАТФЗ- =F=fc АТФ
4-
Ki
K
2
К
я
MgH
2
AT® 7—V MgHAT®
-
7—
v
MgAT®
2
"
Даже при разумных упрощениях полный анализ с определением
всех констант остается очень сложным. Во многих случаях эту
проблему можно решить только при помощи ЭВМ [28].
Интересующимся читателям можно рекомендовать обзорную
статью Филлипса [25] с критическим рассмотрением этой обла-
сти, особенно определений термодинамических параметров комп-
лексообразования, а также другие статьи той же группы [29] и
работу Такуи Хана и Мартелла [30]. Однако здесь следует под-
черкнуть, что не все биохимики при работе с ферментами и, в
частности, при исследовании этих комплексов подходят к ним
со строгих физико-химических позиций. Это проявляется в недо-
статочно правильном выборе ионной силы, интервалов рН и
температуры и особенно буфера, который почти никогда не бы-
вает инертным по отношению к ионам металлов, хотя его взаи-
модействие с ними иногда незначительно. Таким образом полу-
чаются «кажущиеся» (или «эффективные») значения констант
устойчивости, которые зависят от выбора экспериментальных
условий:
[МАТФ
2
-]
А
Э
фф = [м
2
+] [АТФ]
Г
,
(2)

Киназы
665-
где [АТФ]г—суммарная концентрация всех форм незакомп-
лексованного АТФ.
В идеальном случае измерения следует проводить точно в тех
условиях, в которых будет изучаться фермент. Кроме того, обыч-
но можно экстраполировать имеющиеся данные по комплексооб-
разованию к условиям ферментативной реакции или выбрать эти
условия таким образом, чтобы свести различия к минимуму.
Обширные сводки данных по константам устойчивости комп-
лексов металлов с нуклеотидами содержатся в обзоре Филлипса
[25], в публикациях Химического общества [24] (в которых
много типографских ошибок), а также в «Data for Biochemical
Research» [31].
2.2.1. Скорости образования МАДФ~ и МАТФ
2
~
При измерении скоростей образования комплексов металлов с
АДФ и АТФ Хаммс и сотр. [32, 33] пришли к заключению, что
они возникают по внешнесферному механизму SNI С промежу-
точным образованием ионной пары. По-видимому, самым инте-
ресным в их результатах является то, что Ca
2
+ взаимодействует
на два порядка быстрее, чем другие применявшиеся ионы двух-
валентных металлов, включая Mg
2
+ и Mn
2
+. Остается невыяс-
ненным, в какой степени этот факт связан с активацией кальцием
ферментов типа I (Е—S—М) и ингибированием им же ферментов
типа II (Е—М—S).
2.3. Структура комплексов металл — нуклеотид
2.3.1. В растворе
Обнаружив образование в растворе достаточно прочных комп-
лексов металл — нуклеотид, естественно попытаться установить и
их структуру. Ясно, что связывание щелочноземельных металлов
должно осуществляться фосфатными окси-анионами. С металла-
ми, подобными марганцу, возможно также присоединение к азоту
по типу донорно-акцепторной связи. В случае ионов Cu
2
+ послед-
ний вид комплексов может быть даже преобладающим.
Вызывает большой интерес вопрос о том, в какой степени ион
металла, связанный с окси-анионами фосфата, может взаимодей-
ствовать еще и с атомами азота. Хотя для определения структуры-
таких комплексов применялись разнообразные физико-химические
методы, эта проблема пока еще не решена. Она детально рас-
сматривается в гл. 33.
2.3.2. На ферменте
В этом случае ситуация еще менее ясная, чем для комплексов
в растворе. Почти все факты, относящиеся к этому вопросу, по-
лучены косвенным путем.

'<66 Глава
17
Некоторая информация была получена методом ЭПР. Спектры
ЭПР очень чувствительны к напряженности поля около иона
металла и, следовательно, к любым изменениям его лигандов.
При связывании МпАДФ
-
с креатинкиназой [34, 35] и МпАТФ
2-
с аденилаткиназой [36] не обнаружено никаких изменений в
спектрах ЭПР. Эти данные подтверждают (хотя и не доказы-
вают) гипотезу о том, что в растворе, как и на ферменте, струк-
тура комплексов одинакова. В противоположность этому в
спектре МпАДФ~ при связывании с пируваткиназой наблюдались
определенные изменения, вызванные, вероятно, появлением
дополнительных лигандов со стороны фермента [37].
Косвенные данные получены и из кинетических экспериментов
с ферментами; для креатинкиназы установлено, что M
2
+ более
прочно связан с E—АДФ, чем со свободным нуклеотидом [35,
38]. Однако такие выводы несколько искусственны, поскольку они
зависят от выбора модели, которая может не отражать реальной
ситуации (разд. 2.4).
2.4. Кинетические исследования киназ
Главные особенности любого фермента состоят в том, что он
намного (в IO
7
—IO
12
раз [39]) ускоряет реакцию, которая в его
отсутствие идет очень медленно или вообще не идет. Поэтому
было бы естественным, чтобы рациональной основой для нашего
понимания действия ферментов служило изучение кинетики фер-
ментативных реакций. К сожалению, будучи важным подспорьем
другим методам исследования, кинетические эксперименты редко
ведут к точному установлению механизма действия ферментов.
Изучение киназ осложняется образованием большого числа
возможных промежуточных соединений, которые необходимо учи-
тывать. Кроме двух субстратов и фермента, в системе всегда
присутствуют ионы металла-активатора, которые образуют комп-
лексы с нуклеотидным субстратом, а иногда также и с фермен-
том и со вторым субстратом. Вообще говоря, кинетическое иссле-
дование всех киназ, по-видимому, можно' проводить, полагая, чтс
истинными активными субстратами являются МАДФ
-
и МАТФ
2
"
[6]. Однако нельзя быть полностью уверенным в том, что данна*
гипотеза правильно отражает действительный !механизм фермен
тативной реакции. Причиной ошибочных заключений в такю
случаях может являться неспособность модели различать отдель
ные пути реакции.
Хорошим примером развития представлений о роли ионов ме
талла-активатора в кинетике киназных реакций может служит]
исследование креатинкиназы. Результаты ранних работ (Эннор
1
J
Розенберг [40], с одной стороны, и Куби с сотр. [41]—с дру
той) противоречили друг другу. Первая группа исследователей н;

Киназы 667-
основании полученных ими результатов полагала, что образуется
комплекс металла с ферментом, который затем реагирует со сво-
бодным нуклеотидом. Вторая же группа считала реальным суб-
стратом металлонуклеотидный комплекс, даже несмотря на го, что'
опубликованные данные о значении констант устойчивости таких
комплексов были слишком малы для 'количественной обработки
экспериментальных результатов в соответствии с их моделью.
Затем работу продолжили еще две группы. В лаборатории Нода
[42, 43] были получены данные, определенно говорившие о том,
что если принять большие значения соответствующих констант
устойчивости, то подлинными субстратами могут являться
А^АДф- и MgATO
2-
. Морриоон с сотр. [44] попытались решить
проблему. Предполагая постоянство концентрации второго суб-
страта (фосфокреатина), они постулировали, что реакция прохо-
дит через тройной комплекс фермент — металл — субстрат, кото-
рый может возникать тремя способами:
M
+
ш
h
MS
к, K
2
K
4
K
3
E + S E S ^=; EMS EM 5=t E + M
1
I продукты реакции II
Все они эквивалентны, поэтому KiKi=KzKi=KbKe- Если извест-
на величина константы диссоциации MgAflO
-
(ZCs), то на опыте
можно определить и все другие константы.
Таким образом, по этой схеме ион металла действительно мог
присоединяться к ферменту. Но такой вывод противоречил ре-
зультатам термодинамических [45] и ЯМР [34] измерений. Это
потребовало внесения изменений в дальнейшие исследования [38].
Самым важным из них было использование более достоверных
значений констант устойчивости MgAДФ~, отвечающих экспери-
ментальным условиям, и проведение опытов по выяснению приро-
ды ингибирования избытком АДФ и Mg
2
+. Было обнаружено,
что по отношению к МёАДФ
-
избыточный магний является не-
конкурентным ингибитором, а АДФ
3-
— конкурентным (рис. 18.1).
Иными словами, участие реакций II в образовании комплекса
EMS оказалось маловероятным, хотя по этим данным еще нель-
зя сделать выбор и между реакциями I и III. Дальнейшие иссле-
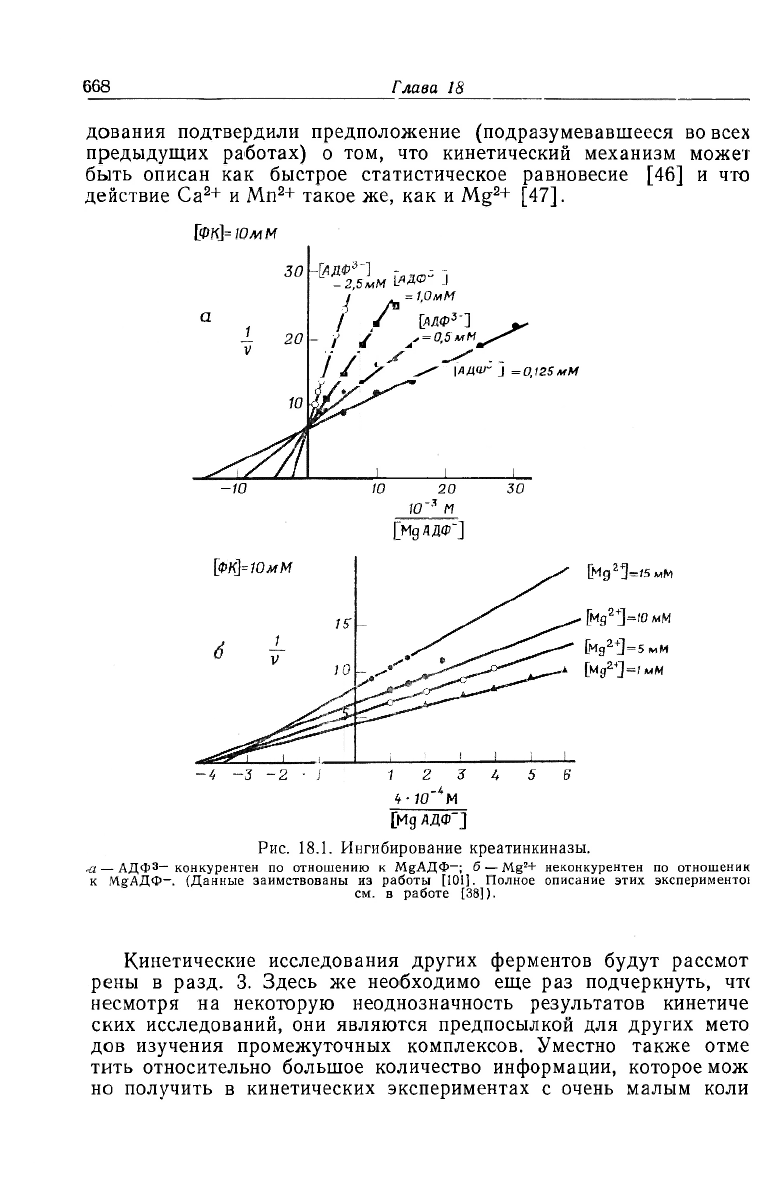
'<668
Глава
17
дования подтвердили предположение (подразумевавшееся во всех
предыдущих работах) о том, что кинетический механизм может
быть описан как быстрое статистическое равновесие [46] и что
действие Ca
2
+ и Mn
2
+ такое же, как и Mg
2
+ [47].
[ФК]=ЮММ
30
~ 2,5 мМ ИД® J
J
=
1,0 мМ
а
1
V
20
10
/ / [ЛДФ
3
"] ~
- / / S = O
i
SmM^^
J /Jf =O
i
IZSMM
I I I
-10 ю 20 зо
W
3
м
[Mg ДДФ~]
10
[Mg ЛДФ"]
Рис. 18.1. Ингибирование креатинкиназы.
— АДфЗ— конкурентен по отношению к МгАДФ-; б — Mg
2
+ неконкурентен по отношеник
к М
В
АДФ-. (Данные заимствованы из работы [101]. Полное описание этих эксперименте!
см. в работе [38]).
Кинетические исследования других ферментов будут рассмот
рены в разд. 3. Здесь же необходимо еще раз подчеркнуть, чтс
несмотря на некоторую неоднозначность результатов кинетиче
ских исследований, они являются предпосылкой для других мето
дов изучения промежуточных комплексов. Уместно также отме
тить относительно большое количество информации, которое мож
но получить в кинетических экспериментах с очень малым коли

Киназы
669-
чеством фермента, когда многие другие методы оказываются
недостаточно чувствительными. Для обычного энзимолога послед-
нее обстоятельство весьма существенно.
2.5. Методы исследования фермент-субстратных комплексов
в равновесии
Основы для понимания механизма функционирования фермен-
тов могут быть получены только при сочетании кинетических и
других физико-химических методов исследования. В принципе
современному биохимику доступны многие такие средства, вклю-
чая равновесный диализ, ультрацентрифугирование, различные
оптические методы, ДОВ и др. Можно указать и на общие руко-
водства по применению физических методов в биохимии [48].
Эти методы пока еще недостаточно широко использовались
для изучения киназ. Ниже приведены результаты некоторых ра-
бот, показывающие ту информацию, которую можно получить
таким путем.
1. Обширное исследование связывания субстратов и т.п. с
креатинкиназой и аденилаткиназой выполнили Куби и сотр. [45].
Методами равновесного диализа и ультрацентрифугирования
были получены доказательства слабого связывания Mg
2
+ и отно-
сительно сильного связывания свободного нуклеотида и его комп-
лекса с металлом.
2. Кинетический анализ защитного действия лиганда приме-
няли Милдван и Лей [49] для пируваткиназы, а для креатинки-
назы— О'Сулливан с сотр. [50] и Каннингам с сотр. [51].
3. При обстоятельном исследовании пируваткиназы, которое
выполнили Сыолтер с сотр. [52], с помощью ультрафиолетовой и
флуоресцентной спектроскопии были получены ясные доказатель-
ства изменения конформации фермента при присоединении раз-
личных субстратов и кофакторов.
К этой группе методов следует отнести и различные методы,
использующие явления магнитного резонанса. Но вследствие их
особой важности для исследования киназ и других ферментов они
более подробно рассмотрены ниже.
2.6. Применение методов магнитного резонанса
В последние годы для изучения белков широко используются
различные методы магнитного резонанса. Мы рассмотрим два из
них: электронный парамагнитный резонанс (ЭПР) и ядерный
магнитный резонанс (ЯМР). При помощи этих методов получают
данные о химических сдвигах и скоростях релаксации. Данные
с химических сдвигах пока еще мало используются в биохимии.

'<670
Глава
17
но с развитием техники высокого разрешения они, по-видимому
приобретут большее значение. Измерения скоростей релаксацш
могут проводиться импульсным или сканирующим методом
Ко времени написания этой книги результаты, наиболее полезные
для понимания киназных реакций, были получены при помощи
импульсной техники, особенно в случае измерения скоростей ре-
.лаксации протонов воды. Можно ожидать, что при комплексном
использовании различных методов будут получены еще более
ценные данные.
2.6.1. Электронный парамагнитный резонанс
Спектры ЭПР дают группировки с неспаренными электронами.
К ним относятся парамагнитные ионы металлов, что, например,
оказалось очень полезным при исследовании металлоферментов,
содержащих Cu и Mo [53—55]. Впервые для изучения киназных
реакций этот метод использовали Кон и Таунсенд [56], которые
таким способом измерили константы устойчивости некоторых
комплексов субстратов с марганцем. Последнее оказалось воз-
можным благодаря тому, что амплитуда сигнала от комплекса
гораздо меньше, чем от свободного металла. Кроме этого случая,
ЭПР-спектроскопия марганца успешно использовалась совместно
с измерениями протонного резонанса для определения концентра-
ции свободных ионов Mn
2
+ [35, 57]. Другие попытки использова-
ния этого метода, основанные на парамагнитных свойствах мар-
ганца, оказались неудачными. Было очень трудно получить сами
спектры комплексов и еще труднее их интерпретировать. Однако
благодаря этим измерениям были получены доказательства,
позволившие Кон разделить киназы на две группы: тип I (напри-
мер, креатинкиназа) и тип II (например, пируваткиназа) в со-
ответствии с тем, как ион металла реагирует с ферментом — через
субстратный мостик (Е—S—М) или непосредственно (Е—M—S)
(см. разд. 2.6.2. и гл. 14).
Использование ЭПР оказалось особенно ценным в одном спе-
циальном случае — при связывании иминоксильной метки с реак-
ционноспособной сульфгидрильной группой активного центра
креатинкиназы. Этот радикал имеет только один неспаренный
электрон (спин V
2
), и поэтому его спектры ЭПР значительно
проще, чем у ионов марганца. Другое преимущество метода ими-
ноксильной метки состоит в том, что хотя модифицирование
SH-группы инактивирует фермент, однако адсорбционный центр
нуклеотида остается ненарушенным. А это позволяет изучать
изменения спектров при введении субстратов или диамагнитных
•солей. Ясно, что синтез новых иминоксильных меток откроет перед
.этим методом дополнительные возможности.

Киназы
669-
2.6.2. Ядерный магнитный резонанс
Измерение химического сдвига. Это наиболее известный тип
(змерений магнитного резонанса. В основном используется ска-
шрующий метод, который позволяет определить спектры иссле-
[уемых ядер. Чаще всего получают спектры протонов, хотя для
[зучения металлонуклеотидных комплексов оказались полезными
I спектры
31
P и
15
N (гл. 33).
В принципе сканирующим методом можно получить больше
jcero сведений, так как он дает информацию об электронной
:труктуре активного центра и о конформации фермент-субстрат-
гых комплексов. Однако его практическое использование часто
затрудняется сложностями при разрешении широких перекрываю-
щихся линий в спектрах больших белковых молекул, а также еще
и необходимостью выполнения измерений протонного резонанса
в D
2
O, для чего обычно требуется неоднократная лиофилизация
белка. Первое осложнение преодолевается применением новейшей
техники с большой разрешающей способностью [59]. О ее воз-
можностях можно судить по работе Ярдецкого с сотр. [60], по-
священной механизму действия рибонуклеазы. Предварительные
эксперименты такого рода были выполнены и с аденилаткиназой
(разд. 3.3).
Релаксационные методы уже обсуждались в гл. 14. Можно
указать также на подробный обзор Милдвана и Кон [5].
В данной главе имеет смысл лишь суммировать те сведения,
которые можно получить при измерениях скоростей релаксации
протонов и которые наиболее важны при изучении киназ.
1. На этом методе основана полезная классификация фермен-
тов, активируемых марганцем, на два типа — I (субстрат в каче-
стве мостика) и II (металл в качестве мостика). Желательно,
чтобы эта классификация была бы подтверждена измерениями
ЭПР (разд. 2.6.1) и скоростей релаксации ядер субстрата (для
определения расстояний от марганца).
2. При изучении парамагнитных частиц эти методы имеют
преимущество перед остальными термодинамическими методами
определения констант диссоциации различных комплексов фер-
ментов. Можно ожидать, что точность получаемой при этом ин-
формации будет повышена при применении ЭВМ [61]. Такие
методы использовались для определения прочности связывания
субстратов со специфически инактивированными формами фер-
ментов [62].
3. Методом протонного резонанса были получены доказатель-
ства того, что субстрат вызвает конформационные изменения в
белке. Данные такого рода относятся прежде всего к креатинки-
назе (они обсуждаются ниже, см. разд. 3.1).
4. Исследования температурной и частотной зависимости мо-
гут способствовать определению механизма релаксации. В ре-

'<672
Глава
17
зультате можно получить сведения о микроокружении иона мар
ганца, а в благоприятном случае — и о количестве молекул вод1
в первой координационной сфере.
5. Введение спиновых меток, первоначально применявшихс
для изучения изменений в спектрах ЭПР [63], влияет также и н
скорости релаксации соседних с ними протонов. Благодаря этом
значительно расширяются возможности применения и методо
протонного резонанса. Примером таких работ могут служить ис
следования алкогольдегидрогеназы, которые выполнили Вейнер i
Милдван [64], а также введение спиновых меток в креатинки
назу [58].
3. ОБСУЖДЕНИЕ ОТДЕЛЬНЫХ ФЕРМЕНТОВ
Хотя известно большое количество киназ, только немногие и:
них изучены подробно с физико-химической точки зрения. По-ви
димому, наибольшее внимание было уделено креатинкиназе и
нируваткиназе, которые послужили прототипами ферментог
типа I (Е—S—М) и II (Е—M—S) соответственно (табл. 18.1)
Таблица 18.,
Классификация ферментов в соответствии со структурой комплексов, содержащие
фермент, металл и субстрат
Тип I (Е—S-M) Тип II (E-M-S)
Креатинкиназа (из мышц и мозга) Пируваткиназа (из мышц и мозга)
Аденилаткиназа
Фосфоенолпируваткарбоксикиназа
Аргининкиназа
Гексокиназа (Енолаза)
а
Фосфоглицераткиназа
(Пируваткарбоксилаза)
а
а
Не относится к классу киназ.
Ниже они рассмотрены более детально. Несколько менее подроб-
но обсуждаются и некоторые другие киназы, включая и такие,
которые не соответствуют «нормальным» моделям.
3.1. Креатинкиназа
Креатинкиназа (АТФ: креатинфосфотрансфераза, КФ 2.7.3.2)
катализирует обратимый перенос фосфорильной группы от АТФ к
креатину. Реакцию можно представить в следующем виде:
МАТФ
2-
+ креатин < > МАДФ~ + фосфокреатин
2
- -f H
+
