Эйхгорн Г. (ред.) Неорганическая биохимия. Том 1
Подождите немного. Документ загружается.

Комплексы металлов с аминокислотами и пептидами
163-
эгда процесс сопровождается дисооциациеи пептидного протона
40]. В противном случае связывание металла с пептидным азо-
JM подразумевает образование четвертой связи с изменением
шгональной гибридизации Sp
2
в тетраэдрическую Sp
3
и потерю
гзонанса пептидной группы. Еще до того, как было установлено
го правило, были предложены структурные формулы, показы-
ающие связывание металла атомами азота протонированных
гптидных групп. Однако в свете изложенного все эти формулы
олжны быть пересмотрены.
1.4. Атомы кислорода пептидных групп
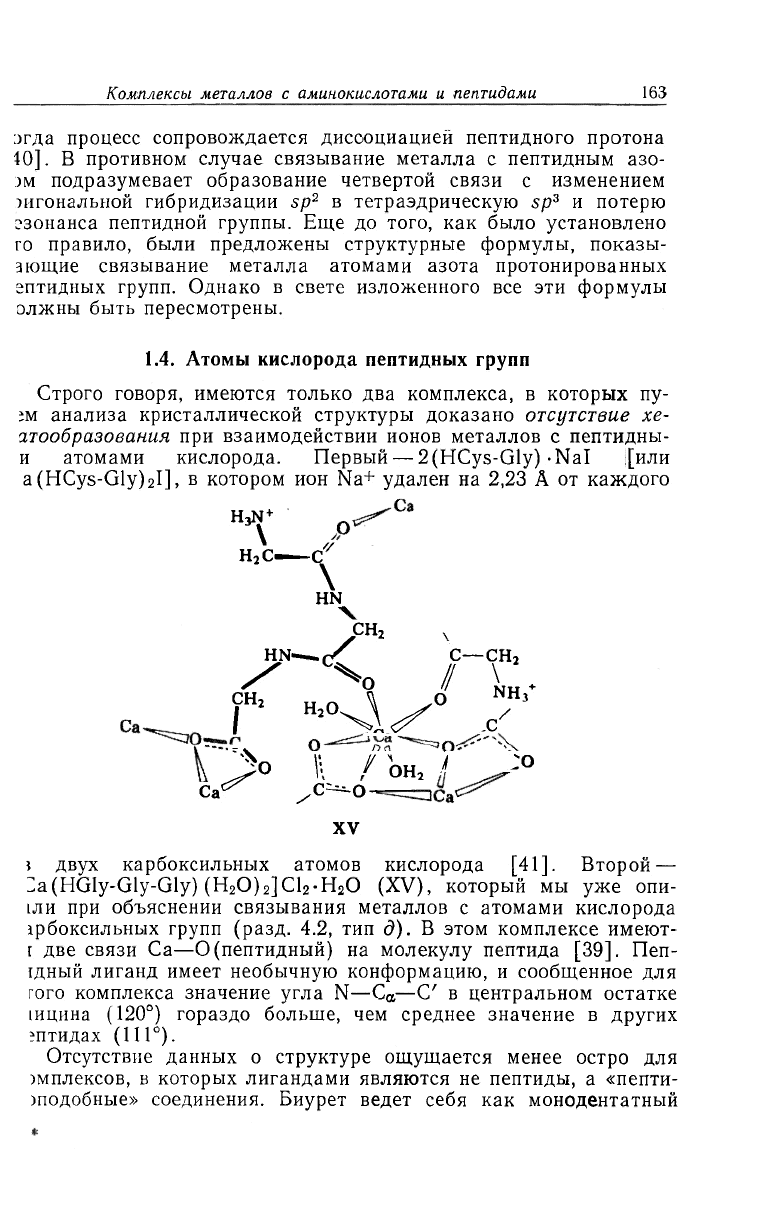
Строго говоря, имеются только два комплекса, в которых пу-
;м анализа кристаллической структуры доказано отсутствие хе-
атообразования при взаимодействии ионов металлов с пептидны-
и атомами кислорода. Первый — 2(HCys-Gly) -NaI [или
a (HCys-Gly)
2
I], в котором ион Na
+
удален на 2,23 А от каждого
H
1
-
H
2
C—C^
HN
/CH
2
HN-—(S C-CH
2
/ X // \
NH +
г
h
^v
o
;
нз
Зо 11 V :о
Ca^ /C=^O-
XV
OH
2
? двух карбоксильных атомов кислорода [41]. Второй —
Za(HGly-Gly-Gly) (H
2
O)
2
JCl
2
-H
2
O (XV), который мы уже опи-
ши при объяснении связывания металлов с атомами кислорода
!рбоксильных групп (разд. 4.2, тип д). В этом комплексе имеют-
t две связи Ca—О (пептидный) на молекулу пептида [39]. Пеп-
1дный лиганд имеет необычную конформацию, и сообщенное для
того комплекса значение угла N—C
a
—С' в центральном остатке
[ицина (120°) гораздо больше, чем среднее значение в других
гптидах (111°).
Отсутствие данных о структуре ощущается менее остро для
жплексов, в которых лигандами являются не пептиды, а «пепти-
шодобные» соединения. Биурет ведет себя как монодентатный

164
i лава 2
лиганд в комплексах Co(BiuH
2
)
2
Cl
2
и Hg(BiuH
2
)
2
Cl
2
[42j. В об
их структурах молекулы биурета образуют по одной связи м
талл — амидный кислород. Атомы металла соединены в беек
нечные цепи металл—Cl
2
—металл мостиками из двух атом<
хлора, которые дополняют октаздрическую координацию. Фор:
амидный комплекс Cd(HCONH
2
)
2
Cl
2
имеет аналогичную структ
ру [43]. В N-метилацетамидном комплексе Li(CH
3
CONHCH
3
)
1
все амидные связи C = O обращены к ионам Li+, а в
амидные связи N—H направлены к ионам Cl
-
[44
В Na(CH
3
CONHCH
3
)
2
Br амидные атомы кислорода молекул д
ацетамида отстоят на 2,3 А от ионов Na+ [45].
Взаимодействие пептидных групп с ионами щелочных и ш
лочноземельных металлов, по-видимому, имеет в значительна
степени ионный характер, но получены доказательства того, ч
это взаимодействие сохраняется и в растворе. Химические сдвн
протонов в спектрах ядерного магнитного резонанса (ЯМР) ук
зывают на то, что взаимодействие металл — амидный кислор
аналогично тому, которое описано для структур, существуют
в растворах N-метилацетамида и ионов Al
3
+, Th
4
+, Mg
2
+ и L
в таком же порядке уменьшаются длины связей металл—лига
[46, 47]. Не будучи специфическим свойством отдельных связ(
взаимодействия металл — карбоксильный кислород и металл
пептидный кислород доказываются также тем фактом, что раст!
римость аминокислот и пептидов в воде изменяется в присутств
галогенидов щелочных и щелочноземельных металлов [48]. I
пример, [Ca(HGly-Gly-Gly) (H
2
O)
2
JCl
2
-H
2
O (XV)—это толь
один из ряда стехиометрических комплексов, которые образую-!
аминокислотами и пептидами хлориды, бромиды и иодиды Са(1
Sr(II) и Ba(II). Для всех выделенных комплексов найдено,
1
растворимость пептида в растворе соли больше, чем в чистой вс
[48]. Дополнительным доказательством взаимодействия кальи
с пептидом в растворе служит наблюдение обратного факта
растворимость иодата кальция в воде возрастает в присутстп
глицилглицина и некоторых других пептидов и аминокислот [4
Увеличение растворимости иодатов щелочноземельных метал.;
было использовано для определения констант устойчивости к<
плексов металлов с пептидами в растворе [50]. И термодинами
екая, и кинетическая устойчивость этих комплексов невелика.
Еще недостаточно данных, которые подтверждали бы взаш
действие металлов с кислородными атомами пептидов с обра
ванием хелатов. Из комплексов, структура которых уже обсуж,
лась, Zn(Gly-Gly)
2
• 2Н
2
0 (II) [19] и Zn(Gly-Gly-Gly)(SOz
l
)
•4Н
2
0 (XIII) [37] служат примерами комплексов с хелатны
кольцами, в которых донором помимо пептидного кислорода
ляется аминный азот. Координация Cu(II) в Cu(Gly-Gly-Gly)
1
•!'/гH
2
O похожа на координацию Zn в XIII [51], и нет сомне!

Комплексы металлов с аминокислотами и пептидами
165-
в том, что такой способ хелатообразования — общий в тех слу-
чаях, когда концевая аминогруппа участвует в связывании с ме-
таллом; исключение составляют комплексы, в которых пептидные
атомы азота депротонированы (см. ниже). Аналогично этому пеп-
тидоподобный лиганд биурет ведет себя как бидентатный хела-
тирующий агент за счет обоих своих амидных атомов кислорода
в Zn(BiuH
2
)
2
Cl
2
(XVI) [52], а также в аналогичных комплексах
-с Ni(II), Mn(II) (данные ИК-спектров [53, 54]) и Cu(II) (дока-
зано путем структурного анализа [55]).
Ряд методов подтверждает существование в растворах метал-
лов с пептидами пятичленных хелатных колец, в которых донора-
ми являются атомы азота аминогрупп и пептидные атомы кисло-
рода. Например, в ПМР-спектре глицилглицина в D
2
O имеются
два сигнала протонов, обусловленных двумя неэквивалентными
группами —CH
2
—. При добавлении ионов Cd
2
+ к раствору один
сигнал сдвигается сильнее, чем другой. Более чувствительный
сигнал должен принадлежать СН
2
-группам, которые расположены
ближе к донорным атомам, т. е. СН
2
-группам, находящимся меж-
ду NH
2
- и пептидной группами. Оказалось также, что при добав-
лении к раствору малых концентраций ионов Cu
2
+ этот сигнал
исчезает первым (вследствие селективного парамагнитного уши-
рения линии). Это доказывает, что первоначальные места хелато-
образования для Cd
2
+ и Cu
2
+ одни и те же. До сих пор экспери-
мент лишь идентифицировал протоны, которым соответствуют
определенные частоты в спектрах ЯМР, при этом предполагалось,
•что донорные группы известны. Распространяя эти подходы на
комплексы Cd(II) с аминокислотами и пептидами с боковыми
цепями, можно дать расшифровку, которая не зависит от этого
предположения. Таким способом были подтверждены места коор-
динации в глицилглицине [56]. В спектрах три- и тетрапептидов
при низких значениях pD сигналы, которые исчезают в присутст-
вии ионов Cu
2
+, всегда принадлежат метиленовым протонам остат-
ка аминокислоты с концевой NH
2
-rpynnoft; это вновь приводит к
заключению, что хелатообразование осуществляется по атому азо-
та аминогруппы и первому пептидному кислородному атому [57].
Такое же заключение получено из исследования ИК-спектров
комплексов металлов с пептидами в D
2
O. Когда НЬ = глицилглицин,
частота пептидной группы C = O смещается от 1645 см
-1
в свобод-
ном лиганде до 1625 см
-1
в [CuL]+. Когда НВ = ди- или тригли-
цилглицин, [CuL]
+
содержит и свободные и координированные
пептидные атомы кислорода и в спектре наблюдаются обе ожи-
даемые частоты C = O [58—60].
И наконец, тщательное калориметрическое изучение системы
i
Cu(II) — пептид по-новому осветило реакцию образования этих
хелатов [18]. Некоторые результаты этого исследования приведе-
ны в табл. 4.1. Константы равновесия являются функциями как

166
i лава 2
Таблица 4.t
Термодинамические функции
11
некоторых реакций Cti(II) с глицином
и пептидами глицина (25 °С, /=0,1 М) [18]
Реакция
IgK
до,
ккал/моль
АН,
ккал/моль
AS,
кал -моль-1
•
град-t
HGG
i
GG- + H+
—8,09(1)
+ 11,03(1)
+10,6(1)
+1,5(4)
HGGG <—>-
GGG- + H+
—7,87(1)
+ 10,73(1) + 10,1(1)
-2,1(4)
Cu
2
+ + G- ^ —[CuG]
+
+8,62
—11,71(4)
—6,76(4)
+16,6(3)
Cu
2
+ + GG-
ч—>- [CuGG]
+
+5,56(1)
—7,58(1)
-6,1(2)
+5,0(7)
Cu
2
+ + GGG
-т—> [CnGGG]
+
—5,04(1)
—6,68(1)
—6,3(2)
+2(1)
[OiGG]
+
-?—
^CuH jGG + H+ —4,06(1) +5,54(1)
+6,9(2)
+4,5(7)
[CuGGG]+=?=
=£CUH_]GGG + H+
—5,06(1) +6,90(1)
+7,5(2)
+2,0(7)
CuH_JGGG [CUH_
2
GGG]"+H+
—6,78(2) +9,25(2)
+7,4(2)
-6,2(8)
а
HG=HGly
dz
, HGG=HGly-Gly
i
, HGGG = HGIy-Gly-Gly
i
-
Число в скобках — стандартное отклонение, вносящее поправку в последнюю значащук
цифру.
энтальпии, так и энтропии реакции (—RT\n K=AG = ЛЯ—TAS)
Величина АН определяется главным образом образованием и раз
рывом связей металл — лиганд* и в меньшей степени изменением
стерических факторов, таких, как напряжение в хелатном кольце
Три комплекса [CuL]
+
(L- = Gly-, Gly-Gly- и Gly-Gly-Gly-) име
ют фактически одинаковые энтальпии образования, что указывает
на то, что со всеми тремя лигандами образуются однотипны*
комплексы. Это согласуется со структурными данными, свиде
тельствующими о том, что с аминокислотами и пептидами обра
зуются пятичленные хелатные кольца. Из данных табл. 4.1 видно
что понижение ступенчатых констант устойчивости от [Cu(Gly) |
к [Cu(Gly-Gly-Gly)]+ целиком обусловлено энтропийным эф
фектом.
1.5. Пептидные атомы азота
Процессы лабилизации пептидных протонов и образовани:
связей металл — пептидный азот вместо связей металл — пептид
ный кислород характерны только для металлов, имеющих таки
ЭСКП, которые могут значительно увеличиваться при замещени:
лиганда слабого поля — кислорода лигандом сильного поля -
* Величина АН зависит также от изменения степени связывания молек>
воды исходными комплексами и продуктами их диссоциации. — Прим. ред.
Комплексы металлов с аминокислотами и пептидами
167-
азотом. В настоящее время известно, что это имеет место для ме-
таллов Co(III) (d
6
), Co(II) ((P), Ni(II), Pd(II), Pt(II) (все d
8
)
и Cu(II) (с?
9
). Влияние поля лигандов пептидного атома азота
само по себе проявляется неодинаково для разных ионов метал-
лов: путем стабилизации Co(III) по сравнению с Co(II) в случае
кобальта, переходом от голубых парамагнитных октаэдрических
комплексов в желтые диамагнитные квадратно-плоскостные комп-
лексы в случае Ni(II), очень низкими значениями рН, при которых
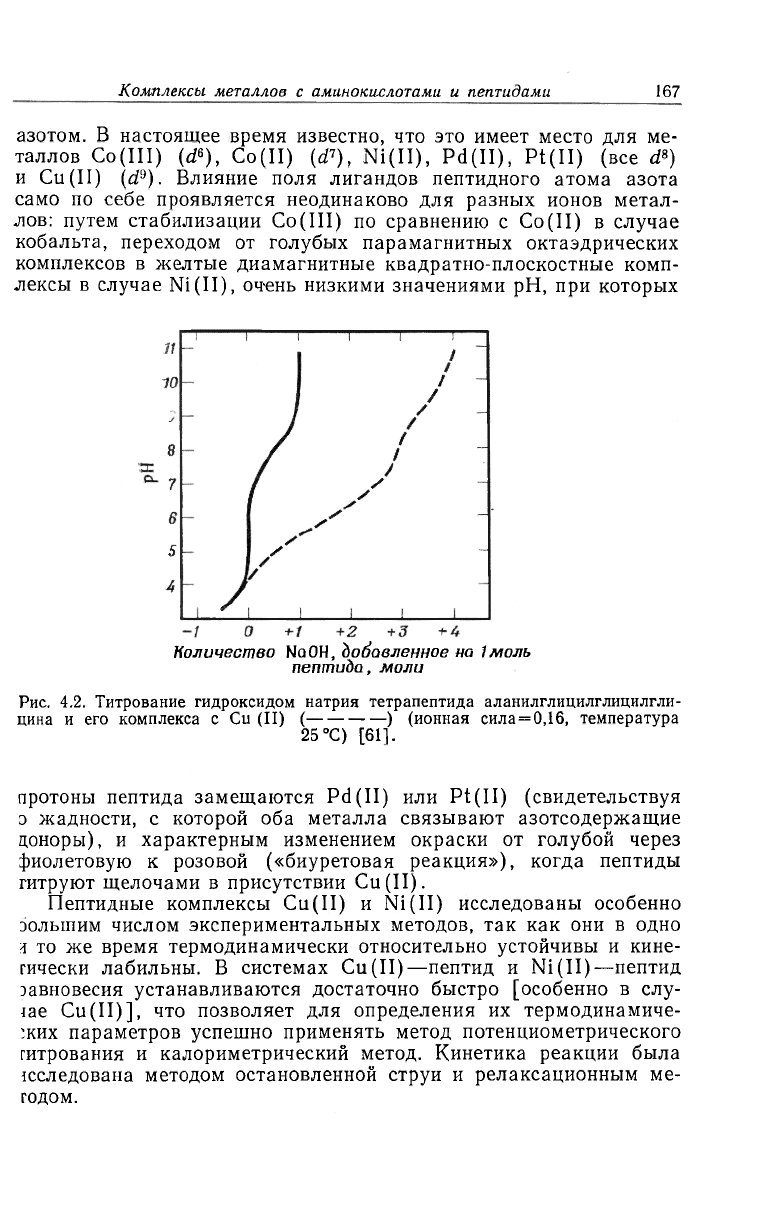
Количество NQOH, добавленное на
1
моль
пептида, моли
Рис. 4.2. Титрование гидроксидом натрия тетрапептида аланилглицилглицилгли-
цина и его комплекса с Cu (II) ( ) (ионная сила = 0,16, температура
25 °С) [61].
протоны пептида замещаются Pd(II) или Pt(II) (свидетельствуя
э жадности, с которой оба металла связывают азотсодержащие
доноры), и характерным изменением окраски от голубой через
фиолетовую к розовой («биуретовая реакция»), когда пептиды
гитруют щелочами в присутствии Cu(II).
Пептидные комплексы Cu(II) и Ni(II) исследованы особенно
эолыпим числом экспериментальных методов, так как они в одно
л то же время термодинамически относительно устойчивы и кине-
тически лабильны. В системах Cu(II)—пептид и Ni(II)-пептид
эавновесия устанавливаются достаточно быстро [особенно в слу-
iae Cu(II)], что позволяет для определения их термодинамиче-
ских параметров успешно применять метод потенциометрического
титрования и калориметрический метод. Кинетика реакции была
!сследована методом остановленной струи и релаксационным ме-
тодом.

168
i лава 2
Результаты типичного потенциометрического изучения приве-
дены на рис. 4.2 для титрования тетрапептида без иона Cu
2
+ и
в присутствии эквимолярной концентрации иона Cu
2
+ [61]. При
рН 6 пептид находится в форме цвиттер-иона, и требуется только
1 экв ОН
-
, чтобы оттитровать прогон из концевой NHrrpyniibi
в интервале рН 7—9. В присутствии Cu
2
+ протон группы NH;
титруется при значительно более низких рН, так как ион Cu
2
+
конкурирует с ионами H+ за NH
2
-rpynny. Затем в интервале рН
от 5 до 10 титруются еще более трех протонов. Если частицы,
образуемые по реакции Cu
2
+ с L
-
, обозначить [CuL]+, последова-
тельная диссоциация трех протонов приведет к CulI_|L.
[CuH_
2
L]~, [CuH-gL]
2-
. Диссоциация с образованием CuII_rL не
имеет места, если остатком второй (считая от концевой NIl
2
-rpyn-
пы пептида) аминокислоты является саркозил или пролил, т. е.
если первая пептидная группа не имеет диссоциирующих протонов
Аналогично этому [CuH_
2
L]- не образуется, если один такой
остаток занимает третье место в пептидной цепи. Это показывает
что пептидные группы являются местами дополнительной диссо
циации протонов. Депротонирование приводит к тому, что пептид-
ные атомы приобретают способность связывать металл без потерг
пептидом резонансной энергии. (После того как депротонируются
все пептидные группы, способные связывать металл, дополнитель
но еще могут лабилизоваться протоны координированных моле-
кул воды.)
Среди систем металл — пептид наиболее подробно методом по
тенциометрического титрования была исследована системг
Cu(II)—• диглицилглицин [62]. Титрование проводили со стеклян
ным электродом в 3 M растворе NaClO
4
для пяти отношений
металл—лиганд при каждой из пяти общих концентраций металлг
(включая нулевую). Полученные данные охватывают следующие
интервалы: 1,5<рН<11,0, общая концентрация металла от 1 дс
100 мМ и общая концентрация лиганда от 2 до 250 мМ. Biopoi
набор данных был получен для серий растворов, в которых коп
центрация лиганда варьировалась, а концентрация свободны)
ионов водорода и общая концентрация металла сохранялись по
стоянными. Концентрация свободных ионов металла измерялаа
с помощью медь-амальгамного электрода. Полученные данные бы
ли обработаны двумя методами — графическим и численным [62]
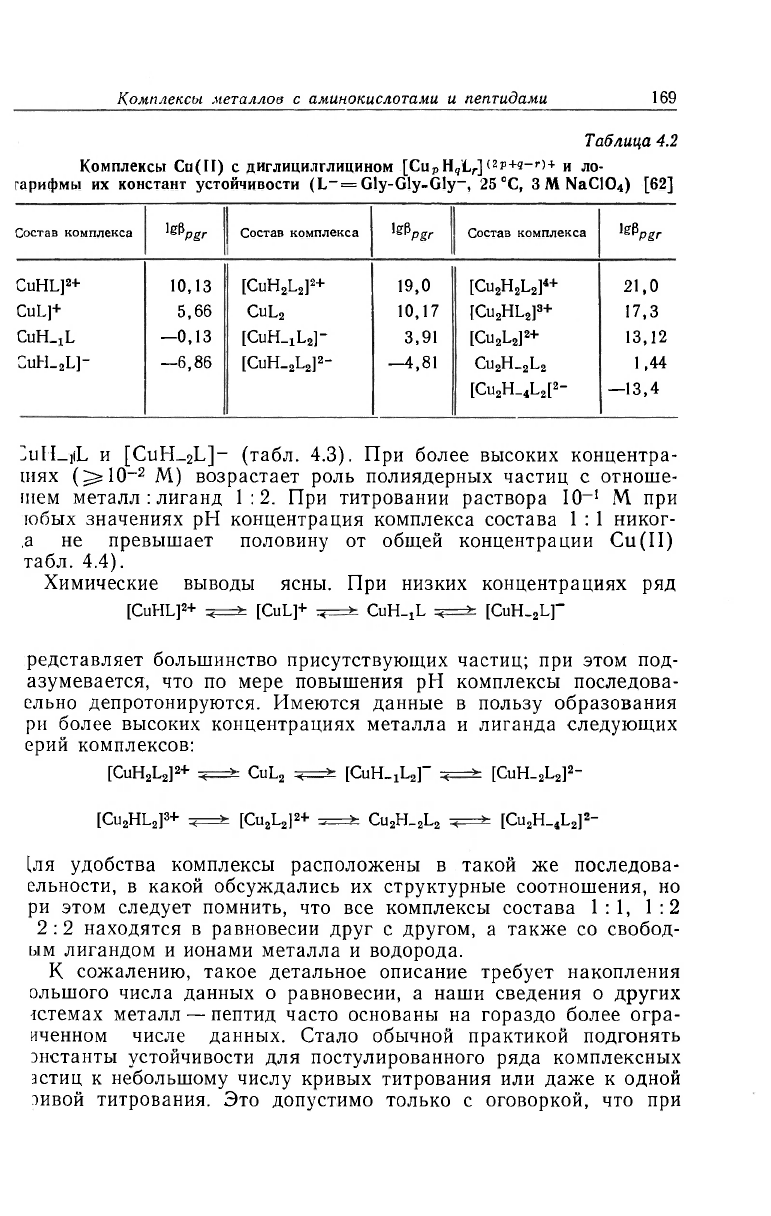
В результате этого исследования было обнаружено не менее
13 комплексных частиц, входящих в состав системы. Состав эти;
комплексов и их константы образования приведены в табл. 4.2
Константы образования могут быть использованы для расчета со
става равновесной смеси, присутствующей в растворе при любы;
заданных условиях. Такой расчет показал, что при низких кон
центрациях (~10
-3
М) существенно важны только моноядерньп
частицы, причем главными являются три частицы: [CuL]
+
Комплексы металлов с аминокислотами и пептидами
169-
Таблица 4.2
Комплексы Cu(II) с диглицилглицином [Cu
p
H,'L
r
](2p+g-r)+
и ло
.
гарифмы их констант устойчивости (L
-
= Gly-Gly-Gly
-
, 25
0
C, SMNaClO
4
) [62]
Состав комплекса
1
^Pgr
Состав комплекса
Wp
S
r
Состав комплекса
1
^PPGR
CuHL]
2
+
10,13
[CuH
2
L
2
]
2
+ 19,0 [Cu
2
H
2
L
2
]
4
+
21,0
CuL]+ 5,66
CuL
2
10,17
[Cu
2
HL
2
]
3
+ 17,3
CUH.jL
—0,13
[CaHL
1
L
2
]- 3,91 [Cu
2
L
2
]
2
+
13,12
CubL
2
L]- —6,86
[CUH.
2
L
2
]
2
-
—4,81
CU
2
H_
2
L
2
1
,44
[Cu
2
H_
4
L
2
[
2
-
—13,4
:uH_,iL и [CUH_
2
L]
-
(табл. 4.3). При более высоких концентра-
шях (^lO
-2
М) возрастает роль полиядерных частиц с отноше-
шем металл : лиганд 1:2. При титровании раствора IO
-1
M при
юбых значениях рН концентрация комплекса состава 1 :1 никог-
,а не превышает половину от общей концентрации Cu(II)
табл. 4.4).
Химические выводы ясны. При низких концентрациях ряд
[CuHL]
2
+ <—>- [CuL]+ <—>- CuH^L •<—>- [CuH^
2
L]
-
редставляет большинство присутствующих частиц; при этом под-
азумевается, что по мере повышения рН комплексы последова-
ельно депротонируются. Имеются данные в пользу образования
ри более высоких концентрациях металла и лиганда следующих
ерий комплексов:
[CuH
2
L
2
]
2
+ <—>• CuL
2
-<—>• [CuH_!L
2
]" <—» [CuH-
2
L
2
]
2
"
[Cu
2
HL
2
]
3
+ «=>: [Cu
2
L
2
]
2
+ Cu
2
H_
2
L
2
[Cu
2
H_
4
L
2
]
2
"
[ля удобства комплексы расположены в такой же последова-
ельности, в какой обсуждались их структурные соотношения, но
ри этом следует помнить, что все комплексы состава 1:1, 1:2
2 : 2 находятся в равновесии друг с другом, а также со свобод-
ым лигандом и ионами металла и водорода.
К сожалению, такое детальное описание требует накопления
ольшого числа данных о равновесии, а наши сведения о других
«темах металл — пептид часто основаны на гораздо более огра-
иченном числе данных. Стало обычной практикой подгонять
энстанты устойчивости для постулированного ряда комплексных
астиц к небольшому числу кривых титрования или даже к одной
тивой титрования. Это допустимо только с оговоркой, что при
170
i лава 2
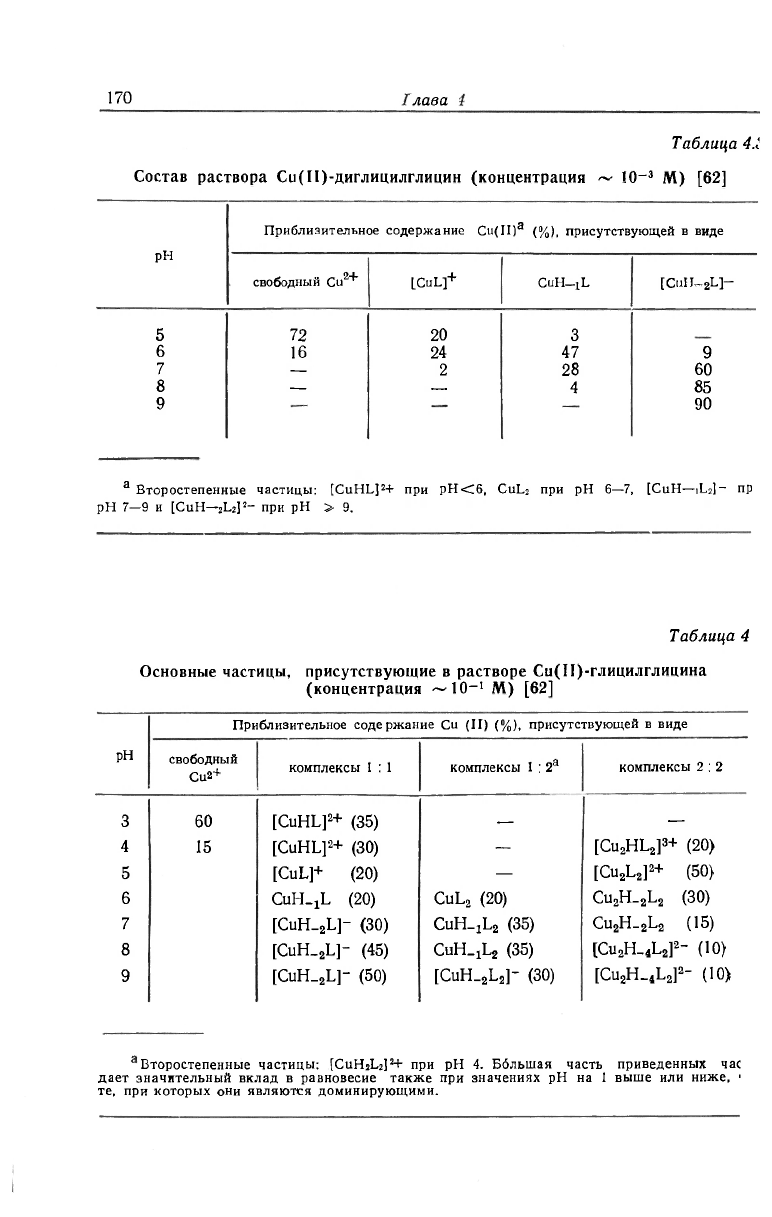
Таблица 4.1
Состав раствора Си(П)-диглицилглицин (концентрация ~ Ю
-3
М) [62]
рН
Приблизительное содержание Cu(II)
3
(%), присутствующей в виде
рН
свободный Cu
2+
LCuL]+ CuH-jL
[CuH-
2
L]-
5
72
20
3
6
16
24 47
9
7
—
2 28 60
8
— —
4 85
9 90
а
Второстепенные частицы: [CuHL]
2
+ при рН<6, CuL
2
при рН 6—7, [CuH—IL
2
]- пр
рН 7—9 и [CuH—
2
L
2
]
2
- при рН » 9.
Таблица 4
Основные частицы, присутствующие в растворе Си(Н)-глицилглицина
(концентрация — 10—
1
М) [62]
Приблизительное содержание Cu (II) (%), присутствующей в виде
рн
свободный
Cu2
+
комплексы 1 : I комплексы 1 : 2
а
комплексы 2 : 2
3
60 [CuHL]
2+
(35)
— —
4
15
[CuHL]
2+
(30)
—
[CU
2
HL
2
]
3+
(20)
5 [CuL]
+
(20)
—
[Cu
2
L
2
]
2+
(50)
6
CuH-J
l
L (20)
CuL
2
(20)
Cu
2
H_
2
L
2
(30)
7
[CuH_
2
L]- (30)
CUH_jL
2
(35)
Cu
2
H_
2
L
2
(15)
8
[CuH_
2
L]- (45)
CUH-JLJ (35)
[Cu
2
H_
4
L
2
]
2
" (10)
9
[CuH_
2
L]~ (50)
[CUH_
2
L
2
]" (30)
[Cu
2
H_
4
L
2
]
2_
(10)
Второстепенные частицы: [CuH
2
L
2
]*+ при рН 4. Ббльшая часть приведенных час
дает значительный вклад в равновесие также при значениях рН на 1 выше или ниже, '
те, при которых они являются доминирующими.

Комплексы металлов с аминокислотами и пептидами 171-
«обработке результатов не могли быть учтены все присутствующие
в данной системе частицы.
В табл. 4.1 включены некоторые термодинамические данные
для реакций депротонирования в системах Cu(II)—дипептиды и
Cu(II) — трипептиды. Лабилизация пептидных протонов, по-види-
мому, в основном обусловлена энтальпийным эффектом. Депро-
тонирование ([CuL]
+
—*-CuH_i<L—*[CuH_
2
L]~)— процесс эндотер-
мический (АН положительна), но в значительно меньшей степени,
чем диссоциация протонов в незакомплексованном лиганде
(ML—*L
-
). Энтальпии реакций диссоциации протонов из [CuL]
+
и CuH_iiL примерно постоянны, и это приводит к поразительному
результату: более положительный энтропийный вклад сам по себе
приводит к тому, что легче удалить протон из [CuL]
+
, чем из
CuH_i'L. Частичным объяснением этого различия является то, что
^епротонирование [CuL]
+
дает нейтральный комплекс, причем по-
южительное изменение энтропии главным образом обусловлено
схелатным эффектом»; потеря следующего протона приводит к
эазделению заряженных ионов (H
+
и [CuH_
2
L]-), при этом мо-
1екулы воды входят в гидратную оболочку этих ионов и неупо-
>ядоченность молекул воды в них понижается [18].
Большинство прямых доказательств того, что диссоциация пеп-
•идных протонов сопровождается образованием связей металл-—
[ептидный азот, получено из данных рентгеноструктурного анали-
а. Структура частиц [CuL]
+
, в которых металл хелатируется
олько атомом азота аминогруппы и пептидным кислородом, уже
бсуждалась на примере [Cu(Qly-Gly-Gly)]Cl- I
1
^H
2
O (разд. 4.4).
аналогично этому анализом кристаллической структуры получе-
ы данные о строении комплексных частиц, в которых Cu(II)
вязана с депротонированным пептидным лигандом. Примерами
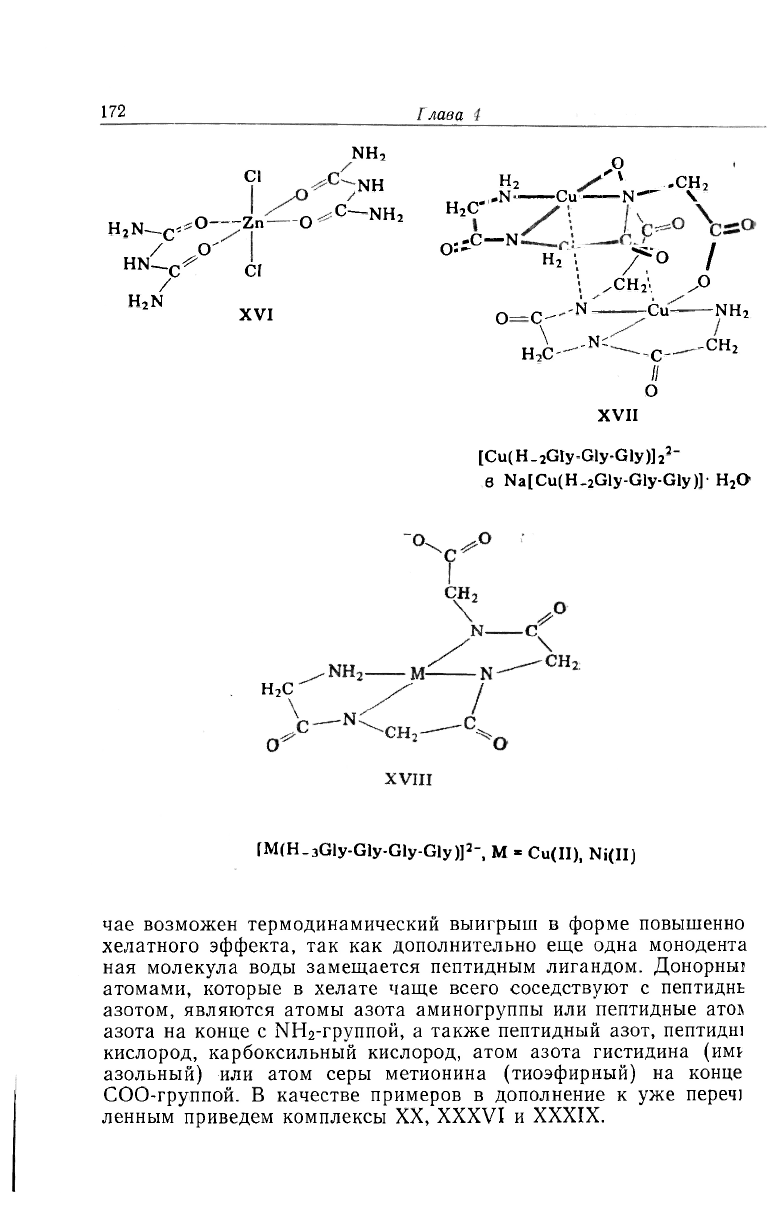
лужат CuH_jL (XXI, XXII) [63, 64], [CuH_
2
,L]- (в [Cu
2
H_
4
L
2
]
2
-,
:VII [65]), [CuH_
3
L]
2-
(XVIII) [66] и [CuH
2
L
2
]
2
- (XIX) [67].
!уществует корреляция между структурой и окраской этих
астиц.
По мере того как число донорных пептидных атомов азота,
зязанных с ионами Cu(II), увеличивается, главный d—d-переход
u(II) сдвигается в более коротковолновую область. Одновре-
енно постепенно понижаются суммы порядков связей для двух
ксиальных связей металл—лиганд до тех пор, пока в [CuH_
3
L]
2
~
ксиальные лиганды не отойдут настолько, что координационное
1сло меди станет 4 [9].
В то время как координированные пептидные атомы кислорода
юметрически не могут образовать более чем одно пяти- или шес-
[членное хелатное кольцо, координация по депротонированному
штидному атому азота создает идеальную конформацию лиган-
>в для сближения двух смежных хелатных колец, имеющих об-
ую связь металл—-пептидный азот. Таким образом, в этом слу-
172
i лава 2
NH,
H
2
N^
/
O-
O'
HN-C^
/
H
2
N
С!
-Zn
CI
XVI
NH
-о
C-NH
2
H
2
C'
H
2
-N
А
.CH
2
O=
-С—N
——Cu N"" V
H
2
: /-о /
/CH
2
', /О
O=C-
\
H
2
C-
-N
-
-Cu-
-Ni
-C-
Il
О
-NH
2
-CH
2
XVII
[Cu(H-
2
Gty-Gly-Gly)]
2
2
~
б Na
[
Cu(H -
2
Gly-Gly-Gly)]
•
H
2
O
H
2
C
[M(H-
3
Gly-Gly-Gly-Gly)]
3
-, M = Cu(II)
1
Ni(II)
чае возможен термодинамический выигрыш в форме повышенно
хелатного эффекта, так как дополнительно еще одна монодента
ная молекула воды замещается пептидным лигандом. Донорньп
атомами, которые в хелате чаще всего соседствуют с пептиднь
азотом, являются атомы азота аминогруппы или пептидные ато!
азота на конце с ЫН
2
-группой, а также пептидный азот, пептидш
кислород, карбоксильный кислород, атом азота гистидина (им*
азольный) или атом серы метионина (тиоэфирный) на конце
СОО-группой. В качестве примеров в дополнение к уже переч)
ленным приведем комплексы XX, XXXVI и XXXIX.
