Эйхгорн Г. (ред.) Неорганическая биохимия. Том 1
Подождите немного. Документ загружается.


Комплексы металлов с аминокислотами и пептидами
153-
кий раз, когда полифункциональный лиганд действует полидентат-
но, одна молекула его замещает две или большее число молекул
воды или другого монодентатного лиганда из окружения иона
металла. Образующийся хелатный комплекс имеет дополнитель-
ную термодинамическую устойчивость вследствие того, что энтро-
пия (мера неупорядоченности) системы увеличилась*. «Хелатный
эффект» объясняет, почему существует лишь небольшое число
комплексов, в которых аминокислоты или пептиды действуют как
монодентатные или нехелатирующие лиганды. Следовательно,
рискованно переносить безоговорочно закономерности взаимодей-
ствия металлов с пептидами на взаимодействие металлов с бел-
ками, так как связь металла с донорным атомом, которая неустой-
чива, может стабилизироваться, если ее образование приводит к
замыканию пяти- или шестичленного кольца.
Во-вторых, все больше появляется доказательств того, что ак-
тивные центры ферментов, в том числе и металлоферменгов, на-
ходятся в полостях или карманах белковой структуры, которые
выстланы главным образом неполярными боковыми цепями амино-
кислот и моделируют, таким образом, неводные растворы. Сле-
довательно, связывание металла таким активным центром или
вблизи него по сути осуществляется в неводных растворах, ди-
электрические проницаемости которых должны отличаться от ди-
электрических проницаемостей водных растворов электролитов, в
которых было исследовано большинство комплексов металлов с
пептидами. В то время как взаимодействие металлов с пептидами
в водных растворах может адекватно представлять условия на
поверхности раздела между белком и окружающей средой, оно
не может быть хорошей моделью того, что происходит внутри бел-
ковой молекулы.
Значительная доля сведений о местах связывания аминокислот
получена анализом кристаллической структуры. Но это не значит,
что каждое взаимодействие, которое обнаружено в данной кон-
кретной структуре, сохраняется при растворении комплекса**.
По-видимому, некоторые межмолекулярные взаимодействия не со-
храняются, в противном случае не происходило бы растворения.
Нельзя также утверждать, что взаимодействие, которое не под-
тверждено анализом кристаллической структуры, не может иметь
место в растворе. Однако неточности, связанные с тем, что дан-
ным о кристаллической структуре придается слишком большое
значение, не больше, чем опасность, возникающая от попыток де-
лать выводы о структуре на основании данных, полученных с по-
* При образовании хелата происходит также дополнительное уменьшение
энтальпии (экзо-эффект), что существенно влияет на стабильность хелата (гл. 2,
разд. 2.2.2). — Прим. ред.
** Последние исследования американских ученых подтвердили это важное
предположение. — Прим. ред.

Глава 4
мощью приборов, которые не прямо измеряют структурные свой-
ства. По крайней мере можно быть уверенным, что любая комп-
лексная частица, существование которой подтверждено анализом
кристаллической структуры, была в растворе, из которого выпали
кристаллы. Эти частицы могли быть не единственными в растворе
и даже не преобладающими, но невероятно, чтобы новые комплек-
сы возникали как артефакт процесса кристаллизации. Наиболее
целесообразно использовать все увеличивающееся число структур-
ных данных для построения и проверки модели процессов или
свойств, обнаруженных другими методами.
1. ФУНКЦИОНАЛЬНЫЕ ГРУППЫ АМИНОКИСЛОТ
И ПЕПТИДОВ КАК МЕТАЛЛСВЯЗЫВАЮЩИЕ ЦЕНТРЫ
Участие данной функциональной группы в связывании металла
зависит от двух факторов, а именно: насколько успешно эта функ-
циональная группа конкурирует с другими соседними и насколькс
успешно ионы металла конкурируют с протонами за потенциаль
но донорные атомы. Часть ответа на первый вопрос можно полу-
чить из анализа констант диссоциации функциональных групп
Чем ниже значение р/С
а
, тем больше способность донорного атоме
к образованию связи металл—лиганд. В соответствии с этиь
тенденция к связыванию металла будет изменяться в следую
щем порядке: карбоксил>имидазол>аминогруппа (рДсоон —1.8
P^CimH
2
-6,5, рДкнз —9,0). Однако было бы рискованно исполь
зовать один только этот критерий, так как порядок значений p/i
может быть иным, чем порядок изменения энтальпии при коми
лексообразовании, которая является мерой относительной термо
динамической устойчивости связей металл—лиганд и протон—ли
ганд. И наконец (как уже отмечалось), связи с низкой энталь
пией образования могут тем не менее стабилизироваться благо
приятными энтропийными факторами.
1.1. Концевые аминогруппы
Несмотря на высокие значения р/С
а
, концевые аминогруппы
—
наиболее обычные места связывания металла. Координации спо
собствуют, во-первых, сильный электронодонорный (основный) ха
рактер атомов азота аминогрупп, во-вторых, относительно силь
ное влияние поля лигандов аминного атома азота в комплекса:
переходных металлов и, в-третьих, тот факт, что атомы кислород;
карбоксильной или пептидной группы, способные образовывав
хелатное кольцо, никогда не бывают разделены более чем трем:
или четырьмя атомами. Единственное геометрическое требование
состоит в том, чтобы угол M—М(амино)—C
a
был почти тетра
Комплексы металлов с аминокислотами и пептидами 155-
>дрическим (109+1° в а-аминокислотах, 110±0,4° в пептидах и
[13+2° в р-аминокислотах).
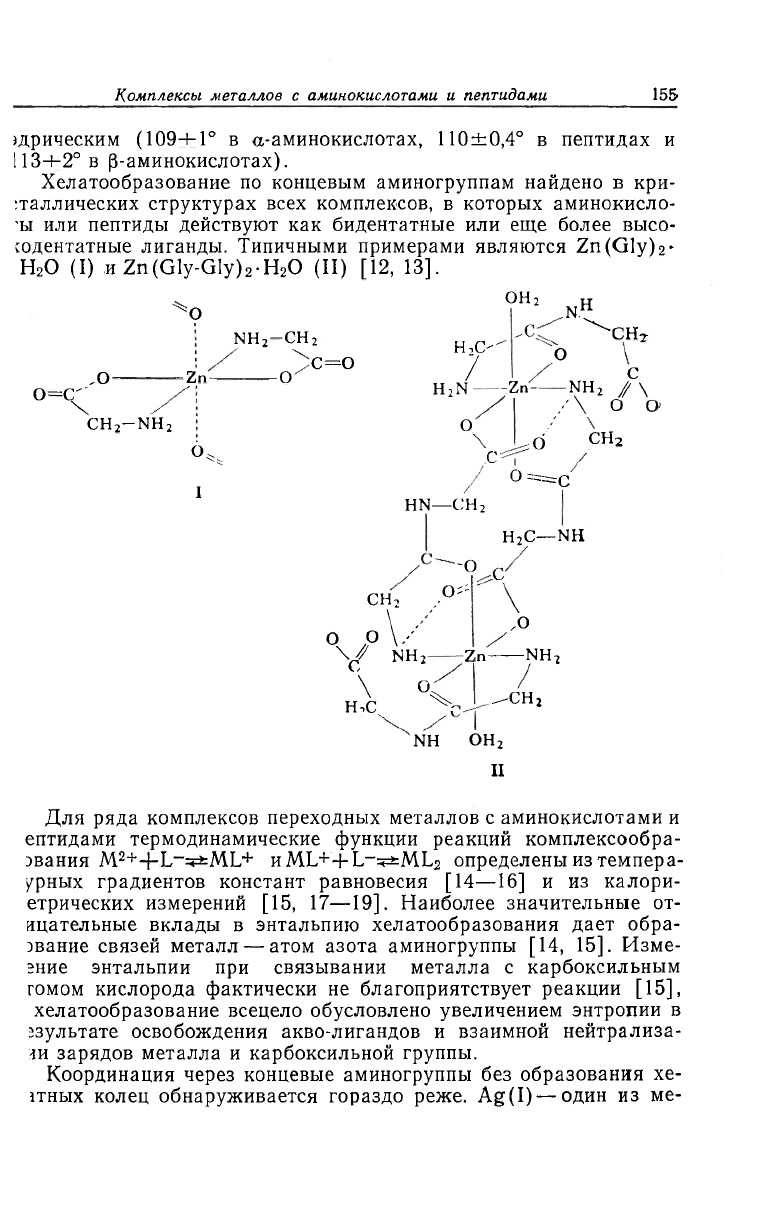
Хелатообразование по концевым аминогруппам найдено в кри-
•.таллических структурах всех комплексов, в которых аминокисло-
'ы или пептиды действуют как бидентатные или еще более высо-
содентатные лиганды. Типичными примерами являются Zn(Gly)
2
-
H
2
O (I) HZn(Gly-Gly)
2
-H
2
O (II) [12, 13].
OH
2
о
O=C'
-O-
N
CH
2
-NH
2
NH
2
-CH
2
-Zn-
0¾
I
-о
C=O
H
1
C-
7
о
H
2
N
о
-Zn-
N»
^CH
2
-
NH
2
/\
\ O O
1
Cl
о
б CH
2
==с
HN-CH
2
-о
CH
2
о о\/
X
f
/ NH
2
\
н,с
O=
H
2
C-NH
-О
О
Ч,
NH
-Zn NH
2
--CH
j
OH
2
II
Для ряда комплексов переходных металлов с аминокислотами и
ептидами термодинамические функции реакций комплексообра-
эвания M
2+
+L-=^fcML
+
и ML++L-=FtML
2
определены из темпера-
/рных градиентов констант равновесия [14—16] и из калори-
етрических измерений [15, 17—19]. Наиболее значительные от-
лцательные вклады в энтальпию хелатообразования дает обра-
звание связей металл — атом азота аминогруппы [14, 15]. Изме-
эние энтальпии при связывании металла с карбоксильным
гомом кислорода фактически не благоприятствует реакции [15],
хелатообразование всецело обусловлено увеличением энтропии в
гзультате освобождения акво-лигандов и взаимной нейтрализа-
m зарядов металла и карбоксильной группы.
Координация через концевые аминогруппы без образования хе-
атных колец обнаруживается гораздо реже. Ag(I)-OFLHH из ме-

156
i лава 2
таллов, с которым комплексообразование происходит по таком;
типу. Его электронная конфигурация d
10
и геометрия координаци
онного полиэдра является линейной или тетраэдрической. Замы
кание пяти- или шестичленных хелатных колец с образование!
линейного комплекса невозможно, а тетраэдрического комплекс;
затруднено, поэтому координация Ag(I) с полидентатными ли
гандами приводит к образованию либо полиядерных комплексоь
либо таких комплексов, у которых не все функциональные групп!
участвуют в связывании металла. Образование комплексов пер
вого типа подтверждается кристаллической структурой комплекс
Ag(Gly), который состоит из бесконечной цепи звенье
-Ag-NH
2
CH
2
COO-Ag-NH
2
CH
2
COO- (III) [20]. Этот комг
леке кристаллизуется также в форме [Ag(Gly)J-
1
^H
2
O, в которо]
чередующиеся атомы серебра связаны с двумя атомами азот
аминогрупп и двумя атомами кислорода карбоксильных груп
соответственно (IV) [20]. В обеих структурах лиганды должш
быть бидентатными, так как на один атом серебра приходите
только одна молекула лиганда.
о—
/С
Н
2
-4
о
О Ag O^
O-Ag-NH
2
/
СН2
~
С
Х
\ /~
С
\
2
CH
2
-C. -Ag-NH
2
О О NH
2
-Ag-NH
a
-
/ О
-Ag-NH
2
H H
4
O
III IV
Известно, что связи Ag—OH
2
очень слабые, так что молекул
H
2
O не могут вытеснить амино- или карбоксильные группы, чтоб
таким образом выполнялось требование связывания атома Ag, г
крайней мере с двумя донорными атомами. В водных растворг
и твердых комплексах с соотношением металл — лиганд 1 :2 им
ется больше донорных атомов, чем необходимо, поэтому образу!
щиеся связи должны иметь наибольшую энтальпию образовани
Величины энтальпии образования неизвестны, но для аминокислс
с боковой цепью, не содержащей функциональных групп, конста
ты устойчивости, соответствующие образованию комплексов Ag
и [AgL
2
]- (lgP
101
= 3,5—4,0; Ig P
102
= 6,5-7,5 [21-23]), аналоги
ны константам устойчивости комплексов Ag — аммин и увелич
ваются в таком же порядке, как константы кислотной диссоциащ
/CNHS аминокислотных лигандов. Отсюда заключили, что сереб]
связывается только атомом азота аминогрупп [23, 24]. К анал
гичным выводам пришли в результате исследования ИК-спектр|
твердых комплексов LifAg(Nle)
2
]. В комплексе асимметричн;
полоса поглощения карбоксильной группы остается неизменной i

Комплексы металлов с аминокислотами и пептидами 157-
сравнению с полосой поглощения свободного норлейцина (HNle),
что дает основание предположить, что карбоксильная группа сво-
бодна [25] (хотя аргументы такого типа можно подвергнуть кри-
тике, если отсутствуют наблюдения за частотами валентных коле-
баний связей металл — лиганд [26]).
Pt(II) —другой металл, к которому аминокислоты часто коор-
динируются только через атомы азота аминогруппы. Комплексы
[Pt(Gly)
4
]
2
- (V), [Pt(Gly)
3
]- (VI), [Pt(GlyH)
2
Cl
2
] (VII) и
[Pt(GlyH)
2
(NH
3
)
2
]
2
+ (VIII) охарактеризованы либо только пре-
паративно [27—29], либо по величинам контактных сдвигов сиг-
налов протонов в спектрах ПМР [30]. Монодентатная координа-
ция в этих комплексах объясняется тем, что донорами являются
атомы азота, которые, находясь близко к концу спектрохимиче-
OOCCH
2
NHa NH
2
CH
a
COO- H
2
C-NH
24
^ /NH
2
CH
2
COO-
-OOCCH
2
NH.
/
4
NH
2
CH
2
COO- O=C о/
4
NH
2
CHoCOO-
2
V VI
[Pt(Gly)
4
]
2-
[Pt(Gly)
3
P
CI
n
^ /NH
2
CH
2
COOH H
3
N
4
^ /NH
2
CH
2
COOH
Cl^
4
NH
2
CH
2
COOH H
3
N
4 4
NH
2
CH
2
COOH
VII VIII
[Pt(GlyH)
2
Cl
2
] [Pt(GlyH)
2
(NH
3
)
2
]
2+
ского ряда (источники сильного поля), вызывают значительную
стабилизацию кристаллическим полем квадратно-плоскостных
комплексов Pt(II) [т. е. энтальпия связывания возрастает за счет
энергии стабилизации кристаллическим полем (ЭСКП) конфигу-
рации d
8
]. Этот эффект настолько выражен, что атомы азота ами-
ногрупп могут связывать Pt(II) даже тогда, когда карбоксильные
группы молекул лиганда протонированы, как в VII и VIII, в ре-
зультате чего порядок, выведенный на основании значений рK
a
,
становится обратным.
1.2. Концевые и находящиеся в боковых цепях
карбоксильные группы
Уже отмечена способность карбоксильных групп участвовать
в образовании хелатных колец. С металлами, имеющими подхо-
дящую «координационную геометрию», способность карбоксиль-
ных групп участвовать в хелатообразовании зависит от присут-
ствия второго донорного атома в подходящем месте для замыка-
ния пяти- или шестичленного кольца. Это условие выполняется в
а- и р-аминокислотах, так как они имеют концевую аминогруппу,
и этим объясняется хелатная структура большинства аминокис-
лотных комплексов. В пептидах, за исключением особых случаев

158
i лава 2
(разд. 4.7), концевая карбоксильная группа неблагоприятно рас-
положена по отношению ко второй координирующейся группе,
если только это не концевая СОО-группа гистидина. Следова-
тельно, взаимодействие металлов с атомами кислорода карбок-
сильных групп в пептидах должно протекать без хелатообразова-
ния или вовсе отсутствовать. Кроме того, при тех значениях pIT,
при которых аминокислоты и пептиды находятся в форме цвиттер-
ионов +NH
3
CHR(CONHCHR)
ri
COO- (и при которых такая основ-
ная группа боковой цепи, как имидазол, протонирована), отри-
цательно заряженная карбоксильная группа является почти един-
ственной группой, которая может непосредственно связываться с
металлом. В этих условиях наиболее вероятно образование связи
металл — карбоксил для тех ионов металлов, на которые не влия-
ет ЭСКП. Ионы металлов, которые образуют прочные ковалент-
ные связи с сильными донорами электронов, а также те, которые
имеют большие значения ЭСКП в присутствии лигандов сильного
поля, могут успешно конкурировать с протонами за неподелен-
ную пару электронов атома азота концевой аминогруппы, как мы
видели это на примере комплексов Pt(II) (формулы VII и VIII).
Экспериментальным доказательством монодентатной координа-
ции через атомы кислорода карбоксильных групп служат кон-
тактные сдвиги в спектрах ПМР растворов гистидинового комп-
лекса Co(II) (растворы в D
2
O при низких значениях pD) [31]
а также частоты валентных колебаний карбоксильных групп Е
ИК-спектрах комплексов 1 : 1 D.L-аланина и L-гистидина с эле-
ментами первого переходного ряда [32]. Кроме того, взаимодейст-
вие металлов с атомами кислорода карбоксильных групп без хе-
латообразования было обнаружено для ряда комплексов, имеющих
кристаллическую структуру и выделенных при низких значения?
рН. Можно было бы подумать, что между положительно заряжен
ными ионами металла и отрицательно заряженными карбоксиль
ными атомами кислорода образуется простая связь, в которой
доли ковалентного и ионного вкладов зависят от электроотрица
тельности металла. Однако такое предположение было бы слиш
ком оптимистичным. На рис. 4.1 показаны пять типов взаимодей
ствий металлов с атомами кислорода карбоксильной группы, ко
торые можно обнаружить в кристаллической структуре комплек
сов аминокислот и пептидов. При взаимодействии по типу а одш
атом металла связывается с одним карбоксильным атомом кис
лорода. При взаимодействии по типу б «свободный» карбоксиль
ный атом кислорода связывается, но не так сильно со вторым ато
мом металла. В форме в карбоксильная группа более или мене»
одинаково связывает два атома металла, при этом она сама ста
новится симметричным мостиком между ними. (Различия в ИК
спектрах дают возможность дальше подразделить типы бив!
соответствии с расположением относительно связей металл — кис
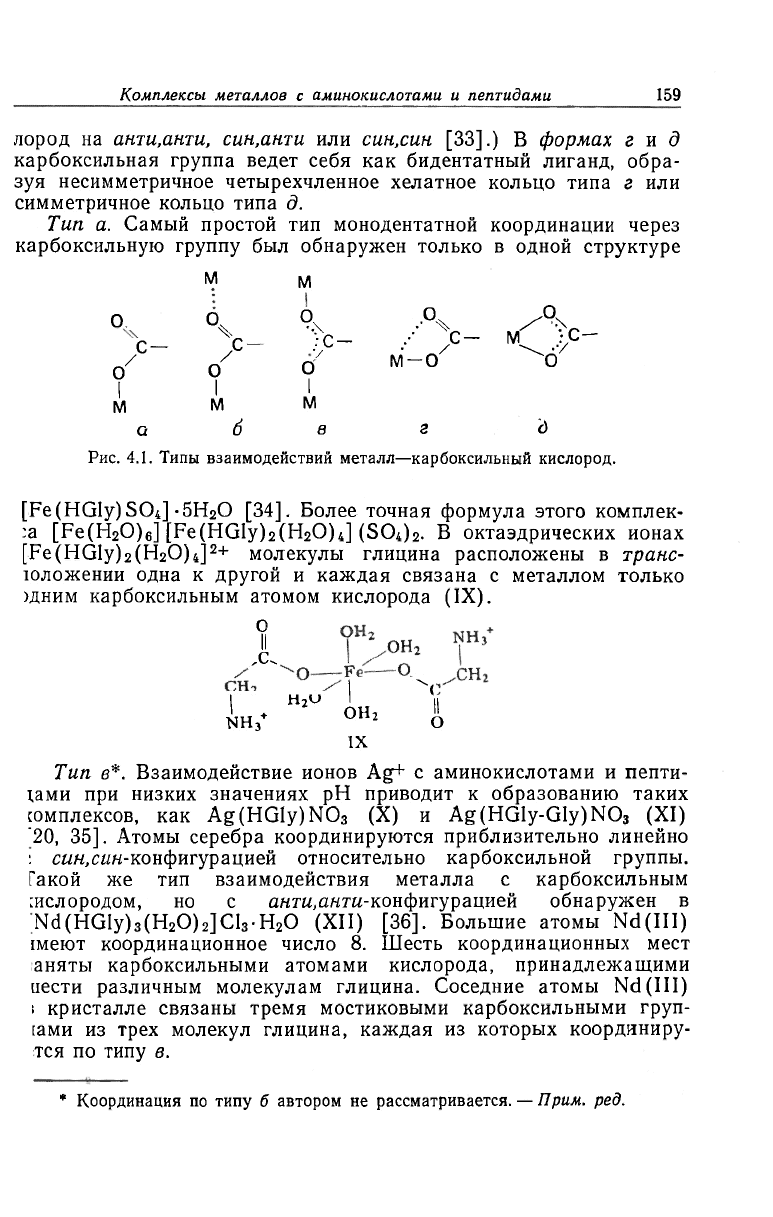
Комплексы металлов с аминокислотами и пептидами
159-
лород на анти.анти, син.анти или син.син [33].) В формах гид
карбоксильная группа ведет себя как бидентатный лиганд, обра-
зуя несимметричное четырехчленное хелатное кольцо типа г или
симметричное кольцо типа д.
Тип а. Самый простой тип монодентатной координации через
карбоксильную группу был обнаружен только в одной структуре
M M
0 O
4
О .0 ,0
ч
с- tc- / >- <>-
/ 0
х
O
7
м-о' ^o
1 I
1
M M M
q бег с)
Рис. 4.1. Типы взаимодействий металл—карбоксильный кислород.
[Fe(HGly)SO
4
]-5Н
2
0 [34]. Более точная формула этого комплек-
:а [Fe(H
2
O)
6
] [Fe(HGly)
2
(H
2
O)
4
] (SO
4
)
2
- В октаэдрических ионах
[Fe(HGly)
2
(H
2
O)
4
]
2+
молекулы глицина расположены в транс-
юложении одна к другой и каждая связана с металлом только
эдним карбоксильным атомом кислорода (IX).
О
Il
,(X
I
<L »
NH
3
u 2
О
IX
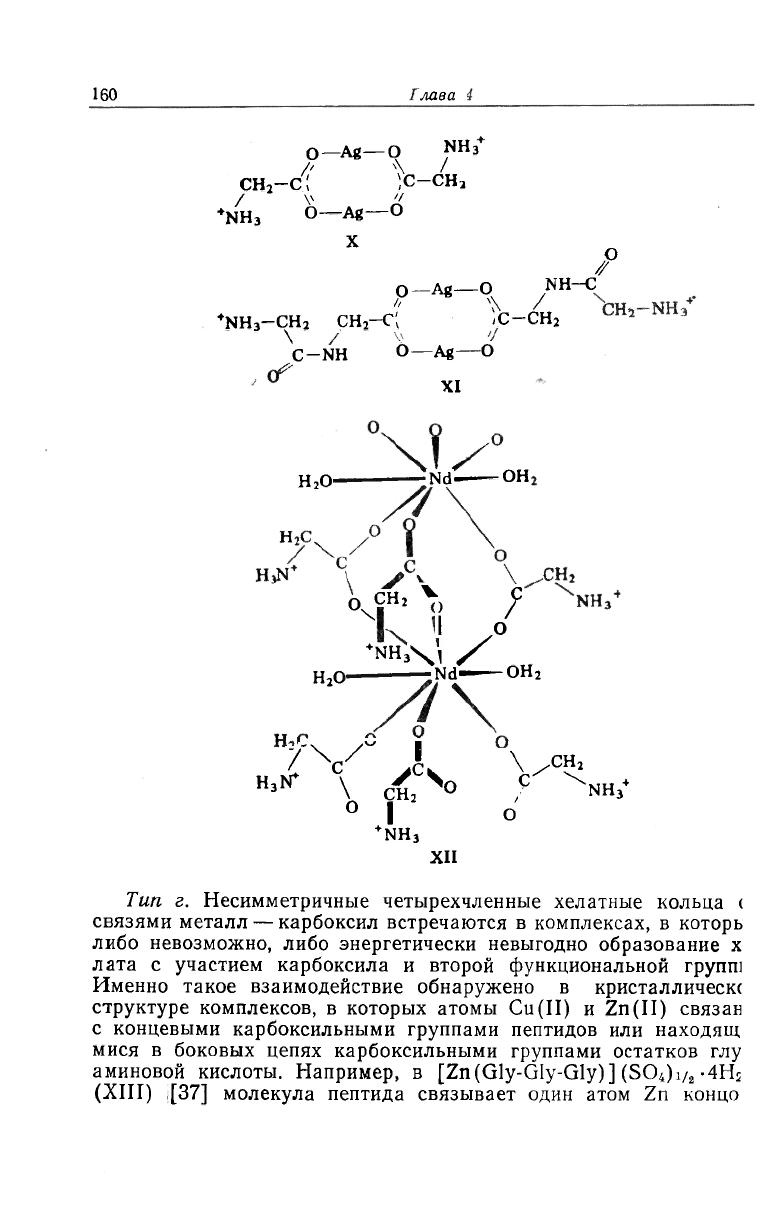
Тип в*. Взаимодействие ионов Ag
+
с аминокислотами и пепти-
дами при низких значениях рН приводит к образованию таких
сомплексов, как Ag(HGly)NO
3
(X) и Ag(HGly-Gly)NO
3
(XI)
'20, 35]. Атомы серебра координируются приблизительно линейно
: аш,сгш-конфигурацией относительно карбоксильной группы.
Гакой же тип взаимодействия металла с карбоксильным
:ислородом, но с анти, сшти-конфигурацией обнаружен в
Nd(HGly)
3
(H
2
O)
2
]Cl
3
-H
2
O (XII) [36]. Большие атомы Nd(III)
шеют координационное число 8. Шесть координационных мест
аняты карбоксильными атомами кислорода, принадлежащими
иести различным молекулам глицина. Соседние атомы Nd(III)
! кристалле связаны тремя мостиковыми карбоксильными труп-
ами из трех молекул глицина, каждая из которых координиру-
йся по типу в.
* Координация по типу б автором не рассматривается. — Прим. ред.
160 i лава 2
О—Ag—О NH
3
/' % /
сн
2
—с! ;с-сн
3
/ V ''
+
NH
3
O-A
g
-O
X
/
O-Ag-O NH-C
t
NH
3
-CH
2
CHj-C^ Vc
7
H
2
4
C-NH О—Ag—О
XI
H
2
O- -Nd ОН
O
x
CH
2
v J
+
NH
3
s
Sj X
H
2
O- -Nd OH
2
/
4
C
x
J
v
\ /CH
2
h
^ \ сО С \
NHj+
° I О
+
NH
3
XII
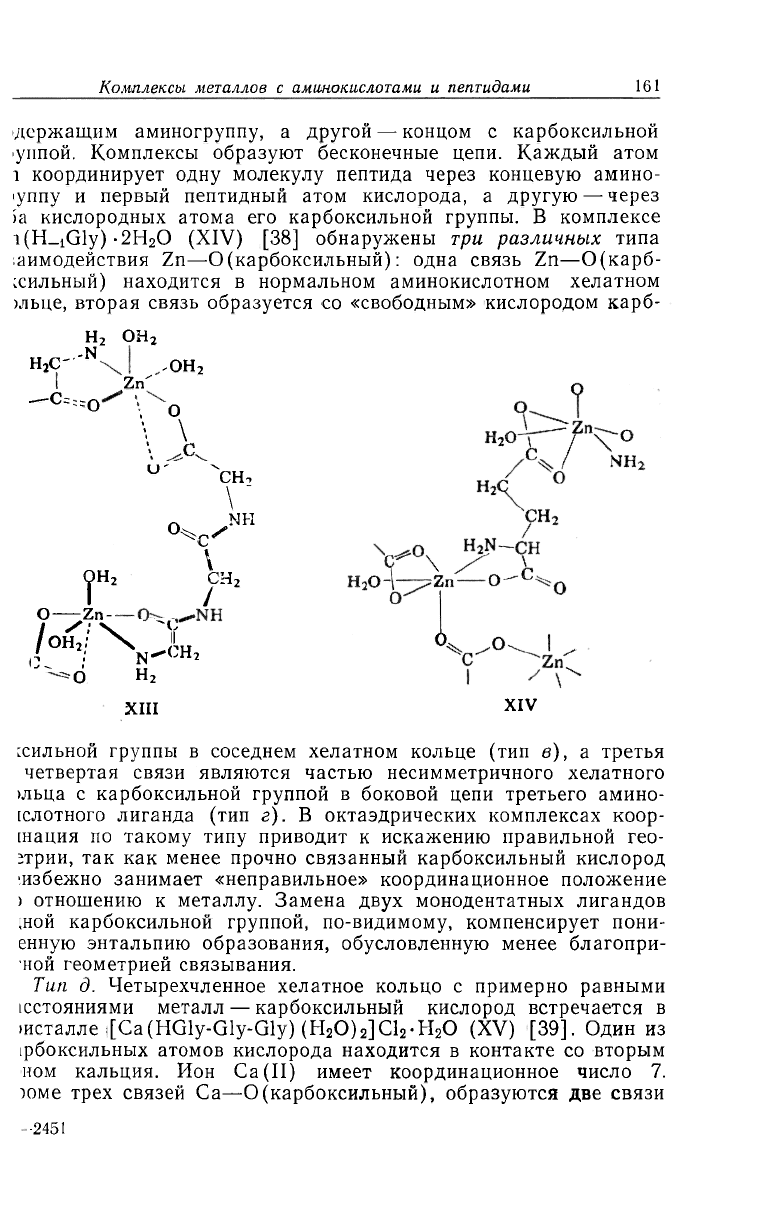
Тип г. Несимметричные четырехчленные хелатные кольца (
связями металл — карбоксил встречаются в комплексах, в которь
либо невозможно, либо энергетически невыгодно образование х
лата с участием карбоксила и второй функциональной групш
Именно такое взаимодействие обнаружено в кристаллическс
структуре комплексов, в которых атомы Cu(II) и Zn(II) связан
с концевыми карбоксильными группами пептидов или находящ
мися в боковых цепях карбоксильными группами остатков глу
аминовой кислоты. Например, в [Zn(Gly-Gly-Gly) ] (SO
4
)i/
2
-4H
S
(XIII) [37] молекула пептида связывает один атом Zn концо
Комплексы металлов с аминокислотами и пептидами
161
•держащим аминогруппу, а другой — концом с карбоксильной
уппой. Комплексы образуют бесконечные цепи. Каждый атом
1 координирует одну молекулу пептида через концевую амино-
уппу и первый пептидный атом кислорода, а другую — через
ia кислородных атома его карбоксильной группы. В комплексе
i(H_iGly)-2Н
2
0 (XIV) [38] обнаружены три различных типа
;аимодействия Zn—О (карбоксильный): одна связь Zn—0(карб-
ссильный) находится в нормальном аминокислотном хелатном
)льце, вторая связь образуется со «свободным» кислородом карб-
H
2
C"
—-С;
H
2
OH
2
-N
Zn'
-OH
2
=O
(J)H
2
О Zn-
H N
j
JSH,
о
, о
\ \
и
сн,
\
О NH
O^
c
X
\
CH
2
/
N-
H
2
XIII
XIV
!сильной группы в соседнем хелатном кольце (тип в), а третья
четвертая связи являются частью несимметричного хелатного
>льца с карбоксильной группой в боковой цепи третьего амино-
[слотного лиганда (тип г). В октаэдрических комплексах коор-
[нация по такому типу приводит к искажению правильной гео-
;трии, так как менее прочно связанный карбоксильный кислород
•избежно занимает «неправильное» координационное положение
> отношению к металлу. Замена двух монодентатных лигандов
,ной карбоксильной группой, по-видимому, компенсирует пони-
енную энтальпию образования, обусловленную менее благопри-
•ной геометрией связывания.
Тип д. Четырехчленное хелатное кольцо с примерно равными
[сстояниями металл — карбоксильный кислород встречается в
шсталле [Ca(HGly-Gly-Gly) (H
2
O)
2
]Cl
2
-H
2
O (XV) [39]. Один из
рбоксильных атомов кислорода находится в контакте со вторым
ном кальция. Ион Ca(II) имеет координационное число 7.
эоме трех связей Ca—О (карбоксильный), образуются две связи
-2451

162
i лава 2
Ca—О (пептидный) и две связи Ca—OH
2
. В этих взаимодействия
участвуют четыре различные молекулы пептида и, наоборот, ка»
дая молекула пептида связывает четыре различных иона Ca(II
Хелатные кольца (типы а, б и в). Взаимодействия металл-
карбоксильный кислород, обнаруженные в хелатных кольца
представлены типами а, б и в на рис. 4.1. В хелатное колы
включен только один атом кислорода карбоксильной группы, BTI
рой карбоксильный кислород остается свободным и может обр,
зовывать водородные связи или связываться со вторым атомо
металла в соседнем комплексе (см., например, I). Взаимодейств!
по типу б ив часто встречаются в кристаллических структура
что дает основания предположить, что они также могут быть npi
чиной образования димерных и полимерных комплексов в ра
творах.
Относительные порядки двух связей С—О в карбоксильнс
группе можно получить из длин связей при условии, что ог
определены с достаточной точностью. Значения длин связей обы
но лежат в интервале 1,25—1,30 и 1,22—1,27 А соответственн
В пятичленном хелатном кольце угол M—О (карбоксильный) —
всегда близок к 114°, а в шестичленном хелатном кольце обыч!
составляет 123—126°. Нет никакого правила, в соответствии с к
торым атом металла должен находиться в плоскости карбоксил
ной группы; тем не менее отклонения редко бывают больше 0,5
в пятичленном кольце и 0,8 А в шестичленном кольце. В т<
случаях, когда есть вторая связь карбоксильный кислород — м
талл, ее направление относительно карбоксильной группы опред
ляется относительным положением соседнего комплекса. /I
1
J
угла M—О (карбоксильный)—С при втором атоме кислорода кар
оксильной группы получены величины угла от 113 до 125° [9].
1.3. Пешидные группы
Хорошо известно, что пептидные группы в первом приближен!
должны оставаться плоскими для того, чтобы сохранялся резона:
между каноническими формами:
HHH
I ! I
NNN
\
+
/ \ \ / \ V /
+
\
CCC
I «II «I
O
-
о о
Пептидный кислород обладает слабыми основными свойствам
Связывание металла с ним слабое, и если оно происходит, •
стабилизируется близостью хелатного кольца к соседней концев<
аминогруппе. Пептидный азот связывает металл только тогл
