Эйхгорн Г. (ред.) Неорганическая биохимия. Том 1
Подождите немного. Документ загружается.


Электронное строение комплексов железа
143-
Соли акводимера никогда не были выделены в кристалличе-
ком состоянии, но вывод о его существовании был сделан на
снове анализа данных титрования [15], появления полосы в
'Ф-области при ~335 нм [16] и уменьшения парамагнетизма
17]. Однако магнитные свойства акводимера не были объяснены
18, 19].
Единственный хорошо обоснованный случай образования ди-
идроксомостика Fe
3
+ — это желто-зеленое кристаллическое веще-
ОН.
тво, по-видимому имеющее строение [(pic)
2
Fe<^ >Fe(pic)
2
]
4
OH/
20]. Этот комплекс имеет пик УФ-поглощения при 342 нм и
роявляет слабые антиферромагнитные свойства (J = —8 см
-1
).
>ыл получен также ряд димерных комплексов Fe
3
+, содержащих
иалкоксимостики и проявляющих подобные свойства [21].
5. ЭЛЕКТРОННОЕ СТРОЕНИЕ МОДЕЛЬНЫХ
ХЕЛАТОВ ЖЕЛЕЗА И РОДСТВЕННЫХ СОЕДИНЕНИЙ,
ПРЕДСТАВЛЯЮЩИХ БИОЛОГИЧЕСКИЙ ИНТЕРЕС
5.1. Димеры железопорфирина
Известно [22], что парамагнетизм гемина в щелочном раство-
е (т. е. гидроксида гемина или продуктов его полимеризации)
осстанавливается. Возможно, с этим наблюдением связаны дан-
ые полярографических исследований [23] и исследований окис-
ительно-восстановительных потенциалов [24], которые указыва-
)т на то, что в щелочных растворах существует димерный геми-
овый продукт неопределенного строения. После того как были
олучены рентгеноструктурные данные о строении [(PhtcMn)
2
O]
рЬ{с = фталоцианат) [25], было предположено [18], что указан-
ые выше результаты магнитных измерений могли быть обуслов-
ены оксомостиковыми димерами железопорфирина. В связи с
езультатами электрохимических исследований представляет ин-
ерес тот факт, что с помощью метода быстрого установления
авновесия наблюдалось двухэлектронное восстановление
(Ре0ЭДТА)
2
0]
2
- (или [(FeSflTA)
2
O]
4
-), находящегося в ла-
ильном равновесии с аналогичным высокоспиновым мономером
FeOSflTA(OH)]- (или [FeSflTA(OH)]
2
-) [26].
Оксомостиковый железопорфирин был впервые синтезирован и
!характеризован Когей и сотр. [27], которые установили строение
оединения [ (диметиловый эфир дейтеропорфирина)Fe(III) ]
2
0
а основе поглощения в ИК-области при 840 см
-1
и данных по
пределению молекулярной массы. Позже были опубликованы
,анные [28], согласующиеся с этой формулой. Синтезирован так-

144
i лава 2
же [(тетрафенилпорфин) Fe(III)J
2
O и его строение установлен
рентгеноструктурным методом [29]. В противоположность роде
венному высокоспиновому мономерному комплексу этот диме
антиферромагнитен. Определенный для димера угол Fe—О—F
168° и расстояние Fe—О 1,76 А близки к соответствующим вел!
чинам 165° и 1,79 А, найденным [30] для [ (Ге0ЭДТА)
2
0]
2
-.
B УФ- и видимой области спектра порфириновых димеров дс
минируют интенсивные полосы, которые обычно рассматривай
как возникающие исключительно за счет интралигандного во:
буждения или возбуждения переноса заряда. Трудно было над<
яться установить местонахождение нормально слабых переходе
поля лигандов, локализованных на ионе железа. Однако, как о(
суждалось ранее, в [(Ре0ЭДТА)
2
0]
2
- и подобных соединения
наблюдалось усиление полос поля лигандов примерно в 100 ра;
Возможно, что такое же или даже большее усиление может имет
место в оксомостиковых железопорфириновых димерах. Кроме т(
го, можно ожидать, что такие димеры могут иметь в УФ-област
довольно интенсивные полосы, возникающие из переходов, связа!
ных с ОПЭ. По этим причинам мы полагаем, что необходимо ш
вторное исследование электронных спектров димерных железе
порфиринов, причем особое внимание должно быть обращено н
характерные спектральные особенности структурных единиц Fe
2
C
5.2. Гидроксиды железо(П1)гемопротеинов
Магнитные свойства гидроксидов железо(III)гемопротеинов
железо (III) порфиринов сходны в том отношении, что обе групп
соединений обладают пониженным парамагнетизмом. Магнитнь
свойства гидроксидов железо(III)гемопротеинов были детали
рассмотрены в важной статье Георга, Битлестоуна и Гриффите
[31]. Они объяснили наблюденное магнитное поведение как те]
мпческое равновесие между высоко- и низкоспиновыми состояни!
мн Fe
3
+. Сущность этого объяснения заключается в том, что ОН
вызывает большее расщепление поля лигандов, чем H
2
O, так ка
известно, что аквомономеры имеют высокоспиновое состояни
Это любопытно с точки зрения того факта, что в простых нео]
ганических гидроксо- и акво-комплексах обычно наблюдаете
обратный порядок расщепления поля лигандов (Н
2
0>0Н~) [1
По стерическим соображениям образование оксомостиковь:
железо(III)гемопротеиновых димеров в щелочном растворе не к;
жется возможным. Структурные исследования показывают, что
кристаллических метгемоглобине и метмиоглобине [32] частиц
железо(Ш)порфирина окружены белком. Следует, однако, зам-
тигь, что в железо(III)гемоглобине обмен гемовой группы в ра<
творе происходит довольно быстро. Скорость обмена, который MI
жет обусловливать диссоциацию железо(П1)порфиринового бл<

Электронное строение комплексов железа
145-
ка, увеличивается на 52% при повышении рН от 6,4 до 7,7 [33].
Таким образом, не кажется невозможным то, что при рН 10 бе-
лок может диссоциировать с отщеплением железо(III)порфирина
и последний может димеризоваться (величина рК для желе-
зо (III) гемопротеина находится в пределах 8,2 — 11,3 [31]). Об-
суждалась также возможность оксомостиковых структур в цито-
хром-с-оксидазе [34].
Полученный в работе [28] спектр соединения [ (диметиловый
эфир дейтеропорфирина)Ре(Ш)]20 в видимой области проявляет
сильное сходство со спектрами железо(III)гемоглобина, желе-
зо(П1)миогл0бина и гидроксида железо(III)пероксидазы [31].
Учитывая этот факт и приведенное выше обсуждение, мы прихо-
дим к выводу, что необходимо дальнейшее выяснение связи между
магнитными свойствами и строением гидроксидов железо (III) ге-
мопротеинов в растворах.
5.3. Гемэритрин и проблема связывания кислорода
Прекрасный пример определения структуры металлопротеина
в основном с помощью спектроскопических и магнитных исследо-
ваний представляет система кислород-транспортного гемэритрина.
Клотц и сотр. (гл. 11) [35] провели обширное исследование белка
из сипункулид Golfingia gouldii. Этот белок имеет молекулярную
массу около 108000 и состоит из восьми соединенных субъединиц,
каждая из которых содержит два атома железа, способных обра-
тимо присоединять одну молекулу кислорода. Магнитные измере-
ния [35] показали, что деоксигенированная форма белка содер-
жит высокоспиновое Fe(II). Электронный спектр поглощения этой
формы относительно понятен до 300 нм; в УФ-области появляется
пик около 280 нм, характерный для тирозина.
При окислении до MeTfFe(III)]-протеина появляется пик по-
глощения в видимой области. Каждая субъединица метпротеина
связывает такие лиганды, как CL
-
, Br
-
и N3, в комплекс 1:2с
Fe(III); положение пика в видимой области спектров поглощения
этих производных слегка различно [36]. Электронный спектр по-
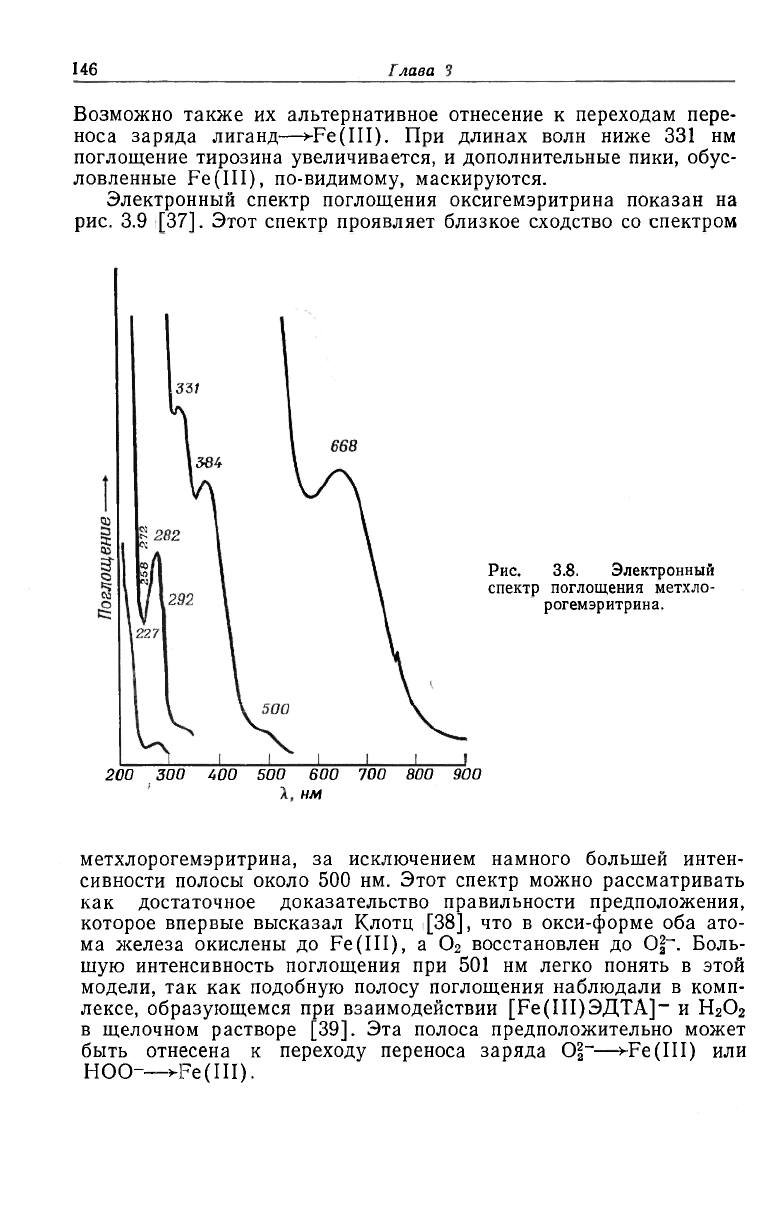
глощения метхлорогемэритрина показан на рис. 3.8. Полосы при
668 и 500 нм могут быть отнесены к полосам поля лигандов в
M!-комплексе Fe(III). Их умеренные интенсивности [36, 37] со-
гласуются с моделью, в которой два иона Fe(III) име-
ют спаренные спины в оксомостиковом димере типа
[Cl-Fe(III)-O-Fe(III)].
Полосы при 384 и 331 нм в метхлоропроизводном также мож-
но отнести к электронным переходам, включающим один или оба
иона Fe(III). Положения и интенсивности этих полос можно по-
нять, если отнести их к переходам, соответствующим одновремен-
ному возбуждению пары электронов в оксомостиковом димере.
10—2451
146
i лава 2
Возможно также их альтернативное отнесение к переходам пере-
носа заряда лиганд—>-Fe(III). При длинах волн ниже 331 нм
поглощение тирозина увеличивается, и дополнительные пики, обус-
ловленные Fe(III), по-видимому, маскируются.
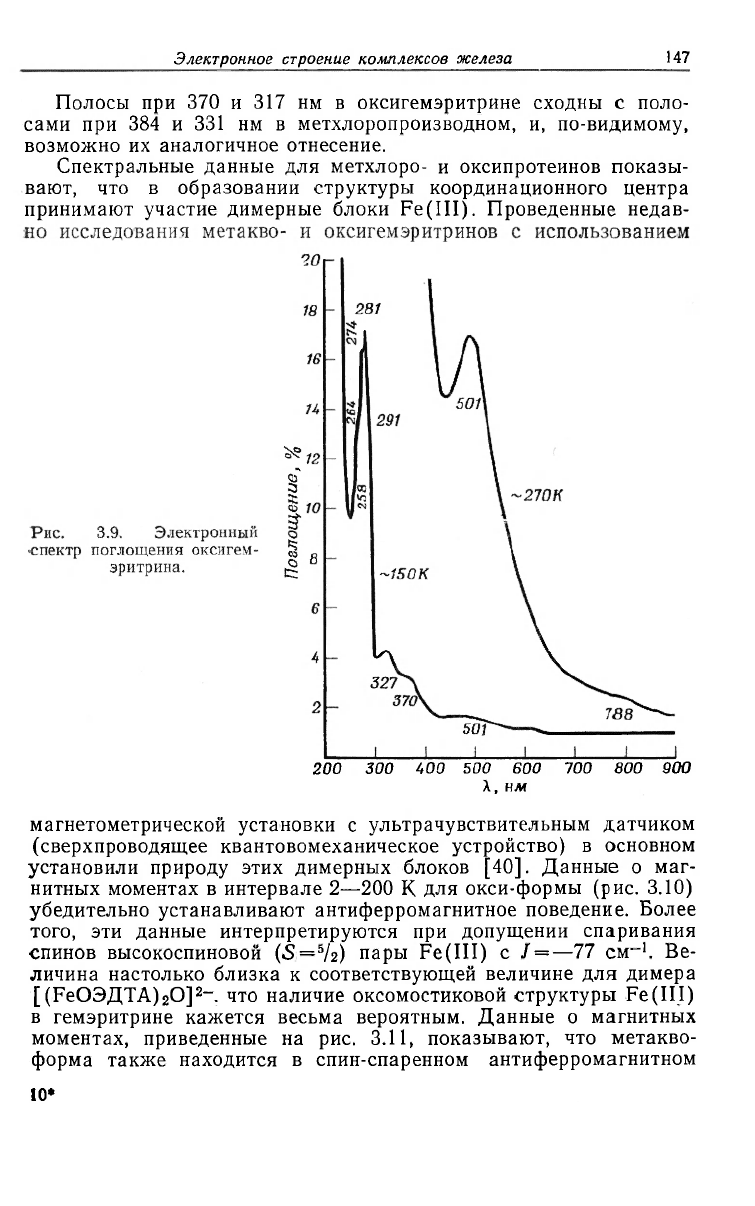
Электронный спектр поглощения оксигемэритрина показан на
рис. 3.9 [37]. Этот спектр проявляет близкое сходство со спектром
метхлорогемэритрина, за исключением намного большей интен-
сивности полосы около 500 нм. Этот спектр можно рассматривать
как достаточное доказательство правильности предположения,
которое впервые высказал Клотц [38], что в окси-форме оба ато-
ма железа окислены до Fe(III), a O
2
восстановлен до 0§-. Боль-
шую интенсивность поглощения при 501 нм легко понять в этой
модели, так как подобную полосу поглощения наблюдали в комп-
лексе, образующемся при взаимодействии [Ре(Ш)ЭДТА]~ и H
2
O
2
в щелочном растворе [39]. Эта полоса предположительно может
быть отнесена к переходу переноса заряда Ojj
-
—^Fe (III) или
Рис. 3.8. Электронный
спектр поглощения метхло-
рогемэритрина.
200 300 400 500 600 700 800 900
нм
HOO--HFe(III).
Электронное строение комплексов железа
147
Полосы при 370 и 317 нм в оксигемэритрине сходны с поло-
сами при 384 и 331 нм в метхлоропроизводном, и, по-видимому,
возможно их аналогичное отнесение.
Спектральные данные для метхлоро- и оксипротеинов показы-
вают, что в образовании структуры координационного центра
принимают участие димерные блоки Fe(III). Проведенные недав-
200 300 400 5OO 600 700 800 900
A, HAf
магнетометрической установки с ультрачувствительным датчиком
(сверхпроводящее квантовомеханическое устройство) в основном
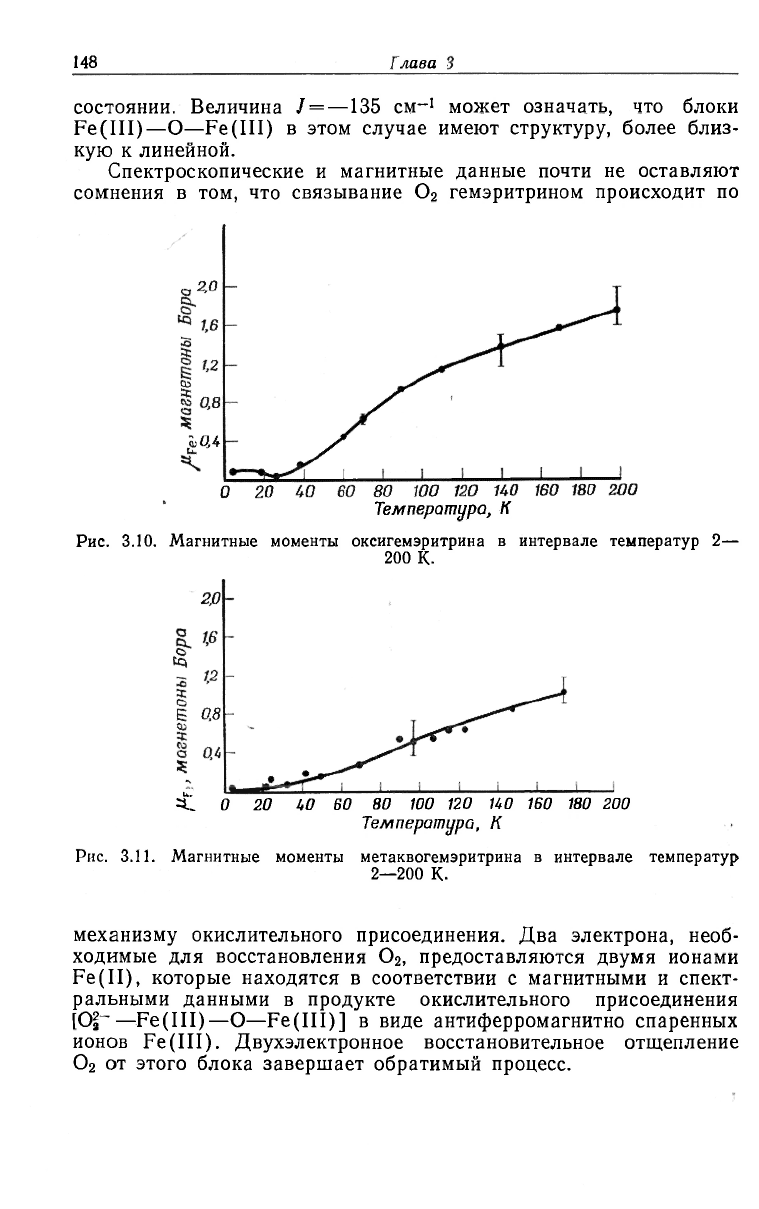
установили природу этих димерных блоков [40]. Данные о маг-
нитных моментах в интервале 2—200 К для окси-формы (рис. 3.10)
убедительно устанавливают антиферромагнитное поведение. Более
того, эти данные интерпретируются при допущении спаривания
спинов высокоспиновой (S =
5
I
2
) пары Fe(III) с J = —77 см
-1
. Ве-
личина настолько близка к соответствующей величине для димера
[(Ре0ЭДТА)
2
0]
2
- что наличие оксомостиковой структуры Fe(III)
в гемэритрине кажется весьма вероятным. Данные о магнитных
моментах, приведенные на рис. 3.11, показывают, что метакво-
форма также находится в спин-спаренном антиферромагнитном
10*
148
i лава 2
состоянии. Величина J = —135 см
-1
может означать, что блоки
Fe(III)—О—Fe(III) в этом случае имеют структуру, более близ-
кую к линейной.
Спектроскопические и магнитные данные почти не оставляют
сомнения в том, что связывание O
2
гемэритрином происходит по
Рис. 3.10.
Температура, К
Магнитные моменты оксигемэритрина в интервале температур 2—
200 К.
^L о 20 UO 60 80 100 120 НО 160 180 200
Температура, К
Рис. 3.11. Магнитные моменты метаквогемэритрина в интервале температур
2—200 К.
механизму окислительного присоединения. Два электрона, необ-
ходимые для восстановления O
2
, предоставляются двумя ионами
Fe(II), которые находятся в соответствии с магнитными и спект-
ральными данными в продукте окислительного присоединения
[O^—Fe(III)—О—Fe(III)] в виде антиферромагнитно спаренных
ионов Fe(III). Двухэлектронное восстановительное отщепление
O
2
от этого блока завершает обратимый процесс.

Электронное строение комплексов железа
149-
Модель окислительного присоединения для обратимого связы-
вания O
2
металлопротеинами была предложена также для гемо-
цианина [6]. Гемоцианин — это медьсодержащий белок, который
присоединяет одну молекулу O
2
на каждые два атома меди
(гл. 12). Деокси-Cu(I)-форма заметно не поглощает в ВИДИМОЙ
области. При оксигенировании белок приобретает голубую окрас-
ку, а его спектр в видимой области имеет большое число полос,
расположенных при 700 (е75), 570 (в 500), 440 (е65) и 347 нм
(е8900) [41]. Наличие полос около 570 нм почти не оставляет
сомнений в том, что оксигемоцианин содержит Cu(II). Повышен-
ная интенсивность полос поля лигандов указывает на наличие в;
нем димерного комплекса Cu(II) [6]. Таким образом, спектраль-
ные данные для оксигемоцианина полностью согласуются с мо-
делью связывания O
2
по механизму окислительного присоедине-
ния типа гемэритрина. Для распространения этих представлений
на оксигемоглобин необходимо предположить структуру семикрат-
но координированного Fe(IV). Обсуждение этой структуры и дру-
гих моделей связывания молекулярного кислорода в гемоглобине
приведено в других работах [6].
СПИСОК ЛИТЕРАТУРЫ
1. Lever А. В. P., Inorganic Electronic Spectroscopy, Elsevier, New York, 1968;
Sutton D., Electronic Spectra of Transition Metal Compounds, McGraw-Hill,
New York, 1968; Schlafer H. L., Gliemann G., Basic Principles of Ligand Field
Theory, Wiley-Interscience, New York, 1969.
2. Earnshaw A., Introduction to Magnetochemistry, Academic Press, New York,
1968; Figgis B. N., Lewis J., in H. B. Jonassen, A. Weissberger (eds.), Techni-
ques of Inorganic Chemistry, Vol. 4, Interscience, New York, 1965, pp. 137—
248.
3. Wertheim G. K., Mossbauer Effect: Principles and Applications, Academic Press,.
New York, 1964; Herber R. H., in F. A. Cotton (ed.), Progress in Inorganic
Chemistry, Vol. 8, Interscience, New York, 1967, pp. 1—41 and references the-
rein.
4. Gray И. B., Beach N. A., J. Am. Chem. Soc., 85, 2922 (1963).
5. Rossman G. R., Ph. D. Thesis, California Institute of Technology, 1971.
6. Gray H. B., Adv. Chem. Ser., 100, 365 (1971).
7. Renovitch G. A., Baker W. A., Jr., J. Am. Chem. Soc., 90, 3585 (1968).
8. Alexander J. J., Gray H. B., J. Am. Chem. Soc., 90, 4260 (1968).
9. Jargensen С. K-, Absorption Spectra and Chemical Bonding, Addison-Wesley,.
Reading, Mass., 1962.
10. Gutterman D. F., Ph. D. Thesis, Columbia University, 1969.
11. Schugar H. J., Rossman G. R., Barraclough C. G., Gray H. B., J. Am. Chem.
Soc., 94, 2683 (1972) and references therein.
12. Wing R. M., Callahan K. P.. Inorg. Chem., 8, 871 (1969).
13. Lohr L. L., McClure D. S., J. Chem. Phys., 49, 3516 (1968).
14. Ferguson J., Guggenheim H. J., Tanabe Y., J. Phys. Soc. Japan, 21, 692
(1966).
15. Hedstrom B. 0. A., Arkiv. Kemi, 6, 1 (1953).
16. Milburn R. M., Vosburgh W. C., J. Am. Chem. Soc., 77, 1352 (1955).
17. Mulay L. N., Selwood P. W., J. Am. Chem. Soc., 77, 2693 (1955).

150
i лава 2
18. Schugar Н. J., Walling С., Jones R. В., Gray Н. В., J. Am. Chem. Soc., 89, 37Н
(1967).
19. Mathe J., Bakk-Mathe E., Revue Roumaine de Chemie, 11, 225 (1966).
20. Sehugar Н. J., Rossman G. R., Gray Н. В., J. Am. Chem. Soc., 91, 4564 (1969)
21. Wu G.-H., Rossman G. R., Gray Н. В., Hammond G. S., Schugar Н. J., J. Am
Chem. Soc., 11, 990 (1972).
22. Rawlinson W. A., Scutt Р. В., Aust. J. Sci. Res., А5, 173 (1952).
23. Jordan J., Bednarski Т. M., J. Am. Chem. Soc., 86, 5690 (1964).
24. Shack J., Clark W. M., J. Biol. Chem., 171, 143 (1947).
25. Vogt L. H., Jr., Zalkin A., Templeton D. H., Inorg. Chem., 6, 1725 (1967).
26. Sehugar Н. J., Hubbard А. Т., Anson F. С., Gray Н. В., J. Am. Chem. Soc., 91
71 (1969).
27. Sadasivan N., Eberspaecher Н. I., Fuchsman W. H., Caughey W. S., Bioche-
mistry, 8, 534 (1969).
28. Cohen I. A., J. Am. Chem. Soc., 91, 1980 (1969).
29. Fleischer E. В., Srivastava Т. S., J. Am. Chem. Soc., 91, 2403 (1969).
30. Lippard S. J., Schugar Н. ]., Walling С., Inorg. Chem., 6, 1825 (1967).
31. George P., Beetlestone J., Griffith J. S., Rev. Mod. Phys., 36, 441 (1964).
32. Dickerson R. E., Geis I., The Structure and Action of Proteins, Harper and Row
New York, 1969.
33. Bunn H. F., Jandl J. H., Proc. Natn. Acad. Sci. U. S., 56, 974 (1966).
34. Caughey W. S., Adv. Chem. Ser., 100, 248 (1971).
35. Okamura M. Y., Klotz I. M., Johnson C. E., Winter M. R. C., Williams R. J. P..
Biochemistry, 8, 1951 (1969); and references therein.
36. Garbett K., Darnall D. W., Klotz I. M., Williams R. J. P., Arch. Biochem. Bio-
phys., 103, 419 (1969).
37. Simon S., Grube B., Rossman G. R., Gray H. B., unpublished data.
38. Klotz I. M., Klotz T. A., Fiess H. A., Arch. Biochem. Biophys., 68, 284 (1957).
39. Walling C., Kurz M., Schugar H. J., Inorg. Chem., 9, 931 (1970).
40. Dawson J. W., Gray H. B., Hoenig H. E., Rossman G. R., Schredder J. M..
Wang R.-H., Biochemistry, 11, 461 (1972).
41. Van Holde K. E., Biochemistry, 6, 93 (1967).

ЧАСТЬ II
ВЗАИМОДЕЙСТВИЕ ИОНОВ МЕТАЛЛОВ
С АМИНОКИСЛОТАМИ, ПЕПТИДАМИ
И РОДСТВЕННЫМИ ИМ ПРИРОДНЫМИ
ХЕЛАТИРУЮЩИМИ АГЕНТАМИ
И БЕЛКАМИ
ГЛАВА 4
КОМПЛЕКСЫ МЕТАЛЛОВ
С АМИНОКИСЛОТАМИ И ПЕПТИДАМИ *
Ганс К• Фриман
Freeman Hans С., School of Chemistry, University of Sydney,
Sydney 2006, Australia
Комплексы металлов с аминокислотами и пептидами в течение-
многих лет служили химикам, занимающимся изучением комп-
лексных соединений, и биохимикам благодатным материалом в их
исследованиях. Твердые производные Cu(II) и Pt(II) с аланином:
были выделены Стрекером в 1850 г. [1], а еще раньше темно-
красное окрашивание, возникающее в присутствии солей Cu(II)
и щелочи, было использовано Видеманом (1847 г.) для того, что-
бы охарактеризовать только что открытое соединение биурет [2].
Упариванием раствора Видеман получил кристаллический, но не-
чистый продукт; при этом он отметил, что необходимо использо-
вать избыток биурета для возникновения цветной реакции, если
в качестве щелочи использовался гидроксид аммония. Прошло
более ста лет, прежде чем структура этих кристаллов была уста-
новлена методом дифракции рентгеновских лучей, и почти столько
* Сокращения, используемые в этой главе: HL
i
или HL — аминокислота или
пептид в форме цвиттер-иона, например: HGly — глицин +NHSCH
2
COO-; HSar —
N-метилглицин, саркозин; HAla — аланин; HAsp — аспарагиновая кислота;
HCys — цистеин; HGlu—глута!Миновая кислота; HHis — гистидин; HMet—ме-
тионин; HNIe — норлейцин; HSer — серии; HTyr — тирозин; H(Gly-Gly) —глицил-
глицин +NH
3
CH
2
CONHCH
2
COO
-
. LH — нейтральная форма аминокислоты или
пептида, например: GlyH — глицин NH
2
CH
2
COOH; GIy-GlyH — глицилглицин
NH
2
CH
2
CONHCH
2
COOH; BiuH
2
-биурет NH
2
CONHCONH
2
; ImH-имидазол
C3N2H4. Символы M(II) и M
2
+ используются, чтобы показать, что металл нахо-
дится в степени окисления II, и для ионных частиц M
2
+ соответственно. Ki, Кь
Кз — ступенчатые константы образования комплексных частиц ML<
n-1
>+, ML^
1-2
>
+
,.
MLC-З)+, где свободный ион металла=М"+. P
pgr
= [M
p
H
g
L<"
,
'
+?-
''
)+
]/[М"+]
3
• [H+]«[L
-
]
r
— общая константа устойчивости частиц M
p
H,L
(
r
"
p+?—

152
i лава 2
же времени ушло на то, чтобы современная координационная хи-
мия объяснила равновесие между ионами [Cu(Biu)
2
]
2-
и
[Cu(NH
3
)
4
]
2+
и причины красной окраски первого и голубой
второго.
После этих первых открытий взаимодействие металлов с ами-
нокислотами и пептидами стало привлекать внимание как явле-
ние, связанное с координацией, как модель реакций металлов с
белками и как модель биологических систем, в которых свойства
белка модифицированы присоединенными к нему атомами метал-
лов. Первый обзор литературы по этому вопросу был сделан Гур-
дом и У ил коксом в 1956 г. [3], а исчерпывающее описание ос-
новных химических свойств вплоть до 1957 г. дано Гринштейном
и Виницем [4]. Интересные примеры комплексов металлов с ами-
нокислотами и пептидами как лигандами встречаются повсемест-
но в книгах Мартелла и Калвина [5] и Накамото и МакКарти
«Спектроскопия и структура хелатных соединений металлов» [6].
В последующих обзорах особое внимание уделено таким вопро-
сам, как стереоселективность и реакционная способность [7],
спектроскопическое поведение меди в комплексах с пептидами и
белками [8], анализ кристаллической структуры [9] и роль мо-
дельных соединений для понимания активности ферментов [10].
Исчерпывающий обзор новейшей литературы вплоть до конца
1968 г. дан Гиллардом и Лаури [11] в первой периодической се-
рии специальных сообщений.
В данной главе на примере взаимодействия с небольшим чис-
лом ионов металлов рассматриваются основные группы атомов
в аминокислотах и пептидах, потенциально способные к связыва-
нию металла. Прежде чем обсуждать эти взаимодействия, отме-
тим, что связывание металла функциональными группами белка
может отличаться от связывания металла такими же группами в
малых пептидах двумя важными особенностями.
Во-первых, функциональные группы, которые связывают атомы
металлов в белках, могут быть сближены в третичной структуре
белка, а в цепи белка разделены несколькими аминокислотными
остатками. Такие функциональные группы действуют сравнитель-
но независимо одна от другой. Каждая подчиняется геометриче-
ским требованиям, налагаемым цепью белка, находящейся в не-
посредственной близости к ней, и вследствие контакта с другими
функциональными группами координируется к тому же атому
металла. Эти ограничения входят в число свойств, которые мы
хотели бы изучить, но их трудно воспроизвести в малых модельных
соединениях именно потому, что лиганды являются малыми моле-
•кулами. Даже в самой простой аминокислоте, глицине, расстояние
между концевыми NH
2
- и СОО~-группами составляет всего не-
сколько ангстрем, а в самом простом пептиде, глицилглицине, кро-
ме этих двух концевых, есть еще пептидная СО—NH-группа. Вся-
