Эйхгорн Г. (ред.) Неорганическая биохимия. Том 1
Подождите немного. Документ загружается.

7V°
H
2
O
CH
2
H
2
C NH
2
--Cu NH
2
-CH
2
\ N''
^C— \
H
2
C
OH
2
с :
//\:
O C-
XIX
H
N
/ /
'NH
2
NH
2
O
Л
-N-
-CH
2
H
2
C
CH
2
-—^
0
Il
О
M = Ni(II)
t
Co(III)
XX
OH
2
HC
4
/ ч
HN N
\ / /
P=CH
NH
,
О—С
-Cu N-
\
,CH
C=O
CH
2
о
/
C-O
HC
O=C
"N-
4
CH
2
-
CH
2
-CH
2 сн
/
CH=C
/ \
NH
cu
^
4
ClT
NH
2
-CH
2
OH
2
XXI
Ъимерный комплекс в Cu (уЗ-Д La-L-H-, His)'2H
2
0
ОН
H
2
Г
-NH
2
2
нс^сн
I /Н
-N=,
CH
О'
-N X)
CH
2
с£ ^CH
2
о
NH С<
К
о
XXII

174
i лава 2
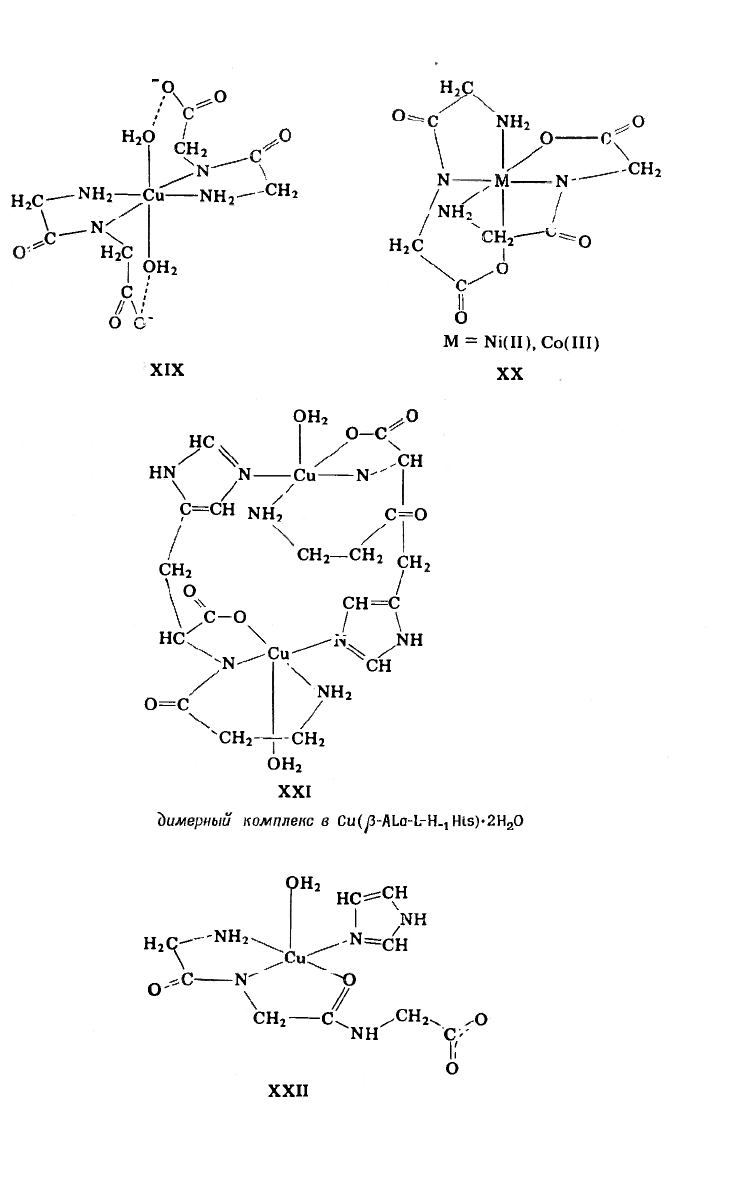
Участие пептидного атома азота в полидентатном хелатообра
зовании определяется двумя геометрическими условиями. 1. До
пускаются только небольшие искажения нормальной тригонально!
конфигурации связей у атома азота. Этим условием объясняете
тот факт, что пептидный атом азота может быть окружен двум:
пятичленными хелатными кольцами или пяти- и шестичленньп
кольцами, но не двумя шестичленными кольцами [63]. 2. Метал,
и атомы пептидной группы должны быть почти копланарны. Велел
ствие этого, если пептидный атом азота и два соседних с ним дс
норных атома тридентатного или тетрадентатного пептида связа
ны с одним и тем же атомом металла, они должны занимать кс
пленарное координационное положение (как в XVIII, XX и XXII)
Размеры пептидной группы слегка (но это существенно) изм(
няются при координации по атому азота пептидной группы [9
При координации Cu(II) длина связи C = O изменяется от 1,2
до 1,26 А, а длина связи С—N от 1,325 до 1,30 А. Это свидетел!
ствует о том, что образование связи металл — пептидный азе
I I
уменьшает вклад резонансной структуры —,N—C = O и увелич!
I !
вает вклад структуры —N
+
С 0~, т. е. сдвиг электронов
металлу меньше, чем к протону, который в комплексе замеще
медью. Такое же заключение получено на основании понижен!:
частоты валентных колебаний группы C = OB ИК-спектре систем
Cu(II)—пептид в D
2
O. По мере того как pD повышается, частот
свободной и координированной группы C = O (1645, 1625 см~
заменяются полосой 1600—1610 см
-1
[58—60].
Изучение взаимодействия между пептидами и Ni(II) помога<
получить представление о связывании металла пептидными ат
мами азота в комплексах Cu(II)—пептид. Существование ком
лекса Ni(II), в котором пептидные группы депротонированы, по,
тверждено препаративным [68], потенциометрическим [60, 69
71], ИК-епектроскопическим [60] и кристаллографическим [71
исследованиями; все они дают результаты, очень похожие на i
что получены для системы Cu(II)—пептиды. Анализ кристалл
ческой структуры был выполнен для комплексных част]
[NiH_
3
L]
2
- (XVIII) и [NiH_
2
L
2
]
2
- (XX) {72]. Термодинамическ;
устойчивость комплексов Ni(II)-HenTHAbi несколько ниже, ч<
устойчивость соответствующих Cu(II)-пептидных комплексов. H
пример, константы образования некоторых комплексов Ni(II)
HGly-Gly-Gly [в скобках даны значения констант устойчивое
комплексов Cu(II), взятые из табл. 4.2] равны Igpioi = 3,7 (5,^
IgPi-H = -5,1 (—0,1) и Ig Pi_
21
= —12,8 (—6,9). Так как различ
между ступенчатыми константами устойчивости отражают зна
1
ния рА'„ пептидных групп, из приведенных данных можно сдела

Комплексы металлов с аминокислотами и пептидами 175-
1Ывод, что пептидные протоны лабилизируются Ni(II) (р/(
а
~8)
1енее эффективно, чем Cu(II) (piC
a
~6).
Однако комплексы пептидов с Ni(II) кинетически более устой-
ивы, чем аналогичные комплексы с Cu(II). В ходе потенциомет-
'ического титрования необходимо выдерживать раствор по мень-
шей мере 5 мин для того, чтобы в нем после добавления каждой
орции основания наступало равновесие [69]. Методом останов-
енной струи была исследована кинетика обратной реакции, а
менно протонирование [MH_
2
L]~. Скорость этой реакции в 25—
О раз меньше для [Ni (H_
2
Gly-Gly-Gly) чем для
Cu(H_
2
Bly-Gly-Gly)]- [71, 73]. С обоими комплексами реак-
ия протекает гораздо медленнее, чем процесс, контролируемый
иффузией, и стадией, определяющей скорость, является пере-
руппировка из состояния с координацией M—N (пептидный) в
эстояние с координацией M-O(пептидный).
При низких значениях рН растворы комплексов Ni(II) с пеп-
идами имеют голубовато-зеленую окраску, что свидетельствует
том, что комплексные частицы октаэдрические и парамагнитные,
[равильная октаэдричеекая геометрия позволяет Ni(II) образо-
ывать с бидентатными пептидами комплексы с отношениями ме-
алл —пептид 1:1, 1:2 и 1 :3. С тридентатными или с еще более
пинными лигандами диссоциация двух или трех протонов по ме-
2 повышения рН приводит к образованию желтых квадратно-
юскостных диамагнитных комплексов, в которых отношение
еталл — лиганд 1:1. Неожиданным следствием приведенных кон-
чит устойчивости комплексов Ni(II) с глицилглицином является
>т факт, что второй пептидный протон диссоциирует легче, чем
;рвый протон (p/C
aa
= Pi_n—01-21=7,7; pK
ai
=Pioi-
¢1-11
= 8,8).
ругими словами, частицы NiH_iL (октаэдрические) термодина-
ически неустойчивы по сравнению как с [NiL]
+
(октаэдрически-
л), так и [NiH_
2
L]~ (квадратно-плоскостными). Депротонирова-
ie является так называемой кооперативной реакцией, и хотя
шплекс NiH_iL должен быть интермедиатом, его содержание
[когда не превышает 5% содержания Ni(II) в растворе [71].
Кооперативная природа перехода от [NiL]
+
к [NiH_
2
L]~ обус-
>влена изменением координации от октаэдрической к квадратно-
юскостной, при этом изменение координационной геометрии
!условлено усилением поля лигандов по мере того, как пептид-
.ie атомы азота связываются с металлом. Комплексы Ni(II)
бо октаэдрические и парамагнитные, либо квадратно-плоскост-
ie и диамагнитные. Для них в отличие от Cu(II) не наблюда-
ся постепенного изменения геометрии. ЭСКП квадратно-плос-
стного комплекса Ni(II), выраженная в единицах А(10Dq),
лыне, чем эта величина для октаэдрического комплекса Ni(II).
>лее сильному полю лигандов в квадратно-плоскостной конфи-
рации способствует повышение ЭСКП. Координации с одним

176
i лава 2
пептидным донором недостаточно, чтобы вызвать изменение гес
метрии, однако возможность образования квадратно-плоскостпо
конфигурации с ее более высокой ЭСКП способствует диссоци;
ции еще одного пептидного протона, с тем чтобы получились Д(
поры с более сильным полем. Кроме того, в квадратно-плоскос
ных комплексах Ni (II) с пептидами донорные атомы находятся г.
0,2 А ближе к иону металла, чем в октаэдрических {72], так чт
влияние поля лигандов еще больше усиливается. Энтропийны
эффект (освобождение аксиальных лигандов) действует в это
же направлении.
Реакция между Ni(II) и глицилглицином, по-видимому, air
мальна. При рН~10 Ni (Gly-Gly)
2
( = NiL
2
) теряет два протон
образуя голубовато-зеленый ион ,[Ni(H-JGly-Gly)
2
]
( = [NiH_
2
L
2
]
2
~) [69]. Натриевая соль этого иона кристаллизует!
в двух гидратированных модификациях, кристаллическая структ
ра которых показывает, что комплекс является бис-тридентатнь
и октаэдрическим (XX). Но, когда HL — глицинамид, частик
[NiH_
2
L
2
]
2
- желтые и квадратно-плоскостные.
Pt и Pd в периодической системе расположены под Ni и таю
имеют электронную конфигурацию d
8
. Подобно Ni(II), двухв
лентные ионы этих металлов вызывают ионизацию пептидных ат
MOB водорода. Они образуют квадратно-плоскостные комплекс
в которых местами связывания металла являются депротонирова
ные пептидные атомы азота. По мере продвижения сверху вн
в группе периодической системы стабилизация кристаллическс
поля донорами более сильного поля увеличивается и, следог
тельно, повышается эффективность ионов металлов в лабилизац
пептидных протонов. В присутствии Pd(II) пептидные прото]
титруются при рН 3,5 [74] по сравнению с рН 8—9 для Ni(I
Когда в растворе происходит смешивание [PtCl
4
]
2-
с пептидаи
депротонирование пептидных групп осуществляется даже при е:
более низких значениях рН. Это демонстрируется структур
комплекса Pt(Gly-L-Met)Cl-H
2
O, который кристаллизуется п
рН 2,5 (см. формулу XXXIX [75]). Положение атомов водорс
в этом комплексе установлено методом дифракции нейтронов, т
что нет сомнения в том, что пептидные группы депротонирова!
в то время как карбоксильная группа еще нейтральна. (Отек
не следует, что в связывании [PtCl
4
]
2-
с белками всегда уча
вуют депротонированные пептидные группы, так как пептиди
атомы азота в белках обычно менее доступны, чем в растворенн
молекулах пептидов.)
Недавно было опубликовано сообщение [76], что Co(II) т
же промотирует диссоциацию пептидных протонов. Для реаю
требуется рН ~10 и отношение металл — лиганд 1:2. Образу]
ся октаэдрические комплексные частицы, в которых связуюи
атомы включают два аминных и два пептидных атома азотг

Комплексы металлов с аминокислотами и пептидами
177-
четыре донора сильного поля. В поле сильного донора становится
предпочтительной более высокая степень окисления кобальта.
В соответствии с этим растворы, содержащие частицы
'[Co
11
(H^
1
Gly-Gly)
2
]
2-
, легко окисляются (через оксигенированное
промежуточное состояние, которое является обратимым носителем
молекулярного кислорода) в [Co
in
(H_iGly-Gly)
2
]
-
. Комплексные
частицы Co
in
нельзя прямо приготовить по реакции
[Co
ni
(Gly-Gly)
2
]+ с основанием, так как для комплексов Co(III)
особенно характерно затруднение разрыва связей металл —
лиганд.
Кинетическую устойчивость связей Co(III)—лиганд можно ис-
пользовать в экспериментах, которые невозможны с более ла-
бильными комплексами Ni(II) и Cu(II) с пептидами. Структура
иона [Co
ni
(H_iGly-Gly)
2
]
-
в четырех различных солях такая же,
как структура [Ni(H^Gly-Gly)
2
]
2-
(XX) [77, 78]. Единственным
элементом симметрии для обоих комплексных ионов является ось
симметрии второго порядка, и они должны существовать в виде
энантиомеров. Это можно доказать для комплексов Co(III) {но
не для комплексов Ni(II)] разделением энантиомеров хромато-
графически на колонке с крахмалом [79]. При добавлении силь-
ной кислоты к раствору [Co(H_iGly-Gly)
2
]~ анион быстро и
обратимо протонируется, образуя ([Co(Gly-Gly)
2
]+ [76, 77, 79].
Структурный анализ Co(Gly-Gly)
2
(ClO
4
) был использован для
доказательства того, что протонирование не затрагивает связи
металл—лиганд, а добавленные протоны присоединяются к пеп-
тидным атомам кислорода [78]. Протонированные катионы, в ко-
торых Co(III) еще связан с пептидными атомами азота, термо-
динамически не устойчивы и, по-видимому, медленно восстанав-
ливаются до Co(II) [77].
1.6. Имидазольные атомы азота
Боковые цепи, содержащие остатки гистидина, являются важ-
ными группами, связывающими металл как в природных металло-
протеинах, например карбоксипептидазах (гл. 15), миоглобине и
гемоглобине (гл. 25), так и в комплексах металла с белком, по-
лученных в лаборатории (гл. 7). При таких взаимодействиях ме-
таллов с белками функциональные группы, присоединенные к ме-
таллу, в большинстве случаев принадлежат аминокислотным
остаткам, которые не находятся по соседству друг с другом в бел-
ковой цепи. Следовательно, остатки гистидина являются типич-
ными группами, не образующими хелатов.
1.6.1. Взаимодействия металл—имидазол
без образования хелатов
Моделирование такого взаимодействия металлов с белками
более простыми системами затруднено из-за того, что гистидин и
гистидилпептиды очень склонны действовать как хелатирующие
J
2—2451

178
i лава 2
агенты. Единственным комплексом, в котором, как было показано,
имидазольная боковая цепь ведет себя не как хелат, является
Cu(p-Ala-L-H_iHis)-2Н
2
0 («медный карнозин», XXI) [63]. Осо-
бенно интересно в этом комплексе то, что Cu(II) связывается
с атомом азота имидазольного кольца в положении 3 (как в ме-
тилмиоглобине кашалота [80]), в то время как в хелатах, образуе-
мых гистидином и гистидилпептидами, всегда участвует атом азо-
та в положении 1 имидазола. Еще не доказано, что структура,
обнаруженная в кристаллическом состоянии, сохраняется в раство-
ре, но такое предположение удовлетворительно объясняет данные
ранее выполненного потенциометрического титрования [63]. Су-
ществование димерных частиц было доказано по уширению линий
в спектрах ЭПР замороженных растворов комплекса независимо
от какой-либо структурной модели [81].
Одним из средств, которое было использовано для того, чтобы
нарушить склонность гистидина к хелатообразованию, было при-
готовление смешанно-лигандных комплексов, в которых содержа-
щие гистидин боковые цепи смоделированы молекулами имидазо-
ла. Существование смешанного комплекса такого типа в растворе
при рН от 5,8 до 7 впервые было доказано тем, что скорость
катализируемого имидазолом гидролиза я-нитрофенилацетата по-
нижается в присутствии Cu(II) и глицилглицина [82]. Смешанные
комплексы имидазола и глицина, глицилглицина или диглицил-
глицина с Cu(II), Ni(II) и Cd(II) были последовательно выде-
лены и охарактеризованы [64, 83, 84] и кристаллическая струк-
тура некоторых из них была определена [64]. Примером может
служить [Cu(H-JGly-Gly-Gly) (ImH) (H
2
O)]-H
2
O (XXII). Наконец,
имеется много спектроскопических и магнитных данных [85—87],
относящихся к комплексам, которые содержат только имидазол
и не содержат аминокислотных или пептидных лигандов. Четыре
комплекса такого типа, структура которых была определена, при-
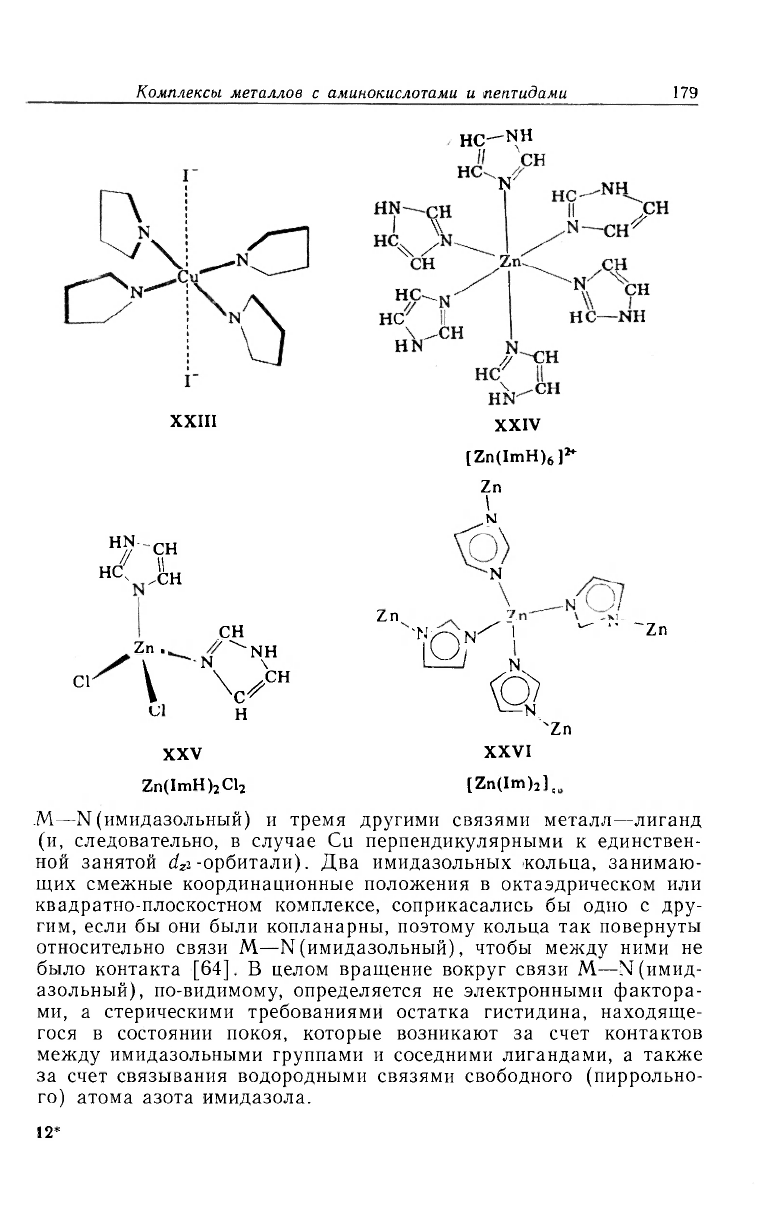
ведены ниже: это [Cu(ImH)
4
]I
2
(катионный) [88], [Zn(ImH)
6
]Cl
2
-
•4Н
2
0 (катионный) [89], [Zn (ImH)
2
] Cl
2
(молекулярный комп-
лекс, образованный водородными связями) [90] и [Zn(Im)
2
]oo
(полимерный) [91] (XXIII—XXVI).
Наиболее полезной информацией, полученной из структурного
исследования модельных соединений — смешанно-лигандных и
чисто имидазольных комплексов, а также хелатов с гистидином,—
было обнаружение гибкости имидазольной группы как лиганда.
Связь металл — имидазольный азот отклонена на 30° от плоско-
сти имидазола, как и в [Cd(L-His)
2
]-5Н
2
0 [92], и угол
M—N (имидазольный)—С при донорном атоме лежит в интервале
121
— 131°. Анализом структуры [Cu(H_iGly-Gly) (ImH) (OH
2
)] •
-IV
2
H
2
O и [Cu(FL
1
Gly-Gly-Gly) (ImH) (OH
2
)]-H
2
O (XXII) [64]
получены доказательства, что стерически незатрудненные имид-
азольные кольца стремятся быть копланарными со связью
Комплексы металлов с аминокислотами и пептидами
179
XXIII
HN-
M
HC
4
CH
11
_СН
Cl
Zn .
\
CH
^NH
"N \
V™
H
XXV
Zn(ImH)
2
Cl
2
HC-NH
XXIV
[Zn(ImH)
6
P
Zn
1
м
Zn
N
'NrxN^
1 Zn
QJ
N
N
v
И
4
Zn
XXVI
[Zn(Im)
2
]
t
M—N (имидазольный) и тремя другими связями металл—лиганд
(и, следовательно, в случае Cu перпендикулярными к единствен-
ной занятой d
Z
2 -орбитали). Два имидазольных кольца, занимаю-
щих смежные координационные положения в октаэдрическом или
квадратно-плоскостном комплексе, соприкасались бы одно с дру-
гим, если бы они были копланарны, поэтому кольца так повернуты
относительно связи M—N (имидазольный), чтобы между ними не
было контакта [64]. В целом вращение вокруг связи M—N (имид-
азольный), по-видимому, определяется не электронными фактора-
ми, а стерическими требованиями остатка гистидина, находяще-
гося в состоянии покоя, которые возникают за счет контактов
между имидазольными группами и соседними лигандами, а также
за счет связывания водородными связями свободного (пиррольно-
го) атома азота имидазола.
12*

180
i лава 2
Гибкость связей имидазол—металл может быть одной из при-
чин эффективности гистидиновых боковых цепей как центров свя-
зывания металла в белках. Другой причиной может быть тот
простой факт, что имидазольные группы являются достаточно хо-
рошими донорами электронов для того, чтобы образовать сильные
ковалентные связи. Калориметрические измерения показали, что
связи металл—N (имидазольный) дают только немного меньшие
вклады в изменение энтальпии в реакциях комплексообразования
[116, 157], чем связи металл—М(аминный). Изменения энтальпии,
связанные с комплексообразованием ионов M
2
+ в растворе с
образованием [M(ImH)
4
]
2
+, составляют —23,0, —18,4 и
—16,2 ккал/моль, когда M = Cu, Ni и Zn соответственно. Измене-
ния энтальпии на первой стадии комплексообразования тех же
ионов металлов с одной молекулой имидазола равны —7,6, —5,8
и —3,8 ккал/моль [158]. Наиболее важные вклады в энергию
связей металл — имидазольный азот дает а-связывание. Возможно
также л-связывание и влияние ЭСКП. Данные о d —р -связыва-
нии изменяются от комплекса к комплексу (см. ниже), а когда
ЭСКП вообще есть, она играет меньшую роль в стабилизации
связей с имидазольным азотом, чем с атомами азота амино- и
пептидных групп. Положение имидазольного азота в спектрохи-
мической серии, по-видимому, ближе к воде (т. е. ниже аминного
и пептидного атомов азота [9, 93]).
Удивительно, что не найдено никакой корреляции между дли-
нами связей металл — имидазол и вращением имидазольных колец
относительно связей металл — азот [64], но химические, магнит-
ные и спектроскопические свойства свидетельствуют о делокали-
зации л-электронов. Во-первых, в [Cu(ImH)
4
]I
2
(XXIII) металл
стабилизирован в степени окисления II, так что он не претерпе-
вает обычного восстановления в присутствии ионов I~ (Cu
2
++
+1-—^Cu++ Vsb)- Несомненно, что исключительная стабильность
Cu(II) в этом комплексе обусловлена взаимодействием с четырь-
мя имидазольными лигандами. Они лежат в плоскости, которая
перпендикулярна плоскости четырех связей Cu—N, и эта ориен-
тация способствует перекрыванию d
xy
—р
ж
-орбиталей. Заметная
делокализация неспаренного электрона от атома Cu на имидазоль-
ные кольца проявляется как сверхтонкое расщепление сигнала
меди, а также как сверхтонкое расщепление, обусловленное ато-
мами азота, в спектре ЭПР комплекса при 80 К [88]. Во-вторых, ши-
рокая полоса в ультрафиолетовом спектре Co(CO
3
)(ImH)
2
(OH
2
)
2
подобным же образом была приписана делокализации я-электро-
нов. Структура комплекса — искаженный октаэдр, и каждый
имидазольный лиганд расположен примерно в перпендикулярной
плоскости, образуемой им самим и тремя другими связями ме-
талл—донор [94]. В-третьих, в полимерном комплексе [Co(Im)
2
]oo
атомы Co(II) имеют тетраэдрическую координацию. Магнитный

Комплексы металлов с аминокислотами и пептидами
179-
момент аномально низкий, и это объясняется сверхобменным взаи-
модействием атомов Co(II), т. е. взаимодействием через подвиж-
ные л-электронные системы имидазольных лигандов, которые соеди-
няют атомы металла [86]. В-четвертых, комплекс [Cu (Im) ^
00
кристаллизуется в голубой, зеленой и коричневой полимерных мо-
дификациях [95]. (Известно, что голубая форма содержит четы-
рехкоординированные атомы Cu(II), связанные в трехмерный по-
лимер бидентатными имидазольными лигандами [96].) В голубой
и зеленой модификациях имеются сильные взаимодействия между
атомами Cu через имидазольные кольца, обнаруживаемые в каж-
дом случае по большой отрицательной константе Вейса (абсолют-
ная температура, при которой обратная магнитная восприимчи-
вость равна нулю) [95].
Третьим свойством имидазольных групп, объясняющим их по-
пулярность как центров связывания металла, является их способ-
ность к координации при физиологическом значении рН. В ряду
гистидилпептидов pAi
mH
£ лежит между 5,5 и 7,2, т. е. на три еди-
ницы рК ниже, чем рАмнз [97]. ЭСКП для иона переходного ме-
талла, связанного с имидазольным атомом азота, меньше, чем
ЭСКП для иона, связанного с атомом азота аминогруппы, но при
этом в случае имидазола ион металла не так жестко конкурирует
с протоном за электронную пару азота. В случае самого гистидина
равновесие между имидазолом и аминогруппами как донорами
создает интересную проблему в координационной химии.
1.6.2. Хелатообразование с гистидином
Частично протонированная форма лиганда H
2
His
2
+ представле-
на формулой XXVII. Константы кислотной диссоциации для ряда
H
3
His
2
+ -<—H
2
His+ <—*- HHis
i
ч—His
-
<—>• H-iHis
2
-
равны рAcooh= 1,8, р/С
И
мидазолий=6,0, рД'инз
=
9,1 и рАимидазол =
=14. Очень соблазнительно допустить, что последовательность, в
которой удаляются протоны при титровании, соответствует поряд-
ку, в котором потенциально донорные атомы используются для
связывания металла по мере повышения рН. Согласно этой после-
довательности, при комплексообразовании металлов с гистидином
должны быть такие стадии: (1) монодентатная координация по
карбоксильному кислороду при низких значениях рН; (2) связы-
вание металла имидазольным атомом азота, приводящее к обра-
зованию семичленного хелатного кольца; (3) связывание по атому
азота аминогруппы, делающее гистидин трехдентатным лигандом,
и, возможно, (4) диссоциация второго протона из имидазольной
группы.

182
Г шва 4
0
1
/
HC-C
CH
2
НШ
^NH
CH
XXVII
H
3
His
2 +
Опубликованные данные о кристаллической структуре комп-
лексов металлов с гистидином не проливают свет на порядок дис-
социации протонов и порядок реакций связывания металлов. За
одним исключением (см. ниже), все они относятся к области рН,
в которой гистидин ведет себя как трехдентатный хелатирующпй
агент [стадия (3)]. Комплексы Co(II) [98, 99] и Ni(II) i[100] с
гистидином, как и ожидали, являются октаэдричеокими (XXVIII).
Комплекс Zn(II) имеет тетраэдрическую структуру с сильными
связями Zn—Щаминный) и Zn—N (имидазольный); имеются еще
более слабые связи Zn—О (карбоксильный) в направлении от дву.ч
граней тетраэдра (XXIX).
Кристаллические производные Zn(II) с о,ь-гистидином имеют
структуру, состоящую из равного числа комплексов Zn(L-His)
2
и
Zn( D-His)
2
. Однако частицы Zn( L-His)
2
в комплексах Zn(L-IIis)
2
-
•2Н
2
0 И Zn(D-His) ( L-His)-5Н
2
0 имеют различные конфигурацш
[101а]. Это явление уже обсуждалось ранее и было названо «сте
реоселективность» [9]. Комплекс Cd(II) с гистидином ведет себ>
подобно комплексу Zn(II), но имеет более правильную геометрик
[92].
Доказательства того, что последовательность реакций согласу
ется с порядком значений рK
a
, во многих случаях были выведень
из ИК-спектров (хотя, к сожалению, наблюдения не были рас
пространены на область, в которой можно измерять частоты свя
зей металл — лиганд) [32]. При очень низких значениях р!
(pD = 2,2—3 в растворе D
2
O) комплексообразование с Mn(II)
Fe(II), Co(II), Ni(II), Zn(II) и Cd(II) при отношениях 1 : 1 вызы
вает в ИК-спектре одинаковые сдвиги полосы антисимметричноп
колебания карбоксильной группы как а-аланина (1615 см
-1
), та
и гистидина (1625 см
-1
). Это доказывает монодентатную коорди
нацию по СОО~-группе. При значениях pD выше 3 в спектра:
комплексов с гистидином появляется полоса, приписываемая ва
