Эйхгорн Г. (ред.) Неорганическая биохимия. Том 1
Подождите немного. Документ загружается.

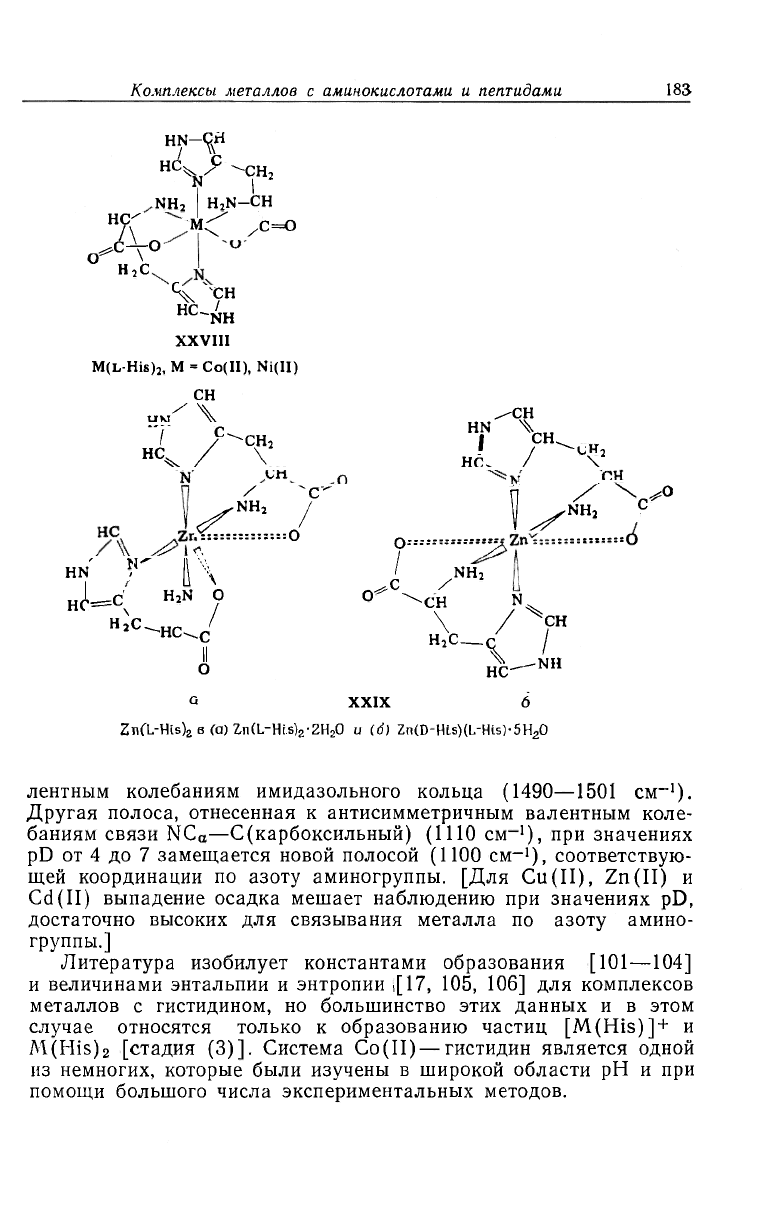
Комплексы металлов с аминокислотами и пептидами
183-
HN-Qri
HcL >
HCK
Л\О
о \
V f
2
NH
2
I HjN-CH
M^ C=O
H
2
C
c
V CH
HC^
h
XXVIII
M(L-HiS)
2
,
M =
Co(II), Ni(II)
CH
„/ \ ^CH
С HN V
II
/ /^CH
2
I CH^
hc
^ / \ HC / \
2
/ QT П X X
0
^O
^NH
1
/ Л
NHl
с
г
HN !• |] I
v
I NH
1
H
1
I=C H
1
N О О' ,.„ N
I
Hic _/ /у
' я J
11
-HC-^
c
Il
О HC-
Q XXIX 6
Zn(L-His)
2
в (а) Zn(L-Hi.s)
z
• 2H
2
O и (d) Zn(D-Hi.s)(L-His)-5H
2
0
лентным колебаниям имидазольного кольца (1490—1501 см
-1
).
Другая полоса, отнесенная к антисимметричным валентным коле-
баниям связи NC
a
—С (карбоксильный) (1110 см
-1
), при значениях
рD от 4 до 7 замещается новой полосой (1100 см
-1
), соответствую-
щей координации по азоту аминогруппы. [Для Cu(II), Zn(II) и
Cd(II) выпадение осадка мешает наблюдению при значениях pD,
достаточно высоких для связывания металла по азоту амино-
группы.]
Литература изобилует константами образования [101—104]
и величинами энтальпии и энтропии ,[17, 105, 106] для комплексов
металлов с гистидином, но большинство этих данных и в этом
случае относятся только к образованию частиц [M(His)]
+
и
M(His)
2
[стадия (3)]. Система Co(II) — гистидин является одной
из немногих, которые были изучены в широкой области рН и при
помощи большого числа экспериментальных методов.

184
i лава 2
Интерес к этой системе отчасти возникает из-за способности
Co
11
(His)
2
образовывать оксигенированные производные, из кото-
рых можно снова получить молекулярный кислород [76, 107—
109], но эта проблема здесь обсуждаться не будет. Измерения
контактных сдвигов в ПМР-спектрах растворов Co(II) — гистидин
[31] показали, что монодентатная координация по карбоксильно-
му кислороду имеет место при рН<4, а октаэдрические комплек-
сы состава 1:1 и 1:2, в которых гистидин тридентатен, сущест-
вуют при 4<рН<11 и что тетраэдрический комплекс образуется
даже при более высоких значениях рН. Существование октаэдрп-
ческого комплекса подтверждается анализом кристаллической
структуры обоих комплексов: Со( L-His)
2
-H
2
0 (XXVIII) [98] и
Co(L-His) ( D-His)-2Н
2
0 [99], что находится в согласии с выво-
дами, сделанными на основании сдвигов в спектрах ПМР [31]
и данных потенциометрического титрования [ПО] о том, что в
растворе эти частицы более устойчивы, чем оптически чистые.
Предложенная тетраэдрическая структура голубого комплекса,
существующего при высоких значениях рН, [Со( i.-H_iHis)
2
]
2
^,
подтверждается как потенциометрическим титрованием, так и от-
несением полос поглощения в УФ- и видимой частях спектра
[111]. Эти частицы образуются после диссоциации второго («пир-
рольного») протона имидазольной группы. Гистидиновые лиганды
бидентатны; донорами являются азот аминогруппы и имидазоль-
ный азот, а тетраэдрическая конфигурация объясняется отталки-
ванием зарядов.
Методом ПМР-спектроскопии было исследовано образование
комплекса 1:2 Pt(II) с L-ГИСТИДИНОМ. Химические сдвиги пока-
зали, что, как и ожидали для Pt(II), координация квадратно-
плоскостная и донорными атомами являются азот аминогруппы
и имидазольный азот во всей области рН: 1^рН^12. Большие
COOH
^COO-J
CH
H
2
N^CH
H
2
N
\ /
Pt
\
//
N
// V
N
H
\
N
XXX
'юординация в IPt(HHts)
2
]
XXXl
координация в [Pt(H-, Hui
2
J
сдвиги в сильное поле для протонов C
a
: H и C
2
: H при повыше
нии рН отчетливо указывают на диссоциацию протонов как и:

Комплексы металлов с аминокислотами и пептидами 185-
карбоксильной, так и из имидазольной групп. Таким образом,
гистидин образует хелаты с Pt(II), которым соответствуют фор-
мулы XXX и XXXI при низких и высоких значениях рН соответ-
ственно. Комплексы существуют в виде двух групп изомеров, и
для обоих групп был сделан полный анализ спектров. Химические
сдвиги протонов C
2
: H дают возможность идентифицировать один
ряд изомеров как цис, а другой как транс. И, наконец, на осно-
вании спин-спиновых взаимодействий
1
H—
1
H и
195
Pt—
1
H можно
дать отнесение конформаций хелатного кольца во всех частицах.
Для аналогичного комплекса Pd(II), Pd(L-His)
2
, длина волны
максимума УФ-поглощения и характер спектра кругового дихро-
изма (КД) (и то и другое по сравнению с аналогичными данными
цля комплексов с другими аминокислотами) показывают, что
структура комплекса квадратно-плоскостная со связями
Pd—Ы(аминный) и Pd—N(имидазольный) [74].
Таким образом, Pd(II) и Pt(II) служат примерами, когда по-
рядок связывания металла не всегда такой, как порядок, в кото-
ром депротонируются потенциальные донорные атомы в отсутствие
шнов металла. Нет сомнения, что причину этого следует искать
i значительном увеличении ЭСКП при связывании Pd(II) и Pt(II)
: аминным и имидазольным атомами азота вместо карбоксильного
(ислорода и имидазольного азота. Этот эффект может оказывать
шияние только на те ионы металлов, которые «чувствуют» стаби-
шзацию кристаллического поля, но есть и вторая причина того,
очему порядок значений рК
а
не всегда соблюдается при связы-
ании металлов. Стадия (2) в предложенной выше последова-
ельности приводит к образованию семичленного хелатного коль-
;а (XXXII), хотя известно, что энтропийный фактор не благопри-
XXXII
семичленное хелатное кольцо
2+
в предложенной структуре [M(HHis)]
•ствует его образованию. Семичленные хелатные кольца редко
!ходят в других координационных соединениях, и (несмотря на
!иные ИК-спектров [32]) еще предстоит объяснить, почему они

186
i лава 2
стабилизируются, когда гистидин и гистидилпептиды образуют
хелаты с металлами по атомам карбоксильного кислорода и имид-
азольного азота.
В случае взаимодействия Cu(II) с гистидином существует
прямое и неразрешенное противоречие между данными ИК-спект-
ров для комплекса состава 1 : 1 в D
2
O [32] и анализом кристалли-
ческой структуры комплекса 1 :2. ИК-спектры показывают, чтс
за связыванием Cu(II) с карбоксильным кислородом при очень
низких значениях рН следует при немного более высоких рН об-
разование семичленного хелатного кольца, в котором вторым до-
норным атомом является имидазольный азот. Исследования мето-
дами температурного скачка и остановленной струи реакции меж
ду Cu
2
+ и HHis
rt
в интервале рН от 2,5 до 4,0 согласуются с
образованием комплексов [Cu(HHis)]
+
и [Cu(HHis)
2
]
2+
; в эти;
реакциях стадией, определяющей скорость, является замыкашп
семичленных хелатных колец [О(карбоксильный), Щимидазоль
ный)]. Авторы этих работ не могут воспроизвести наблюдаемук
кинетику, если их расчеты основываются на образовании пяти
членных хелатных колец (по карбоксильному кислороду и амин
ному азоту) [112]. По-видимому, кинетические расчеты не учи
тывают существования других частиц, кроме {Cu(HHis)]
2
+
[Cu(HHis)
2
]
2
+. Новейшее и наиболее обширное исследование си
стемы Cu(II) — гистидин методом потенциометрического титровг
ния показало, что в условиях, при которых измерялась скор ост
некоторых реакций, частицы [Cu(HHis)]
+
и [Cu(HHis)(His)]
должны составлять до 7 и 24% соответственно от общего колич(
ства Cu. В противоположность данным ИК-спектроскопии и кин<
тическим данным анализ кристаллической структуры комплекс;
кристаллизующегося при рН 3,7, [Cu(L-HHis)
2
(H
2
O)
2
] (NO
3
)
показал, что молекулы гистидина координируются через атом
азота аминогруппы и карбоксильного кислорода и что оба атом
в каждой имидазольной группе протонированы и не участвуют
хелатообразовании (XXXIII) [113].
I .^
n1
WH
OH
2
XXXIII
Какой бы ни была структура комплексов Cu(II) с гистидинс
при низких значениях рН—[Cu(HHis)]
2
+ или [Cu(HHis)
2
]
2
+,
Комплексы металлов с аминокислотами и пептидами
187-
имеются веские доказательства в пользу того, что при более вы-
соких значениях рН координация в частицах [Cu(His)]
+
и
Cu(His)
2
главным образом осуществляется по атомам азота ами-
ногруппы и имидазольного кольца. Участие атома азота амино-
группы в области рН от 5 до 11 подтверждается данными ИК-
спектров упомянутого выше типа [32], а прямым доказательством
связывания меди имидазольной группой является парамагнитное
уширение сигнала ЯМР протонов C
2
: H и C
4
: H имидазольного
сольца. Константы образования [115], энтальпии образования [105,
116] и разложение с помощью H
2
O
2
комплексов Cu(II) с гистиди-
аом очень похожи на те же величины для комплексов Cu(II) с
-истамином, образующихся в таких же условиях. (Гистамин не име-
;т карбоксильной группы, так что металл должен связываться с
!томами азота аминогруппы и имидазольного кольца.) Аналогичные
Юказательства получены из спектров дисперсии оптического враще-
1ия (ДОВ) комплекса Cu(His)
2
при рН 8. Резких изменений в этих
пектрах не наблюдается при замене гистидина его метиловым
фиром (это показывает, что вклад карбоксильной группы гисти-
,ина в координацию незначителен), но они сильно отличаются от
пектров ДОВ комплекса с 1-метилгистидином, в котором невоз-
южна координация через азот имидазольного кольца [117]. Эти
аключения подтверждаются рентгеноструктурными данными.
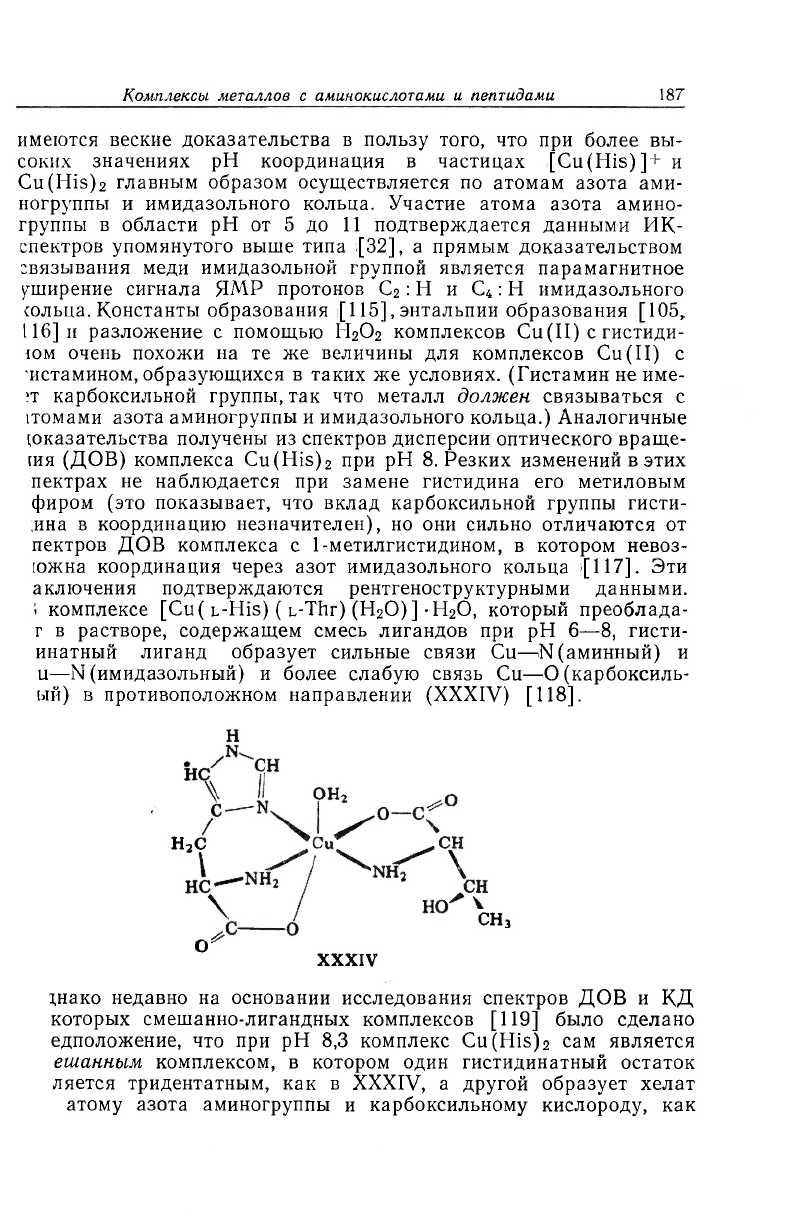
1 комплексе [Cu ( ь-His) ( L-Thr) (H
2
O)] -H
2
O, который преоблада-
г в растворе, содержащем смесь лигандов при рН 6—8, гисти-
инатный лиганд образует сильные связи Cu—>Ы(аминный) и
u—N (имидазольный) и более слабую связь Cu—О (карбоксиль-
ый) в противоположном направлении (XXXIV) [118].
1,нако недавно на основании исследования спектров ДОВ и КД
которых смешанно-лигандных комплексов [119] было сделано
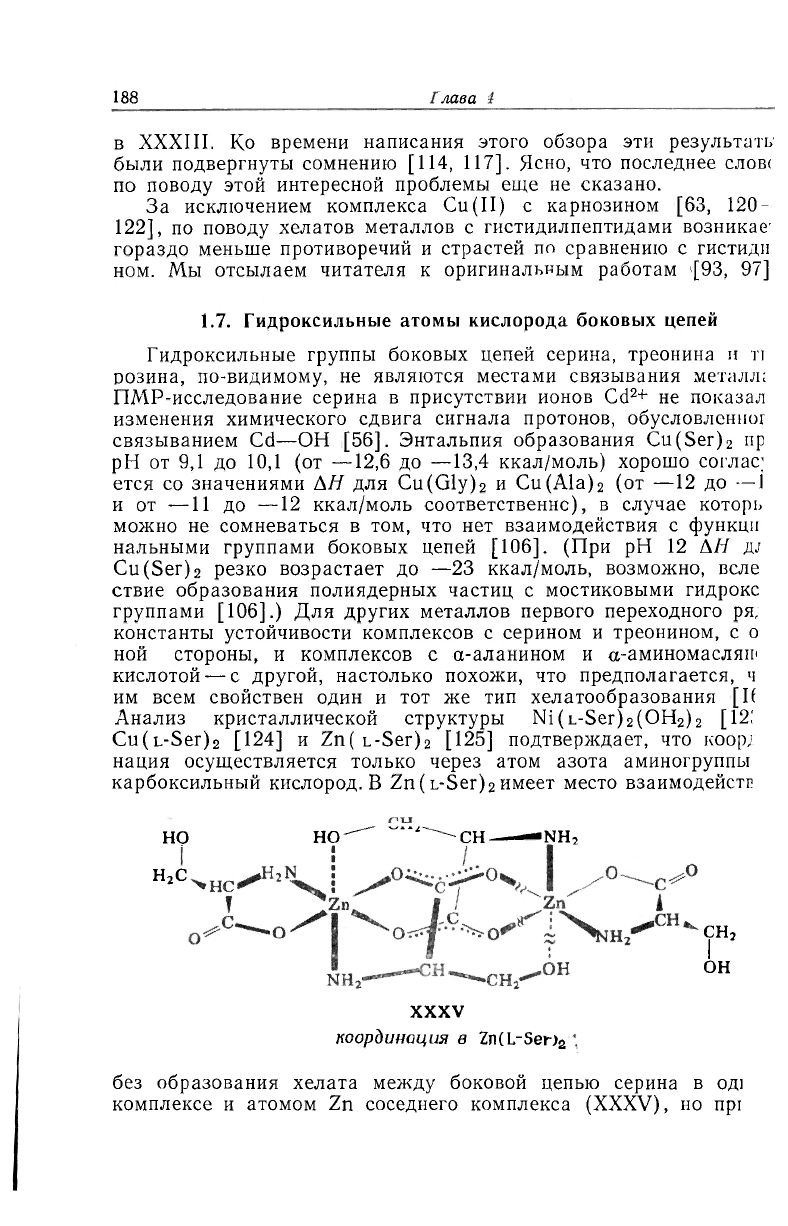
едположение, что при рН 8,3 комплекс Cu(His)
2
сам является
ешанным комплексом, в котором один гистидинатный остаток
ляется тридентатным, как в XXXIV, а другой образует хелат
атому азота аминогруппы и карбоксильному кислороду, как
H
О
CH
3
XXXIV
188
i лава 2
в XXXIII. Ко времени написания этого обзора эти результата
были подвергнуты сомнению [114, 117]. Ясно, что последнее слов<
по поводу этой интересной проблемы еще не сказано.
За исключением комплекса Cu(II) с карнозином [63, 120-
122], по поводу хелатов металлов с гистидилпептидами возникае
-
гораздо меньше противоречий и страстей по сравнению с гистиди
ном. Мы отсылаем читателя к оригинальным работам >[93, 97]
Гидроксильные группы боковых цепей серина, треонина и Ti
розина, по-видимому, не являются местами связывания металл;
ПМР-исследование серина в присутствии ионов Cd
2
+ не показал
изменения химического сдвига сигнала протонов, обусловленног
связыванием Cd-OH [56]. Энтальпия образования Cu(Ser)
2
пр
рН от 9,1 до 10,1 (от —12,6 до —13,4 ккал/моль) хорошо со глас;
ется со значениями АН для Cu(Gly)
2
и Cu(Ala)
2
(от —12 до —I
и от —11 до —12 ккал/моль соответственно), в случае которь
можно не сомневаться в том, что нет взаимодействия с функцп
нальными группами боковых цепей [106]. (При рН 12 АН дj
Cu(Ser)
2
резко возрастает до —23 ккал/моль, возможно, всле
ствие образования полиядерных частиц с мостиковыми гидрокс
группами [106].) Для других металлов первого переходного ря,
константы устойчивости комплексов с серином и треонином, с о
ной стороны, и комплексов с а-аланином и а-аминомаслян
кислотой — с другой, настолько похожи, что предполагается, ч
им всем свойствен один и тот же тип хелатообразования [If
Анализ кристаллической структуры Ni(L-Ser)
2
(OH
2
)
2
[12!
Cu(L-Ser)
2
[124] и Zn(L-Ser)
2
[125] подтверждает, что коор;
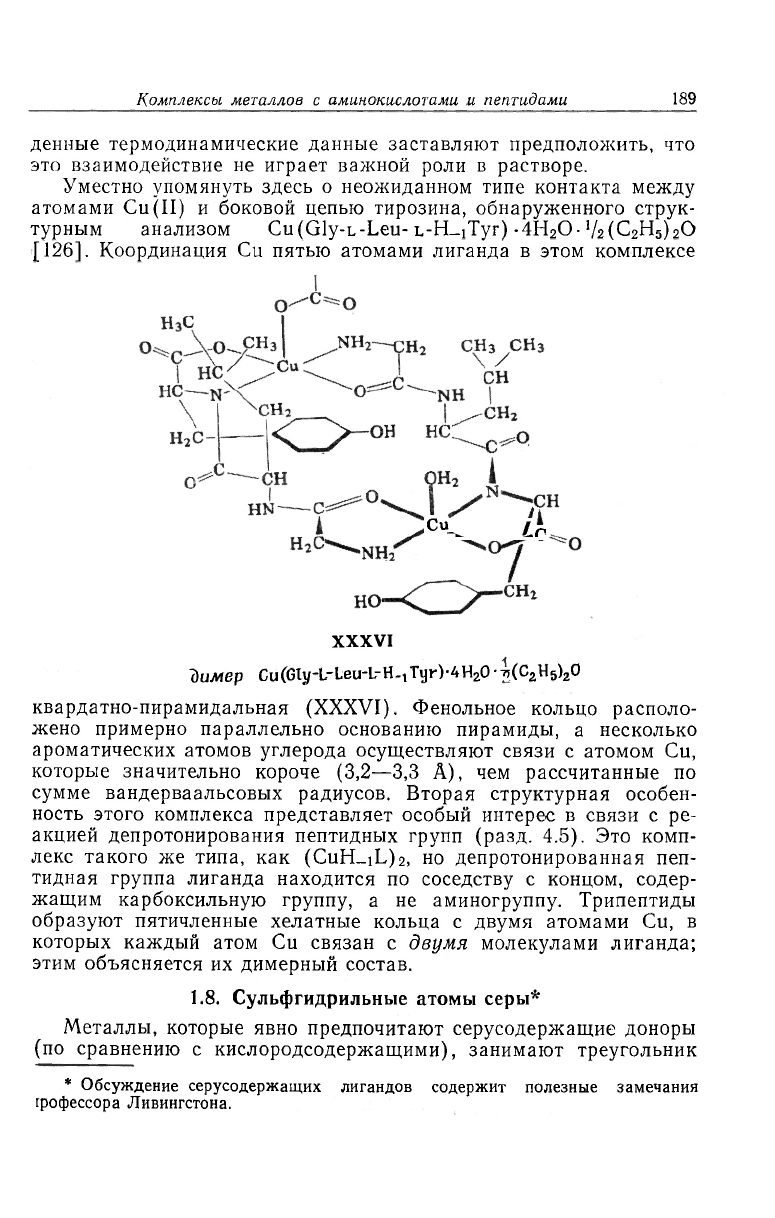
нация осуществляется только через атом азота аминогруппы
карбоксильный кислород. В Zn(L-Ser)
2
HMeeT место взаимодейста
НО HO""^ --СН—— NH,
1.7. Гидроксильные атомы кислорода боковых цепей
H
2
C
CH
2
I
он
XXXV
координация в Zn(L-Ser)
2
без образования хелата между боковой цепью серина в од]
комплексе и атомом Zn соседнего комплекса (XXXV), но npi
Комплексы металлов с аминокислотами и пептидами
189-
денные термодинамические данные заставляют предположить, что
это взаимодействие не играет важной роли в растворе.
Уместно упомянуть здесь о неожиданном типе контакта между
атомами Cu(II) и боковой цепью тирозина, обнаруженного струк-
турным анализом Cu (Gly-L-Leu-L-H_iTyr)-4Н
2
0-'/г (C
2
H
5
)
2
O
[126]. Координация Cu пятью атомами лиганда в этом комплексе
Cu
- Ln
XXXVI
димер Cu(Gty-L-Leu-L-H-,Tyr)-4H
2
O-Tj(C
2
H
5
)
2
O
квардатно-пирамидальная (XXXVI). Фенольное кольцо располо-
жено примерно параллельно основанию пирамиды, а несколько
ароматических атомов углерода осуществляют связи с атомом Cu,
которые значительно короче (3,2—3,3 А), чем рассчитанные по
сумме вандерваальсовых радиусов. Вторая структурная особен-
ность этого комплекса представляет особый интерес в связи с ре-
акцией депротонирования пептидных групп (разд. 4.5). Это комп-
лекс такого же типа, как (CuH_iL)
2
, но депротонированная пеп-
тидная группа лиганда находится по соседству с концом, содер-
жащим карбоксильную группу, а не аминогруппу. Трипептиды
образуют пятичленные хелатные кольца с двумя атомами Cu, в
которых каждый атом Cu связан с двумя молекулами лиганда;
этим объясняется их димерный состав.
1.8. Сульфгидрильные атомы серы*
Металлы, которые явно предпочитают серусодержащие доноры
(по сравнению с кислородсодержащими), занимают треугольник
* Обсуждение серусодержащих лигандов содержит полезные замечания
фофессора Ливингстона.

90
i лава 2
в центре периодической таблицы и относятся к «классу (б)»
[127]. Они характеризуются способностью образовывать не только
сильные 0-связи с легко поляризуемыми лигандами, но также и
я-связи посредством обратного переноса электронов с ^я-орбита-
лей металла на d
K
- или р
я
-орбитали лиганда. Даны три объясне-
ния этой способности серусодержащих лигандов [128].
1. Электроотрицательность серы низкая (гораздо ниже, чем
брома, и примерно равна электроотрицательности углерода), а ее
поляризуемость высокая. Атом серы сильно поляризуется в поле
маленького иона металла с высокой плотностью заряда, даже
если ион металла имеет конфигурацию d
10
i[Cu(I), Ag(I), Hg(II)].
2. Расчеты показали, что для ионов с конфигурацией d
10
ни
поляризуемость, ни теплота образования простой ковалентной
связи не могут объяснить даже порядков устойчивости сравни-
ваемых связей металл—О и металл—S [128]. Поэтому пришли
к заключению о существовании d
n
—d
n
-связи металл—кпиганд,
хотя следует признать, что в настоящее время еще нет прямых
доказательств этого.
3. Возможно, в случае связей с низкоспиновыми ионами с кон-
фигурацией d
8
[Pd(II), Pt(II), Au(III)] такая дополнительная
стабилизация вызвана увеличением ЭСКП. Этот вопрос оконча-
тельно еще не решен, так как серусодержащие лиганды, по-види-
мому, должны находиться в различных местах спектрохимической
серии. Некоторые занимают место ближе к более низким значе-
ниям спектрохимического параметра вблизи иона Br, другие, на-
пример тиоэфиры, занимают положения с промежуточными и вы-
сокими значениями спектрохимического параметра [129].
Хорошо известно особое сродство цистеинильных боковых це
пей к Ag(I) и Hg(II); это свойство широко использовалось дл?
приготовления производных белков с тяжелыми атомами. Устой
чивость [Ag(H-ICys)
2
]
3-
примерно такая же, как устойчивосп
[Ag(CN)
2
]
-
. В растворах с низкими значениями рН доминирую-
частицы [Ag(HCys)
2
]
+
и комплексообразование в этой систем!
заметно даже при рН 1,3 [130]. Однако связывание металло:
ионизированными тиоловыми группами боковых цепей цистеин
не ограничивается ионами металлов «класса (б)». Константы об
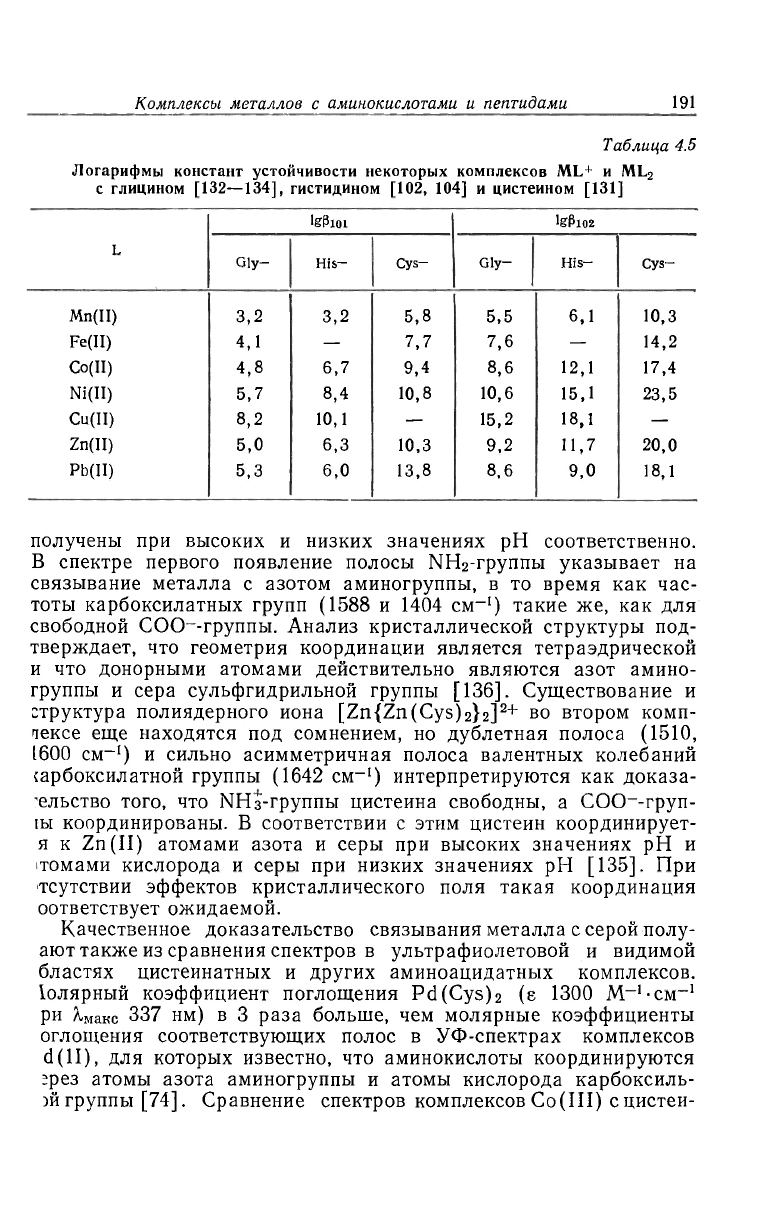
разования цистеинатных комплексов Mn(II), Fe(II), Co(II)
Ni(II), Zn(II) и Pb(II) [131] значительно выше, чем констант]
образования глицинатных [131—134] и гистидинатных [102, 104
комплексов тех же металлов (табл. 4.5). Многие другие свойств
подтверждают, что повышенные устойчивости во всех случая
сопровождаются связыванием металла с серой.
Например, в ИК-спектрах твердых образцов ряда цистеиновк
комплексов Zn(II), Cd(II), Hg(II) и Pb(II) отсутствует погл<
щение, обусловленное группой S—H [108]. Два из этих компле]
сов — Na
2
[Zn(Н—iCys)
2
] -4Н
2
0 и [Zn
3
(Cys)
4
] [ZnCl
4
], — очевидн
Комплексы металлов с аминокислотами и пептидами 191-
Таблица 4.5
Логарифмы констант устойчивости некоторых комплексов ML
+
и ML
2
с глицином [132—134], гистидином [102, 104] и цистеином [131]
L
IgPlOl
lgPl02
L
Gly-
Hib-
Cys- Gly-
His-
Cys-
Mn(II)
3,2 3,2
5,8
5,5
6,1
10,3
Fe(II)
4,1
—
7,7
7,6
—
14,2
Co(II)
4,8
6,7 9,4 8,6 12,1 17,4
Ni(II) 5,7
8,4
10,8
10,6
15,1 23,5
Cu(II)
8,2 10,1
—
15,2
18,1
—
Zn(II)
5,0
6,3
10,3
9,2
11,7
20,0
Pb(II)
5,3
6,0
13,8
8,6 9,0 18,1
получены при высоких и низких значениях рН соответственно.
В спектре первого появление полосы NH
2
-rpynnbi указывает на
связывание металла с азотом аминогруппы, в то время как час-
тоты карбоксилатных групп (1588 и 1404 см
-1
) такие же, как для
свободной СОО--группы. Анализ кристаллической структуры под-
тверждает, что геометрия координации является тетраэдрической
и что донорными атомами действительно являются азот амино-
группы и сера сульфгидрильной группы [136]. Существование и
структура полиядерного иона [Zn(Zn(Cys)
2
)
2
]
2+
во втором комп-
тексе еще находятся под сомнением, но дублетная полоса (1510,
1600 см
-1
) и сильно асимметричная полоса валентных колебаний
сарбоксилатной группы (1642 см
-1
) интерпретируются как доказа-
тельство того, что ЫНз-группы цистеина свободны, а СОО~-груп-
[ы координированы. В соответствии с этим цистеин координирует-
я к Zn(II) атомами азота и серы при высоких значениях рН и
'томами кислорода и серы при низких значениях рН [135]. При
тсутствии эффектов кристаллического поля такая координация
оответствует ожидаемой.
Качественное доказательство связывания металла с серой полу-
ают также из сравнения спектров в ультрафиолетовой и видимой
бластях цистеинатных и других аминоацидатных комплексов.
1олярный коэффициент поглощения Pd(Cys)
2
(е 1300 M
-1
-см
-1
ри Ямакс 337 нм) в 3 раза больше, чем молярные коэффициенты
оглощения соответствующих полос в УФ-спектрах комплексов
d (11), для которых известно, что аминокислоты координируются
;рез атомы азота аминогруппы и атомы кислорода карбоксиль-
эй группы [74]. Сравнение спектров комплексов Co(III) с цистеи-

192
Глава 4
ном NH
2
—CH
2
—CH
2
—SH и HOOC—CH
2
—CH
2
—SH показало, что
в K
3
[Co
III
(H_
1
Cys)
3
]-3H
2
0 (зеленый, высокие рН) координация
осуществляется через атом азота аминогруппы и атом серы сульф-
гидрильной группы, а в Co(III) (Cys)
3
-3H
2
0 (красный, низкие
рН) — через карбоксильный кислород и сульфгидрильную серу.
ИК-спектр зеленого комплекса подтверждает, что карбоксильные
группы в нем не координированы [138].
Комплексы Fe(III) с цистеином особенно важны, так как они
имеют отношение к изучению ферредоксина (гл. 22). Fe
3
+ (подоб-
но Cu
2
+) катализирует окисление цистеина. Чрезвычайно лабиль-
ные комплексы с соотношениями металл—лиганд 1 : 1 (голубой),
1 : 2 (красный) и 1 :3 (фиолетовая и зеленая формы, термически
равноценные) были выделены при —78 °С. Координация осущест-
вляется через кислород и серу в голубой, красной и фиолетовой
формах и через азот и серу в зеленой форме. Это доказывается
спектрами поглощения, ДОВ и КД, а также сравнением этих
спектров со спектрами аналогичных тиогликолятных комплексов
[139]. В родственном комплексе [Fe
11
(L-Cys)
2
(CO)
2
] координация
осуществляется через атомы азота и серы. Тиоловая группа обла-
дает большим сродством к иону Ag+, чем к иону Fe
2
+, и ионы
Ag+ превращают комплекс в [Fe(L-CysAg)
2
(CO)
2
], в котором
Fe(II) связывается с цистеинатным лигандом теперь уже посред-
ством атомов азота аминогруппы и карбоксильного кислорода
[140].
Взаимодействие Cu(II) с цистеином также осложняется вос-
становлением иона металла. Аминокислота окисляется до цисти-
на. Взаимодействие Cu(I) с меркаптидами широко исследовалось
титрованием в водно-ацетонитрильных растворах [141].
Упоминавшиеся до сих пор комплексы служили примерам*
монодентатной координации только по атому серы и бидентатно
го хелатообразования по N и S, N и О, О и S. Выводы о триден
татном хслатообразовании со всеми функциональными группам!
цистеина основаны на детальной интерпретации спектров ДОЕ
растворов, содержащих ионы Co(II) и цистеинатные ионы [142]
Такая координация обнаружена также в кристаллической струк-
туре Na
2
[Mo^ (L-H^Cys)
2
O
4
]-5Н
2
0 (XXXVII) [143]. Другим:
XXXVII
