Эйхгорн Г. (ред.) Неорганическая биохимия. Том 1
Подождите немного. Документ загружается.

Устойчивость координационных соединений
103
:орий для объяснения порядка устойчивости комплексов Ирвин-
I—Уильямса [52]. Вычисленные энергии стабилизации кристал-
дчеоким полем вместе с энергиями электростатической связи ка-
?ственно объясняют последовательность Ирвинга—Уильямса для
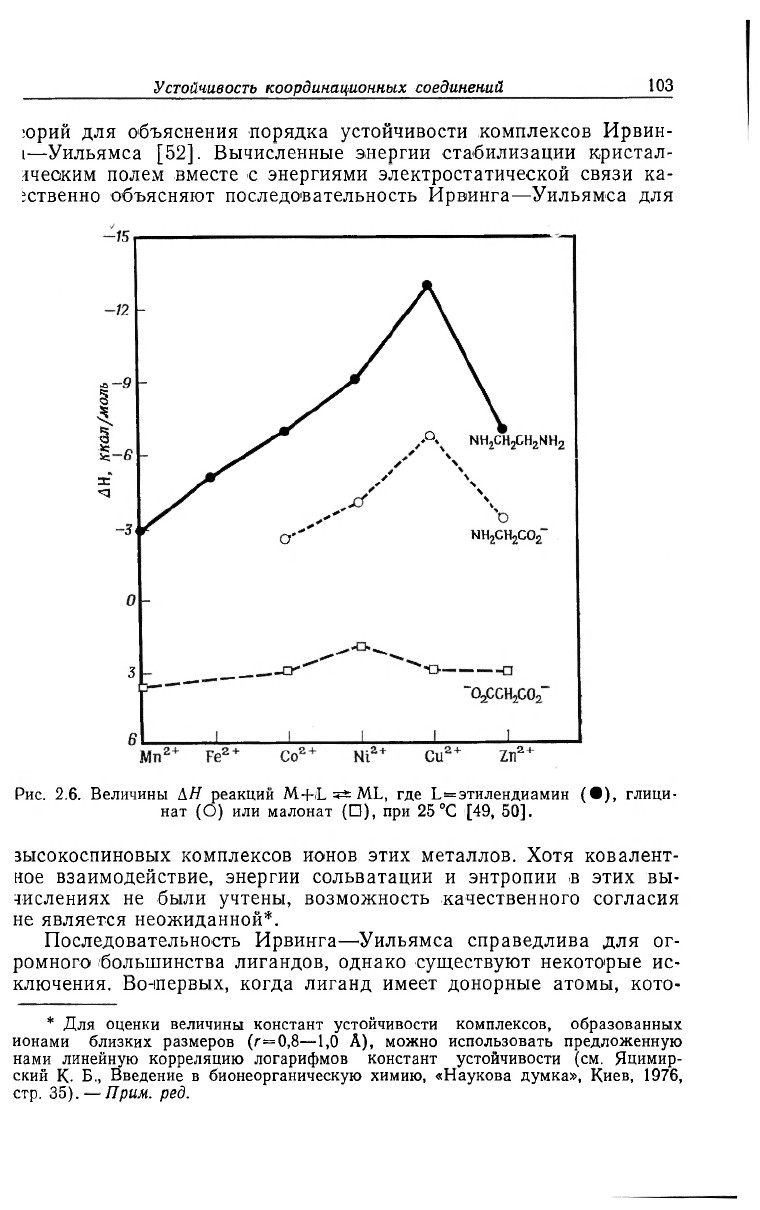
Рис. 2.6. Величины АН реакций M+iL ML, где L=этилeндиaмин (•), глици-
нат (О) или малонат (•), при 25 °С [49, 50].
зысокоспиновых комплексов ионов этих металлов. Хотя ковалент-
ное взаимодействие, энергии сольватации и энтропии в этих вы-
числениях не были учтены, возможность качественного согласия
не является неожиданной*.
Последовательность Ирвинга—Уильямса справедлива для ог-
ромного большинства лигандов, однако существуют некоторые ис-
ключения. Во-первых, когда лиганд имеет донорные атомы, кото-
* Для оценки величины констант устойчивости комплексов, образованных
ионами близких размеров (г=0,8—1,0 А), можно использовать предложенную
нами линейную корреляцию логарифмов констант устойчивости (см. Яиимир-
ский К. Б., Введение в бионеорганическую химию, «Наукова думка», Киев, 1976,
стр. 35). — Прим. ред.

104
i лава 2
рые могут все координироваться в октаэдрическом комплексе (нг
пример, Ni
2
+), но не все в квадратно-плоскостном кок
плексе (Cu
2
+). Так, например, Ki комплекса Cu
2
+ с шее™
дентатмым лигандом ЭДТА [зтилендиаминтетраацета
(-O
2
CCH
2
)2NCH2CH2N (CH
2
CO
2
)
2
] только немного больше, че:
для Ni
2
+. Медь неспособна прочно координировать все шесть дс
норных атомов. Во-вторых, когда лиганды, характеризующиес
высокой силой поля, изменяют состояние иона металла от высоко
спинового к низкоспиновому. Это 'В основном имеет место дл:
комплексов Fe
2
+ с такими лигандами [53], как о-фенаятроли*
2,2'-дипиридил и цианид. При этом образуются необычно устой
чивые комплексы. Подобные изменения в порядке устойчиво
стей наблюдаются для двух лигандов, представляющих интере
для биохимии, — имидазола и гистамина. Тенденцию к образова
нию исключительно устойчивых комплексов с Fe
2
+, кажется, паи
более обычно проявляют лиганды, содержащие дояорные атомь
ароматического гетероциклического азота.
2.2. Природа лиганда
2.2.1. Основность лиганда
Как было отмечено в разд. 2.1.1, электростатическая модель
химических связей в комплексах ионов металлов имеет ограничен-
ное применение для объяснения последовательности констант
устойчивости с различными ионами металлов и почти непримени-
ма для объяснения последовательностей изменения устойчивости
в зависимости от природы лиганда. Это не является неожиданным,
так как сольватация, энтропия и ковалентное взаимодействие
имеют большое значение. Поэтому были изучены корреляции дру-
гих свойств лиганда с константами устойчивости. Одной из наи-
более успешных была корреляция с основностью (рЛа) лиганда
{54]. При этом исходили из того, что и H+, и ионы металла
M
m
+ взаимодействуют как кислоты Лыоиса с лигандами, пред-
ставляющими основания Льюиса. В качестве меры основности
лиганда (L
-
) по отношению к протону принят рK
a
(т. е. —IgZC
n
)
«а
для реакции HL^±H++L~ в водном растворе; чем выше р/С
а
, тем
более сильным основанием является данный лиганд (L ) по от-
ношению к H+ и, предположительно, также к M
m
+. Действитель-
но, часто наблюдается линейная корреляция между рK
a
и лога-
рифмом константы К реакции комплексообразования.
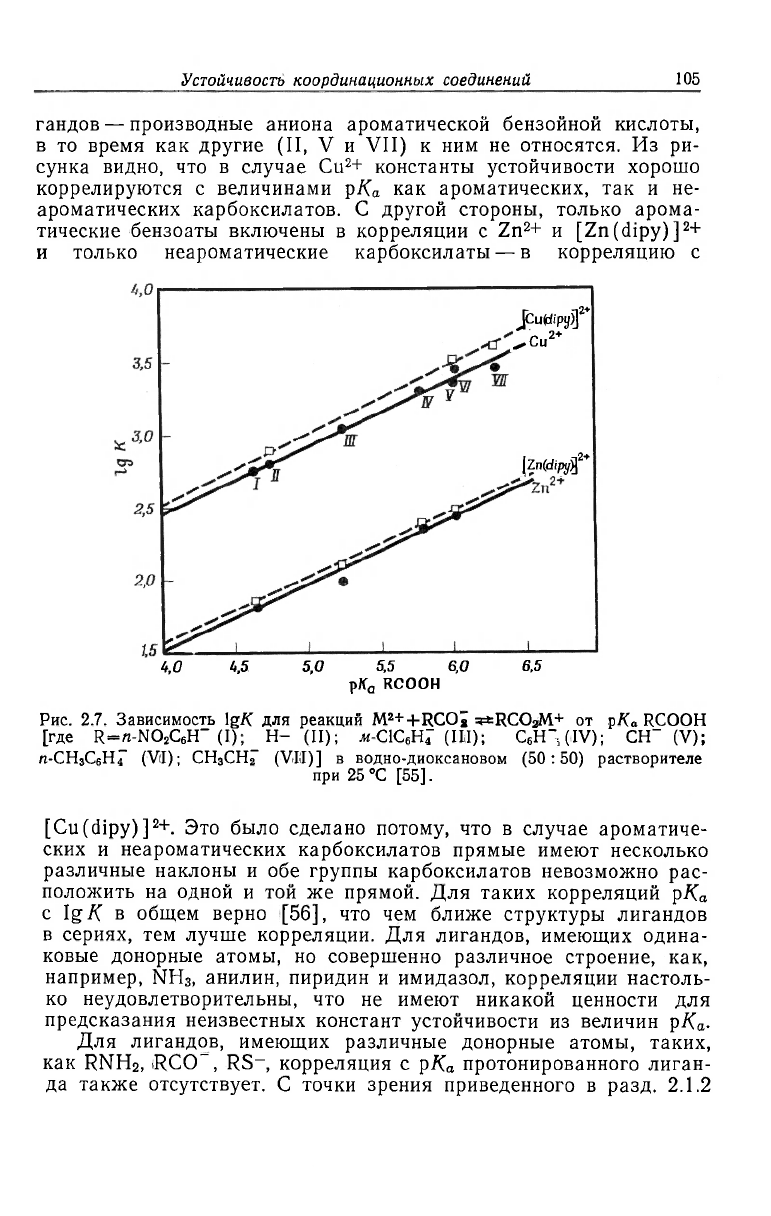
На рис. 2.7 показано несколько таких корреляций |[50], в
которых кислотами Льюиса являются [Cu(dipy)]
2
+, Cu
2
+,
[Zn(dipy)]
2
+ и Zn
2
+. Лиганды — монодентатные карбоксилатные
анионы RCO_. Как указано на рисунке, некоторые из этих ли-
Устойчивость координационных соединений
105
гандов — производные аниона ароматической бензойной кислоты,
в то время как другие (II, V и VII) к ним не относятся. Из ри-
сунка видно, что в случае Cu
2
+ константы устойчивости хорошо
коррелируются с величинами рК
а
как ароматических, так и не-
ароматических карбоксилатов. С другой стороны, только арома-
тические бензоаты включены в корреляции с Zn
2
+ и [Zn(dipy)]
2
+
и только неароматические карбоксилаты — в корреляцию с
Рис. 2.7. Зависимость lg/С для реакций M
2
++RCOa ^RCO
2
M
+
от рКа RCOOH
[где R=W-NO
2
C
6
H
-
(I)H- (II); ж-С1С
6
НГ (IIiI); C
6
H" (IV); CH
-
(V);
/I-CH
3
C
6
Hl" (ViI); CH
3
CH^ (ViIiI)] в водно-диоксановом (50:50) растворителе
при 25
0
C [55].
[Cu(dipy)]
2
+. Это было сделано потому, что в случае ароматиче-
ских и неароматических карбоксилатов прямые имеют несколько
различные наклоны и обе группы карбоксилатов невозможно рас-
положить на одной и той же прямой. Для таких корреляций р/С
а
с Ig К в общем верно [56], что чем ближе структуры лигандов
в сериях, тем лучше корреляции. Для лигандов, имеющих одина-
ковые донорные атомы, но совершенно различное строение, как,
например, NH
3
, анилин, пиридин и имидазол, корреляции настоль-
ко неудовлетворительны, что не имеют никакой ценности для
предсказания неизвестных констант устойчивости из величин рК
а
-
Для лигандов, имеющих различные донорные атомы, таких,
как RNH
2
, RCO , RS
-
, корреляция с р/С
а
протонированного лиган-
да также отсутствует. С точки зрения приведенного в разд. 2.1.2
Jcu Wpyf*
^Cu
2+
jz n(dipyf*
U,О Ь.5 5,0 5,5 6,0 6,5
?К
а
RCOOH

106
i лава 2
обсуждения, касавшегося сопоставления жесткости и мягкости
ионов металлов и донорных атомов лигандов, какой-либо корре-
ляции Ig К с р/Са для различных донорных атомов и нельзя было
ожидать. Для того чтобы учегть колебания в жестком и мягком
характере ионов металлов и лигандов, в качестве эталона были
использованы и другие кислоты, кроме H+. Так, в качестве меры
донорных свойств лигандов (L~) использовали константы устой-
чивости (IgiC) их комплексов (ML) с ионом металла, выбранным
в качестве стандарта. Эти величины
1
gK коррелировали [57, 58]
с константами устойчивости комплексов M'L, используя другой ион
металла (M') с сериями лигандов (L
-
) с различными донорными
свойствами. Такие зависимости, как показано на рис. 2.7, подчи-
няются уравнению
IgK = арК
а
+
Ь
(6)
Наклон а прямых для всех ионов металлов на рис. 2.7 примерно
равен 0,5. Хотя положительный наклон указывает, что более ос-
новные лиганды образуют более устойчивые комплексы, наличие
H+ в водных растворах означает, что более основные лиганды
будут более сильно связываться с H+.
Итак, в растворе существуют два равновесия:
H
+
+ L
-
HL, MKa (7)
M
M
++ L
-
ML'"*-
1
'+, К (8)
После вычитания уравнения (7) из уравнения (8) получаем урав-
нение (9), соответствующее равновесию, доминирующему в рас-
творе при низких рН, где концентрация L~ очень мала.
HL + M"
1
+ Ч >- ML'"
1
-
1
'+ -J- Н
+
, KaK (9)
Таким образом, константа равновесия для реакции (9) равна
K
a
K. При использовании величин_.К
а
и К из рис. 2.7 для реакции
Cu
2
+ со слабым основанием HCO и сильным основанием CII
3
CO
2
получаем следующие величины констант равновесия для реакции
(9): (10~
4
'
75
) (10
2
'
8
) =IO
-1
'
95
для HCO
2
и (Ю-
601
) (10
336
) =10"
265
для CH
3
CO
2
. Таким образом, константы равновесия реакции
комплексообразования ![уравнение (9)] действительно меньше для
более основных лигандов, т. е. формиат будет связан в комплекс
с Cu
2
+ в большей степени, чем ацетат. Необходимо помнить, что
количество комплекса, действительно присутствующего в водном
растворе, будет зависеть не только от константы устойчивости
комплекса, но также от рКа лиганда.
В случае сильноосновных лигандов иногда необходимо путем
добавления OII
-
сделать раствор относительно щелочным для то-
го, чтобы обеспечить достаточную концентрацию непротонирован-
ного лиганда для комплексообразования с ионом металла. Иногда
необходимая концентрация OH
-
превосходит произведение раство-

Устойчивость координационных соединений
107
римости гидроксида металла M(OH)
2
и он осаждается из раство-
ра, что исключает возможность образования комплекса. Это имеет
место в реакциях Ni
2
+ и Zn
2
+ с 1,1,7,7-тетраэтилдиэтилентриами-
ном; этот лиганд — очень сильное основание, но не очень сильный
лиганд. При тех значениях рН, при которых присутствует доста-
точное количество непротонированного триамина, пригодного для
координации с ионом металла, концентрация ОН" достаточно вы-
сока для осаждения гидроксида металла M(OH)
2
. Осаждение
гидроксидов препятствует комплексообразованию этих ионов ме-
таллов с указанным лигандом в водном растворе. С другой сто-
роны, Cu
2
+ образует с этим лигандом достаточно устойчивый
комплекс, чтобы его можно было исследовать [59]. Растворимо-
сти гидроксидов металлов приведены в работе i[60].
Для серий лигандов, подчиняющихся уравнению (6), если
а<1, количество действительно присутствующего в растворе комп-
лекса иона металла с лигандом меньше для более основных ли-
гандов; если а= 1, количество комплекса не изменяется с повыше-
нием р/С
а
лиганда; если а> 1, то при повышении р/С
а
лиганда
также увеличивается количество комплекса иона металла в рас-
творе.
Хотя представляло бы интерес узнать, какие свойства ионов
металлов и лигандов определяют величины а, в настоящее время
для этого недостаточно данных. Некоторые авторы [61, 62] пы-
тались объяснить те величины, которые известны, но, по-видимо-
му, не пришли к общим выводам. Величины а, кажется, лежат в
пределах [62] от 0,5 (как на рис. 2.7) до 1,5, многие близки
к 1,0. Как найдено для Cu
2
+ и Zn
2
+, показанных на рис. 2.7, ве-
личины а для ионов металлов первого переходного ряда очень
близки, но больше, чем для Mg
2
+ или Ca
2
+.
Такие графические зависимости Ig К от рК
а
были особенно
ценны для установления координации дополнительных групп ли-
ганда. Например, лиганды — производные ацетата (HOCH
2
CO
2
и
CH
3
CH
2
SCH
2
CO
2
)—образуют с Cu
2
+ более устойчивые комплек-
сы, чем можно ожидать, исходя из их величин р/(
а
[43]. Это
указывает на то, что атом кислорода гидроксильной группы и
атом серы в этих двух лигандах координируются к иону металла,
образуя комплексы необычно высокой устойчивости. Подобным
образом было показано, что атом серы CH
3
CH
2
SCH
2
CoJ не ко-
ординируется к Mn
2
+ или Zn
2
+.
Получены корреляции констант устойчивости комплексов раз-
личных ионов _металлов с производными иминодиуксусной кисло-
ты RN (CH
2
CO
2
)
2
с рК
а
диссоциации H+ от атома азота лиганда
[32, 63]. Для того чтобы установить зависимость между Ig К и
рАа, использовали некоординирующиеся группы R, такие, как CH
3
,
(CH
3
)
3
C и C
6
H
5
. Затем константы устойчивости комплексов с ли-
гандами, содержавшими потенциальные донорные атомы, были

108
i лава 2
сопоставлены с полученной зависимостью Ig /С от р/С
а
. Были ис-
пользованы следующие группы R: HOCH
2
CH
2
—, CH
3
OCH
2
CH
2
-,
HSCH
2
CH
2
—,
_
SCH
2
CH
2
—, NH
2
CH
2
CH
2
—, -O
2
CCH
2
—,
NH
2
(O)CCH
2
-, N=CCH
2
- и (CH
3
)
3
N
+
CH
2
CH
2
-. В зависимости
от природы иона металла и донорного атома в группе R некото-
рые константы устойчивости были намного больше, чем можно
было ожидать на основании значений рK
a
лиганда. Было предпо-
ложено, что это следствие наличия некоторого взаимодействия
между донорными атомами групп R и ионами металлов. Было
найдено, что группы R, содержащие мягкие донорные атомы (на-
пример, атом серы), координируются мягкими атомами металлов
(например, Cu
2
+), а жесткие донорные атомы (например, О) —
жесткими ионами металлов (например, Mg
2
+) (разд. 2.1.2). В ре-
зультате подобного рассмотрения [64] констант устойчивости
комплексов C
2
HSO
2
CCH
2
N(CH
2
CO
2
)
2
С различными ионами ме-
таллов был сделан вывод об отсутствии взаимодействия между
ионом металла и эфирной группой. Эти данные были использованы
для интерпретации механизма гидролиза эфиров, катализируемого
ионами металлов.
2.2.2. Хелатный эффект
Образование хелата. Экспериментально установлено, что комп-
лексы хелатообразующих лигандов более устойчивы, чем комплек-
сы аналогичных монодентатных лигандов. Например, константа
комплексообразования Ni
2
+ с этилендиамином (en) больше, чем
константа комплексообразования с двумя молекулами NH
3
Ni
2+
+ en [Ni(en)]
2
+, IgК = 7,5 (IO)
Ni
2
+ + 2NH
3
[Ni(NH
3
)
2
]
2
+, IgK = 5,0 (11)
Комбинируя эти уравнения, получаем
[Ni(NH
3
)
2
]
2
+ + en =e=fc [Ni(en)]
2
+ + 2NH
3
, lg/C = 2,5 (12)
AH
0
=—1,9 ккал/моль, AS
0
=+6,2 кал-моль
-1
-град-
1
.* Этиленди-
амин и NH
3
можно сравнивать, так как величины их р/С
а
(9,6 для
H
2
NCH
2
CH
2
NH
3
И 10,0 для NH
4
) очень близки, и различие кон-
стант устойчивости нельзя объяснить их различной основностью
(разд. 2.2.1). Это повышение устойчивости хелатов по сравнению
с устойчивостью комплексов с аналогичными монодентатными ли-
гандами известно как хелатный эффект [65].
Ясно, что в случае реакции, включающей замещение двух ли-
гандов NH
3
этилендиамином [уравнение (12)], как отрицательное
значение AH
0
, так и положительное значение AS
0
дают вклад в
* Данные для АH
0
и AS
0
автор приводит без ссылки на первоисточник. —
Прим. ред.

Устойчивость координационных соединений
увеличение устойчивости хелатного комплекса. Образование 3 мо-
лей продукта по сравнению с 2 молями вступающих в реакцию
веществ должно давать положительную поступательную энтропию,
которая дает вклад в общую положительную величину AS
0
. Та-
ким образом, хелатный эффект, по крайней мере частично, явля-
ется следствием благоприятного изменения энтропии реакции.
Следует, однако, заметить, что величина AS
0
зависит от стандарт-
ного состояния, использованного для ее оценки. Если использу-
ются мольные доли вместо обычных одномоляльных стандартных
состояний, то вычисленные энтропии для такой реакции, как (12),
будут ниже, фактически — очень близки к нулю. Таким образом,
использование этого стандартного состояния приводит к умень-
шению эффекта поступательной энтропии, возникающего из обра-
зования 3 молей продукта из 2 молей реагирующих веществ. Бо-
лее того, зависимость AS
0
от выбора стандартного состояния де-
лает трудной количественную интерпретацию величин AS
0
.
Следует также отметить, что величина АН, соответствующая
уравнению (12) (отрицательная), благоприятствует хелатообра-
зоваьию. Это обычно объясняют отталкиванием между двумя до-
норными атомами, когда они приближаются друг к другу при
образовании комплекса. Взаимное отталкивание двух групп NH
2
этилендиамина имеет место уже в свободном лиганде до комплек-
сообразования, и при образовании комплекса возникает только
небольшое дополнительное отталкивание. С другой стороны, меж-
ду молекулами NH
3
в растворе отталкивания нет, но они начина-
ют отталкивать друг друга при комплексообразовании. Это пре-
имущественно электростатическое отталкивание групп NH
3
в
комплексе делает АН° менее благоприятным. Независимо от того,
как объясняют изменение АН° при комплексообразовании, оно
так же, как и AS
0
, вносит существенный вклад в хелатный эф-
фект [66].
Размер хелатного кольца. В общем устойчивость хелатного
комплекса уменьшается [66] при увеличении размера хелатного
кольца от пятичленного к шести- и семичленному. Поэтому в ряду
комплексов дикарбоновых кислот с ионом металла наиболее
устойчивый комплекс образует оксалатный анион:
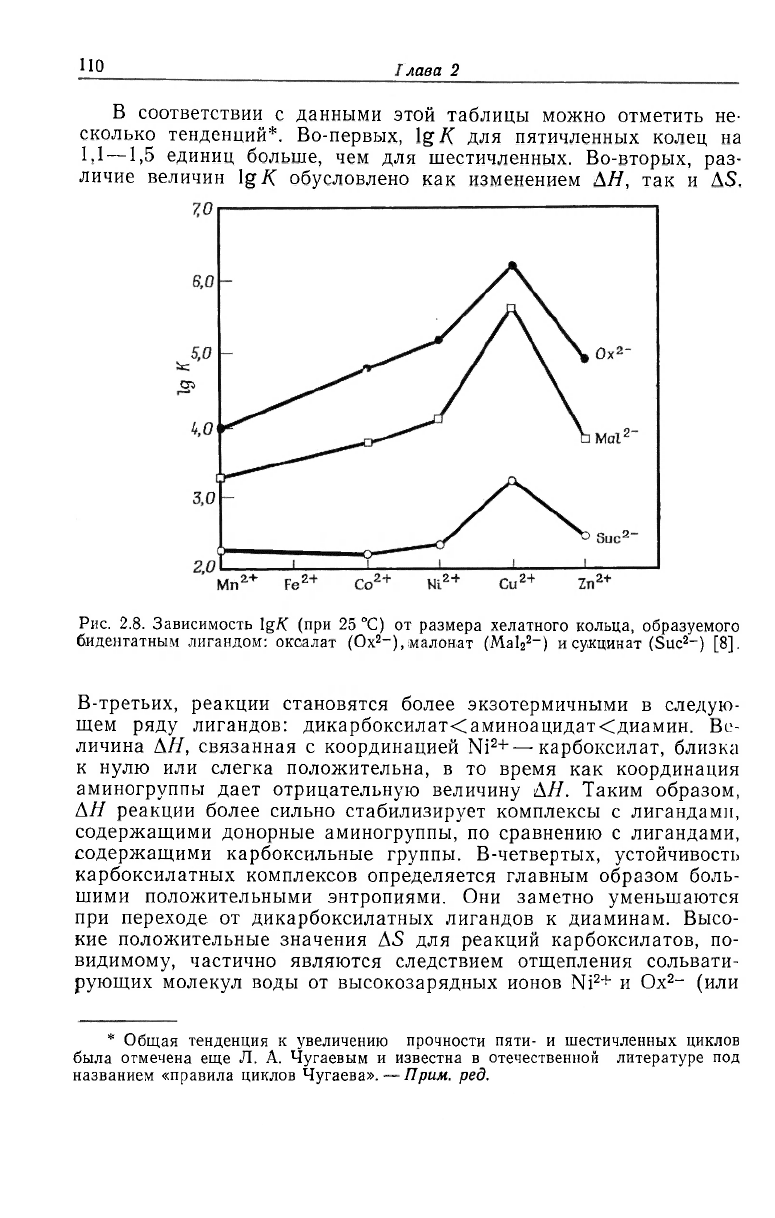
Данные, приведенные на рис. 2.8, иллюстрируют понижение
устойчивости пяти-, шести- и семичленных хелатных комплексов
ионов металлов первого переходного ряда с анионами щавелевой,
малоновой и янтарной кислот. Данные об устойчивости ряда
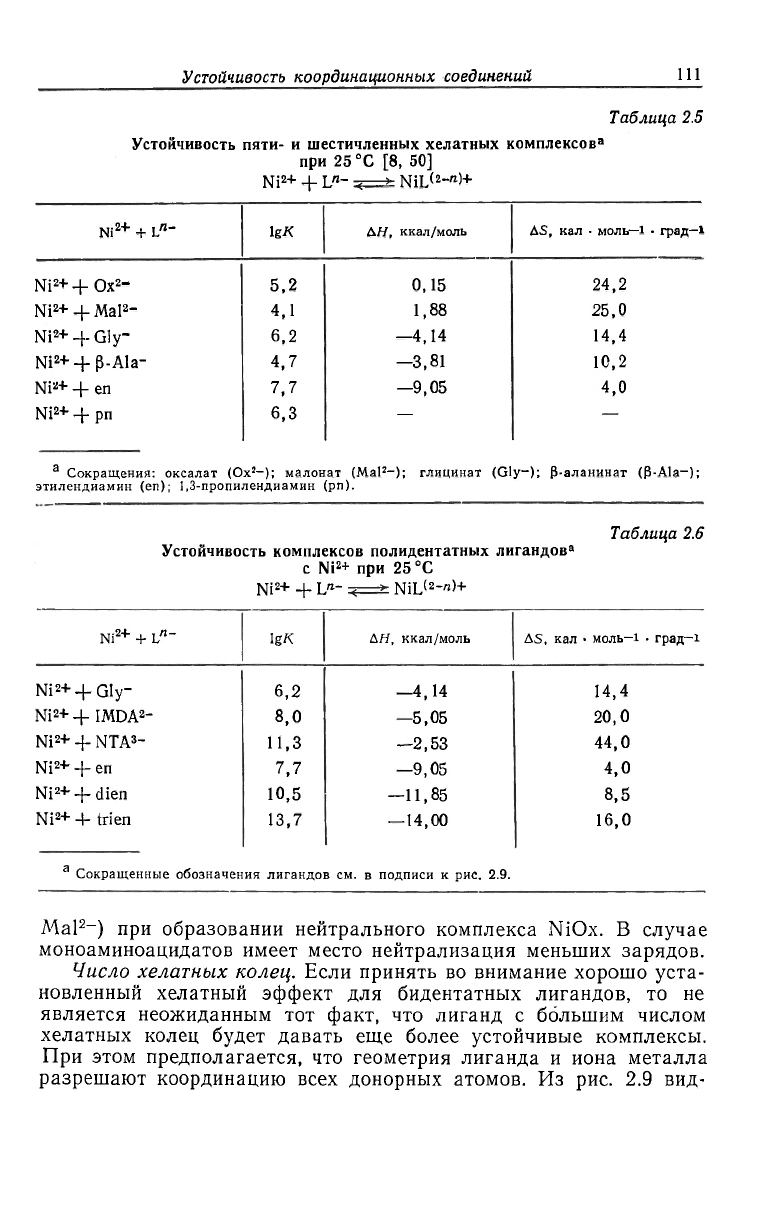
других пяти- и шестичленных хелатных комплексов приведены
в табл. 2.5.
110
i лава 2
В соответствии с данными этой таблицы можно отметить не-
сколько тенденций*. Во-первых, Ig К для пятичленных колец на
1,1
—1,5 единиц больше, чем для шестичленных. Во-вторых, раз-
личие величин Ig К обусловлено как изменением АН, так и AS.
Рис. 2.8. Зависимость lg/С (при 25 °С) от размера хелатного кольца, образуемого
биденгатным лигандом: оксалат (Ох
2
-),маловат (Mal
2
2-
) и сукцинат (Sue
2
-) [8].
В-третьих, реакции становятся более экзотермичными в следую-
щем ряду лигандов: дикарбоксилат<аминоацидат<диамин. Ве-
личина АН, связанная с координацией Ni
2
+ —карбоксилат, близка
к нулю или слегка положительна, в то время как координация
аминогруппы дает отрицательную величину АН. Таким образом,
АН реакции более сильно стабилизирует комплексы с лигандами,
содержащими донорные аминогруппы, по сравнению с лигандами,
содержащими карбоксильные группы. В-четвертых, устойчивость
карбоксилатных комплексов определяется главным образом боль-
шими положительными энтропиями. Они заметно уменьшаются
при переходе от дикарбоксилатных лигандов к диаминам. Высо-
кие положительные значения AS для реакций карбоксилатов, по-
видимому, частично являются следствием отщепления сольвати-
рующих молекул воды от высокозарядных ионов Ni
2
+ и Ox
2
- (или
* Общая тенденция к увеличению прочности пяти- и шестичленных циклов
была отмечена еще Л. А. Чугаевым и известна в отечественной литературе под
названием «правила циклов Чугаева».— Прим. ред.
Устойчивость координационных соединений
111
Таблица 2.5
Устойчивость пяти- и шестичленных хелатных комплексов
3
при 25
0
C [8, 50]
Ni
2
+ + L
n
- ч—>- NiL
(2
-"'+
Ni
2
+ + L
n
- IgX
АН, ккал/моль
AS, кал • моль—1 • град—1
Ni
2
++Ox
2
-
5,2
0,15
24,2
Ni
2
+ + Mal
2
"
4,1
1,88
25,0
Ni
2
+ -J- Gly-
6,2
—4,14 14,4
Ni
2
+ -J- P-Ala-
4,7
—3,81
10,2
Ni
2
+ + en
7,7 —9,05
4,0
Ni
2
+ -J- рп 6,3
—
—
а
Сокращения: оксалат (Ox
2
-); малонат (Mal
2
-); глицинат (Gly-); (5-аланинаг (P-Ala-);
этилендиамин (en); 1,3-пропилендиамин (рп).
Таблица 2.6
Устойчивость комплексов полидентатных лигандов
3
с Ni
2
+ при 25
0
C
Ni
2
+ -J- L"- <—>- NiL<
2
-«>+
Ni
2
+ + L
n
-
IgK
АН, ккал/моль
AS, кал - моль—1 • град—1
Ni
2
+ + Gly-
6,2
—4,14
14,4
Ni
2
+ + IMDA
2
"
8,0
—5,05
20,0
Ni
2
+ -J- NTA
3
-
11,3
-2,53
44,0
Ni
2
+ -J- еп 7,7
—9,05
4,0
Ni
2
+ -J- dien
10,5
—11,85 8,5
Ni
2
+ trien 13,7
—14,00 16,0
а
Сокращенные обозначения лигандов см. в подписи к рис. 2.9.
Mal
2-
) при образовании нейтрального комплекса NiOx. В случае
моноаминоацидатов имеет место нейтрализация меньших зарядов.
Число хелатных колец. Если принять во внимание хорошо уста-
новленный хелатный эффект для бидентатных лигандов, то не
является неожиданным тот факт, что лиганд с большим числом
хелатных колец будет давать еще более устойчивые комплексы.
При этом предполагается, что геометрия лиганда и иона металла
разрешают координацию всех донорных атомов. Из рис. 2.9 вид-
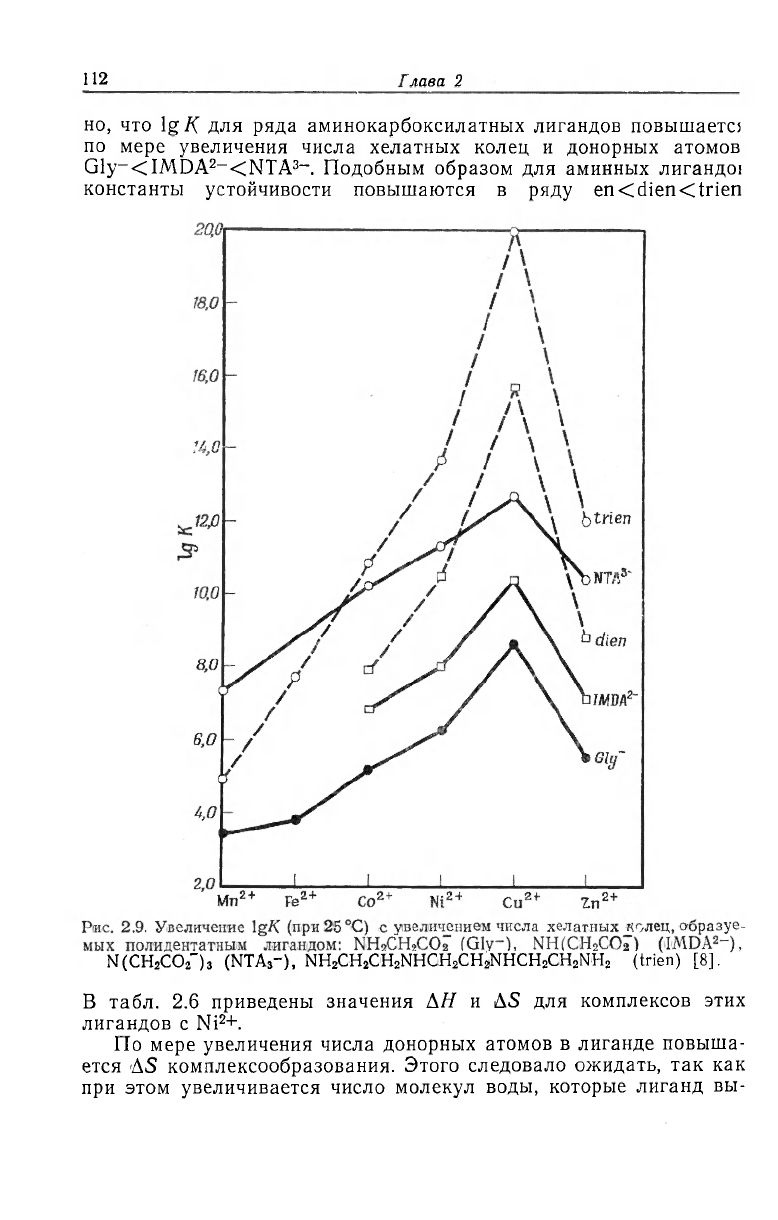
112
i лава 2
но, что Ig К для ряда аминокарбоксилатных лигандов повышаете:
по мере увеличения числа хелатных колец и донорных атомов
Gly-<IMDA
2
~<NTA
3_
. Подобным образом для аминных лигандо!
константы устойчивости повышаются в ряду en<dien<trien
N (CH
2
CO
2
-
) з (NTA
3
-), NH
z
CH
2
CH
2
NHCH
2
CH
z
NHCH
2
CiH
2
NH
2
(trien) [8].
В табл. 2.6 приведены значения AH и AS для комплексов этих
лигандов с Ni
2
+.
По мере увеличения числа донорных атомов в лиганде повыша-
ется AS комплексообразования. Этого следовало ожидать, так как
при этом увеличивается число молекул воды, которые лиганд вы-
