Чемерис М.М., Люкшова Н.В., Мозуленко Л.М. Органическая химия.Часть 1
Подождите немного. Документ загружается.

151
Общий выигрыш в энергии между двумя альтернативными ре-
акциями 1 и 2 составляет 36
ккал/моль (150,72 кДж/моль) и равна
энергии резонанса. Это является основной причиной протекания ре-
акции 2, а не 1. В общем случае стадией, определяющей скорость ре-
акции при электрофильном замещении, является образование σ-
комплекса (самая медленная стадия).
3.6.5.1.1.
Ориентирующее влияние заместителей
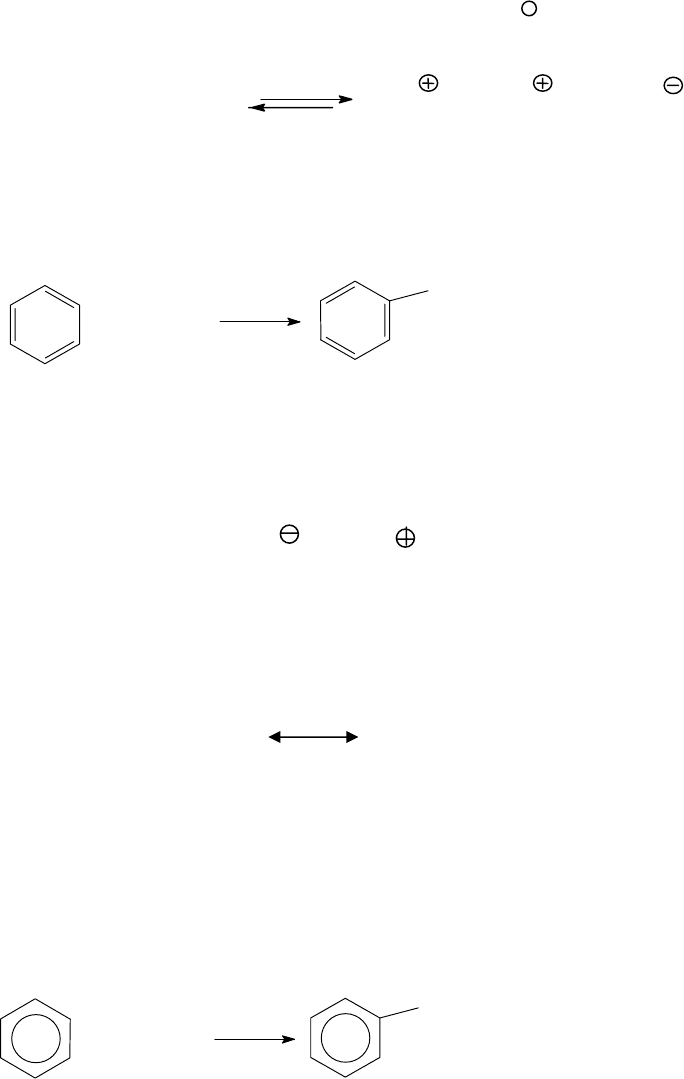
Если реакции электрофильного замещения проводят с моноза-
мещенным бензолом, то вступающая группа может занимать
орто-,
мето- или пара- положение по отношению к имеющемуся заместите-
лю. Причем реакция может протекать быстрее или медленнее по срав-
нению с незамещенным бензолом.
Достоверно установлено, что положение входящей группы, а
также относительная реакционная способность замещенных аренов,
по сравнению с бензолом, характерным образом определяются уже
имеющимися заместителями. Различают заместители первого и второ-
го рода.
Заместители первого рода, как правило, активируют бензольное
ядро и облегчают преимущественно (региоселективно) замещение в
орто- и пара- положения. К заместителям первого рода относятся
атомы или группы атомов, проявляющие электронодонорные свойст-
ва. Например:
O
;
O
H
O
R
;
N
R
2
N
H
R
;
;
N
H
2
;
;
O
N
H
C
R
;
S
H
+
M
>
I
C
H
3
;
C
2
H
5
;
C
H
3
;
C
C
H
3
H
I
C
H
3
C
C
H
3
C
H
3
+
M
г
+
I
+
Исключительное положение занимают галогены, у которых замес-
тители ориентируют
о-
и
n-
положения, благодаря своему
+М
- эф-
фекту. Однако, из-за своего
-I
эффекта они затрудняют прочие заме-
щения.
и другие алкильные
группы
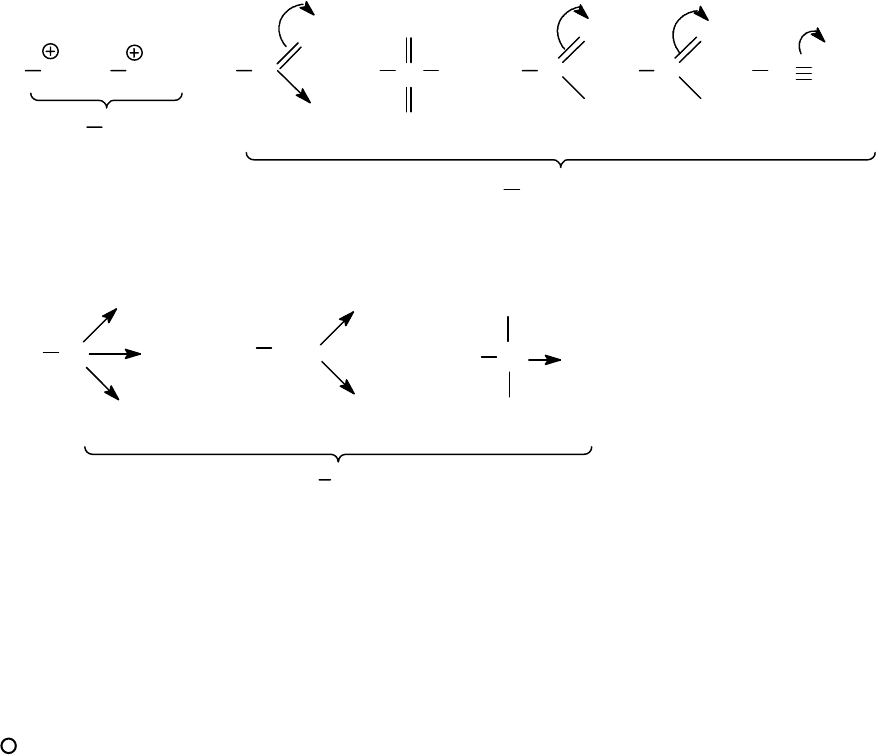
152
-F, -Cl, -Br, -I -I > +M
Заместители второго рода дезактивируют бензольное ядро, за-
трудняют электрофильное замещение и направляют вновь входящий
заместитель в
м-
положение.
Как правило, это заместители, обладающие
–I
и (или)
-М
- эф-
фектами. Отличительным признаком этих заместителей является на-
личие у атома, соседствующего с атомом углерода бензольного коль-
ца, положительного заряда, либо недостатка электронной плотности,
например:
N
H
3
;
N
R
3
;
N
O
O
δ
δ
+
-
;
S
O
O
H
O
δ
+
δ
-
I
I
C
;
O
R
δ
+
δ
-
C
O
H
δ
+
δ
-
;
C
;
N
δ
δ
-
+
,
-
M
NO
2
;
δ
δ
+
-
δ
-
I
Cl
C
δ +
δ
-
CH
H
δ
+
δ
-
;
Cl
Cl
Cl
Cl
δ
-
C
H
δ
-
Как уже отмечалось стадией, определяющей скорость электро-
фильного замещения, является образование
σ
-комплекса. Следова-
тельно, легкость протекания замещения по тому или иному положе-
нию в бензольном кольце будет зависеть от стабильности соответст-
вующих арениевых ионов.
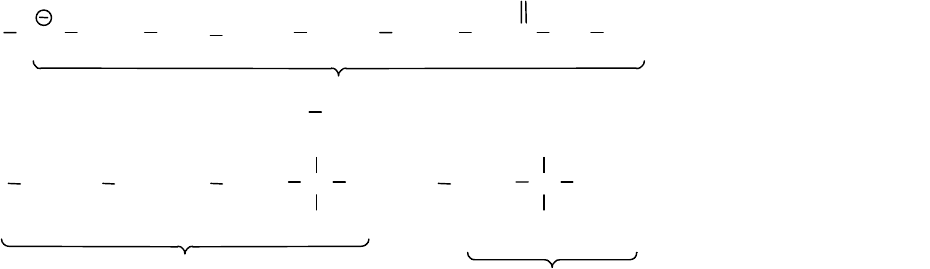
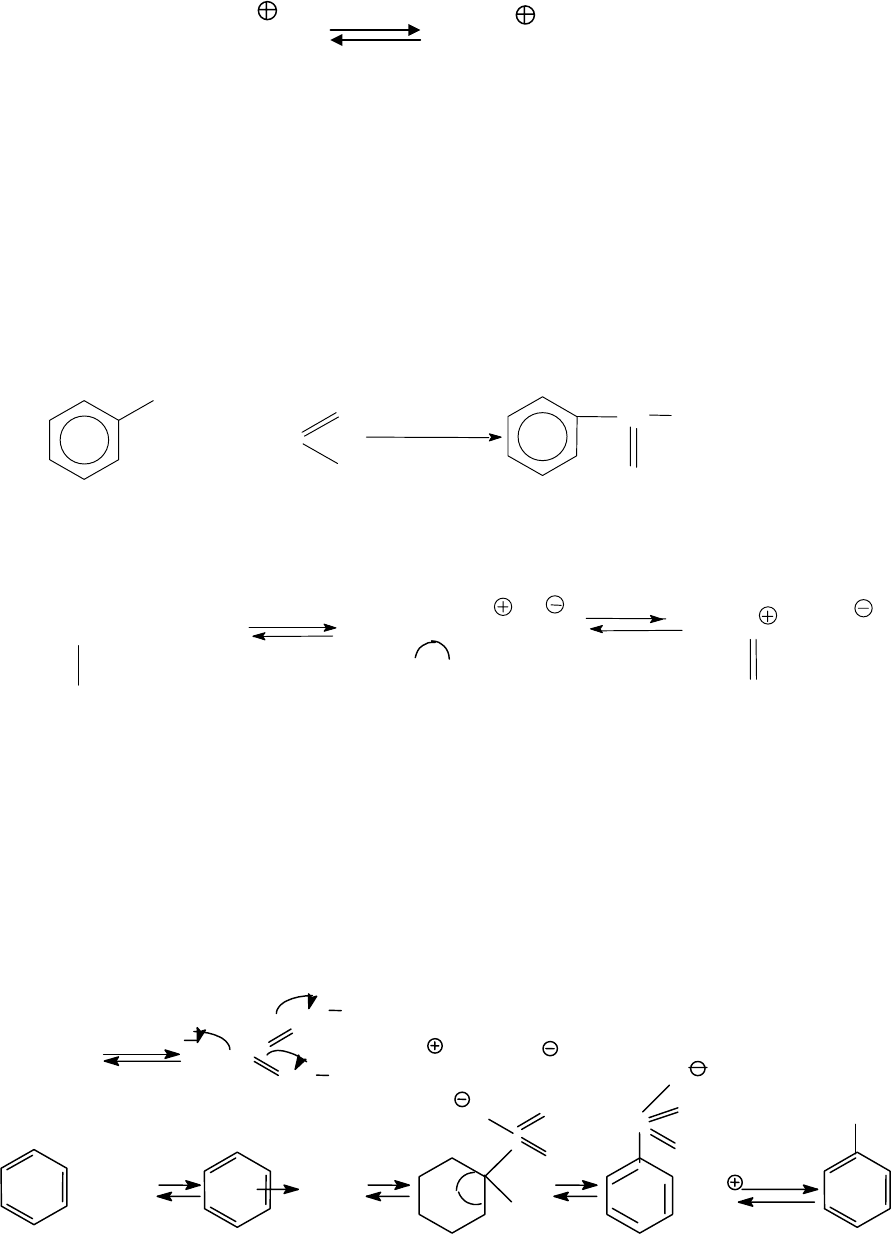
Если в реакцию вводить монозамещенный бензол, содержащий
заместитель А, и подвергнуть его действию электрофильного агента
Х
+
, то возможно образование трех
σ
-комплексов, каждый из которых
может быть представлен в виде предельных структур (1-9).
При рассмотрении устойчивости
σ
-комплексов на конкретных
примерах мы убедимся в том, что не все эти предельные структуры
обладают одинаковой устойчивостью (стабильностью), кроме того у
этих предельных структур возможны и другие предельные структуры
153
с участием в резонансе уже имеющегося заместителя в бензольном
кольце.
(1) (2) (3)
A
+ X
X H
A
σ
-
комплекс
n-
замещения
+
A
H X
H X
A
H X
A
X
H
A
o-
заме
-
-
ком
-
σ
A
H
X
X
H
A
+
A
H
X
(4) ( 5) (6)
X
H
A
+
A
H
X
X
H
A
X
H
A
H
X
A
1
3
3
1
3
1
X H
1
3
1
3
1
3
A
1
3
1
3
3
1
X
H
A
плекс
щения
щ
ения
плекс
σ
-
ком-
o-
заме-
Рассмотрим строение
σ
-комплексов при электрофильном замеще-
нии производных бензола, содержащих заместитель первого рода, на-
пример, -ОН-группу.

154
Как при
о
- и
n-
замещении так и при
м-
замещении, ядро в
σ
-
комплексе несет положительный заряд. Электронодонорные замести-
тели в любом случае стабилизируют
σ
-комплекс по сравнению с бен-
золом и, таким образом, увеличивают скорость реакции. Для обра-
зующихся в случае фенола
σ
-комплексов
о-
и
n-
замещения наряду с
приведенными выше предельными структурами (1 и 9) можно изобра-
зить предельные структуры (10 и 11), в которых положительный заряд
дополнительно делокализуется с участием гидроксильной группы. За
счет такой дополнительной делокализации, невозможной в
σ
-
комплексе
м-
замещения,
σ
комплексы
о-
и
n-
замещения стабилизиро-
ваны дополнительно так, что региоселективно образуются
о
- и
n
- за-
мещенные соединения.
Аналогично объясняется
о-
и
n-
ориентирующее влияние для дру-
гих заместителей первого рода, в том числе галогенов, для
σ
-
комплексов которых (
о
- и
п
-замещения) возможно образование до-
полнительных структур (12 и 13)
:
Hal
..
H
X
H
..
:
Hal
:
..
H
(12) (13)
Для галогенов
–I
эфф.
> +M
эфф.
, поэтому бензольное кольцо де-
зактивируется в реакциях электрофильного замещения, однако, за
счет
+М
эффекта Hal участвует в дополнительной делоколизации
σ
-
комплекса в
о
- и
n-
замещениях, образуя резонансные структуры 12 и
155
13 подобных структурам 10 и 11
σ
-комплексах фенолов. Итогом
влияния
–I
и
+M
эффектов галогена в галогена в галогенарилах в ре-
акциях электрофильного замещения является меньшая скорость реак-
ции по сравнению с бензолом и тем более фенолом. Однако региосе-
лективно будут образовываться
о-
и
n-
замещенные галоидарилы.
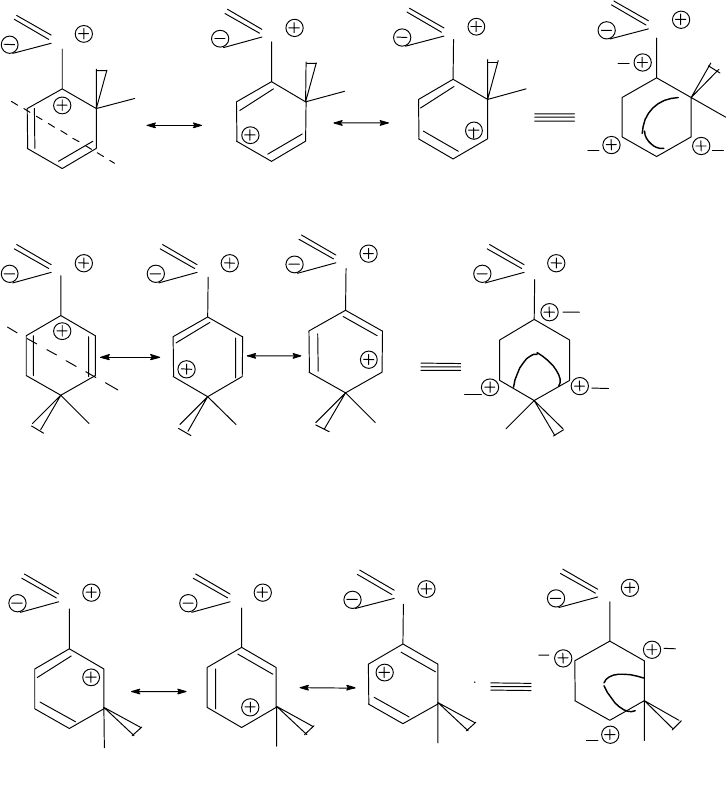
Теперь на примере нитробензола рассмотрим электрофильное за-
мещение производных бензола, содержащих заместители второго ро-
да.
O
O
N
O
O
N
O
O
N
N
O
O
пара-
σ
-
комплекс
O
O
N
H
X
1
3
3
1
3
1
3
1
3
1
3
1
X H
O
O
N
N
O
O
орто-
σ
-
комплекс
O
O
N
X
H
H
X
(1'') (3'') (4'')
X
H
H X
H X
H X
(4'') (5 '' ) (6'')
(7
'') (8'') (9'')
H
X
X
H
X
H
H
X
1
3
3
1
3
1
мета-
σ
-
комплекс
N
O
O
O
O
N
O
O
N
O
O
N
Все предельные структуры
σ
-комплекса для
о-; n-
и
м-
заме-
щения могут быть стабилизированы только за счет делокализации по-
ложительного заряда по
π
,
π
-сопряженной системе. Такая делокали-
зация будет менее эффективна в случае
орто-
и
пара
- замещения, так
156
как в каждом из этих двух случаев одна из структур соответственно
(1
″
и 4
″
) будет нести положительный заряд на атоме углерода, кото-
рый уже связан с положительно заряженным атомом азота, что энер-
гетически явно невыгодный.
Для
σ
-комплекса
мета-
замещения это ограничение отсутствует,
и он должен быть более устойчивым. Скорость образования
м
- изоме-
ра по сравнению с
о-
и
n-
изомерами должна быть самой высокой и
его концентрация в реакционной смеси, следовательно, максималь-
ной. Однако, следует иметь при этом ввиду, что все три
σ
-комплекса,
возникающие при электрофильном замещении нитробензола стабили-
зированы значительно слабее, чем
σ
-комплекс бензола и тем более
фенола и поэтому атака даже в
мета-
положение для нитробензола
осуществляется с трудом.
Теперь мы можем сформулировать еще одно отличие заместите-
лей второго рода от заместителей первого рода. Заместители второго
рода не могут принимать участие в резонансной стабилизации
σ
-
комплексов за счет дополнительной делокализации положительного
заряда с участием заместителя. Наоборот, заместители второго рода
σ
-комплекс дестабилизируют.
Завершая рассмотрение ориентирующего влияния заместителей,
необходимо отметить, что хотя заместители и подразделяются для
удобства на два класса (
о, n-
или
м-
ориентанты), практически суще-
ствует очень мало реакций, в которых образовались бы только
о-, n-
или
м-
замещенные продукты. Большинство реакций приводит к по-
лучению всех трех изомеров. Речь может только идти о том, какие из
изомеров (
о-, n-
или
м-)
образуются преимущественно. Кроме того
о-,
n-
часть продуктов реакции редко состоит точно из 67% - орто- и 33%
-
пара-
продуктов, как это должно быть согласно статистическому
распределению. Причиной этому служат, в основном, стерические
факторы как реагента, так и субстрата, ибо атака электрофилом
о-
положения
встречает большие стерические затуднения, чем
п-
положения. Иногда разграничение между
о-, n-
и
м-
ориентациями
при электрофильном замещении сделать трудно (см. табл.3)

157
Таблица 3
Результаты нитрования монозамещенных бензола С
6
Н
5
-А
А Элект-
ронное
влия-
ние
К
ОТН.
орто
%
мета
%
пара
%
Условия нитро-
вания
-NO
2
-I; -M 10
-6
6,4 93,3 0,3
-
+
N(CH
3
)
3
-I ~10
-5
0 89 11
-CHO -I; -M 19 72 9,0
-C
≡
N
-I; -M 17 81 2,0
-CCl
3
-I 6,8 64,5 28,7 HNO
3
+ H
2
SO
4
-CH
2
NO
2
-I 0,12 22,2 53,1 24,7
-CH
2
C
≡
N
-I; +M
г
0,35 22,0 20,7 57,3
-CH
2
OCH
3
-I; +M
г
0,45 28,6 18,1 53,3
-CH
2
Cl -I; +M
г
0,72 34,4 14,1 51,5
-Cl -I; +M 0,031 29,6 0,9 69,5 CH
3
-C-ONO
2
-Br -I; +M 0,028 36,5 1,2 62,4
-I -I; +M 0,22 38,3 1,8 59,7 O
-O-Ph -I; +M 157 50 - 50 в уксусн. ангид-
-NH-Ph -I; +M 4,43
.
10
6
71 - 29 риде при 25
0
С
-CH
3
+I; +Mг 27,2 61,4 1,6 37
-C
2
H
5
+I; +Mг 22,8 45,9 3,3 50,8 HNO
3
в уксус-
изо -C
3
H
7
- +I; +Mг 17,7 28,0 4,5 67,5 ном ангидриде
трет -С
4
H
9
- +I 15,1 10,0 6,8 83,2 при 0
0
С
3.6.5.1.2. Некоторые реакции электрофильного замещения
Поскольку механизм реакций электрофильного замещения нами
рассмотрен, приведем лишь условия реакций и способы образования
электрофилов.
3.6.5.1.2.1.Нитрование
+ HNO
3
(к.)
H
2
SO
4
NO
2
+ H
2
O
158
Электрофильной частицей является NO
2
+
- нитроний - катион,
образование которого можно представить следующей схемой:
HNO
3
+ 2H
2
SO
4
NO
2
+ H
3
O + 2HSO
4
3.6.5.1.2.2. Галогенирование аренов
+ Hal
2
Al(Hal)
3
Hal
+ HHal
Hal = Cl, Br
Образование электрофильной частицы в реакции хлорирования в
присутствии хлорида алюминия:
Cl
2
+ AlCl
3
⎯→
Cl + AlCl
4
Некоторые авторы трактуют галогенирование через образование
поляризованной молекулы галогена с AlCl
3
.
Cl - Cl + AlCl
3
Cl
δ+
- - Cl - -
δ
AlCl
3
Образовавшийся активированный комплекс является достаточно
активным для атаки ароматического кольца. Кроме хлоридов алюми-
ния могут быть взяты хлориды Fe
3+
и Zn
2+
и другие кислоты Льюиса.
3.6.5.1.2.3.
Алкилирование по Фриделю - Крафтсу
+ R -X
AlX
3
R
+ Н-X
где Х= F, Cl, Br, I
В качестве катализаторов кроме галогенидов Al могут быть взяты
галогениды Fe
(III), Zn
(II) , BF
3
и другие кислоты Льюиса .
Существует несколько мнений относительно того, в каком виде
вступает в реакцию электрофильная алкилирующая частица:
а) поляризованного комплекса:

159
R-X + AlX
3
R
δ
+
- - - X - - - - Al(X)
δ
−
3
б) ионной пары
R-X + AlX
3
R AlX
4
в) карбокатиона
+ AlX
4
R
R-X + AlX
3
Все эти три реакции можно рассматривать как равновесные ста-
дии одного и того же процесса.
В процессе алкилирования возможна изомеризация алкильной
группы:
AlCl
3
ArH + CH
3
- CH
2
- CH
2
Cl ⎯⎯→ Ar - CH
2
- CH
2
- CH
3
Ar - CH - CH
3
⏐
CH
3
(преимущественный
продукт)
Это связано с тем, что при образовании электрофильной частицы
пропилкатион (1) будет превращаться в более стабильный изопро-
пилкатион(2):
СН
3
- СН
2
- СН
2
Cl + AlCl
3
⎯⎯→ CH
3
CH
2
-CH
2
⎯→ СН
3
– С Н - СН
3
-AlCl
3
3.6.5.1.2.4. Алкилирование бензола и его гомологов спиртами
и алкенами
Такие реакции протекают в присутствии сильных минеральных ки-
слот:
H
2
SO
4
; H
3
PO
4
; HF+BF
3
CH
3
- CH
2
- CH
2
OH + H CH
3
-CH
2
-CH
2
CH
3
-C H - CH
3
-Н
2
О
160
CH
3
- CH = CH
2
+ H CH
3
– C H - CH
3
Образующиеся карбокатионы атакуют бензольное кольцо по ме-
ханизму электрофильного замещения.
3.6.5.1.2.5.
Ацилирование по Фриделю – Крафтсу
Это реакция взаимодействия галогенангиридов или ангидридов
карбоновых кислот с аренами в присутствии кислот Льюиса (AlX
3
;
FeX
3
; ZnX
2
; BX
3
и т.д.), где Х= Наl.
H
+ CH
3
- C
O
Cl
AlCl
3
- HCl
C
CH
3
O
Образование электрофильной частицы можно представить сле-
дующим образом:
Cl
O
- C =
CH
3
..
..
+ AlCl
3
..
CH
3
- C =
O -
Cl
AlCl
3
CH
3
- C
O
:
+ AlCl
4
3.6.5.1.2.6. Сульфирование
Сульфирование аренов проводят концентрированной (дымящей)
H
2
SO
4
, а также триоксидом серы в пиридине или диоксане. Из много-
численных данных следует, что электрофильным реагентом является
триоксид серы.
2
H
2
S
O
4
O
=
S
O
O
δ
δ
δ
δ
+
+
H
3
O
+
H
S
O
4
+
S
O
3
δ
+
S
O
3
δ
+
+
S
O
O
O
H
+
S
O
O
O
H
быстро
быстро
S
O
3
H
