Чемерис М.М., Люкшова Н.В., Мозуленко Л.М. Органическая химия.Часть 1
Подождите немного. Документ загружается.

141
бензоидного типа (тиофен, пиридин, тропилиевый катион, циклопен-
тадиенильный анион, хинолин, карбазол и другие подобные им со-
единения), в которых протоны находятся только на периферии кольца.
Совершенно очевидно, что протоны соединений типа [14] аннуле-
на и [18] аннулена, будут попадать в разные участки конуса анизотро-
пии: [14] аннулен в ПМР - спектре содержит 2 сигнала, один в
области
7,.6
м.д. (для десяти периферийных протонов) и другой в области
0,00
м.д. для четырех внутренних протонов; [18] аннулен также со-
держит 2 сигнала, один в области 9
м.д. (для 12 периферийных прото-
нов) и другой в области -3.0
м.д. для (6 внутренних протонов).
Таким образом, исходя из сказанного, ароматичность можно опре-
делить как способность создать сильный кольцевой ток. Соединения,
обладающие такой способностью, называются диатропными. Экспе-
риментально принадлежность к ароматическим соединениям опреде-
ляется по наличию сигнала дезэкранированных протонов в области от
6 до 9
м.д.
Чтобы циклическое соединение обладало ароматическими свойст-
вами, не обязательно, чтобы все его атомы лежали в одной плоскости.
Об этом мы уже говорили на примере 1,6-метано-[10] аннулена. Важ-
но, чтобы взаимодействующие орбитали были достаточно копланарны
для создания под воздействием магнитного поля непрерывного коль-
цевого тока. Это наглядно демонстрируется на примере гомотропиле-
вого катиона.
3
5
H
H
а
7
H
4
6
H
2
H
H
+ H
+
b
1
(12) (13)
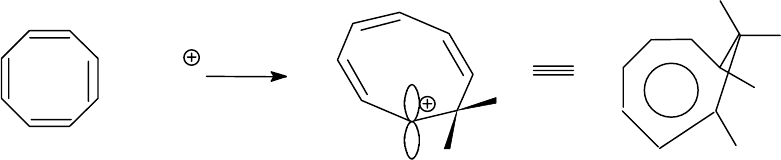
При растворении циклооктатетраена (12) в концентрированной
серной кислоте к одной из двойных связей присоединяется протон и
образуется гомотропилевый катион (13).В этом соединении аромати-
ческий секстет принадлежит семи углеродным атомам. Восьмолй
sp
3
-
гибридизованный атом углерода выведен из плоскости молекулы и не
участвует в ароматической системе.
Спектр ПМР показывает на принадлежность этого соединения к
диатропным. Он содержит четыре сигнала (6,4
м.д., принадлежит про-

142
тонам 1 и 7; 8,5 м.д., принадлежит протонам 2-6; 0,3 м.д. и 5,1 м.д.
принадлежат соответственно протонам Н
b
и Н
а
)
.
Протон Н
b
сильно экранируется, так как попадает в положитель-
ную часть конуса анизотропии.
Таким образом, чтобы отнести соединение к ароматическому, не-
обходимо соблюдение следующих факторов:
1) наличие магнитного
кольцевого тока; 2) равенство или приблизительное равенство
межатомных расстояний за исключением тех случаев, когда сим-
метрия системы нарушена присутствием гетероатома или по дру-
гой причине; 3) копланарность; 4) химическая устойчивость; 5)
способность вступать в реакции ароматического замещения.
Из большой группы ароматических углеводородов в этой главе
мы более подробно остановимся на бензоле и его производных.
3.6.2. Номенклатура моноядерных аренов
По номенклатуре IUPAC бензол называется бензеном, а его про-
изводные правильнее называть как производными бензена.
Однако в России, Германии и некоторых других странах сохрани-
лось привычное название бензол, хотя оно и содержит характерное
для спиртов и фенолов окончание -
ол.
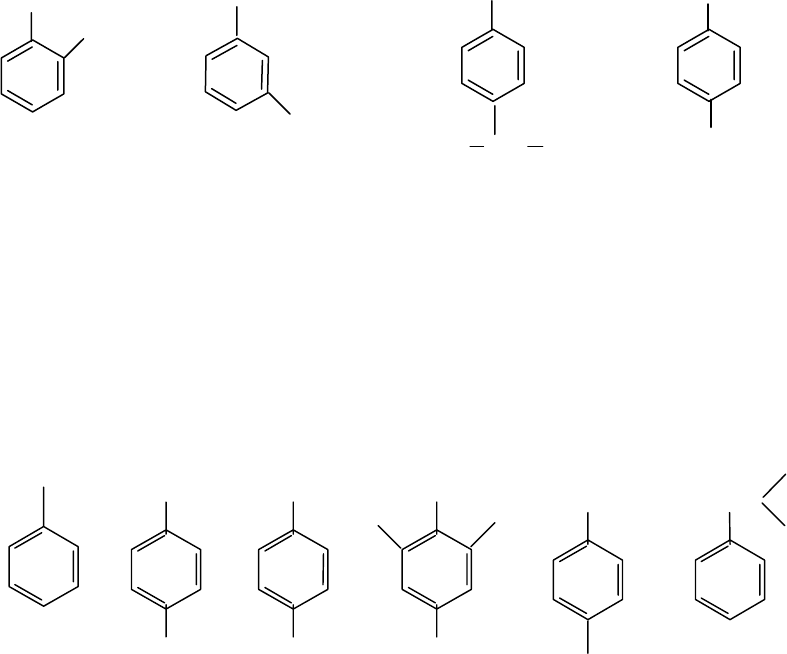
Для производных бензола широко употребляются некоторые три-
виальные названия:
CH
3
CH CH
3
CH
3
CH
3
CH
3
H
3
C
CH = CH
2
кумол толуол мезитилен стирол
(изопропилбензол) (метилбензол) (1,3,5-триметил- (винилбензол)
бензол)
По систематической номенклатуре производные бензола называ-
ют, указывая цифрой местонахождение заместителя. Если заместите-
лей только два, то вместо цифр 1,2-; 1,3-; 1,4-. могут быть использова-
ны обозначения
о- (орто), м- (мета), п- (пара). Положение заместите-
лей обозначают наименьшими номерами. Если заместитель один -
цифра 1 не ставится.
143
CH
3
CH CH
3
CH
3
CH
3
CH
3
CH
3
CH
3 CH
3
CH
3
о-ксилол; м-ксилол; п-цимол; п-ксилол;
2-диметил- 1,3-диметил- 1-изопропил-
п-диметил-
бензол; бензол; 4-изопропил- бензол;
о-диметил м-диметил- бензол 1,4-диметил-
бензол бензол бензол
При составлении некоторых более сложных производных, осо-
бенно по рациональной номенклатуре, иногда необходимо использо-
вать название ароматических радикалов. Назовем некоторые:
C
H
3
C
H
2
C
H
3
C
H
3
C
H
3
C
H
фенил п-толил бензил мезитил п-фенилен бензилиден
3.6.3. Спектральные характеристики
УФ - спектры: сам бензол имеет спектр поглощения из трех по-
лос: 184
нм (
β
-полоса), 205 нм (р-полоса) и 255 нм (
α
-полоса), убы-
вающие по интенсивности. α-Полоса имеет характерную колебатель-
ную структуру. При введении в бензольное кольцо электронодонор-
ных и электроноакцепторных заместителей все полосы сдвигаются в
длинноволновую область (батохромное смещение). Аналогичный эф-
фект наблюдается и для конденсированных ароматических углеводо-
родов. При введении в бензольное кольцо заместителей, обладающих
сильным -М - эффектом,
р-полоса сдвигается батохромно сильнее,
чем
α-полоса, и перекрывает ее.
ИК - спектры: Арены имеют характеристические полосы погло-
щения в области 1400-1600
см
-1
(3 полосы), относящиеся к колебани-
ям скелета (С-С). Кроме того, ИК-спектр содержит полосу колебаний
связи С
sp
2
- H в области 3000 см
-1
.

144
По полосам деформационных колебаний С-Н связей бензольного
кольца (ниже 900
см
-1
) можно определить тип замещения, например:
монозамещенные -2 полосы в областях 770-730
см
-1
и 710-690 см
-1
;
1,2 - дизамещенные - 1 полоса в области 770-735 см
-1
; 1,3 - дизаме-
щенные имеют 3 полосы в областях 900-800
см
-1
, 810 - 750 см
-1
, 725 -
680
см
-1
; 1,4 - дизамещенные - 1 полоса в области 860 - 800 см
-1
.
ПМР- спектры. Протоны бензола имеют синглет при 7,27 м.д. По-
ложение и форма сигналов протонов замещенных бензолов зависит от
типа замещения, силы и знака индуктивного и мезомерного эффектов
заместителей.
В целом можно сказать, что протоны аренов, в том числе и кон-
денсированных, лежат в области от
6-9 м.д.
3.6.4. Способы получения ароматических углеводородов
Основными природными источниками ароматических углеводо-
родов являются уголь и нефть. При коксовании угля, наряду с коксом,
образуются газообразные продукты и каменноугольная смола, из ко-
торой выделяют ароматические углеводороды. Из одной тонны угля
таким образом можно получить: 900
г бензола, 225 г толуола,
225
г фенола, 900 г крезолов, 2300 г нафталина. Выход бензола невы-
сок, однако коксованию подвергается такое большое количество угля,
что ежегодное производство бензола из каменноугольной смолы дос-
тигает больших размеров.
Из нефти гомологи бензола получают в результате каталитическо-
го риформинга (см. 3.6.4.1.1). Ниже описаны синтетические способы
получения бензола и алкилбензолов.
3.6.4.1. Синтезы из алифатических углеводородов
3.6.4.1.1. Каталитический риформинг алканов
Алканы при температуре 500
0
С (паровая фаза) над катализатором
(молибденовая кислота, оксиды Cr, Al) превращаются в ароматиче-
ские углеводороды. Этот процесс называется каталитическим рифор-
мингом:
+ 4H
R
1
2
t, P
2
2
CH -R
кат.
(CH
2
)
4
CH -R
1
R
145
Реакция используется в промышленности для ароматизации неф-
ти. В настоящее время освоено промышленное производство толуола
из гептановой (С
7
Н
16
) и изомерных ксилолов из октановой (С
8
Н
18
)
фракций нефти.
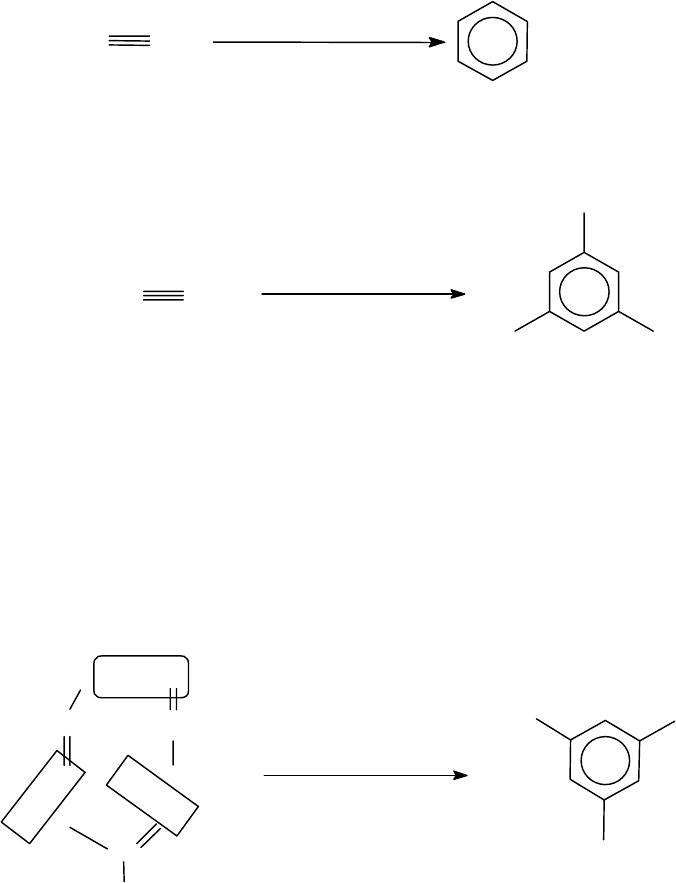
3.6.4.1.2. Тримеризация алкинов
Процесс проводят либо в паровой фазе при температуре 400-
600
0
С, либо в жидкой фазе на катализаторе (комплекс карбонила ни-
куля и трифенилфосфина) (Реппе, 1948 г.):
кат.,60-70
о
С
3CH CH
Монозамещенные алкилацетилены в указанных условиях образуют
преимущественно симметричные триалкилбензолы:
3
3
3
CH
H C
3
кат.,70
о
С
CH - C CH
CH
пропин 1,3,5-триметилбензол
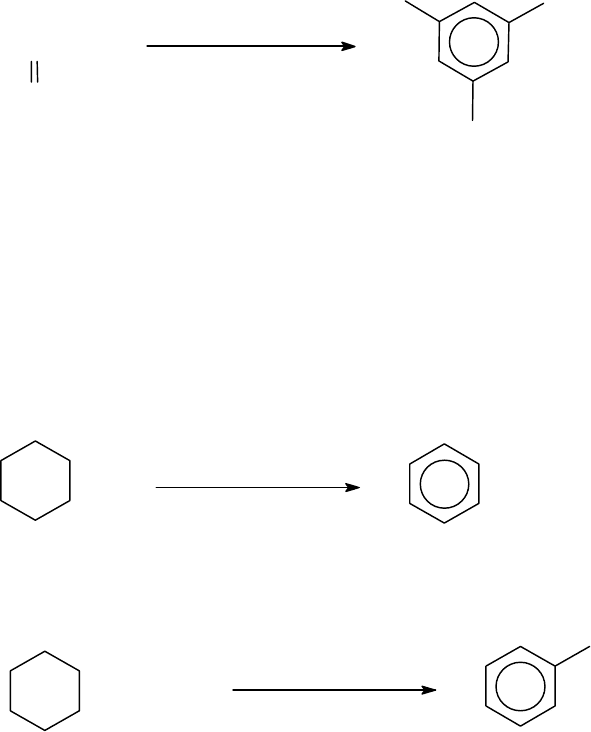
3.6.4.1.3. Конденсация алифатических кетонов
При нагревании трех моль кетона с концентрированной серной
кислотой происходит конденсация их в симметричные триалкилбен-
золы с отщеплением воды:
R
R
2
C - R
R
2
H CH
O
+ 3H
2
O
C
H CH
R
H
2
SO
4
HC Н
2
O
O
R - C
t
о
С
146
Например, ацетон в указанных условиях образует 1,3,5-
триметилбензол:
3
3
H C
CH
3
3
t
о
С
+ 3H O
2
3CH - C - CH
CH
3
H
2
SO
4
O
3.6.4.2. Дегидрирование циклоалканов
Циклогексан и алкилциклогексаны способны отщеплять водород
при нагревании с катализатором при высоких температурах. В качест-
ве катализаторов используют Pt, Pd или Ni, а также Se и S
(Н.Д.Зелинский, 1912 г., Л. Ружичка)
2
H C
CH
2
2
0
CH
2
2
CH
Pd
+ 3H
2
2
бензол
(выход 90%)
циклогексан
CH
300 C
H C
2
H C
CH - CH
2
2
CH
3
2
CH
кат.,t
о
С
+ 3H
2
2
толуол
CH
3
метилциклогексан
CH
H C
3.6.4.3. Синтезы алкилбензолов на основе бензола
3.6.4.3.1.
Алкилирование бензола
Наиболее распространенным методом получения алкилбензолов
является реакция Фриделя-Крафтса. Сущность метода состоит в за-
мещении атомов водорода ароматического кольца алкильными ради-
калами.
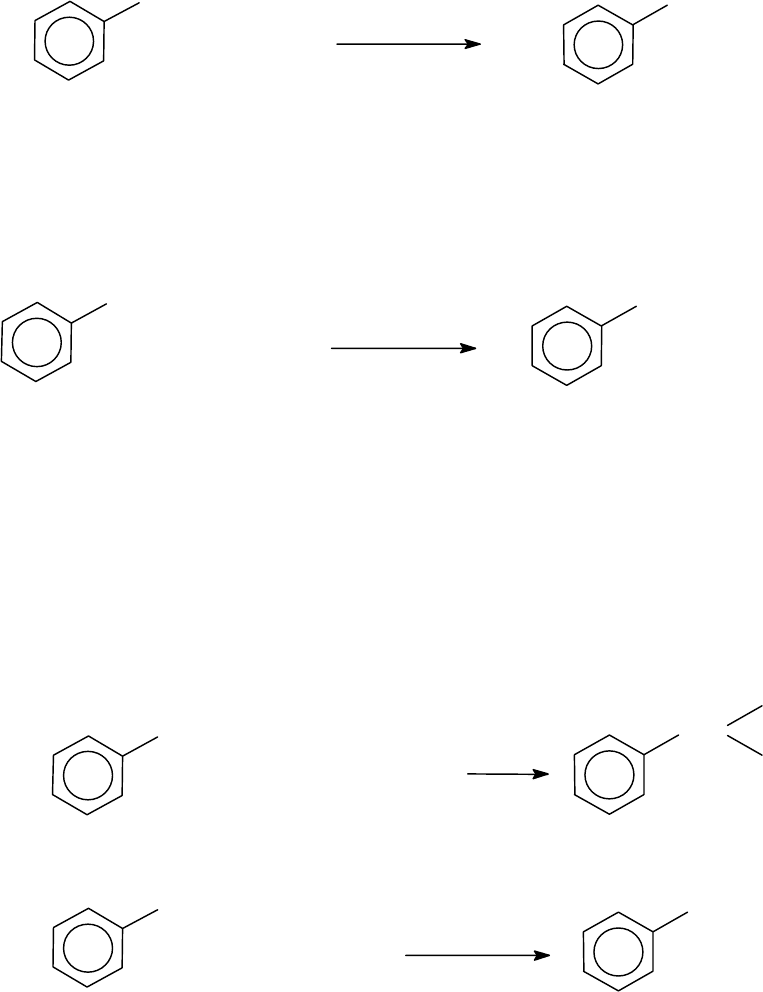
147
+ R - X
кат.
+ HX
H
X = Cl, Br, F, I
R
В качестве алкилирующих агентов чаще всего используются ал-
килгалогениды; в качестве катализаторов используются кислоты
Льюиса – галогениды алюминия, бора, сурьмы, олова, цинка и др.
5
+ C H Br
0
AlBr
2
5
2
+ HBr
бензол
H
C H
3
элтилбензол
выход 83%
0 C
По реакционной способности алкилгалогениды располагаются в
ряд: R-F
>
R-Cl
>
R-Br
>
R-I. Активность катализаторов в реакции
Фриделя-Крафтса убывает в ряду: AlBr
3
>
AlCl
3
>
SbCl
5
>
BF
3
>
BCl
3
>
SnCl
4
>
TiCl
4
>
ZnCl
2
.
Алкилирование бензола можно осуществить также спиртами и
алкенами в присутствии минеральных кислот (H
2
SO
4
, H
3
PO
4
, HF).
Примеры:
3
3
+ CH - CH = CH
0
CH
HF
CH
2
H
CH
3
изопропилбензол (кумол)
0 C
5
+ C H OH
2
4
H SO
2
5
2
+ H O
2
H
C H
этилбензол
Реакция алкилирования аренов осложняется побочными реак-
циями (изомеризация алкильного радикала, образование диалкилбен-
золов и другие). Механизм алкилирования бензола рассмотрен в раз-
деле 3.6.5.1.2.3.
148
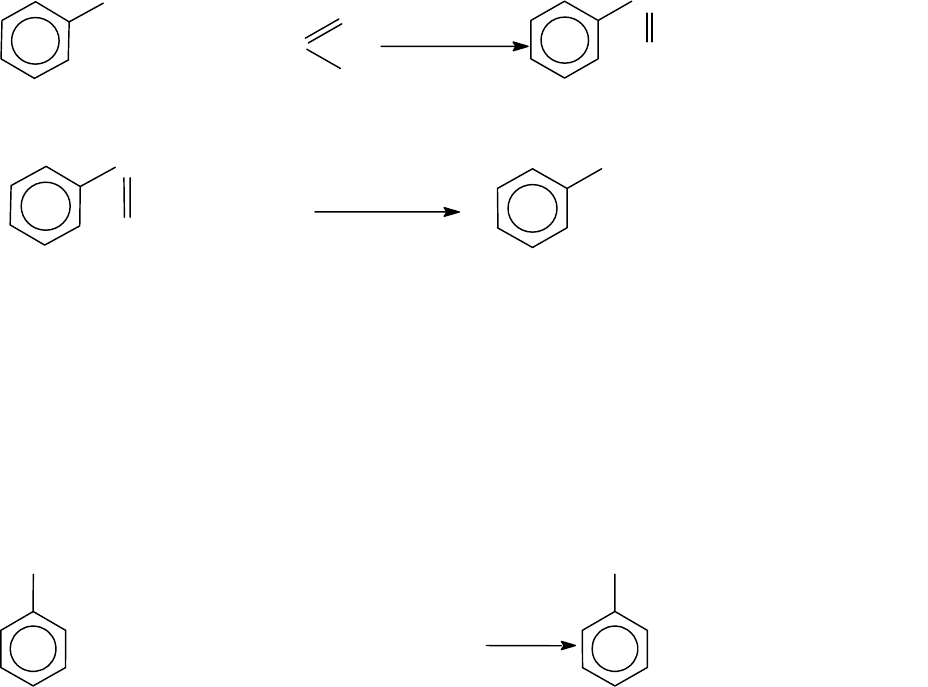
3.6.4.3.2. Получение алкилбензолов с неразветленными
радикалами
Как уже было отмечено, особенностью реакции алкилирования
любыми алкилирующими агентами (см. 3.6.4.3.1.) является изомери-
зация алкильного радикала, поэтому преимущественными продуктами
реакции являются алкилбензолы с разветвленными радикалами.
Алкилбензолы неразветвленного строения получают косвенным
путем: ацилированием бензола по Фриделю-Крафтсу с последующим
восстановлением продукта ацилирования (алкиларилкетона) (амаль-
гамой цинка в соляной кислоте) по Клемменсену.
3
+ CH CH C
2
Cl
AlCl
3
3
+ HCl
2
H
C - CH CH
этилфенилкетон
O
O
3
C - CH - CH
2
HCl
Zn/Hg
2
3
2
CH - CH - CH
пропилбензол
O
3.6.4.3.3. Реакция Вюрца - Фиттига
Эта реакция является модификацией реакции Вюрца в ароматиче-
ском ряду. В синтетических целях реакция Вюрца - Фиттига исполь-
зуется относительно редко. Она позволяет получить алкилбензолы с
неразветвленным радикалом.
3
2
+ 2NaBr
2
2
2
3
Br
2
2
+ CH CH CH CH Br + 2Na
CH CH CH CH
н-б
у
тилбензол
3.6.5. Реакции моноядерных аренов (бензола и его гомологов)
Арены, также как алкены и алкины, обладают нуклеофильным ха-
рактером, но существенное отличие аренов состоит в том, что реакции
+ Н
2
О
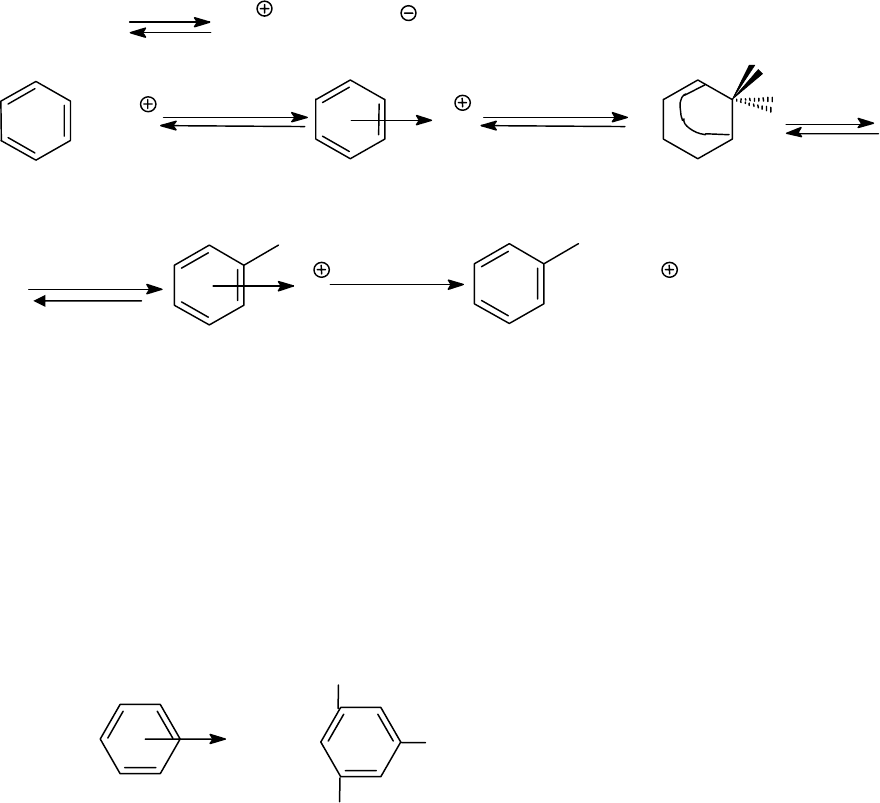
149
присоединения для них идут крайне медленно. Напротив, замещение
атомов водорода электрофильными частицами протекает относитель-
но легко.
3.6.5.1. Реакции электрофильного замещения (S
E
)
При S
E
- реакциях бензольное кольцо атакуется электрофилом,
который может представлять собой либо дипольную молекулу (ред-
ко), либо катион (чаще).
В качестве примера рассмотрим механизм с участием катионидно-
го электрофила:
XY X Y
+
+ X
+
π−
комплекс (1)
быстро
H
σ−
комплекс
X
медленно
X
X
+ H
X
H
быстро
быстро
π−
комплекс (2)
На первой стадии реакции в качестве промежуточного продукта
образуется донорно-акцепторный комплекс (π-комплекс). В этом ком-
плексе ароматическая система бензольного кольца еще сохраняется. В
отдельных случаях π-комплекс удалось идентифицировать спек-
трально, либо выделить. Хорошо известны π-комплексы с пикриновой
кислотой (2,4,6- тринитрофенолом), представляющие собой кристал-
лические соединения, температуры плавления
которых могут служить
для характеристики аренов.
NO
2
NO
NO
2
H - O -
R -
2
На второй стадии π-комплекс переходит в σ-комплекс. В этом
случае уже имеет место образование бензолениевого иона (в общем
случае арениевого иона) с переходного атома углерода в
sp
3
-
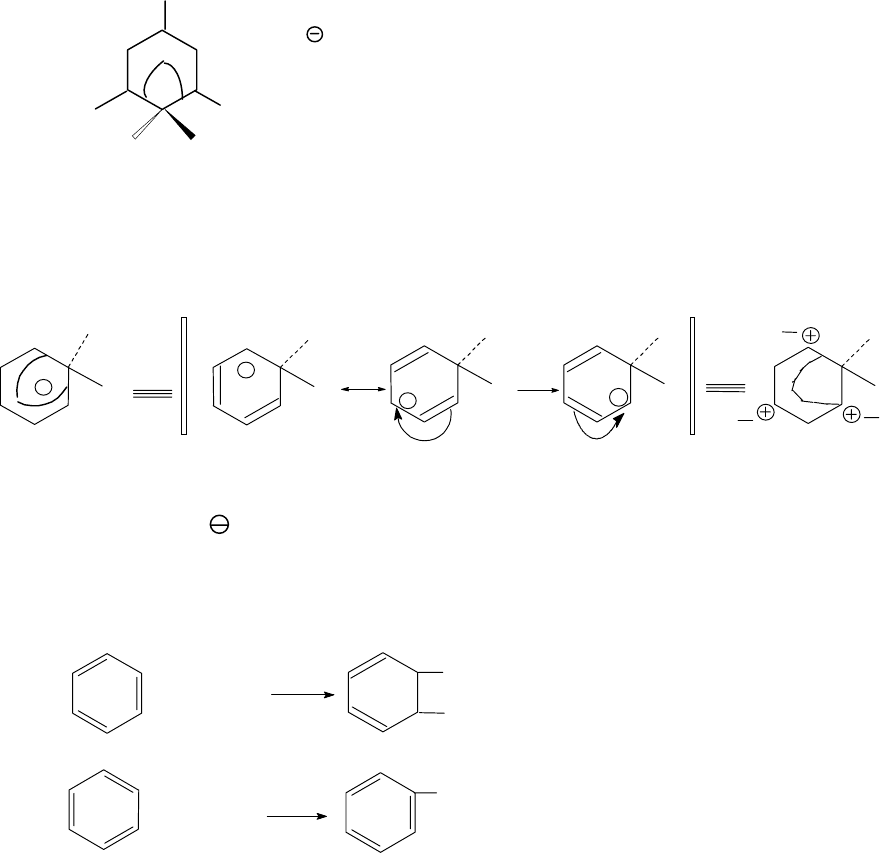
150
гибридное состояние. Ароматическая система нарушена. В этом ком-
плексе 4π-электрона (2 электрона π - системы пошли на образование
связи с электрофилом) делокализованы между пятью атомами угле-
рода.
Энергия стабилизации (резонанса) σ-комплекса ниже, чем у бен-
зола. Она составляет соответственно 108,8 к
Дж/моль и 150,7
кДж/моль.
Тем не менее, σ-комплекс довольно устойчивая система, и часто
σ-комплекс удается выделить. Например, при алкилировании мезити-
лена (1,3,5- триметилбензола) фторэтаном в присутствии фторида бо-
ра при -80
0
С удалось выделить σ-комплекс в виде оранжевого твердо-
го вещества (Тпл. 15
0
С с разложением):
+
C
H
3
C
H
3
C
H
3
H
C
H
3
C
H
2
B
F
4
Высокая устойчивость σ-комплексов вызвана эффективной де-
локализацией положительного заряда вследствие резонансной стаби-
лизации.
+
Н
Х
+
H
X
+
H
X
+
H
X
1
3
3
1
3
1
H
X
Далее σ-комплекс стабилизируется, отщепляя протон под дейст-
вием основания (Y
). Этот процесс энергетически выгоден, поскольку
при этом вновь возникает ароматическая система и высвобождается
энергия резонанса.
+
Х Y
Х
Y
(1)
+
Х Y
Х
+
НY
(2)
