Брунауер С. Адсорбция газов и паров
Подождите немного. Документ загружается.


СМЕШАННА я л л с ОР Б ЦП Я 651
ншо загрязнений, если не имеется других, усложняю-
щих факторов. Работы Олмэнда и его сотрудников
продемонстрировали это положение. Олмэнд и Чап-
лин
[1®]
исследовали вытеснение углекислого газа как
загрязнения из угля с помощью четыреххлористого
углерода, а Олмэнд и Лизиус[''^] изучили вытеснение
сероуглеродом. Количество углекислого газа, вытес-
ненного сероуглеродом, найдено было большим, хотя
теплота адсорбции четыреххлористого углерода боль-
ше. Причиной этого является то, что меньшие молекулы
сероуглерода могут проникать в тонкие поры угля,
куда не может войти молекула четыреххлористого
углерода. Подобные результаты получил Чаплин [1^],
который исследовал вытеснение загрязнений с поверх-
ности угля с помощью четыреххлористого углерода и
цианистого водорода. Эти пары, примененные в отдель-
ности, не могли вытеснять всех загрязнений, но сов-
местно они их вытесняли. Молекулы четыреххлористого
углерода имеют наибольшую теплоту адсорбции и
поэтому—большую способность вытеснять загрязнения,
но они не могут проникать во все поры вследствие
своей величины. Меньшие молекз^лы цианистого во-
дорода могут входить в более узкие поры и очищать их
от загрязнений*.
Измерения скоростей адсорбции бинарных газовых
смесей доставляют дополнительное качественное и по-
луколичественное подтверждение теории Лэнгмюра.
Трайхорн и Виатт["'] исследовали адсорбцию бинар-
ных жидких смесей на угле из паровой фазы. Для на-
чальной стадии адсорбции можно принять, что ско-
рость равна числу молекул, которые ударяются о
поверхность в секунду:
11.
= р31(2т1МКТу!-^, (13)
* Дейц и Глейстин [1®] нашли, что уголь можно привести
к постоянному весу, если образец выдерживается в атмосфере,
насыщенной водяным паром, в течение 18 часов, а затем сушится
в атмосфере гелия при 105°. Малые молекулы воды могут бы-
стро проникать в поры угля, удаляя из них загрязнения; сами
они удаляются затем легко, потому что адсорбция воды на угле
при низких относительных давлениях очень мала (изотерма
типа V).
632
ГЛАВА .ТИТ
где р—давление и М — молекулярный вес пара, а
.5' — поверхность адсорбента. Для бинарной смеси от-
ношение для двух адсорбированных компонентов будет
(14)
если молек}глы адсорбируются тотчас же, как только
они достигают поверхпости. Если х^ выражает моляр-
ное процентное содержание одного из компонентов в
фазе пара, (100—ж^) — то же для другого компонента,
то мы получаем
1^2
•(100 —XI)
(15)
Уравнение (15) содержит допущение о том, что пар-
циальное давление каждого компонента пропорцио-
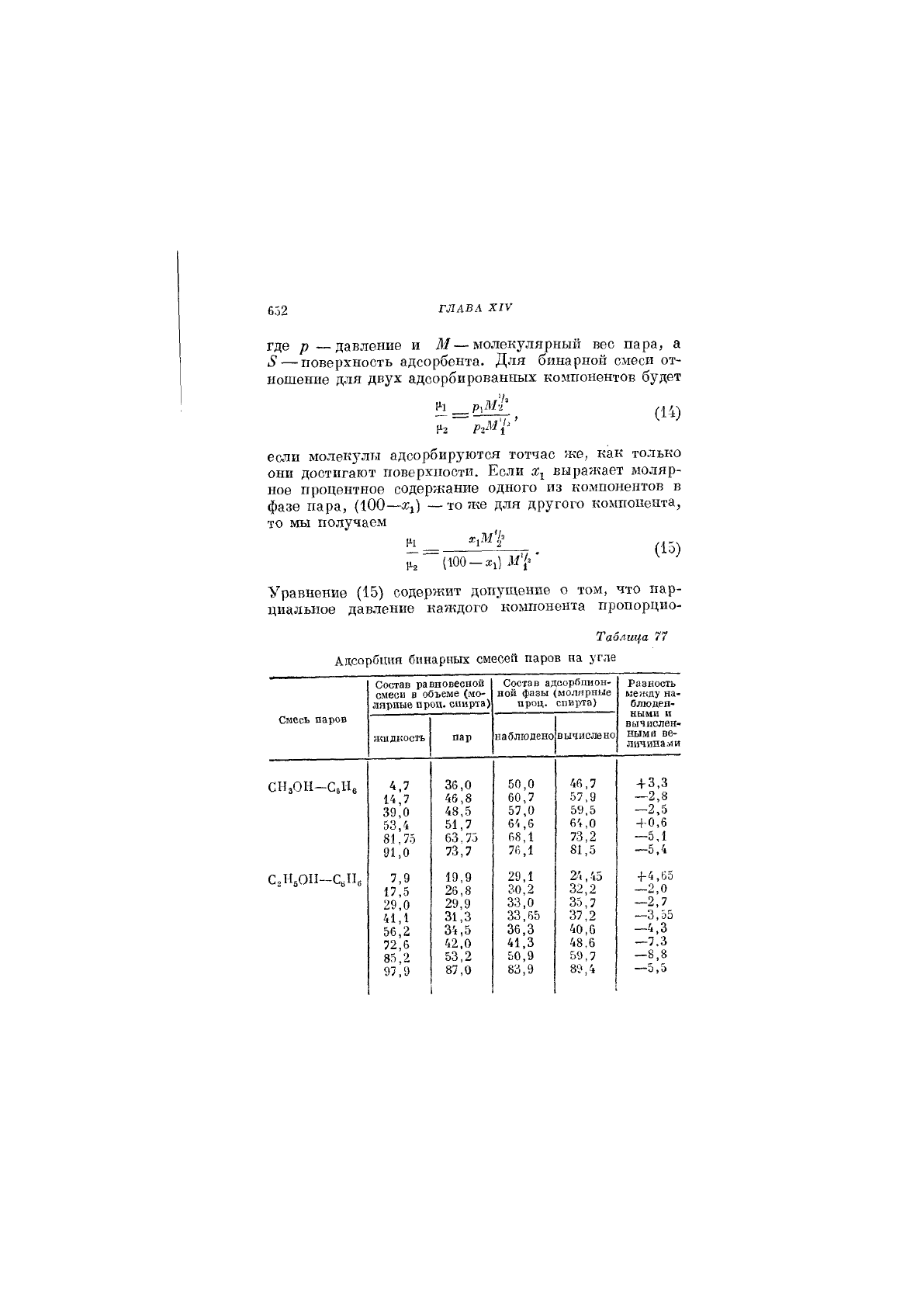
Таблица 77
Адсорбция бинарных смесей паров на угла
Состав равновесной
смеси в объеме (мо-
лярные проц. спирта)
Состав адсорбцион-
ной фазы (молярные
проц. спирта)
Разность
кешду на-
блюден-
ными и
вычислен-
ными ве-
личина .X и
Смесь паров
жидкость
пар
наблюдено
вычислено
Разность
кешду на-
блюден-
ными и
вычислен-
ными ве-
личина .X и
СНзОН-СвНе 4,7
14,7
39,0
53,4
81.75
91,0
36,0
46,8
48,5
51,7
63.75
73,7
50,0
60,7
57.0
64,6
68.1
76,1
46,7
57,9
59,5
64,0
73,2
81,5
+ 3,3
—2,8
-2,5
+ 0.6
-5,1
-5,4
СгН^ОП-С^Пб
7,9
17.5
29.0
41.1
56.2
72.6
85.2
97,9
19,9
26,8
29,9
31,3
34,5
42,0
53,2
87,0
1
29.1
30.2
33,0
33,65
36.3
41,3
50,9
83,9
24,45
32,2
35,7
37,2
40,6
48.6
59.7
89,4
+ 4,65
—2,0
—2,7
•—3,55
-4,3
-7.3
—8,8
—5,5

СМЕША ИНАЯ ЛЛСОРБПИЯ
С53
пально его молярной доле. Это не является вполне
правильным; тем не менее, вычисленные и наблюден-
ные значения состава адсорбционной фазы показывают
удовлетворительное совпадение. Это можно видеть
из табл. 77.
Результаты, полученные для смесей п-пропиловый
спирт — бензол и к-бутиловый спирт — бензол, не
V
800
800
700
600
500
то
300
гоо
100
1
-
со^*
н^
/
/
^—•—
СОг
1
г
ч/
п п
'Нг
и
1
/
10 го
за 40 50
60 V
Рис. 100. Скорость адсорбции углекислого газа и
водорода на угле из смесл 95%Н2-(-а%С02.
V - адсорбция в сл.'; V — объем газа, пропущенного над
адсорбентом, в литрах.
приведены в таблице, они показывают несколько худ-
шее совпадение, чем в случае данных, приведенных в
таблице. Трайхорн и Виатт отметили, что приведенные
в последнем столбце расхождения приближаются к
нулю вблизи состава, соответствующего смесям спир-
тов с бензолом с минимальной точкой кипения. Это
показывает, что, по крайней мере, часть расхождения
обязана отсутствию пропорциональности между пар-
циальным давлением и молярными долями.

654 ГЛАВА .ТИТ
Лоренц И Видбраук[1®] измерили динамическим лгс-
тодом адсорбцию на угле смесей углекисльп! газ — водо-
род. На рис. 160 показаны нолучепные ими кривые ско-
рости при 18° для смесей 95% Нд—5% СОд. Абсцисса
представляет количество газа, проходящего через адсор-
бент, которое пропорционально времени (скорость по-
тока была около 150 с.дг® в минуту). Вначале адсорби-
руется очень мало углекислого газа, в то время как
водород поглощается с большой скоростью. Причиной
этого является то, что водород быстро диффундирует
в поры угля, и поэтому его парциальное давление
вблизи поверхности адсорбента много выше, чем в
газовой смеси. Излом на кривой водорода обязан тому,
что по мере того как приблишаются условия равнове-
сия, некоторое количество водорода вытесняется с
поверхности углекислым газом. Конечное количество
адсорбированного углекислого газа вдвое больше ад-
сорбции водорода, несмотря на то, что парциальное
давление водорода в этих опытах в 19 раз больше, чем
углекисло1^о газа. Это естественно, так как углекислый
газ имеет намного большую теплоту адсорбции, чем
водород.
Отклонения от уравнения Лонгмюра
В предыдз'щем разделе были упомянуты некоторые
опыты, которые не мохут быть объяснены на основе
теории Лэнгмюра, а именно те, в которых адсорбция
0ДН01Ю газа возрастала в присутствии другого газа.
Бергтер[1®] был первым, заметившим, что уголь, ад-
сорбировавший кислород, был способен адсорбировать
азота больше, чем свободный от кислорода уголь. Его
наблюдение не считалось достоверным, пока другие ис-
следователи не получили сходных результатов. Магнус
и Рот[^®] измеряли адсорбцию смесей водород —угле-
кислый газ на угле динамическим методом и получили
кривые, показанные на рис. 161. С ростом содержания
водорода в газовой фазе (в молярных процентах) при
всех температурах адсорбция сначала возрастает со-
гласно закону Генри, затем проходит через максимум
и начинает уменьшаться. Это значит, что адсорбция
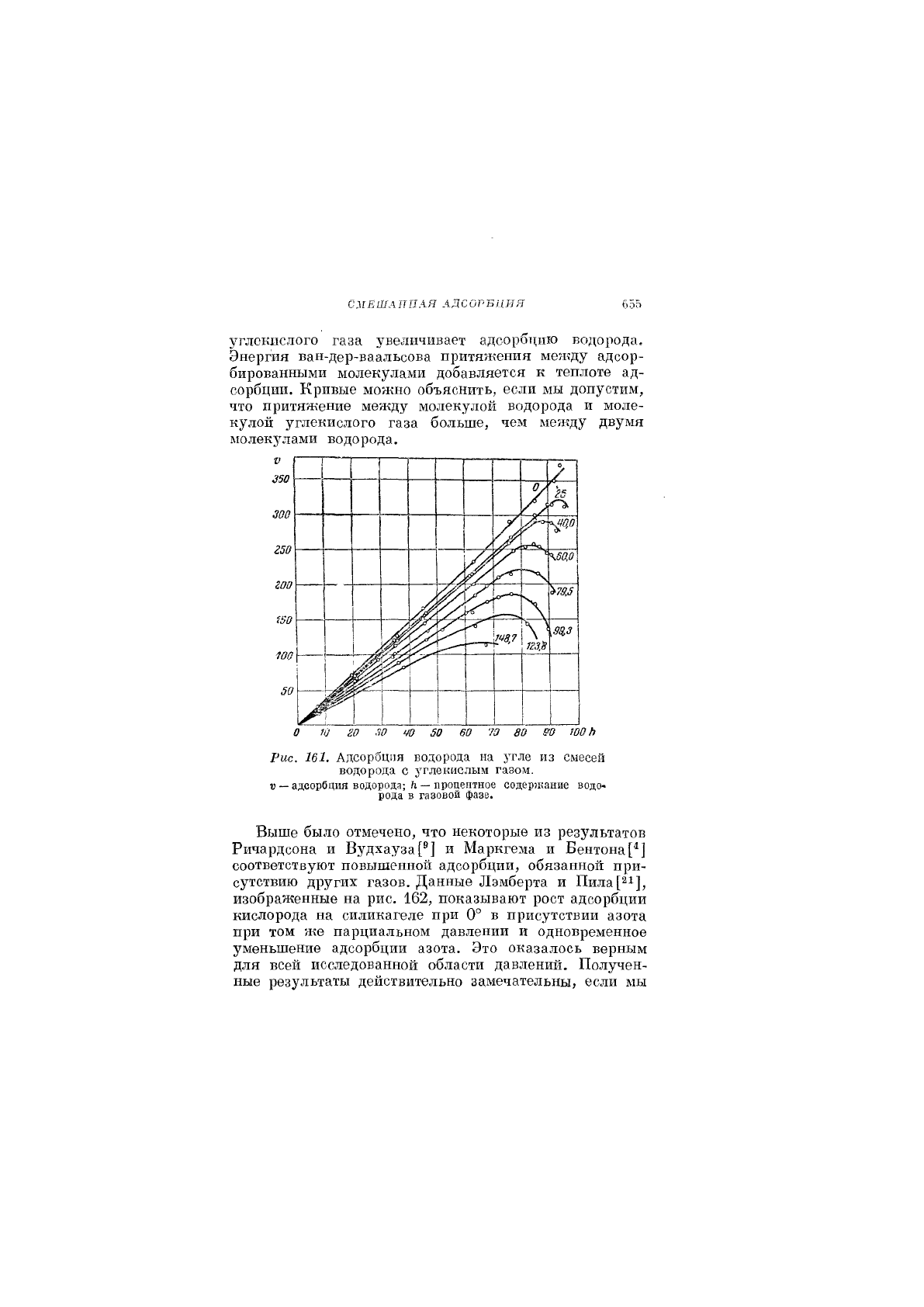
СИЕШАППАЯ АДСОРБЦИЯ 655
углекислого газа увеличивает адсорбцию водорода.
Эиерпш ваи-дер-ваальсова притяжения между адсор-
бированными молекулами добавляется к теплоте ад-
сорбции. Кривые можно объяснить, если мы допустим,
что притяжение между молекулой водорода и моле-
кулой углекислого газа больше, чем между двумя
молекулами водорода.
ъ
у
^0.0
\во.о
л
/ у Л
4
•р-
—•—5-
748,7
1гз:й
м
т
4
•р-
:
о 10 го яо ио 50 60 70 80 ео юо ь
Рис. 161. Адсорбция водорода на угле из смесе1"1
водорода с углекислым газом.
» —адсорбция водорода;
?1
— процентное содержание водо-
рода в газовой фазе.
Выше было отмечено, что некоторые из результатов
Ричардсона и Вудхауза[®] и Маркгема и Бентона[^]
соответствуют повышенной адсорбции, обязанной при-
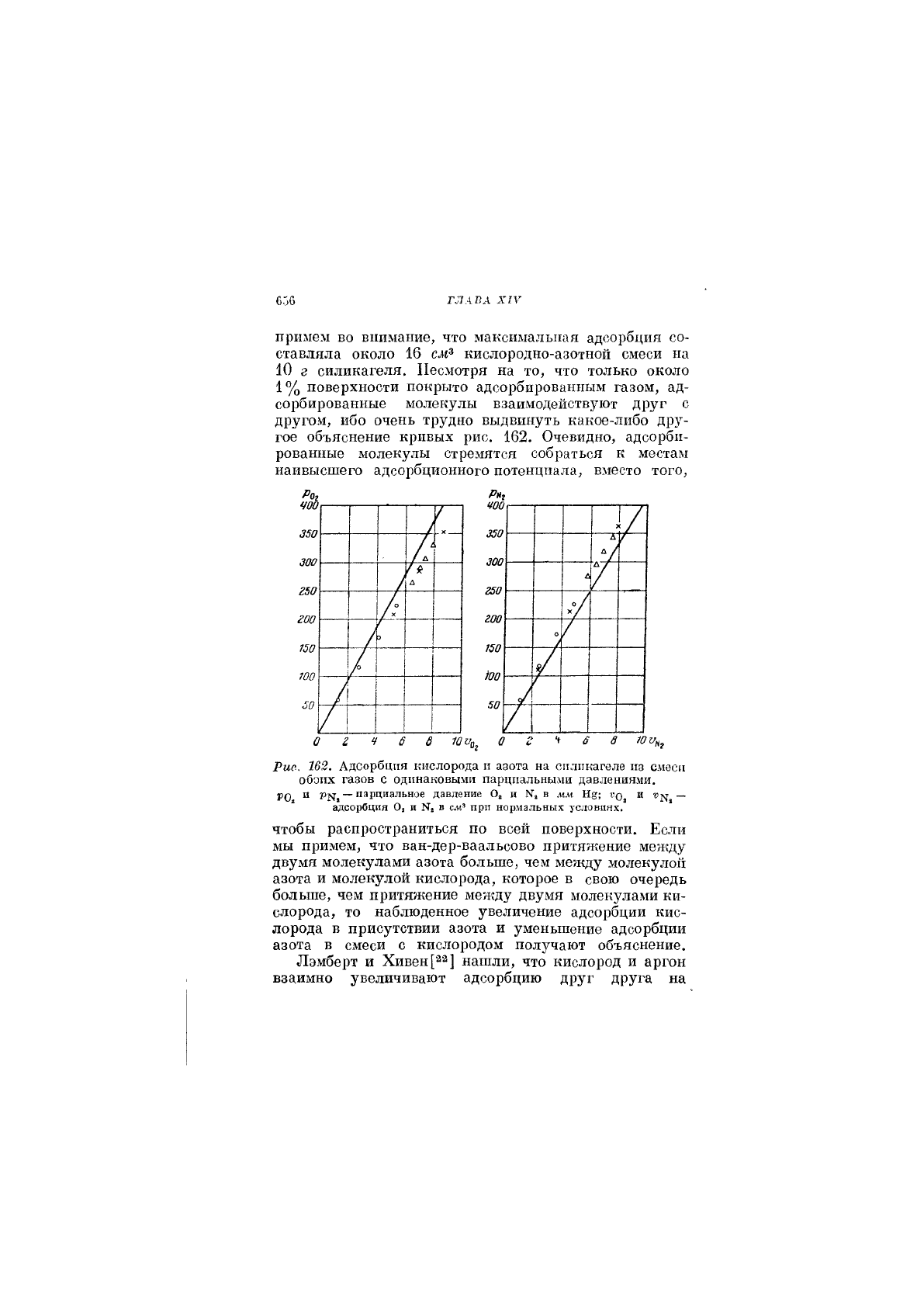
сутствию других газов. Данные Лэмберта и Пила[21],
изображенные на рис. 162, показывают рост адсорбции
кислорода на силикагеле при 0° в присутствии азота
при том же парциальном давлении и одновременное
уменьшение адсорбции азота. Это оказалось верным
для всей исследованной области давлений. Получен-
ные результаты действительно замечательны, если мы
656
глава .ТИТ
примем во внимание, что максимальная адсорбция со-
ставляла около 16 см^ кислородно-азотной смеси на
10 г силикагеля. Несмотря на то, что только около
1% поверхности покрыто адсорбированным газом, ад-
сорбированные молекулы взаимодействуют друг с
другом, ибо очень трудно выдвинуть какое-либо дру-
гое объяснение кривых рис. 162. Очевидно, адсорби-
рованные молекулы стремятся собраться к местам
наивысшего адсорбционного потенциала, вместо того,
Ро,
Р»г
350
300
г5о
гоо
750
700
/
/
ж
А
/
/
/
г
/
У
/
350
300
250
гоо
750
т
50
>
л
V
л
7
о
/
/
/
/
/
/
о
6 8 10 V.
8 70 И,
«г
Рш. 162. Адсорбция кислорода и азота на сплпкагеле пз смеси
обоих газов с одинаковыми парциальными давлениями.
РО и р^-, —парциальное давление О^ и К, в мм Н§; во^ и —
адсорбция О, и Ка в с.«' при нормальных условиях.
чтобы распространиться по всей поверхности. Если
мы примем, что ван-дер-ваальсово притяжение между
двумя молекулами азота больше, чем между молекулой
азота и молекулой кислорода, которое в свою очередь
больше, чем притяжение между двумя молекулами ки-
слорода, то наблюденное увеличение адсорбции кис-
лорода в присутствии азота и уменьшение адсорбции
азота в смеси с кислородом получают объяснение.
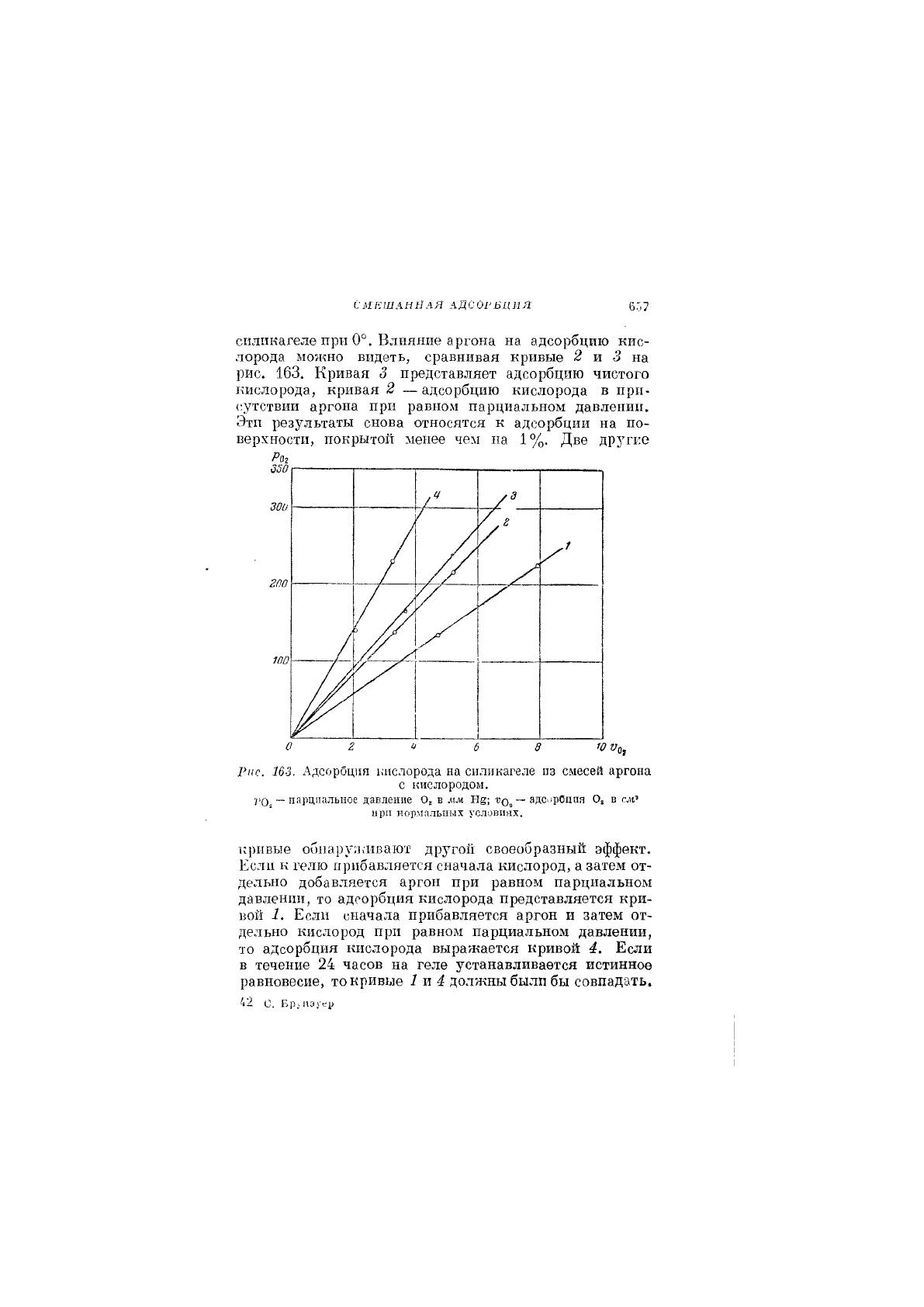
Лэмберт и Хивен[22] нашли, что кислород и аргон
взаимно увеличивают адсорбцию друг друга на
с М Е Ш А Н Ы А И А Д С 01'ВЦ 11Я
657
силикагеле при 0°. Влияние аргона на адсорбцию кис-
лорода можно видеть, сравнивая кривые 2 и 5 на
рис. 163. Кривая 3 представляет адсорбцию чистого
кислорода, кривая 2 — адсорбцию кислорода в при-
сутствии аргона при равном парциальном давлении.
Эти результаты снова относятся к адсорбции на по-
верхности, покрытой менее чем па
1
%. Две дрз^гке
Рйг
250
ЗОН
гпо
100
/
/
/
1
о
в
Рис. 163. Адсорбция кислорода на силикагеле из смесей аргона
с кислородом.
Ч'О,
~ парциальное давление Оа в мм Н§; — адО"Рбция Оа в сл1'
при нормальных условиях.
кривые оо11ару;кивают другой своеобразный эффект.
Если к гелю прибавляется сначала кислород, а затем от-
дельно добавляется аргон при равном парциальном
давлении, то адсорбция кислорода представляется кри-
В011 1, Если сначала прибавляется аргон и затем от-
дельно кислород при равном парциальном давлении,
то адсорбция кислорода выражается кривой 4. Если
в течение 24 часов на геле устанавливается истинное
равновесие, то кривые 1 ш 4 должны были бы совпадать.
42 о. Бр.пэуер

658 глава .ТИТ
Возможное объяснение этих результатов состоит в
том, что адсорбция имеет место на наиболее активной
части поверхности силпкагеля, вероятно, в очень тон-
ких порах, сравнимых по размерам с диаметрами
атома аргона или молекулы кислорода. Диффузия
кислорода внутрь этих пор и наружу против равного
парциального давления аргона может потребовать
больше временн, чем 24 часа, Ричардсон и В5^дхауз[®]
определили таким же способом адсорбцию смесей угле-
кислый газ — закись азота на угле, добавляя сна-
чала один газ, а затем ун;о другой. Они нашли, что
замещение на поверхности идет вначале быстро, по
затем замедляется и становится после 39 часов столь
медленным, что они сомневались, будет ли когда-либо
достигн^гто равновесие.
Теория Лэнгмюра требует, чтобы адсорбция одного
газа всехда улюньшалась в присутствии другого. Если
температура и давление поддерживаются постоянными
и изменяется состав газовой фазы, то график, выража-
ющий зависимость концентрацпи компонента I в ад-
сорбированной фазе от его коицептрации в газовой
фазе, должен дать какую-либо из кривых 1 или 2
рис. 104. Этот рисунок взят из работы Дамкёлера[-®].
Кривая 1 получается в том случае, если компонент/
обладает более высоким коэффициентом адсорбции, челг
компонент II; если же компонент II обладает бблынпм
коэффициентом адсорбции, то получается кривая 2.
Кривая 3 не может быть получена на основании теории
Лэнгмюра. Она указывает на непостоянство теплоты
адсорбции или, может быть, на полимолекулярную
адсорбцию. Дамкёлер нашел, что смесь азота и аргона
как на силикагеле, так и на активном угле «норит»
дает в определенном интервале температур и давлени!!
кривые, подобные кривой 3. Прп низкпх концентра-
циях азота в газовой фазе адсорбированная смесь была
богаче азотом, чем аргоном, а при высоких концентра-
циях азота наблюдалось обратное соотношение. Дам-
кёлер объясняет этот факт на основании представлений
о полимолекулярной адсорбцпп и предполагает, что
соответствующий переход происходит после того, как
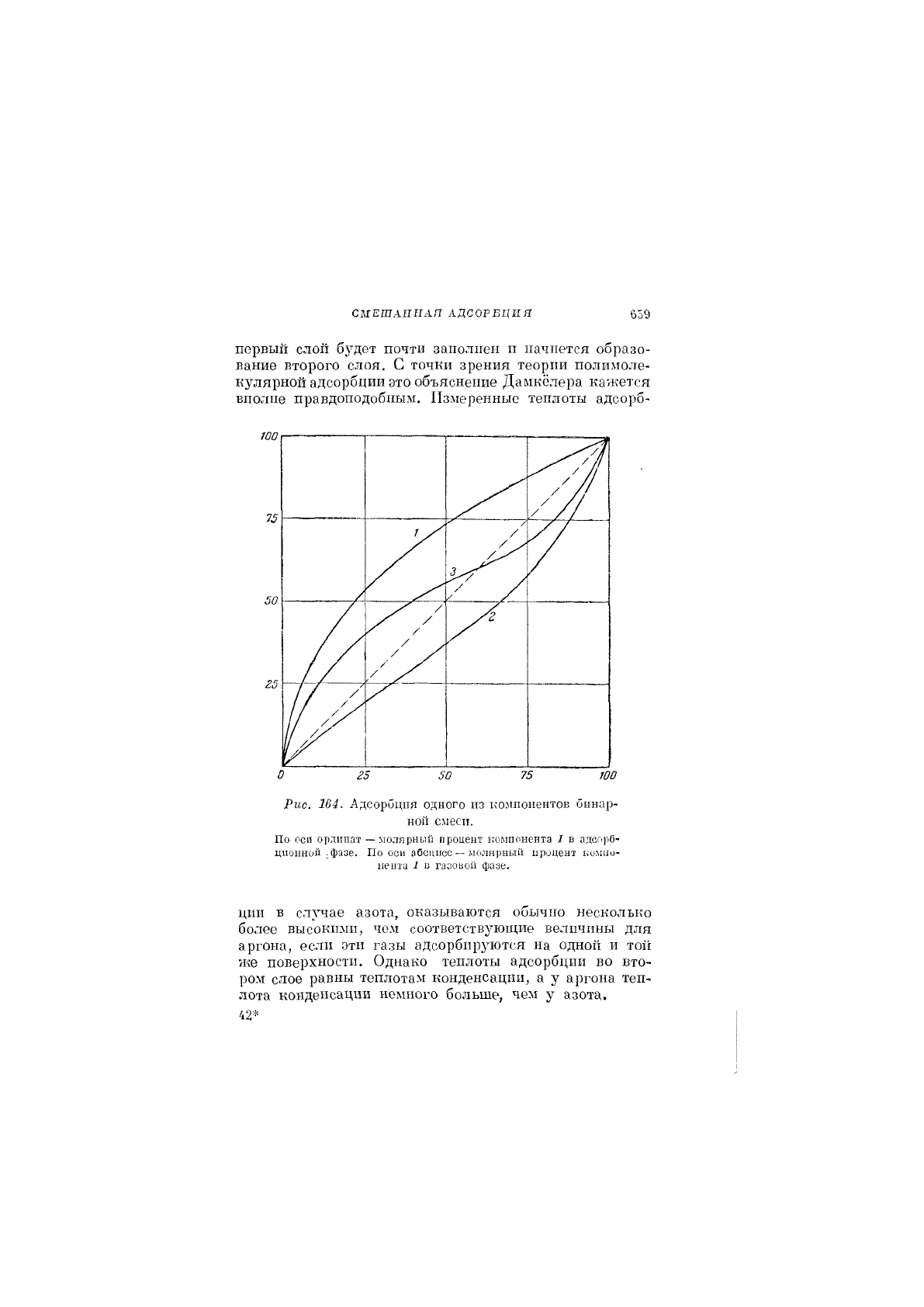
СМЕШАННАЯ АДСОРБДИЯ
659
первый слой будет почти заполнен п начнется образо-
вание второго слоя. С точки зрения теории полимоле-
кулярной адсорбции это объяснение Дамкёлера кажется
вполне правдоподобным. Измеренные теплоты адсорб-
100
75
50
25
/
У/
/
X /
/ /
/ /
/ /
25 50
75
100
Рис. 164. Адсорбция одного из компонентов бинар-
ной смеси.
По оси ордигаат — молярный процент компонента I в адсорб-
цио1шо11 .фазе. По оси абсцисс — молярный процент компо-
нента 1 в газовой фазе.
ции В случае азота, оказываются обычно несколько
более высокими, чем соответствующие велнчины для
аргона, еслп эти газы адсорбируются на одной и той
же поверхности. Однако теплоты адсорбции во вто-
ром слое равны теплотам конденсации, а у аргона теп-
лота конденсации немного больше, чем у азота.
&

6Г0
глава хгу
Тоорпя адоо11б!1,ии смесей по Магнусу
^'равнение Магиуса для адсорбции одного компо-
нента было рассмотрено в гл. IV. Маги}'с[-''] вывел
хак;1;е }"равнение для сл}'чая адсорбции газов из би-
нарных смесей. Для молек\'л, не обладающих дипо-
лям:, эти уравнения имеют вид:
1
/'1 ^ г']
р, =
11
. у'
V
'Н
«13
АНТ ^^ АЕ7
п
Го,
Л
'--л'-- А
-АНТ '-Г
Ч-2
АНТ
(16;
(17)
Величины, входящие в эти уравнения, ихгеют тот и;е
смысл, что и в уравнении (62) гл. IV. Значения
всех констант могут быть вычислены на основании
изотерм адсорбции индивидуальных газов, за исклю-
чением константы выражающей сплы взаимодей-
ствия между молекулами двух различных типов. В то
время как а^ и а^ считаются всех'да положительныдш,
так как они характеризуют отталкивание, константа а^^
мо;кет быть как положительной, так и отрицатель-
нон, в зависимости от того, отталкиваются или притя-
гиваются взап.мно индуцированные диполи. Уравне-
ние (16) переходит в простое уравнение Магнуса (62)
гл. IV, если положить Соотношение между
уравнениями Магнуса (16) и (17), с одной стороны, и
уравнениями (5) и (6) Маркгема и Бентона[''], с другой
стороны, совершенно аналогично соотношению между
простым зфавнением Магнуса и уравнением Лэнгмюра.
Если пренебречь силами взаимодействия ме/кду адсор-
бированными молекулами, т, е. положить Й!, а^ п
равными нулю, то уравнения (16) и (17) перейдут
в уравнения (5) и (С).
Магнус и Краус[^^] измерили адсорбцию смеси
ацетилена и метилового эфира на древесном угле, при-
ме лив для анализа газов интерферометрпческий метод.
Хотя в более ранней статье Магн}'С[2''] утверп;дас1, что
