Брунауер С. Адсорбция газов и паров
Подождите немного. Документ загружается.


ТЕЯЛОТА АДСОРБЦИИ II 331
ОКИСИ углерода на угле 7800 кал/моль. Грегг[®] на-
шел для углекислого газа на угле 7900 кал/моль.
Для этилена на силикагеле Кэльберер и Шустер
получили 7200 кал/моль, а для этилена на угле Грегг[®]
определил 8100 кал/моль. Эти величины соответствуют
малым количествам адсорбированного газа (при-
близительно 3 см^ на 1 г) и температуре 0° или близкой
к ней. В общем, теплоты адсорбции неполярных газов
на угле немного выше, чем на силикагеле и на боль-
шинстве других адсорбентов.
Из этих примеров мы можем заключить, что теплоты
ван-дер-ваальсовой адсорбции газа на различных ад-
сорбентах не показывают большого различия*. Хотя
методы вычисления энергии взаимодействия между
данной молекулой и ионным адсорбентом, с одной сто-
роны, и той же молекулы и металлическим провод-
ником — с другой, совершенно различны, эти раз-
личные трактовки приводят приблизительно к одним
и тем же величинам теплоты. Так, для теплоты адсорб-
ции аргона на иодистом калии вычисление дает
2100 кал/моль, для аргона на меди 2700 и для азота на
угле 2400 кал/молъ (гл. VII). Все эти значения
являются, конечно, грубыми приближениями и не-
сколько преуменьшенными по сравнению с экспери-
ментальными теплотами адсорбции.
В следующем разделе мы обсудим изменение диф-
ференциальных теплот адсорбции с количеством ад-
сорбированного газа. Обычно начальные теплоты ад-
сорбции больше, чем величины, полученные при по-
следующих добавках газа. Различие в начальных
значениях какого-либо газа на разных адсорбен-
тах обычно много больше, чем для последующих. Ес-
ли теплоту адсорбции вычислять для достаточно боль-
шого количества адсорбированного газа, то получа-
ются приблизительно одинаковые значения для раз-
личных адсорбентов. Это показано в табл. 34, взятой
* Замечательным исключением является шабазит, ко-
торый дает много ббльшие теплоты физической адсорбции,
чем другие адсорбенты. Это обстоятельство обсуждается далее,
в гл. XI.

332
ГЛАВА VI >
ИЗ работы Кройта и Моддерман [*]. Интегральные теп-
лоты адсорбции углекислого газа на разных углях
были вычислены для всего интервала давлений от
О до 760 мм. Несмотря на большие различия в природе
исследованных углей и в предварительной их обра-
ботке, величины д^ оказываются почти одинаковыми
(приблизительно 7000 кал1молъ). Все эти значения
были определены калориметрически.
Таблица 34
Теплоты адсорбции углекислого газа на различных углях
Тип угля
Температура
отначки
РС)
91
(кал/сл»')
Исследователя
французский про-
Кейс и Маршалл[1")
тивогазовый . . 900
0,313
Кейс и Маршалл[1")
Древесный . . .
600
0,313 Магнус и Кэльберер!'^!
Различных сор
ФаврГ®®] тов неизвестна
0,311
ФаврГ®®]
Березовый . . .
400
0,311
Грегг[8)
Кокосовый . . .
400
0,311
Титов12]
Древесный . . .
100
0,308
Магнус и Кэльбе рер[®'1
Еуопутиз еигора-
Шаппюи[«2]
еиз
неизвестна
0,304
Шаппюи[«2]
Изменение теплоты адсорбции с количеством
адсорбированного газа
В гл. VII теплота адсорбции вычислялась как
энергия взаимодействия между изолированной моле-
кулой и идеально однородной адсорбирующей поверх-
ностью. Мы говорили о теплоте адсорбции аргона на
меди или азота на угле, как о постоянной величине,
характеризующей систему адсорбент — адсорбируемое
вещество, и до сих пор не рассматривали ее зависи-
мость от таких факторов, как температура, давление
или количество адсорбированного газа.
Одним из основных допущений, сделанных при
выводе уравнения Лэнгмюра, было предположение о
том, что теплота адсорбции не изменяется с количе-

ТЕЯЛОТА АДСОРБЦИИ II 333
ством адсорбированного газа. Такое же допущение
содержится в выводе уравнения Вильямса и Генри,
как мы видели в гл. IV. Если изотермы адсорбции
выражаются этими уравнениями, то исследователь,
возможно, имеет дело с приблизительно однородной
поверхностью или, по крайней мере, с достаточно од-
нородной частью поверхности.
Приблизительно постоянная теплота адсорбции бы-
ла найдена Ивенсом для адсорбции аммиака на
шабазите при 0°, обсужденной в гл. IV. Другие при-
меры можно найти в приведенных в таблицах 27 и
28 опытных данных. Величины ёд/(}а для углекисло-
го газа на угле приблизительно постоянны в интер-
вале величин адсорбции от 20 до 45 дифферен-
циальные теплоты для воды на угле можно считать
постоянными в пределах от 20 до 200 слг® адсорбиро-
ванного пара и величины для азота на угле практи-
чески постоянны во всем интервале величин адсорбции,
приведенном в таблице. Б этом последнем случае азо-
том покрыто, вероятно, менее 10% поверхности.
Примеры постоянства теплот адсорбции для всей
поверхности адсорбента или хотя бы даже для боль-
шой ее части весьма редки. Обычно дифференциальные
теплоты адсорбции значительно изменяются с количе-
ством адсорбированного газа, и часто это изменение
оказывается очень сложным. Шаппюи[®^], первый ис-
следователь дифференциальных теплот адсорбции, уже
отметил это изменение.
Существуют две причины, которые могут вызвать
изменение дифференциальных теплот адсорбции: одна,
зависящая от природы адсорбента, другая — от при-
роды адсорбируемого вещества. В гл. VII мы ви-
дели, что теплота адсорбции изолированной молекулы
на плоской поверхности отличается от теплоты ад-
сорбции молекулы, адсорбированной в трещинах, ще-
лях, каналах или пустотах адсорбента. Даже на пло-
ской поверхности теплота адсорбции может значи-
тельно изменяться благодаря различиям в упаковке
поверхностных атомов: молекула, адсорбированная на
кристаллической плоскости (100), будет иметь отличную
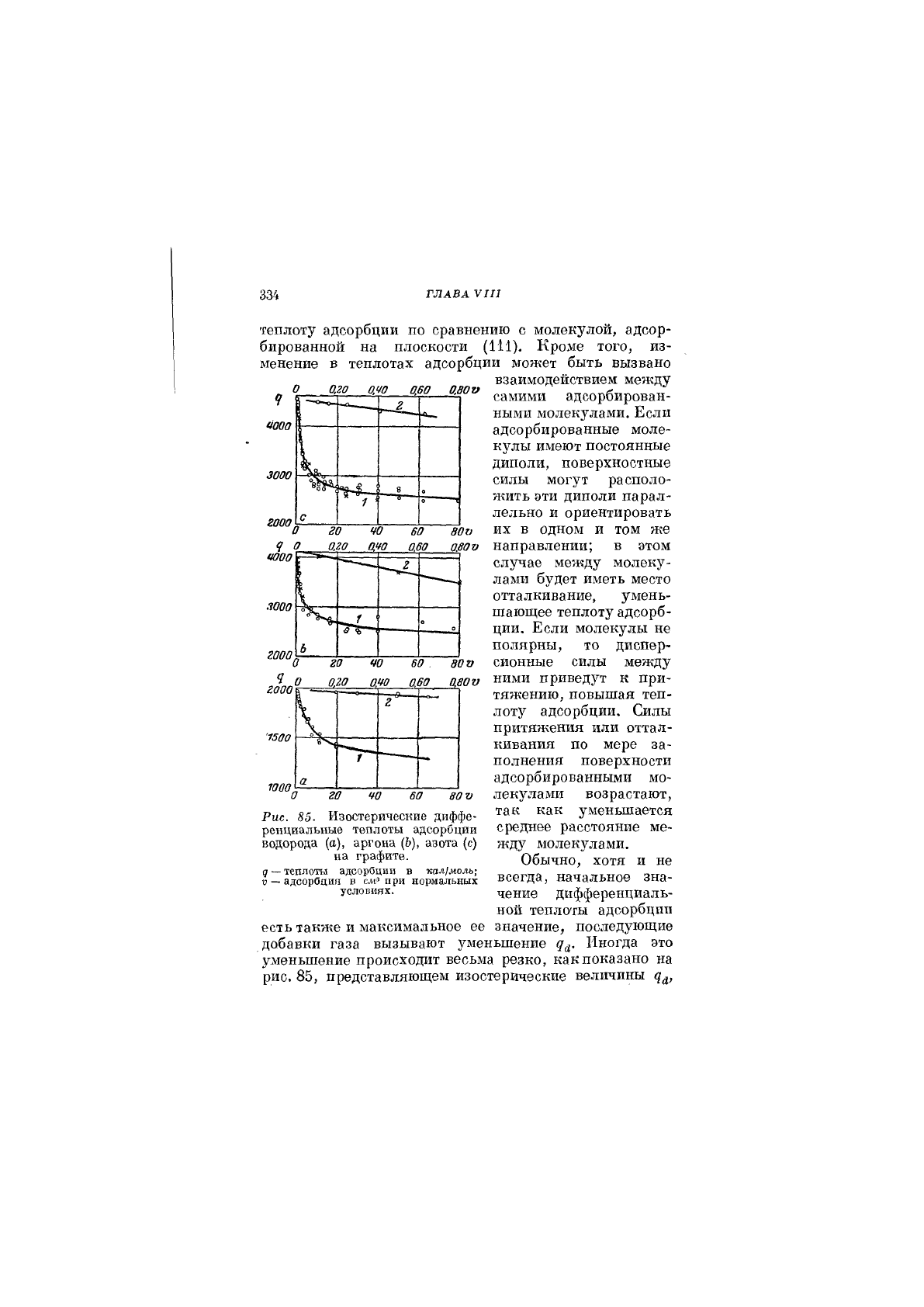
334
ГЛАВА VI >
теплоту адсорбции по сравнению с молекулой, адсор-
бированной на плоскости (111). Кроме того, из-
менение в теплотах адсорбции может быть вызвано
взаимодействием между
—самими адсорбирован-
ными молекулами. Если
адсорбированные моле-
кулы имеют постоянные
диполи, поверхностные
сипы могут располо-
жить эти диполи парал-
лельно и ориентировать
их в одном и том же
направлении; в этом
случае между молеку-
лами будет иметь место
отталкивание, умень-
шающее теплоту адсорб-
ции. Если молекулы не
полярны, то диспер-
сионные силы между
ними приведут к при-
тяжению, повышая теп-
лоту адсорбции. Силы
притяжения или оттал-
кивания по мере за-
полнения поверхности
адсорбированными мо-
лекулами возрастают,
так как уменьшается
среднее расстояние ме-
жду молекулами.
Обычно, хотя и не
всегда, начальное зна-
чение дифференциаль-
но!! теплоты адсорбции
есть также и максимальное ее значение, последующие
добавки газа вызывают уменьшение д^. Иногда это
уменьшение происходит весьма резко, как показано на
рис, 85, представляющем изостераческие величины
Рис. 85. Изостерические диффе-
ренциальные теплоты адсорбции
водорода (а), аргона (Ь), азота (с)
на графите.
д — теплоты адсорбции в кал/моль-,
V — адсорбция в при нормальных
условиях.

ТЕЯЛОТА АДСОРБЦИИ II 335
Полученные Баррером[®*] для водорода, аргона и азота
на графите в области температуры 71—288°К. Кривая
1 для азота показывает, что д^ уменьшается на 1900 кал
при адсорбции первых 20 сл® и только на 200 кал
при адсорбции последующих 60 см^. Кривые 2 пред-
ставляют изменение при адсорбции первых несколь-
ких десятых см^ газа. Для аргона д^ падает на 600 кал
для первых 0,8 см^ адсорбированного газа и толь-
ко приблизительно на 150 кал для последних 60 см^.
Максимальное значение теплоты адсорбции в кри-
вых Баррера отвечает покрытию адсорбированным ве-
ществом очень малой части поверхности. Так как сред-
нее расстояние между адсорбированными молекулами
слишком велико, чтобы привести к заметному взаи-
модействию, то причину максимума следует искать в
структуре адсорбента. Одна из возможносте!! заклю-
чается в том, что различные плотности упаковки ато-
мов углерода в призматических и базисных гранях
вызывают изменение теплот адсорбции. В этом случае
мы должны ожидать больших величин теплот на приз-
матических поверхностях, так как призматические
площади малы, и большие величины д^ встречаются
только на малой части поверхности. Однако, вычис-
ление показывает, что теоретическая теплота адсорб-
ции на призматических гранях меньше, чем на базис-
ных. Большие начальные величины теплот адсорбции
Баррер приписывает адсорбции в трещннах адсор-
бента. По мере того как угол между двумя поверхно-
стями, которые образуют трещину, становится более ост-
рым, Она приближается к трещине с параллельными
стенками. В такой трещине теплота адсорбции должна
быть вдвое больше, чем на плооко11 поверхности. На-
чальное и конечное значения действительно близки
как раз к этому отношению 2:1, а именно — они
составляют 4600 и 2500 кал!моль Д^я азота, 4100 и
2400 для аргона и 2000 и 1100 для водорода.
Начальное уменьшение теплоты адсорбции проис-
ходит не всегда столь резко, как на кривых Баррера.
-Более постепенное уменьшение величин д^ иллюстри-
рует рис. 86, представляющий изостерические теплоты
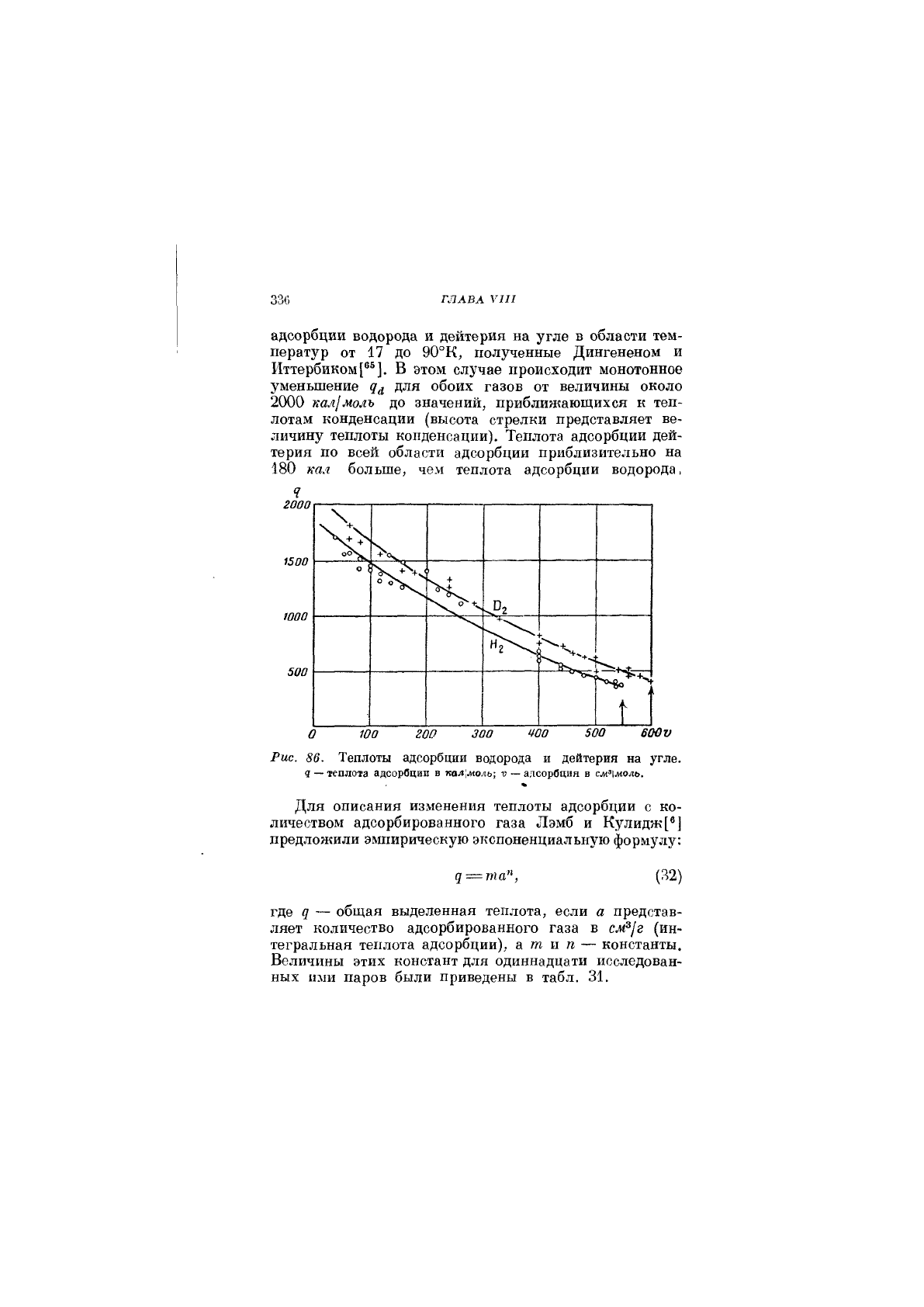
336
ГЛАВА VI >
адсорбции водорода и дейтерия на угле в области тем-
ператур от 17 до 90°К, полученные Дингененом и
Иттербиком[®®]. В этом случае происходит монотонное
уменьшение для обоих газов от величины около
2000
кал]молъ
до значений, приближающихся к теп-
лотам конденсации (высота стрелки представляет ве-
личину теплоты конденсации). Теплота адсорбции дей-
терия по всей области адсорбции приблизительно на
180 кал больше, чем теплота адсорбции водорода,
Ч
гооо
1500
юоо
500
•х-
о {
.02
Рис. 86. Теплоты адсорбция водорода и дейтерия на угле.
я — теплота адсорбции в кал;жоль; V — адсорбция в
см^\моль.
Для описания изменения теплоты адсорбции с ко-
личеством адсорбированного газа Лэмб и Кулидж[®]
предложили эмпирическую экспоненциальную формулу:
5 = та",
(32)
где 5 — общая выделенная теплота, если а представ-
ляет количество адсорбированного газа в сл^/г (ин-
тегральная теплота адсорбции), а т и га — константы.
Величины этих констант для одиннадцати исследован-
ных ими паров были приведены в табл. 31.
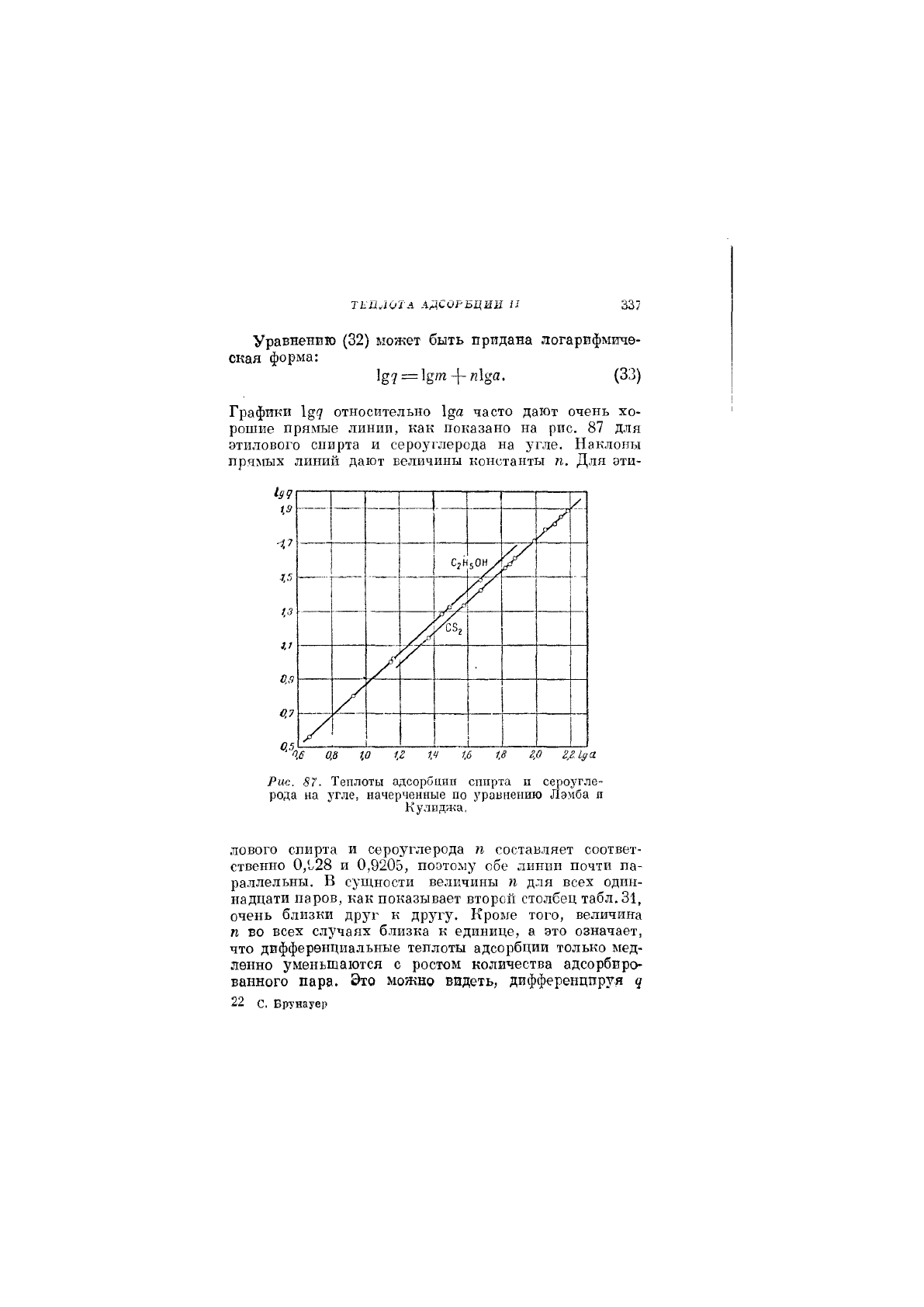
7КПЛ0ТА АДСОРБЦИИ П
337
Уравнению (32) может быть придана логарифмиче-
ская форма:
]§^ = \цт-\-п\§а. (33)
Графики 1^(7 относительно часто дают очень хо-
рошие прямые линии, как показано на рис. 87 для
этилового спирта и сероуглерода на угле. Наклоны
прямых линий дают величины константы п. Для эти-
Г, 5
V
0.9
0.7
0.5,
/ /
СгН
фу
/Иг
/•
Г
/
г
1
1
ав аз 1,0 1.г
1.4
1,0
1,8 г,о г.гьда
Рис. 87. Теплоты адсорбции спирта и сероугле-
рода на угле, начерченные по уравнению Лэмба я
Кулиджа.
лового спирта и сероуглерода п составляет соответ-
ственно 0,1У28 И 0,9205, поэтому обе линии почти па-
раллельны. В сущности величины п для всех один-
надцати паров, как показывает второй столбец табл.31,
очень близки друг к другу. Кроме того, величина
п во всех случаях близка к единице, а это означает,
что дифференциальные теплоты адсорбции только мед-
ленно уменьшаются с ростом количества адсорбиро-
ванного пара. Это можно видеть, дифференцируя ц
22 с. Брунауер

338 ГЛАВА УП1
ПО а В уравнении (32):
а
с1а а' •
(34)
Когда показатель степени (1—п) приближается к
нулю, величина (1д1с1а становится постоянной, т. е.
дифференциальная теплота адсорбции перестает за-
висеть от адсорбированного количества. Из табл. 31
мы можем видеть, что величина (1—п) для всех один-
надцати паров очень мала. Лэмб и Кулидж нашли не-
который параллелизм между величинами (1—п) и
точками кипения жидкостей: чем выше точка кипения,
тем меньше величина (1—тг). Таким образом изменение
Лд1(1а с а было наибольшим для наиболее низко ки-
пящих веществ; например, величина (1—п) для ам-
миака, вычисленная из опытов Шаппюи[®2], была
0,305, что в 3—4 раза больше величин, полученных
для органических паров, приведенных в таблице.
Другие исследователи также нашли, что уравне-
ние (32) Лэмба и Кулиджа описывает их результаты с
приемлемой точностью. Пэтрик и Грейдернашли,
что для адсорбции паров веды и сернистого газа сили-
кагелем величины п бь ли соответственно 0,914 и
0,860. Двуокись серы кипит при более высокой темпе-
ратуре, чем аммиак, но при более низкой, чем пары,
приведенные в табл. 31, и значение п для нее так/ке
располагается между соответствующими значениями
для аммиака и органических паров. Однако, Грегг[®]
нашел для этана, этилена и ацетилена на угле для
п соответственно величины 0,966, 0,945 и 0,925, не-
смотря на то, что эти газы кипят при значительно бо-
лее низких температурах, чем аммиак.
Хотя уравнение (32) и применимо для краткого вы-
ражения опытных данных, оно очень мало говорит о
природе самого адсорбционного процесса. Другое важ-
ное возражение против его применения было выдви-
нуто Кройтом и Моддерман[''], которые отметили, что,
когда кривая, показывающая изменение с1д1с1а с а,
имеет окстрем}'м, кривая, выражающая изменение д
с а, должна иметь точку перегиба; однако, такая

71:ил)ТА АЖОРБцпи п
ЗЗУ
кривая не может быть выражена экспоненциальной фор-
мулой. Причина, по которой эта формула часто ока-
зывается удовлетворительной, показана на рис. 88.
Здесь кривая 2 передает изменение д с а для какого-
либо воображаемого газа так, как оно определено из
опыта, а кривая 1 построена по экспоненциальной фор-
муле (32). Отклонения действительной кривой от вы-
численной по этой формуле распределяются по обеим
ее сторонам и могут быть неправильно приписаны
ошибкам опыта. Поэтому лучше давать полностью из-
менение сЩйа с а так,
как оно найдено на ?
опыте.
Измепеппе дифферен-
циальных теплот адсорб-
ции с адсорбированным
количеством не всегда
столь просто, как на
рис. 85 и 83. Кривые ока-
зываются часто очень
сложными, имеющими 5П1-
нимумы и максимумы.
Подобный пример приве-
ден на рис. 89, взятом
из работы Кройта и Мод-
дерман[''], показывающем
изменение ^(^/йа с а для
эфира на угле. Кривая 1 изображает результаты
опытов Кейса и Маршалла['^°] при 0°, кривая 2 —
аналогичные результаты Лэмба и Кулиджа[®] при 0°
п кривая 5—Пирса и Мак-Кинли при 25°,—
все калориметрические данные. Хотя эти исследо-
ватели работали с углями различной структз^ры
и сорбционпой емкости, ход кривых оказывается уди-
вительно сходным. Все три кривые показывают сна-
чала снижение, затем идут приблизительно горизон-
тально, а затем снова снижаются; две из этих кривых
продолжаются затем с восходящим участком. Таким
образом, на кривых, представляющих данные Лэмба п
Кулиджа и Пирса и Мак-Кинли, имеется минимум,
Рис. 88. Измопенпе интеграль-
ной теплоты адсорбции с ко-
личеством адсорбированного
вещества.

340
Г.ЛЬ'Л \'1П
который не может быть воспроизведен экспоненциаль-
ной формулой (32).
Появленпе минимума на кривых д^ = /(а) является
совсем не редким. Данные табл. 26 показывают, что
Титов [2] получил минимум и для азота и для аммиака
на угле. Шаппюи[®2] также нашел минимум для ам-
миака на угле. Грегг[®] и Пире и Мак-Кинли[®®] по-
лучили минимум для нескольких органических паров
на угле и Вильяме нашел два минимума для серни-
стого газа на кровяном угле,
(1^/аа
\ 2 0° \
/X \
V
N
Риг. 89. Дифференциальные теплоты адсорбции эфира на угле.
Имеется несколько различных нуте!! для объясне-
ния сложной зависимости теплоты адсорбции от коли-
чества адсорбированного газа. Согласно теории поли-
молекулярной адсорбции, рассмотренной в гл. VI,
кривая относительно а должна показать: 1) снижа-
ющуюся часть для величин д^, больших, чем Е^, соот-
ветствующих адсорбции на наиболее активной части
поверхности; 2) приблизительно горизонтальную часть
с теплотой адсорбции Е,, соответствующую адсорбции
на менее активно!! и приблизительно однородной части
поверхности; 3) дрлтую снижающуюся часть, обязан-
ную переходу от ^^ к 4) другую, более длтаную
