Брунауер С. Адсорбция газов и паров
Подождите немного. Документ загружается.


•ТЕПЛОТА АДСОРБЦИИ 1
кивание между нейтральными молекулами может быть
объяснено электростатическими кулоновскими силами,
которые существуют менаду частицами, составляю-
щими молекулы (электронами и ядрами).
Уравнение (1) показывает, что внешнее давление
меньше динамического давления на величину я/?;®.
Это подразумевает притягательные силы между мо-
лекулами, а константа Ван-дер-Ваальса а дает меру
этих притягательных или кохезионных сил. Непо-
средственная причина увеличения сил притяжения
между незаряженными молекулами на больших рас-
стояниях не очевидна; поэтому не является неожидан-
ным, что проблема ван-дер-ваальсова притяжения не
была успешно разрешена вплоть до недавних лет.
Природа этих сил уже давно предполагалась электро-
статической, так как гравитационные или магнитные
силы слншком малы, чтобы объяснить наблюдаемое
притяжение. И действительно, мы знаем теперь, что
имеются три электростатических эффекта, которые
совместно объясняют притягательные силы Ван-дер-
Ваальса: ориентационный эффект Кизома, индукцион-
ный эффект Дебая и дисперсионны!! эффект Лондона.
Многие из незаряженных молекул имеют диполь-
ные моменты, и Кизом[^] в 1921 г. высказал предпо-
ложение, что ван-дер-ваальсово притяжение вызы-
вается взаимодействием между этими дипольными мо-
лекулами. Если центр тяжести положительных заря-
дов не совпадает с центром тяжести отрицательных, то
молекула, как говорят, обладает постоянным диполь-
ным моментом. Аммиак, вода, спирт и фенол являются
типичными примерами дипольных молекул. Диполь-
ный момент определяется как произведение заряда
на расстояние между центрами тяжести положитель-
ных и отрицательных зарядов:
[Л
==
ех. (3)
Когда две молекулы, имеющие дипольные моменты
Р-! и подходят друг К другу, взаимодействив между
диполями проявляется двумя путями. Во-первых, ди-
поли возде11ствуют друг на друга силами притяжения

232 ГЛАВА VI >
ИЛИ отталкивания в зависимости от их относительной
ориентации. Если разноименные заряды ближе друг
к другу, чем одноименные, то результирующим эф-
фектом будет притяжение, в противном случае — от-
талкивание. Во-вторых, каждый диполь подвергается
воздействию враодательного момента в поле другого
диполя. Эти вращательные моменты стремятся ориен-
тировать диполи параллельно друг другу так, чтобы
положительный конец одного был ближе к отрицатель-
ному концу другого.
Так как молекулы в газовой фазе имеют вращатель-
ные степени свободы, то в случае дипольпых молекул
мы имеем дело с врапдающимися диполями. Если бы
диполи вращались одинаково во всех направлениях,
то результир}^ющая сила была бы равна нулю, потому
что сила меняла бы знак, когда диполь оказывался бы
перевернутым. Однако вращение не является одинако-
вым, потому что вращательные моменты стремятся
удержать диполи в параллельных положениях. Каж-
дое положение дв,ух диполей соответствует некоторо1"1
взаимно!! потенциальной энергии. Благодаря закону
распределения Максвелла — Больцмана ориентации,
имеющие более низкие потенциальные энергии, будут
статистически б 1агоприятными, и диполи будут ориен-
тированы в г ол >жении, соответствующем минималь-
Н0Г1 потенциально!! энергаи, более часто, чем в каком-
либо другом положении. Таким образом, в среднем
иритяжение будет преобладать над отталкиванием.
Усредняя по всем положениям, Кизом нашел для энер-
гии взаимодействия формулу
о 2 2
/7—ел
у • кт ' У^!
где потенциальная энергая, обязанная ориента-
ционному эффекту, г — расстояние между центрами
двух диполе!! и к — константа Больцмана. Кизом
приписал ван-дер-ваальсово притяжение этому ориен-
тационному эффекту.
В 1920 г. Дебайр] отметил, что один ориентацион-
ный эффект не может объяснить ван-дер-ваальсового

г Е плот л АР.СОРБПиП { 253
Притяжения. Согласно уравнению (4) потенциал при-
тяжения уменьшается обратно пропорционально аб-
солютной температуре, но полученные эксперименталь-
но ван-дер-ваальсовы поправки на кохезию не пока-
зывают такого быстрого уменьшения с температурой.
Поэтому он пришел к выводу, что должен существо-
вать дополнительный член энергии взаимоде11ствия,
который не зависит от температуры.
Кизом рассматривал молекулы как жесткие ди-
поли, т. е. он принпмал, что распределение зарядов в
молекуле не изменяется под влиянием других молекул,
1шходяш;ихся поблизости. Однако в действительности
распределение заряда в молекуле нарушается в при-
сутствии другого заряженного тела: молекз'ла, как
говорят, становится поляризовапноп. Это является
одним из примеров явления индукции. Давно из-
вестен факт, что еслн электрический заряд прибли-
жается к проводнику, то на прилежащей стороне про-
водника индуцируется заряд противоположного знака,
а заряд того же знака индуцируется на противо-
положной стороне. Аналогичным образом положитель-
ный конец диполя смещает электрические заряды в
соседней молекуле, вызывая появление отрицательного
заряда на ближайшей ее стороне и положительного
заряда на противоположной стороне; другими слова-
ми, в другой молекуле индуцируется диполь. Взаимо-
действие между индуцирующим и индуцированным
диполем всегда дает притяжение. Это составляет ин-
дукционный эффект Дебая.
Индуцированный дипольнып момент пропорциона-
лен внешнему полю, которое его вызывает:
11.
= аЕ, (5)
где Е — напряжение поля, а коэффициент иронорцио-
нальности а называется поляризуемостью. 'Энергия
взаимодействия, обязанная индукции между молеку-
лой, имеющей дипольный момент р.,, и другой моле-
кулой, имеющей поляризуемость а^, выражается;
Ф)

254 ГЛАИЛ VII
Если другая молекула имеет дппольнып ^юмент р.о,
то энергия взаилюдействия, обязанная взаимной ин-
дукции, равна:
(7)
Если обе молекулы однот'о и того же рода, то это сво-
дится к
Г'
(8)
Дебай полагал, что сумма Г^ и дает ван-дер-
ваальсово притяжение между дииолышми молекулами.
Потенциал взаимодействия изменяется обратно про-
порционально шестой степени расстояния между мо-
лекулами в обоих Зфавнониях (4) и (8). Так как сила
дается выражением
то ван-дер-ваальсовы силы притяжения изменяются
обратно пропорционально седьмой степени расстоя-
ния между молекулами. Так как С/^ не зависит от тем-
пературы, то часть энергии взаимодействия не умень-
шается с ростом температуры. Это стоит в согласии с
результатами опыта. Тем не менее очевидно, что ориен-
тационный и индукционный эффекты в лучшем слу-
чае могут объяснить ван-дер-ваальсово взаидюде11ст-
вие только между молекулами, обладающими постоян-
ными диполями. Но многие молекулы, как водород,
гелий, аргон, азот, метан и т. д., не имеют постоянных
диполей. Чтобы объяснить ван-дер-ваальсово притя-
жение между двумя такиьга молекулами, Дебай и
Фалькенхаген[®] допустили существование квадру-
польных моментов. Они предположили, что квадру-
польный момент в одной молекуле индуцирует ди-
польный момент в другой и что взаимодействие между
постоянным квадруполем и индуцированным диполем
дает ван-дер-ваальсово притяжение.
Простейший пример квадруполя показан на рис.80а,
взятом у Гюккеля [']. Он состоит из двух подобных
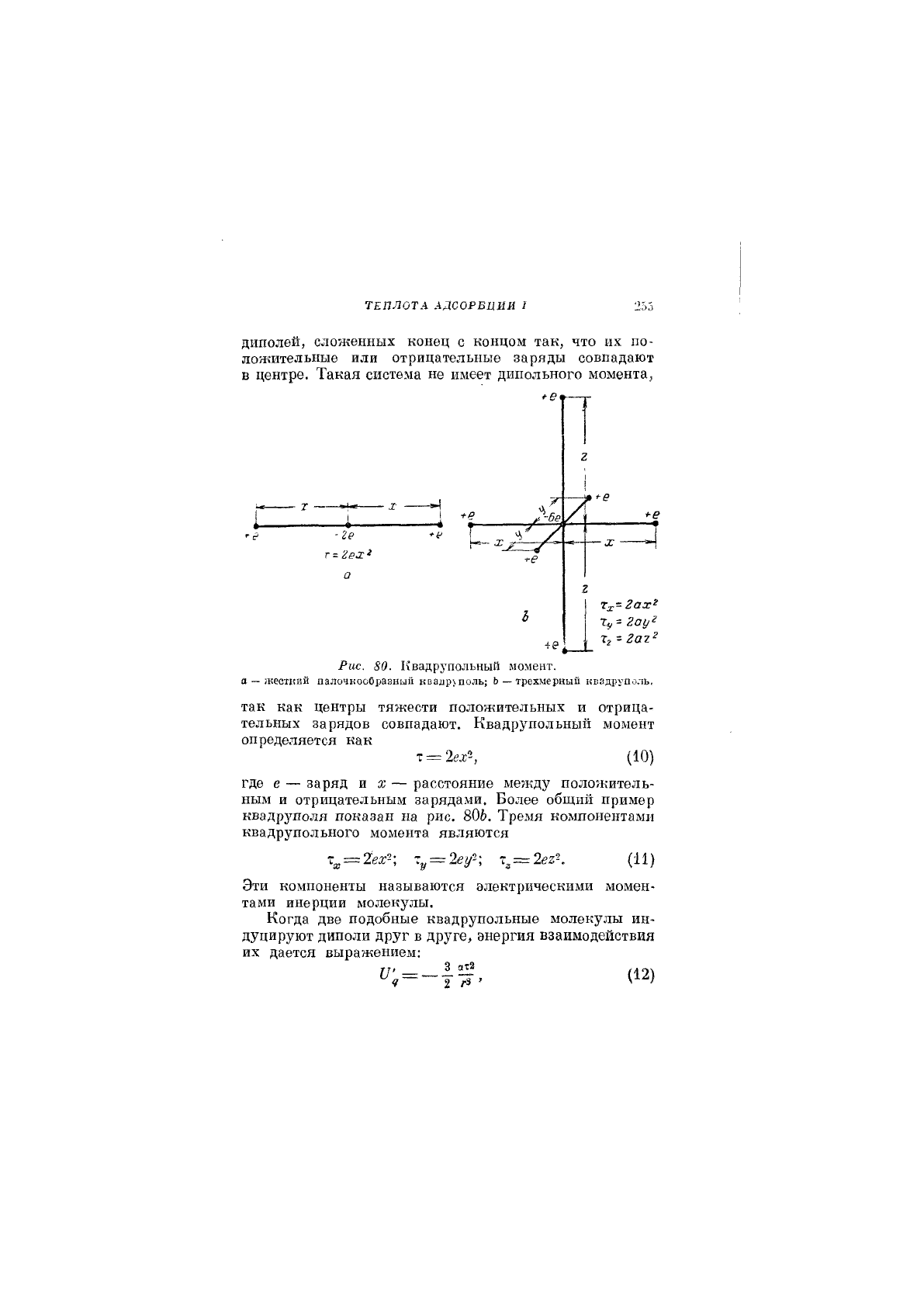
ТЕПЛОТА АДСОРБЦИИ I
диполей, сложенных конец с концом так, что их по-
ложительные или отрицательные заряды совпадают
в центре. Такая система не имеет дипольного момента,
-ге
о
\ +р
-4 »-
<
/г
•-Л. ^
/
-X ^
Ту-гауг
Тг
=
гаг^
Рис. 80. Квадрупольный момент,
а — жесткий палочкооОразный квалр\поль; Ь — трехмерный квадруполь.
так как центры тяжести положительных и отрица-
тельных зарядов совпадают. Квадрупольный момент
определяется как
т = 2ех^ (10)
где е — заряд и ж — расстояние между положитель-
ным и отрицательным зарядами. Более общий пример
квадруполя показан на рис. 806. Тремя компонентами
квадрупольного момента являются
= = (И)
Эти компоненты называются электрическими момен-
тами инерции молекулы.
Когда две подобные квадрупольные молекулы ин-
дуцируют диполи друг в друге, энергия взаимодействия
их дается выражением:
(12)
1 ^
2 гЗ •

256 ГЛАВА VI >
где а. — поляризуемость молекул. Потенциал взаимо-
действия в этом случае изменяется обратно пропор-
ционально восьмой степени расстояния ме.кду моле-
кулами. За исключением малых расстояний, взаимо-
дех1ствием квадруполя с диполем можно поэтому
пренебречь.
Дппольпые моменты могут быть определены физи-
ческими измерениями, которые не зависят от обсуж-
денных выше теорий, но квадрупольные моменты не
могут быть измерены экспериментально. Их суще-
ствование было выведено исключительно из того факта,
что ван-дер-ваальсовы силы притяжения существуют
между молекулами, не имеющими постоянных дипо-
.Т10Й, а их величина была вычислена из ван-дер-вааль-
совых констант. Появление квантовой механики, од-
нако, пролило новый свет на этот вопрос. Она вновь
привела к представлению о том, что распределение
заряда в атомах благородного газа имеет тсчно сфери-
ческую симметрию; эти атомы поэтому не мог^^т иметь
пи постоянных диполей, ни квадруполе!!, ни каких-
либо других мультиполей. Такие молекулы, как во-
дород, азот, обладают квадруполями, но квадруполь,
вычисленный для всдорсда из квантовой механики,
может объяснить только 1/100 часть ван-дер-ваальсо-
вого притяжения, которое существует между молеку-
лами водорода. Поэтому казалось, что должен суще-
ствовать друге й эффект, который приводит к притя-
жению между молекулами, не имеющими постоянных
электрических моментов какого-либо рсда. Этот эф-
фект, открытый Лондоном [®] в 1930 г., был назван
дисперсионным эффектем.
Ради простоты в качестве примера пеполярной мо-
лекулы рассмотрим атом аргона. Такой атом в любое
мгновение обладает дииольным моментом. У атома
имеется 18 электронов, двигающихся вок5)уг централь-
ного ядра в различных направлениях, и является
весьма неправдоподобным, что в какой-либо момент
электроны расположатся так, чтобы получился ди-
польный момент, точно равный нулю. Крайним при-
мером этого является атом водорода, который никогда

ТЕПЛЭТ А ЛЛСОРВ.цт I 257
не может иметь дипольиый момент равным нулю, так
как электрон всегда находится либо по одну сторону
от ядра, либо по другую. Мгновенный дипольный мо-
мент атома аргона будет относительно малым, так
как некоторые из его электронов будут по одну сто-
рону от ядра, а.другие — по другую. Дипольный момент
будет постоянно колебаться по величине и направле-
нию. Так как ориентация в одном направлении совер-
шенно так же вероятна, как и в противоположном,
то средний дипольный момент будет равен нулю.
Обычно при экспериментальном определении ди-
польного момента молекулы действительно измеряют
средний дипольный момент. Если атом аргона помещает-
ся в электрическое поле, то ориентация атома проис-
ходит настолько медленнее скорости движения элек-
тронов, что измеряют среднее по времени значение мгно-
венных дипольных моментов, которое равно пулю.
Поэтому и говорят, что атом аргона не обладает по-
стоянным дипольным моментом.
Имеются, однако, два явления, в которых флюктуи-
рующий диполь оказывается весьма важным. Во-пер-
вых, осциллирующий дипольный момент связан с излу-
чением света; во-вторых, он ответственен за ван-дер-
ваальсово притяжение ме'жду молекулами. Поэтому
оба эти процесса имеют отношение друг к другу, и
Лондон вывел с помощью квантовой механики урав-
нение, которое показывает зависимость ван-дер-вааль-
сова притяжения между двумя атомами от вероятно-
стей различных оптических переходов, которые могут
происходить в атоме. Вследствие связи с явлением
дисперсии света эти притягательные силы были на-
званы дисперсионными силами.
Флюктуирующий дипольный момент в атоме аргона
создает флюктуацию электрического поля вокруг
атома, которая вызывает смещенхте заряда в соседнем
атоме. Смещения должны быть в фазе с флюктуациями.
Сила, действующая со стороны флюктуирующего по-
ля на смещенны11 заряд, в среднем не будет равна
нулю, потому что имеется стремление со стороны
флюктуирующего диполя и индуцированного диполя
17 с. Брунпуер

258 ГЛАВА VI >
двигаться в фазе друг с другом. Результатом этого будет
нритяжение, даваемое выражением
где Г/д — дисперсионная энергия, а — поляризуемость
и
[л^
— средний квадратичный дипольный момент. Это
выражение будет отлично от нуля, даже если средний
дипольный момент равен нулю.
Для целей нашего обсуждения не является необ-
ходимым воспроизводить полное уравнение, которое
Лондон вывел для потенциала дисперсионных сил.
Вместо этого более сложного выражения Лондон со
значительным успехом применил приближенную фор-
мул^г
где
ЛУД
— характеристически!! терм энергии, который
может быть оценен из экспериментально определенно!!
формулы для оптическог! дисперсии газа. Приближе-
ние сводится к замене одним электрическим осцил-
лятором всех осцилляторов, которые составляют атом.
Такая замена оказалась допустимой для некоторых
простых молекул, как атомы благородных газов, во-
дород, азот, метан и т. д.
Проиллюстрируем теперь на примере оценку глав-
ной частоты из дисперс!10нн0й формулы. Упрощен-
ная дисперсионная формула Дрз^де—Фойгта, названная
уравнением Зельмейера, дает соотно!пе!гие между по-
казателем преломления п и частотой света V:
= • (15)
-'О
где — частота электрического осциллятора, ответ-
ственного за рефракцию, а к — константа при данной
температуре и давлении газа. Как показано в табл. 17,
уравнение (15) часто может воспроизвести экспери-
ментальные факты с большой точностью. Данные были
получены К. Катбертсоном и М. Катбертсоном[®] для

т/;пЛ()тл АДСОРБЦИИ г
259
дисперсии света газообразным неоном при 273Д°К и
1 ат давления. Применив значения =3,9160-Ю^^сек-^
и
/г
=2,61303-Ю^' сек-2, они вычислили величины
для п—1, указанные в последнем столбце табл. 17.
Ясно поэтому, что допущение о единственном электри-
ческом осцилляторе частоты V(, достаточно для того,
чтобы воспроизвести дисперсионную кривую неона.
То же самое справедливо для других благородных
газов.
Таблица 17
Дисперсия света неоном при 273,1°К
II ат
(г/ч =
Х)х
10'
см
в вакууме
(п-1)х10'
(г/ч =
Х)х
10'
см
в вакууме
наблюдено
вычислено
54Г,2,23
0725,0 0724,5
4917/10 0737,2
0736,7
4359,54
6754,0
6754,3
4078,98
0766,2
6766,2
4047,68 6767,5 6767,6
3907,56
6774,4
6774,6
3664,10
6789,1
6788,8
3342,42
6812,9
0812,9
3132,59 6832,4 6832,7
3022,37
6844,7
6844,9
2968,13
6851,6
6851,3
2894,44 0861,2
68С0,9
Величина ^'о в уравнении (15) является топ же са-
мой, Что и Ч'о ван-дер-ваальсового потенциала в урав-
нении (14). Лондон[1®] отметил, что для всех газов,
для которых дисперсионная формула могла быть
выражена уравнением (15), энергетический терм
кУо был приближенно равен ионизационному потен-
циалу. Это показано в табл. 18, в столбцах 2 и 3. Вто-
рой столбец показывает энергию ионизации ЛV^, а
третий — величину к))^, вычисленную из дисперсион-
ной формулы (15). Лондон поэтому предположил,
что по крайней мере в первом приближении можно

260
ГЛЛВЛ VII
применять понизадпопный потепцггал вместо ку^ даже
для молекул, дисперсионная формула которых не была
определена.
Мы можем выразить уравнение (14) в форме
= (16)
в котором велнчипа С дается выражением
(17)
В табл. 18 в четвертом столбце помечены поляри-
зуемости молекул и в пятом — значения константы
дисперсионной энергии С. Интересно отметить, что
Таблица 18
Дисперсион[1ый эффе1!т между простыми молекулами
Газ
еУ
Й7„
еУ
•
а. 10^''
СЛЕ^
еУ-сл4®
Не 24,5
25,5
0,20
0,77
Ке 21,5 25,7 0,39
2,93
Лг 15,4 17,5 1,63 34,7
Кг
13,3
14,7
2,46 69
Хе
11,5 12,2 4,00 146
Н,
16,4 0,81
8,3
N. 17,0
17,2
1,74 38,6
0,
13,0 1'1,7 1,57 27,2
СО
14,3 1,99 42,4
сн.
14,5 2,58
73
СОа
15,45 2,85
94,7
С1, 18,2
4,60
288
НС1
13,7 2,63
71
НВг
13,3
3,58
128
И1
12,7
5,4
278
Ка
2,1
29,7
960
величина этой константы показывает изменение в ты-
сячу раз от 1-елия к натрию.
Для молекул, обладающих постоянным дипольным
моментом, ван-дер-ваальсова энергия притяжения полу-
