Жариков В.А. Основы физической геохимии
Подождите немного. Документ загружается.

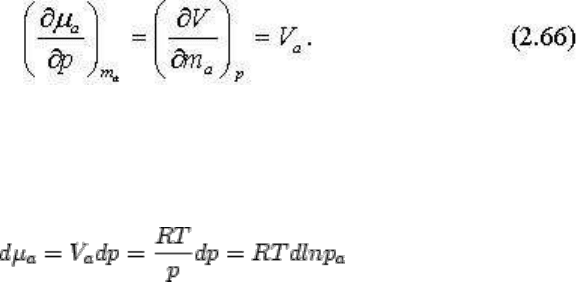
которые подробнее рассмотрены в следующей главе. Здесь обратим внимание на то, что
если производная от G-потенциала по массе компонента всегда химический потенциал
компонента, то производная по мольной доле более сложное выражение - в бинарной
системе она равна разности химических потенциалов компонентов.
Раскроем теперь значение химического потенциала компонента. На основании свойств
уравнения (2.32) как полного дифференциала путем перекрестного дифференцирования
получено соотношение:
Полагая все другие параметры постоянными и заменяя, согласно уравнению Менделеева-
Клайперона V = RT / p, придем к выражению:
(2.128)
которое показывает зависимость химического потенциала компонента от его
парциального давления.
Интегрируя уравнение (2.128), получим:
μ
a
= RTlnp
a
+ C
Физический смысл константы интегрирования виден из следующего: при p
a
= 1, μ
a
= C т.е.
константа представляет значение химического потeнциала компонента при стандартных
условиях, когда парциальное давление компонента равно единице. Обозначим тогда C =
μ
0
a(T)
, показав кроме того, что все операции мы проводим при постоянной температуре
(индекс Т). В итоге получим
μ
a
= μ
0
a(T)
+ RTlnp
a
+ RTlnx
a
(2.130)
и, включив RTlnp в член μ
0
a(T)
получим следующее выражение:
μ
a
= μ
0
a
+ RTlnx
(2.131)
где μ
0
a
- константа, которая уже зависит и от температуры, и от давления (ниже мы
раскроем эти зависимости), и представляет химический потенциал чистого компонента
(при x
a
= 1, μ
a
= μ
0
a
) при данной температуре и давлении. Обычно индексы T и p опускают,
предоставляя читателю возможность судить о характере константы по выражению члена,
зависящего от состава. Соответствующий член, кроме представленных уравнениями
(2.120) и (2.131), может быть также выражен, как мы покажем ниже, и в единицах
концентрации (весовой или мольной). Обратим внимание, что величина μ
0
a
будет
различна при разных способах задания или описания состава системы.

Два важных соотношения, непременно встречающихся в дальнейшем, получим
дифференцированием уравнения (2.131):
dμ
a
= RT dlnx
a
(2.131)
Рассмотрим теперь зависимость химического потенциала какого-либо инертного
компонента от температуры, давления и других параметров системы. Пусть задана
равновесная изотермо-изобарическая система с вполне подвижными компонентами, в
которой μ
a
= ƒ(T, p, m
a
,..., m
i
, μ
j
,...,μ
k
) поскольку в состоянии равновесия любой параметр
системы представляет однозначную функцию k+2 факторов состояния. Поэтому можно
записать
Путем перекрестного дифференцирования членов уравнения G
m
- термодинамического
потенциала системы, как это было показано выше, получим:
Уравнения (2.66), (2.74) и (2.75) показывают, что химический потенциал (химическая
энергия) компонента увеличивается с возрастанием давления и уменьшается с
повышением температуры и возрастанием химического потенциала вполне подвижного
компонента, пропорционально соответственно парциальным мольным объему и энтропии,
а также массе вполне подвижного компонента.
Выражая, как принято количества компонентов через их мольные доли соответственно
получим:

Принимая мольные доли и химические потенциалы других компонентов постоянными
(или пренебрегая их влиянием на μ
a
) и используя (2.133) получим выражение
дифференциальной зависимости μ
a
от температуры, давления и мольной доли компонента
а:
dμ
a
= -S
a
dT + V
a
dp + RT dlnx
a
(2.137)
Сопоставляя уравнения (2.137), (2.131), (2.132), нетрудно видеть, что: а) выражение
(2.132) справедливо только при постоянных Т и р; б) член μ
0
a
включает значения S
a
и V
a
при данных Т и р; в) при изменении Т и р величина μ
a
изменяется в соответствии с (2.137),
а величина μ
0
a
- в соответствии с dμ
0
a
= -S
a
dT + V
a
dp. Учитывая двойственную
зависимость химического потенциала от Т и р, с одной стороны, и от концентрации
компонента, с другой, удобно принять следующие обозначения. Член μ
0
a
обозначить как
стандартный химический потенциал компонента, а концентрационный член RTlnx
a
обозначить как эффективный химический потенциал компонента. Очевидно, что вполне
подвижный режим компонентов выражается через независимое изменение их
эффективных химических потенциалов.
Выше, как и в большинстве разделов этой главы для выражения относительного
содержания компонента использовалась его мольная доля. В определенных случаях (при
практической работе нередко) целесообразно вместо мольной доли применять
концентрацию компонента выражая ее через молярность (число молей растворенного
компонента на 1000 см
3
раствора) или моляльность (число молей растворенного вещества
на 1000 г раствора).
Молярная концентрация компонента i равна
(2.138)
где V - объем раствора содержащего m
i
молей растворенного компонента i. Для
разбавленных растворов с хорошим приближением V ≅ m
sol
V
0
sol
где V
0
sol
- мольный объем
растворителя. Тогда
или
x
i
≅ C
i
V
0
sol
(2.139)
подставляя последнее выражение в μ
i
, получим
μ
i
= μ
0
i
RTlnV
0
sol
+ RTlnC
i
= μ*
i
+ RTlnC
i
(2.140)
где μ
0
a
и RTlnV
0
sol
зависят только от T, p и природы растворителя и объединены в μ*
i
. При
этом важно, что μ
0
a
≠ μ*
a
, а условие стандартизации μ*
a
= μ
a
при концентрации раствора,

равной единице (1 моль/литр). Уравнения (2.137) и (2.140) справедливы, естественно, для
растворов свойства которых являются идеальными.
Обратим внимание на следующее. Если оказывается, что воздействием других
компонентов на μ
i
нельзя пренебречь, т. е. система является не идеальной, то это влияние
учитывается не путем решения последних членов уравнения (2.133), а введением
суммарных поправочных коэффициентов активности и заменой мольной доли в
уравнениях (2.129), (2.131), (2.137) и концентрации в (2.140) на активность компонента.
Рассмотрим это подробнее.
Идеальные и реальные растворы
Остановимся на краткой характеристике термодинамических свойств растворов. Как
известно, по своим физико-химическим свойствам, отражающим особенности поведения
компонентов, растворы разделяются на идеальные и неидеальные (или реальные).
Идеальные растворы характеризуются следующими термодинамическими признаками.
1. Парциальные мольные объемы компонентов не зависят от состава и концентрации
раствора, объемный эффект смешения равен нулю:
1. Парциальные мольные объемы компонентов не зависят от состава и концентрации
раствора, объемный эффект смешения равен нулю:
V
i
= V
0
i
(при 0 < x
i
≤ 1), ΔV
mix
= 0,
(2.141)
откуда непосредственно следует
2. Парциальные мольные энтальпии и энергии компонентов не зависят от состава и
концентрации раствора, или, что то же, теплота (энтальпия) и энергия смешения равны
нулю:
H
i
= H
0
i
(при 0 < x
i
≤ 1), ΔH
mix
= 0,
(2.143)
U
i
= U
0
i
(при 0 < x
i
≤ 1), ΔU
mix
= 0,
(2.144)
откуда также следует:
3. Парциальная мольная энтропия компонента при растворении возрастает на величину,
равную -Rlnx
i
:
ΔS
i
mix
= S
i
- S
0
i
=-Rlnx
i
,
(2.147)
и для всего раствора
Из последнего заключения можно сделать вывод о том, что причина образования
идеального раствора состоит в возрастании энтропии при смешении. Этот вывод не столь
очевиден, как первые два свойства, покажем его кратко. Взяв производную по
температуре от уравнения (2.131) для i-ого компонента, получим:
но, согласно (2.74),
подставляя сразу, имеем искомое:
ΔS
i
mix
= S
i
- S
0
i
= -Rlnx
i
,
(2.147)
Согласно свойствам парциальных величин (уравнение 2.88):
тогда энтропия смешения всех компонентов раствора
4. Термодинамический потенциал раствора, как было показано выше, равен:
или, подставляя μ
a
,
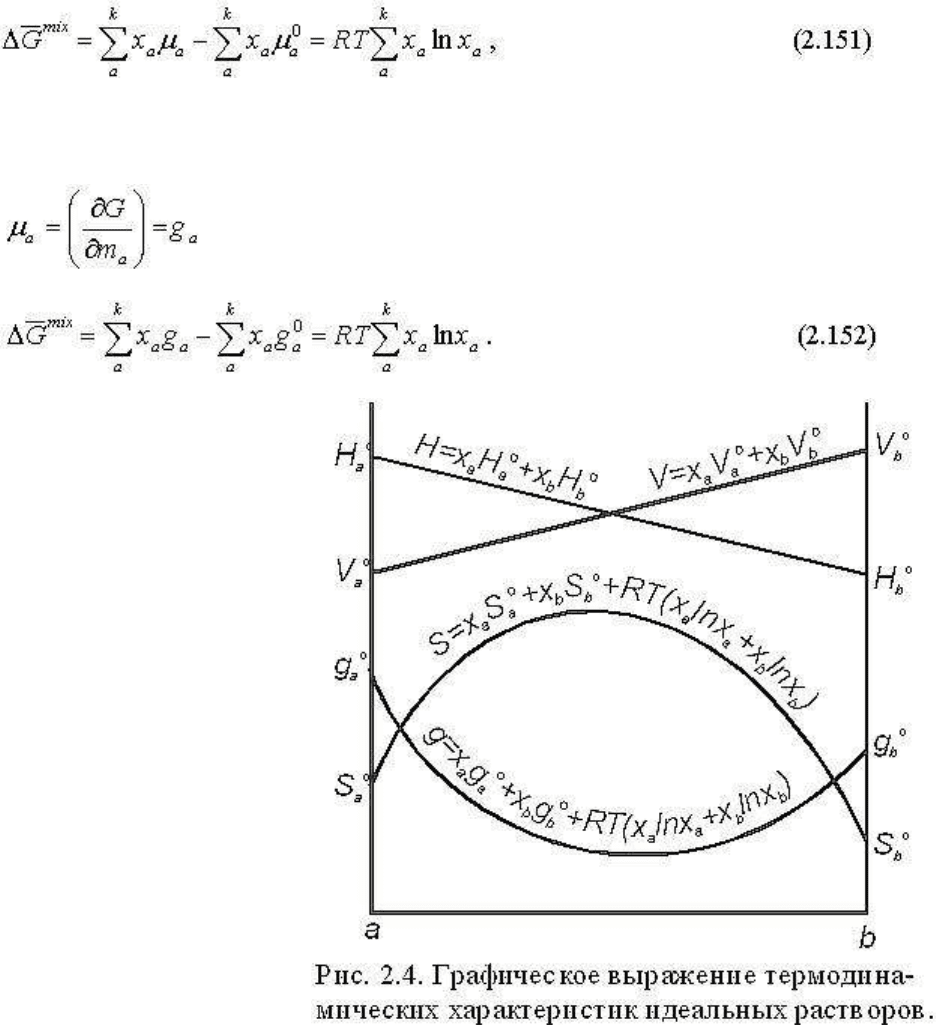
Свободная энергия смешения в соответствии с (2.144) выразится как
поскольку нередко принято выражать μ
a
через
, то уравнение (2.145) можно записать как
Из уравнений (2.150)-(2.152)
следует, что свободная
энергия (термодинамический
потенциал) уменьшается при
образовании идеального
раствора и соответственно
всегда меньше, чем у
механической смеси того же
состава. Этот вывод очевиден
и из соотношения ΔG
mix
=
ΔH
mix
- TΔS
mix
: при ΔH
mix
= 0
и ΔS
mix
> 0 ΔG
mix
< 0. Для
иллюстрации полученных
зависимостей на рис.2.4
представлены графики
V=f(x), H=f(x), S=f(x) и
G=f(x) для бинарного
идеального раствора.
Рассмотренные соотношения представляют фундаментальное определение идеальных
растворов. Только соблюдение всех условий обеспечивает такие свойства растворов,
которые определяются как идеальные. Используя эти соотношения, а также
установленные ранее общие термодинамические зависимости, можно описать различные
термодинамические свойства идеальных растворов.
Обратим внимание на следующее. Вместо перечисленных выше условий идеальности
можно равнозначно определить идеальный раствор как таковой, для которого, в
определенной области Т и p, для всех компонентов выполняется соотношение:
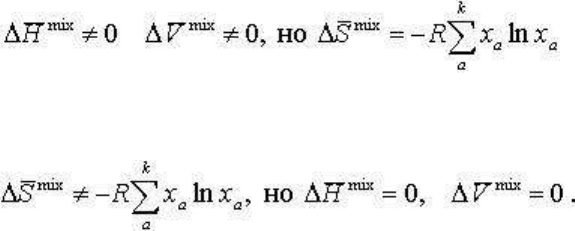
μ
i
= μ
i
0
+ RTlnx
i
,
(2.131)
т. е. химический потенциал любого компонента зависит только от Т и p и мольной доли
(или концентраций, или парциального давления) этого компонента. Из уравнения (2.131)
(сходно тому, как показано условие ΔS
i
mix
= - Rlnx
i
) выводятся все названные выше
условия идеальности.
В принципе, рассмотренные условия идеальности полностью равнозначны. Первые имеют
более наглядный физический смысл, вторые - более общее и компактное, поэтому
использование их определяется конкретными задачами изложения или исследования.
Неидеальными растворами называют такие, для которых не выполняется по крайней
мере одно из перечисленных условий идеальности. Существует несколько различных
классификаций неидеальных растворов, но с термодинамических позиций доминирует
разделение растворов в зависимости от нарушенных (и выполненных) трех условий
идеальности. Выделяют:
а) регулярные растворы, для которых
и б) атермические растворы, в которых
Такое разделение существенно для вычисления различных термодинамических
параметров растворов, но для нашей цели предпочтительно вначале обратиться к
обобщенной характеристике неидеальных растворов. Такая обобщенная характеристика
состоит в введении особой термодинамической функции (что было впервые сделано
Г.Льюисом), называемой термодинамической активностью, или просто активностью.
Активность i-ого компонента a
i
определяется cоотношением
a
i
= γ
i
x
i
,
(2.153)
где x
i
- мольная доля компонента i, а γ
i
коэффициент активости i-ого компонента,
суммарно отражающий отклонение режима компонента от идеального. Тогда химический
потециал i-го компонента будет равен
μ
i
= μ
i
0
+ RTlna
i
,
(2.154)
Уравнение (2.154) является фундаментальной зависимостью термодинамики неидеальных
растворов. Оно показывает, что реальные растворы подчиняются всем законам идеальных
растворов и на них распространяются все термодинамические соотношения, если вместо
мольной доли (или соответствующего ее параметра) состав раствора будет
охарактеризован термодинамической активностью компонента. Несколько упрощая,
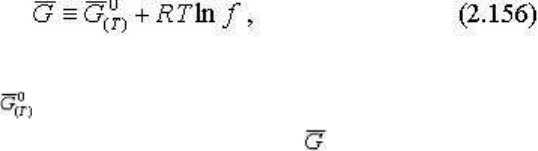
можно сказать, что активность представляет реальную термодинамическую или
эффективную концентрацию неидеального раствора.
Первостепенное значение имеет установление соотношений между активностью и
формами задания или описания состава растворов, а также необходимых при этом
условий стандартизации.
Активность связана с мольной долей или концентрацией компонента следующей
зависимостью:
a
i
= γ
i
x
i
,
(2.153)
или
a
i
= γ
i
*C
i
,
(2.155)
где γ
i
- коэффициент активности, выражающий степень отклонения раствора от
идеального поведения. Состояния, когда γ
i
> 1, называют положительными отклонениями
от идеальности, состояния γ
i
< 1 - отрицательными, тогда как γ
i
= 1 очевидно
характеризует идеальный раствор. Коэффициент активности зависит от индивидуальных
свойств вещества, от температуры, давления, состава, концентрации растворов и имеет
различное значение при разных способах выражения концентрации раствора (γ
i
≠ γ
i
*, так
как x
i
≠ C
i
). В качестве стандартных состояний для твердых и жидких растворов
принимают состояние чистого компонента, полагая, что в этом состоянии γ
i
= 1 и a
i
=1.
Однако для жидких растворов существует и другой выбор стандартного состояния, когда
для растворителя принимают а=1 при x=1, а для растворенного компонента i в качестве
стандартного выбирают бесконечно разбавленный раствор, полагая a
i
→ x
i
при x
i
→ 0 и
приблизительно lim γ
i
= 1 при x
i
→ 0. Такая стандартизация имеет ясный физический
смысл: при уменьшении концентрации растворы все более приближаются к идеальным.
Выражение химического потенциала через молярную концентрацию справедливо, как мы
отмечали, для идеальных растворов и если при C=1 моль/литр μ
0
≠ μ
i
0
, то γ
i
* также
отлично от нуля и a
i
→ C
i
при γ
i
* → 1 по мере разбавления раствора.
Для газовых смесей введение активностей оказывается недостаточно для полного
описания отклонений газов от идеального режима. Установлено, что поведение многих
индивидуальных однокомпонентных газов при различных Т и р отличается от идеального.
Для термодинамической характеристики таких газов введено понятие фугитивности или
летучести (предложенное также Г. Льюисом), которое определяется соотношением
где ƒ - летучесть, - значение изотермо-изобарического потенциала, зависящее только от
температуры. Для однокомпонентной системы = μ, тогда, сравнивая с (2.126), уравнение
(2.135) можно представить как
μ
i
= μ
0
i(T)
+ RTlnƒ
i
0
,
(2.157)
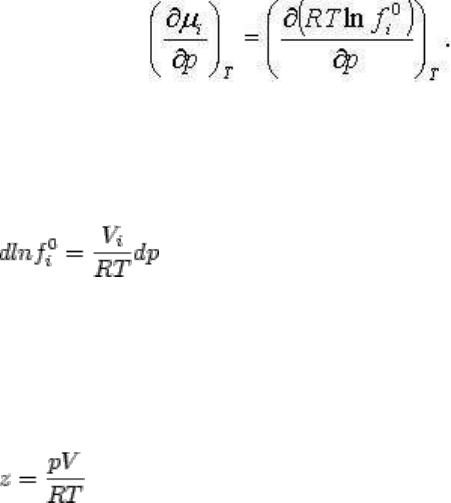
где ƒ
i
0
- летучесть чистого газового компонента, поскольку символом ƒ
i
обозначается
обычно летучесть компонента i в газовой смеси в соответствии с зависимостью
ƒ
i
= ƒ
0
i
x
i
,
(2.158)
Физическую сущность летучести можно наглядно представить, взяв производную по р от
(2.157) при T = const:
Подставляя значение левой части (из уравнения (2.66)), преобразовывая и переходя к
обычной производной, получим
(2.138)
Нетрудно убедиться, что если газ характеризуется идеальными свойствами, т. е.
подчиняется закону pV=RT, то dlnƒ
i
0
= dlnp
i
. Если это соотношение нарушается, то
летучесть представляет эффективное газовое давление, которое определяется
зависимостью V
i
от давления или в общем виде сжимаемостью газа:
,
(2.160)
где z = 1 для идеального газа, z > l характеризует положительные, а z < 1 отрицательные
отклонения от идеальности. Отклонение газов от идеальности может быть в общем виде
оценено через коэффициент летучести или фугитивности θ
i
, определяемый соотношением
θ
i
= ƒ
i
0
/ p
i
0
,
(2.161)
Коэффициент летучести зависит от Т, р, индивидуальных свойств газов и может быть с
известным приближением рассчитан. В качестве стандартного состояния при расчетах
летучестей принимается условие, когда давление равно одной атмосфере (т. е. θ
i
= 1 при
p=1 атм).
Кроме отклонений индивидуальных газов от идеальности в зависимости от Т и р следует,
так же как для жидких и твердых растворов, через активности охарактеризовать
поведение газов в смесях. Из известных зависимостей (легко вспомнить законы Рауля):
p
i
= p
i
0
x
i
,
(2.162)
ƒ
i
= ƒ
0
i
x
i
,
(2.158)
нетрудно видеть, что отношения ƒ
i
/ƒ
0
i
и p
i
/p
i
0
равны мольной доле идеального и реального
газа в идеальной газовой смеси (растворе). Для неидеальной газовой смеси по аналогии с

жидкими растворами это соотношение должно быть исправлено на коэффициент
активности. Тогда
,
(2.163)
и
,
(2.163)
где а
i
- активность газового компонента. Химический потенциал газового компонента в
неидеальной смеси имеет такое же выражение, как и для жидкого раствора:
μ
i
= μ
0
i
+ RTlna
i
= μ
0
i
+ RTlnx
i
+ RTlnγ
i
,
(2.165)
Условия стандартизации газовых растворов аналогичны жидким: при определенных Т и р
a
i
→ 1 при x
i
→ 1 и при x
i
→ 1 γ
i
→ 1.
Поскольку в реальных растворах химический потенциал компонента зависит от
активности компонента, уравнения мольного термодинамического потенциала и
химического потенциала в дифференциальной форме будут иметь вид
dμ
i
= -S
i
dT + V
i
dp + RTdlna
i
= -S
i
dT + V
i
dp +
RTdlnx
i
+ RTdlnγ
i
,
(2.166)
Сопоставляя это выражение с уравнениями (2.133) и (2.134) можно видеть, что член
RTdlnγ
i
выражает влияние других компонентов на μ
i
, описывая отклонение от
идеальности компонента i.
Рассмотрим теперь некоторые главные термодинамические функции реальных растворов.
Мольный изотермо-изобарический потенциал реального раствора будет равен
Сопоставляя это выражение с уравнением (2.150), нетрудно видеть, что первые два члена
уравнения (2.167) равны уравнению (2.150) и представляют термодинамический
потенциал идеального раствора. Тогда уравнение (2.167) можно представить как
т. е. свободная энергия реального раствора равна сумме свободной энергии идеального
раствора (2.150)
