Жариков В.А. Основы физической геохимии
Подождите немного. Документ загружается.

Рассчитаем К
с
= [K
+
] / [H
+
], где [K
+
], [H
+
] -
концентрации ионов калия и водорода для
условий а) Т=298К, 1 бар и б) Т=573К
(300
о
С), 673К (400
о
С), 773К (500
о
С) и
р=1000 бар. Формула расчета
. Результаты расчетов,
выполненных обычным способом, как и в
вышеприведенных случаях, показаны в
табл.4.16.
Для стандартных условий (298К, 1 бар) в
результате расчетов получаем совершенно
нереальное значение lgK
с
=6,83, [K
+
] / [H
+
]
= 6.8
.
10
6
, которое показывает, что в
стандартных условиях эта реакция
метастабильна.
Таблица 4.16 Термодинамические данные для расчета моновариантной кривой реакции
1,5Kfs+Н
+
= 0,5Mc+3Q + К
+
298К
(25
o
С)
573К
(300
o
С)
673К
(400
o
С)
773К
(500
o
С)
V,
см
3
/моль
ΔG
f
мусковита (ккал)
-1337,4
-1253,9
-1223,8
-1194,0
140,7
ΔG
f
кварца (ккал)
-204,5
-192,5
-188,1
-183,6
22,7
ΔG
f
калиевого полевого
шпата (ккал)
-893,6
-843,2
-824,9
-806,8
108,7
ΔG
R
f K
+
(ккал)
-67,5
принято - 67,5
ΔG
R
T,p
(кал)
9300
6858
6758
6158
lg К
с
= lg ([K
+
] / [H
+
])
6,83
2,62
2,20
1,74
При расчете реакции для 300
o
С возникает вопрос о значении ΔG
K
+
при этой температуре.
Надежные данные по величине ΔG
K
+
для температур 300-500
o
С и давления 1000 бар
отсутствуют. Прогнозные данные противоречивы: одни исследователи указывают на
уменьшение ΔG
K
+
с повышением температуры, другие - на увеличение. В наших расчетах
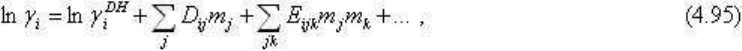
принято ΔG
K
+
=-67,5=const для температур 300
o
, 400
o
и 500
o
С (Основанием этому
допущению послужило соображение об эквивалентном изменении ΔG
H
+
,
компенсирующем изменение ΔG
K
+
). Для того, чтобы проверить справедливость такого
предположения была рассчитана реакция 1.5KAlSi
3
O
8
+ HCl = 0.5KAl
3
Si
3
O
10
(OH)
2
+ 3SiO
2
+ KCl для Т=300
o
С (573К). Оказалось, что lg ([KCl] / [HCl]) = 2.66, что вполне
сопоставимо с lg К
с
573
= lg ([K
+
] / [H
+
]) = 2.62 и разница объясняется не учетом степени
диссоциации KCl и HCl.
В табл.4.15 представлены также расчеты реакции (4.92) для 400 и 500
o
С. Константы
соответствия равны lg К
с
673
= lg ([K
+
] / [H
+
]) = 2.20, lg К
с
773
= lg ([K
+
] / [H
+
]) = 1.74. На
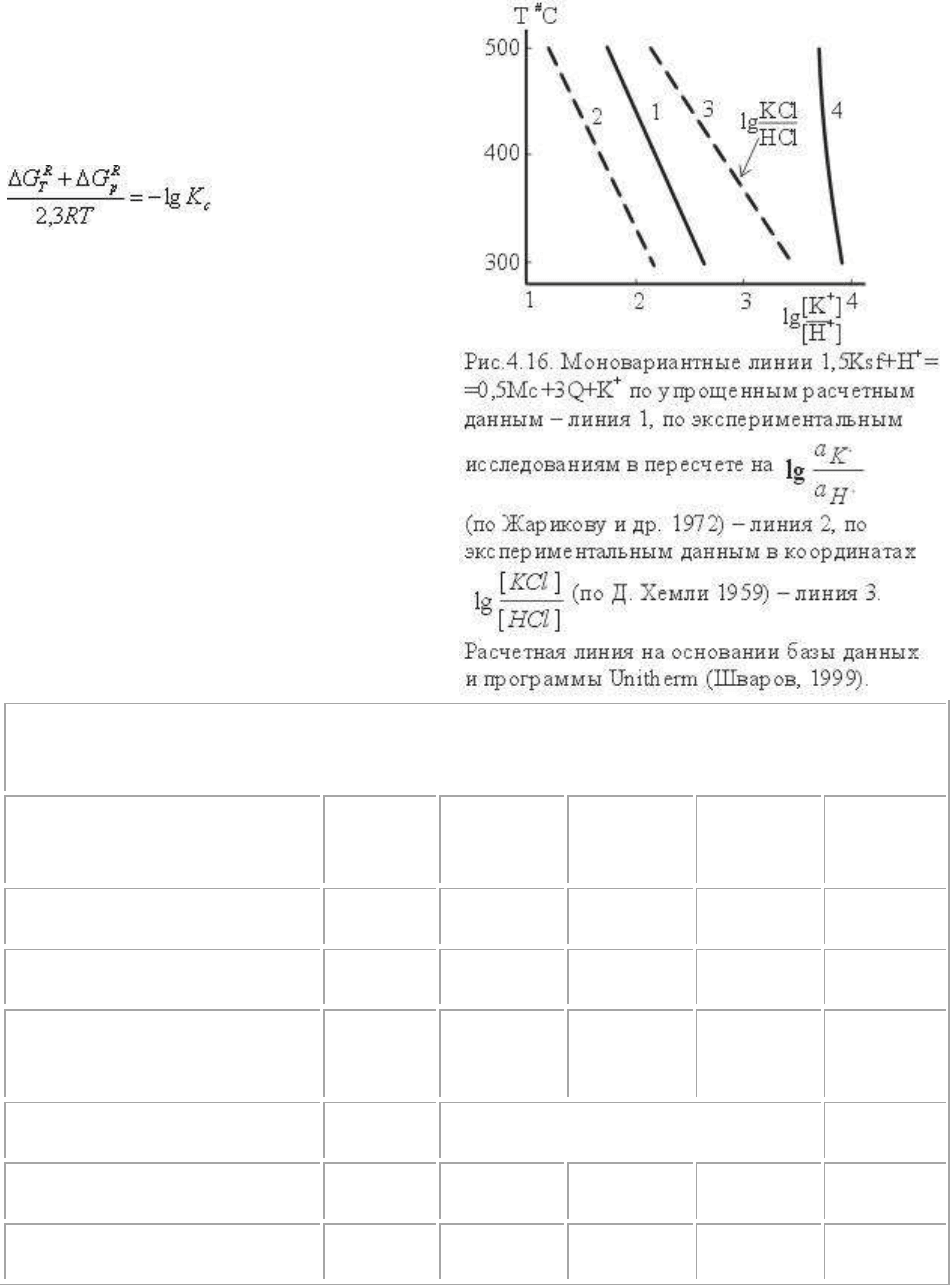
рис.4.16 под номером 1 нанесена расчетная моновариантная линия, а под номером 2,
изученная нами экспериментальная кривая (Жариков и др., 1972), пересчитанная с учетом
степени диссоциации и коэффициентов активности с экспериментальной кривой в
координатах T-lg ([KCl] / [HCl]). Линия 3 обозначает экспериментальную
моновариантную линию, полученную Дж.Хемли (1959) в координатах T-lg ([KCl] / [HCl])
при давлении 1000 бар. Сопоставляя моновариантные линии можно видеть, что расчетная
линия (1) дает неплохую ориентировку в общей зависимости и величинах константы
равновесия. Различия между координатами моновариантных линий связано с несколькими
причинами: степенью диссоциации KCl и HCl, величинами свободной энергии ионов и,
главное, величинами коэффициентов активности и зависимостью всех этих параметров и
свойств воды как растворителя от температуры. Количественная оценка всех этих
параметров - задача непростая и прежде всего она в обобщенном виде выражается в
зависимости коэффициентов активности вполне подвижных компонентов.
Поэтому следующая, более сложная задача - расчеты равновесий с активностями
ионизированных вполне подвижных компонентов. Наиболее простым приближением,
вполне удовлетворительным для разбавленных электролитов (до 2 М) 1:1 и 1:2, и близких
к нормальным температурам, является предельное уравнение Дебая-Хюккеля:
lg γ = -A|Z
1
Z
2
|√Y
(4.94)
где ионная сила Y = 1/2∑m
i
L
i
2
, коэффициент А, равный 1.823
.
10
6
/ (DT)
3/2
, зависит от
температуры непосредственно и через D - диэлектрическую проницаемость среды.
Для более сложных по составу и более концентрированных растворов приходится вводить
поправки на сложное взаимодействие многих ионов. Это выражено в уравнении Питцера:
где первый член вычисляется по предельному уравнению Дебая-Хюккеля, коэффициенты
D
ij
, E
ijk
и т.д. - эмпирические, выражающие различные типы взаимодействия. Они
определяются экспериментально. Кроме уравнения Питцера существуют другие подходы
к вычислению коэффициентов активности ионов в сложных растворах, например модель
Харви с коллегами (модель HMW) и др.
Для высоких температур и давлений определение коэффициентов активности или
избыточной свободной энергии представляет собой весьма сложную задачу. Попыткам
решения еѐ посвящены исследования крупных физико-химиков и геохимиков.
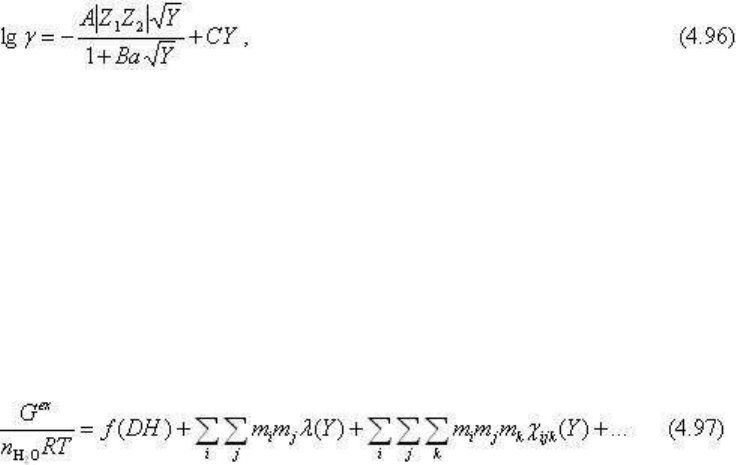
Наметилось несколько подходов. Прежде всего, это усложнение уравнения Дебая-
Хюккеля, представленного в виде:
где коэффициент А существенно зависит от температуры и давления (напомним, что от
давления зависит плотность раствора и , следовательно, его диэлектрическая
проницаемость), коэффициент В изменяется с Т и р, но незначительно, а - средний
диаметр ионов, коэффициент С - эмпирический и зависит от концентрации и состава
растворов (при необходимости выражается более сложной зависимостью, например, в
виде многочлена или частичного ряда). Правильность расчета всегда проверяется
экспериментом.
Другие подходы выражаются в расчете избыточной свободной энергии. Для стандартных
условий избыточная свободная энергия G
ex
(см. выше) связана с уравнением Питцера
соотношением:
Зависимость G
ex
от Т и р вычисляется по сложным уравнениям, поскольку приходится
учитывать зависимость от Т и р свойств растворителя (плотность, диэлектрическая
проницаемость, степень диссоциации), изменения свойств ионизированных частиц
(степень диссоциации, параметры межионного взаимодействия, теплоемкости, мольные
объемы и некоторые другие параметры). Поэтому не имеет смысла приводить здесь эти
сложные уравнения, тем более в учебных целях. Для этого интересующиеся должны
обратиться к специальным работам Питцера, Хельгессона, Харви, Уира, Рыженко и др.
(см., например, книгу "Термодинамическое моделирование в геологии", 1992). Заметим,
что кроме исследователей, непосредственно разрабатывающих эти проблемы, все другие
пользуются расчетными компьютерными программами, составленными на основании
одной из моделей и соответствующей согласованной базе данных. Такой программой
является, например, разработанная Ю.В.Шваровым на кафедре геохимии МГУ программа
UNITHERM. Рассматриваемая линия равновесия, рассчитанная по программе UNITHERM
нанесена на рис.4.16 линией 4. Отличия в lg (a
K
+
/ a
H
+
), показываемые этой кривой,
связаны с условиями стандартизации: в программе UNITHERM принято ΔG
H
+
= 0 для всех
температур. Мы отмечали выше, что это приводит к искусственной - условной шкале ΔG
ионов. Для реакций, в которых водород не участвует, это допущение не сказывается на
константах реакции, поскольку соответствующее искажение вносится для всех ионов и
тем самым компенсируется в обменных ионных реакциях. Однако в тех случаях, когда
активность ионов водорода (или pH) является независимым параметром, не учет реальных
значений ΔG
H
+
приводит к заметным отличиям от констант равновесия, полученных из
экспериментальных данных. Например, для сопоставимости расчетной кривой (кривая 4)
с экспериментальными следовало бы принять:
ΔG
H+
= ΔG
H+
298
- S
H+
(T-298) = 0 - (20 -:- 25)(T - 298) кал/моль,
т.е. учесть зависимость ΔG
H
+
от температуры.
При этих данных линия 4 была бы близка к линии 1. Это можно проверить тщательным
перерасчетом экспериментальных кривых, полученных в координатах lg ([KCl] / [HCl])
или lg ([K
+
][OH
-
]), или в координатах lg (a
K
+
/ a
H
+
).
Эффективное решение сложных задач, подобных рассмотренной выше, возможно
единственным разумным путем: эксперимент → теоретический обсчет результатов и
прогнозный расчет → эксперимент → корректировочный и прогнозный расчет →
контрольный эксперимент → дополнительные эксперименты, выявляющие физико-
химический смысл эмпирических коэффициентов → теоретическая (системная)
генетическая модель (или какое-то приближение к ней).
Вместо заключения.
Выше были изложены основы, необходимые для того чтобы приступить к решению
многообразных задач физической геохимии. Для решения одних из них достаточно
изложенных методов, надо только наполнить задачи конкретным содержанием, т.е.
численно охарактеризовать параметры, описывающие изучаемый объект или процесс.
Другие проблемы требуют дальнейшего развития и углубления изложенных методов. И
то, и другое уже является исследовательской работой в области физической геохимии,
подготовить к которой заинтересованного специалиста было целью предлагаемой книги.
Во введении отмечалось, что создание физико-химических моделей является
неотъемлемой частью познания любого природного процесса, венчающей представление
о его генезисе.
Несмотря на значительные успехи в развитии физической геохимии - нерешенных
проблем значительно больше. Они касаются всех геосфер, всех типов объектов и
процессов. Особенно важно наряду с общими моделями создание количественных
генетических моделей отдельных объектов, позволяющих значительно глубже проникнуть
в существо природных процессов.
Литература.
Основная
Базаров И.П. Термодинамика.М.,Физматгиз, 1961.
Белянкин Ю.С., Лапин В.В., Торопов Н.А. Физико-химические системы силикатной
технологии. М., Промстройиздат, 1954.
Гаррелс Р.М., Крайст Ч.Л. Растворы, минералы, равновесия. М., Мир, 1968.
Герасимов Я.И.и др. Курс физической химии. Т.1. М., Госхимиздат, 1963.
Грот де. С., Мазур Г. Неравновесная термодинамика. Мир. 1964.
Жариков В.А. Основы физико-химической петрологии. Изд-во МГУ, 1976.
Заварицкий A.Н., Соболев В.С. Физико-химические основы петрографии изверженных
пород. М., Госгеолтехиздат, 1961.
Керн Р., Вайсброд А. Основы термодинамики для минералогов, петрографов и геологов.
М., Мир, 1966.
Коржинский Д.С. Теоретические основы анализа парагенезисов минералов. М., Наука,
1973, 288 с.
Минералы. Диаграммы фазовых равновесий (справочник). Вып.1 и 2. М., Наука, 1974.
Наумов Г.Б., Рыженко Б.Н., Ходаковский И.Л. Справочник термодинамических величин.
М., Атомиздат, 1971.
Ниггли П. Магма и ее продукты. М., Госгеолиздат, 1946.
Перчук Л.Л., Рябчиков И.Д. Фазовое соответствие в минеральных системах. М., Недра,
1981.
Gugenheim E. A. Thermodynamics. Amsterdam, 1950.
Robie R.A.,Hemingway B.S., Fishen J.R. Thermodynamic properties of minerals and related
substances at 298, 15K (25
o
C) and 1 bar (105 Pascals) pressure and at higher temperature.
Washington, 1979.
Дополнительная
Бабушкин В.И., Матвеев Г.М., Мчедлов-Петросян О.П. Термодинамика силикатов. М.,
Атомиздат. 1972.
Борисов М.В., Шваров Ю.В. Термодинамика геохимических процессов. М., Изд-во МГУ,
1992.
Булах А.Г., Булах К.Г. Физико-химические свойства минералов и компонентов
гидротермальных растворов. Л., Недра, 1978.
Булах А.Г., КривовичевВ.Г., Золотарев А.А. Формулы минералов. Термодинамический
анализ в минералогии и геохимии. Изд-во. СПб университета, 1995.
Валяшко М.Г., Кравчук К.Г., Коротаев М.Ю. Фазовые состояния бинарных водных
растворов неорганических веществ при высоких температурах и давлениях. Обзоры по
теплофизическим свойствам веществ, N 5. М., 1984.
Винклер Г. Генезис метаморфических пород. М., Недра.
Вуд Б., Фрейзер Д. Основы термодинамики для геологов. Под редакцией чл.корр. АН
В.А.Жарикова. М., Мир, 1981.
Гиббс Дж.В. Термодинамические работы. Гостехиздат, 1950.
Гугенгейм Э.А. Cовременная термодинамика, изложенная по методу Гиббса. М.,
Госхимиздат, 1941.
Жариков В.А. Термодинамическая характеристика необратимых природных процессов
//Геохимия, 1965, N10.
Жариков В.А. Режим компонентов в расплавах и магматическое замещение. //Проблемы
петрологии и генетической минералогии. т.1. М., Наука, 1969.
Жариков В.А. Критерии кислотности процессов минералообразования. //Кислотно-
основные свойства химических элементов, минералов, горных пород и природных
растворов. М., Наука, 1982.
Жариков В.А. Парциальные величины в системах с в.п.к. //Очерки физико-химической
петрологии. М., Наука, 1987.
Жариков В.А. Экспериментальное изучение процессов образования горных пород и руд //
Вестник АН СССР.1988. N8. С.29-41.
Жариков В.А. Физико-химическая геология (состояние и прогноз развития научного
направления) // Изв. АН СССР. сер. геол. 1988. N3.
Жариков В.А. А.П.Виноградов и современная геохимия//Вестн. Моск. ун-та, Сер.4,
Геология, 1995, N5.
Жариков В.А., Власова О.К. Контактовые роговики и скарны Майхуры. //Физико-
химические проблемы формирования горных пород и руд. М., Изд-во АН СССР. 1961.
Жариков В.А., Горбачев Н.С. Распределение редкоземельных элементов и иттрия между
флюидом и базальтовым расплавом при Т = 1100
o
С в интервале Р = 1-12 кбар // ДАН 1999.
Т.367. N4.
Жариков В.А., Иванов И.П., Литвин Ю.А., Ишбулатов Р.А. Экспериментальные
исследования плавления пород щелочно-земельной серии при давлении 35 килобар. //
ДАН СССР. 1974.Т.219. N2.
Жариков В.А., Иванов И.П., Литвин Ю.А., Ишбулатов Р.А. Экспериментальное изучение
плавления пород щелочно-земельной серии при давлении 45 килобар //ДАН СССР. 1975.
Т.220, N4.
Жариков В.А., Иванов И.П., Фонарев В.И. Минеральные равновесия в системе К2О -
Аl2O3 - SiO2 - H2O. М., Наука, 1972, 160 с.
Карпов И.К., Кашик С.А., Пампура И.К. Константы веществ для термодинамических
расчетов в геохимии и петрологии. М.,Наука,1968.
Коржинский Д.С. Теория метасоматической зональности. М., Наука, 1969, 1972.
Льюис Г., Рендал М. Химическая термодинамика. М., ОНТИ. 1936.
Маракушев А.А. Петрология метаморфических горных пород. М., Изд-во МГУ, 1974.
Мюнстер А. Химическая термодинамика. М., Мир, 1971.
Ниггли П. Магма и ее продукты. М., Госгеолтехиздат, 1946.
Перчук Л.Л. Равновесия породообразующих минералов. М., Наука, 1970.
Пригожин И., Дефай Р. Химическая термодинамика. М., Наука, 1968.
Равич М.И. Водно-солевые системы при повышенных температурах и давлениях. М.,
Наука,1974.
Саксена С. Термодинамика твердых растворов породообразующих минералов. М., Мир,
1975.
Самайлович А.Г. Термодинамика и статистическая физика.Гостехтеориздат, 1955.
Скрейнемакерс Ф.А. Нонвариантные, моновариантные и дивариантные равновесия. М.,
ИЛ, 1948.
Файф У., Тернер Ф., Ферхуген Дж. Метаморфические реакции и метаморфические фации.
М., ИЛ, 1962.
Элерс Э. Интерпретация фазовых диаграмм в геологии. М., Мир, 1975.
Barth T.F.W. Theoretical Petrology. J.Wileyd Sous New York Chapman and Hall London, 1952.
Burnham C.W. Hydrothermal fluids at magmatic stage // Geochemistry of hydrothermal ore
deposits, N4. Holt, Rinerort, Winstou, 1967. Пер. в кн. Геохимия гидротермальных рудных
месторождений.М., Мир, 1970.
De Donder Th. L'Affinite. Paris, Gauthie-Villars. Part 1., 1927; Part 2., 1931; Part 3., 1934.
E - an - Zen. Construction of pressure-Temperature Diagrams for Multicomponent Systems after
the method of Screinemakers. //Bull. Geol. Soc. of Am., 1965, N 1225.
Fluids in the Crust. Equlibrium and transport properties. Chapman and Hall, 1995, 323 p.
Kennedy G.C. A portion of the system silica-water // Econ. Geol. 1950, v.45.
Luth W.S. The system NaAlSi
3
O
8
-SiO
2
and KAlSi
3
O
8
-SiO
2
to 20 kbar and the relationship
between H2O content to P
H2O
and P total in granitic magmas // Am. J. Sci., 1969, Vol. 267A.
Masson C.R. An approch to the problem of ionic distribution in liquid silicates // Proc. Roy. Soc.
1965. Vol. 287.
Pabolaw R.T., Pitzer K.S. Thermodynamics of concentrated electrolyte mixtures and the
prediction of mineral solubilites to high temperatures for mixture in system Na - K - Mg - Cl -
SO
4
- OH - H
2
O // Geochem. at Cosmoch. Acta. 1987. Vol. 51.
Progres in Metamorphic and Magmatic Petrology. Korzhinsky's volume. Canbuidge Univer.
Press, Canbuidge, 1991.
Richardson F.D. Activites in ternary silicate melts //Trans. Fanadey Soc. 1956, Vol. 52.
Shottky W, Ulich H., Wagner G. Thermodynamik. Berlin, 1929.
Winkler H. Petrogenesis at metamorphic rocks. Springu-Verlag, 1965, 1974.
Zavel'sky V.O., Bezmen N.J., Zharikov V.A. Water in albite glasses: OH-groups, isolated
molecules and clusters. // Jour. of Non-crystaline solids. 1998. Vol. 224.
