Жариков В.А. Основы физической геохимии
Подождите немного. Документ загружается.


Таблица 4.11 Коэффициенты летучести углекислоты (по PVT данным К.И.Шмуловича и
В.М.Шмонова, 1973)
p,
бар
T
o
C
(T K)
200
250
300
350
400
450
500
550
600
650
700
750
800
850
900
950
100
0
(473
)
(523
)
(573
)
(623
)
(67
3)
(72
3)
(77
3)
(82
3)
(87
3)
(92
3)
(97
3)
(102
3)
(107
3)
(112
3)
(117
3)
(122
3)
(127
3)
50
0,95
0,97
0,98
0,99
0,9
9
1,0
0
1,0
0
1,0
0
1,0
0
1,0
0
1,0
0
1,00
1,00
1,00
1,00
1,00
1,00
100
0,91
0,94
0,97
0,99
1,0
0
1,0
0
1,0
1
1,0
1
1,0
1
1,0
1
1,0
2
1,02
1,02
1,02
1,02
1,02
1,02
200
0,84
0,90
0,95
0,99
1,0
1
1,0
2
1,0
3
1,0
3
1,0
4
1,0
4
1,0
4
1,04
1,04
1,04
1,04
1,04
1,04
500
0,76
0,87
0,94
0,99
1,0
3
1,0
6
1,0
8
1,1
0
1,1
1
1,1
2
1,1
2
1,13
1,13
1,13
1,13
1,13
1,13
100
0
0,83
0,97
1,06
1,14
1,1
9
1,2
3
1,2
5
1,2
7
1,2
8
1,2
9
1,3
0
1,30
1,30
1,30
1,30
1,30
1,29
200
0
1,40
1,57
1,68
1,75
1,8
0
1,8
3
1,8
4
1,8
5
1,8
4
1,8
4
1,8
3
1,81
1,80
1,78
1,77
1,75
1,74
250
0
1,88
2,05
2,15
2,21
2,2
3
2,2
4
2,2
3
2,2
1
2,1
9
2,1
6
2,1
3
2,11
2,08
2,05
2,02
2,00
1,97
300
0
2,62
2,79
2,85
2,87
2,8
6
2,8
2
2,7
8
2,7
3
2,6
7
2,6
2
2,5
7
2,51
2,47
2,42
2,37
2,33
2,29
350
0
3,69
3,80
3,81
3,75
3,6
7
3,5
7
3,4
7
3,3
7
3,2
7
3,1
8
3,0
9
3,01
2,93
2,86
2,79
2,73
2,67
400
0
5,20
5,21
5,09
4,92
4,7
3
4,5
4
4,3
5
4,1
8
4,0
2
3,8
7
3,7
3
3,60
3,49
3,38
3,28
3,19
3,11
450
0
7,34
7,15
6,81
6,45
6,1
0
5,7
6
5,4
6
5,1
8
4,9
3
4,7
0
4,5
0
4,31
4,15
4,00
3,86
3,73
3,62
500
10,3
9,80
9,12
8,46
7,8
7,3
6,8
6,4
6,0
5,7
5,4
5,16
4,92
4,72
4,53
4,36
4,20

0
8
5
1
3
1
4
1
2
550
0
14,6
7
13,4
4
12,2
0
11,0
8
10,
11
9,2
7
8,5
5
7,9
3
7,3
9
6,9
2
6,5
1
6,15
5,84
5,56
5,30
5,08
4,87
600
0
20,7
1
18,4
1
16,2
9
14,4
9
12,
99
11,
73
10,
67
9,8
7
9,0
2
8,3
7
7,8
1
7,33
6,90
6,53
6,20
5,90
5,64
650
0
29,2
0
25,1
8
21,7
3
18,9
3
16,
66
14,
81
13,
30
12,
04
10,
99
10,
11
9,3
5
8,71
8,14
7,66
7,23
6,85
6,51
700
0
41,1
1
34,3
8
28,9
3
24,6
7
21,
32
18,
67
16,
53
14,
79
13,
36
12,
17
11,
17
10,3
2
9,59
8,95
8,40
7,92
7,49
750
0
57,7
7
46,8
5
38,4
4
32,0
8
27,
23
23,
47
20,
50
18,
13
16,
20
14,
62
13,
30
12,1
9
11,2
5
10,4
5
9,75
9,14
8,60
800
0
81,0
4
63,7
3
50,9
6
41,6
3
34,
70
29,
44
25,
37
22,
17
19,
60
17,
52
15,
81
14,3
8
13,1
8
12,1
5
11,2
7
10,5
1
9,85
850
0
113,
46
86,5
0
67,4
2
53,9
1
44,
12
36,
85
31,
32
27,
04
23,
65
20,
94
18,
73
16,9
1
15,3
9
14,1
0
13,0
1
12,0
6
11,2
4
900
0
158,
54
117,
16
89,0
0
69,6
5
55,
96
46,
00
38,
57
32,
89
28,
47
24,
97
22,
14
19,8
3
17,9
2
16,3
2
14,9
6
13,8
0
12,8
0
950
0
221,
08
158,
35
117,
24
89,7
8
70,
82
57,
30
47,
38
39,
92
34,
18
29,
69
26,
10
23,2
0
20,8
2
18,6
4
17,1
7
15,7
6
14,5
4
100
00
307,
66
213,
58
154,
09
115,
47
89,
42
71,
20
58,
07
48,
33
40,
94
35,
22
30,
70
27,0
7
24,1
2
21,6
9
19,6
5
17,9
4
16,4
7
Т-р диаграммы дегидратации и декарбонатизации в присутствии флюида H
2
O и
СО2.
В самом общем случае реакции карбонатизации и гидратации протекают одновременно в
присутствии флюида, состоящего из Н
2
О, СО
2
. и других компонентов. Уравнение реакции
можно представить как А+В+С+D+Н
2
О+СО
2
=0 .
Факторы равновесия: Т, p
t
(общее), a
H2O
, a
CO2
. Расчетная формула:
В уравнении (4.71) под знаком логарифма расположены расшифрованные выражения
активностей летучих компонентов (например, a
H2O
= γ
H
2
O
p,T
θ
H
2
O
p,T
x
H2O
p
t
),
стандартизованные таким образом, что в другие члены уравнения входит только μ
o
(T)
, т.е.
энтропии Н
2
О и СО
2
. В тех случаях, когда коэффициенты активности Н
2
О и СО
2

неизвестны (система Н
2
О-СО
2
надежно изучена в диапазоне 1-10 кбар, 25-1000
о
С),
пользуются приближением об идеальности газовой смеси, и под знаком логарифма
остается парциальная летучесть f
H2O
= θ
H
2
O
pt,T
.
x
H2O
.
p
t
= f
H
2
O
pt,T
.
x
H2O
. Как известно, p
t
≠
p
H2O
+ p
CO2
, но формула (4.71), полностью справедлива и для частного решения, когда p
t
=
p
H2O
+ p
CO2
т.е. газовая смесь состоит только из воды и углекислоты.
Схема расчета: 1) вычисляются ΔG
R
T*, p*, a*
и ΔS
R
T
. Как и в рассмотренных выше случаях,
исходными могут быть стандартные условия: Т=298
o
С, р=1 бар и активности компонентов
равны единице, или экспериментально установленные координаты равновесия; 2)
рассчитываются значения ΔG
R
T
= ΔG
R
T*, p*, a*
+ ΔG
R
ΔT
для интересующих температур;. 3)
находятся равновесные значения р из соотношения:
В этом выражении одна определяемая величина р
t
(при задаваемых Т, x
H2O
и x
CO2
) (Прим.
автора: Если x
H2O
и x
CO2
неизвестны, уравнение, естественно, неразрешимо. При
отсутствии их, в первом приближении можно подсчитать равновесные р
t
, p
H2O
и p
CO2
),
коэффициенты активности и летучести вычисляются в зависимости от Т и р
t
по
имеющимся экспериментальным (табличным) данным.
Нахождение равновесных p
t
, a
H2O
, a
CO2
- достаточно кропотливая операция, поэтому лучше
предварительно графически или аналитически построить значения ΔG
s
p
, ΔG
H2O
и ΔG
CO2
их
суммы для различных Т, р, и если надо, x
H2O
и x
CO2
, а затем находить -ΔG
R
T
= ΔG
s
p
+
ΔG
H
2
O
p
+ ΔG
CO
2p
линейной интерполяцией. Компьютерный расчет по соответствующей
программе намного облегчает работу.
В качестве примера рассмотрим расчет реакции тремолит (Tr) + кальцит (Cal) + кварц (Q)
= диопсид (Di) + Н
2
О + СО
2
от стандартных условий, задав состав флюида x
H2O
= 0.7, x
CO2
= 0.3, x
H2O
+ x
CO2
= 1.
Уравнение реакции:
Ca
2
Mg
5
Si
8
O
22
+
3CaCO
3
+
SiO
2
=
5CaMgSi
2
O
6
+ Н
2
О + 3СО
2
Tr
Cal
Q
Di
Термодинамические данные фаз и компонентов приведены в табл.4.12.
Таблица 4.12 Термодинамические данные для расчета реакции разложения тремолита
Фаза
-ΔG
298
S
298
V, см
3
/моль
С
р
=a+bT-cT
-2
ккал/моль
кал/моль
.
град
(кал/моль
.
бар)
a
b
.
10
3
c
.
10
-5
Диопсид
724,67
34,2
66,10 (1,5797)
55,87
7,84
15,74
Тремолит
2775,40
131,20
272,95 (6,5235)
85,38
193,37
-
Кварц
204,71
9,88
22,69 (0,5422)
11,22
8,20
2,7

Кальцит
269,68
21,92
36,94 (0,8828)
24,98
5,24
6,20
Н
2
О
54,614
45,104
-
7,30
2,46
-
СО
2
94,255
51,06
-
10,57
2,10
2,06
1. Вычисляем стандартную свободную энергию и энтропию реакции:
2. Рассчитываем ΔG
R
T
для температур 300, 400, 500 и 600
o
С. Например,
Соответственно после вычисления получим:
ΔG
R
773K
= -44806 кал/моль
ΔG
R
873K
= -61529 кал/моль
ΔG
R
573K
= -11103 кал/моль
3. Ищем равновесные значения давления. Для этого составляем табличку (табл.4.12)
значений ΔG
R
p(T)
:
для интервала Т, отвечающего рассчитанным значениям ΔG
R
T
, и интервала р,
достаточного, чтобы ΔG
R
p
перекрывало значения ΔG
R
T
. Например, для заданных x
H2O
=
0.7, x
CO2
= 0.3 для 400
o
С (673К) при давлении 500 бар:
Для давления 1000 бар (опустив промежуточные обозначения размерности единиц) имеем
Поскольку ΔG
R
T
= -27931 и -ΔG
R
T
= ΔG
R
p
по линейной интерполяции находим значение
равновесного р, расположенного, очевидно, между 500 и 1000 бар. Аналогично тому, как
производилось выше,
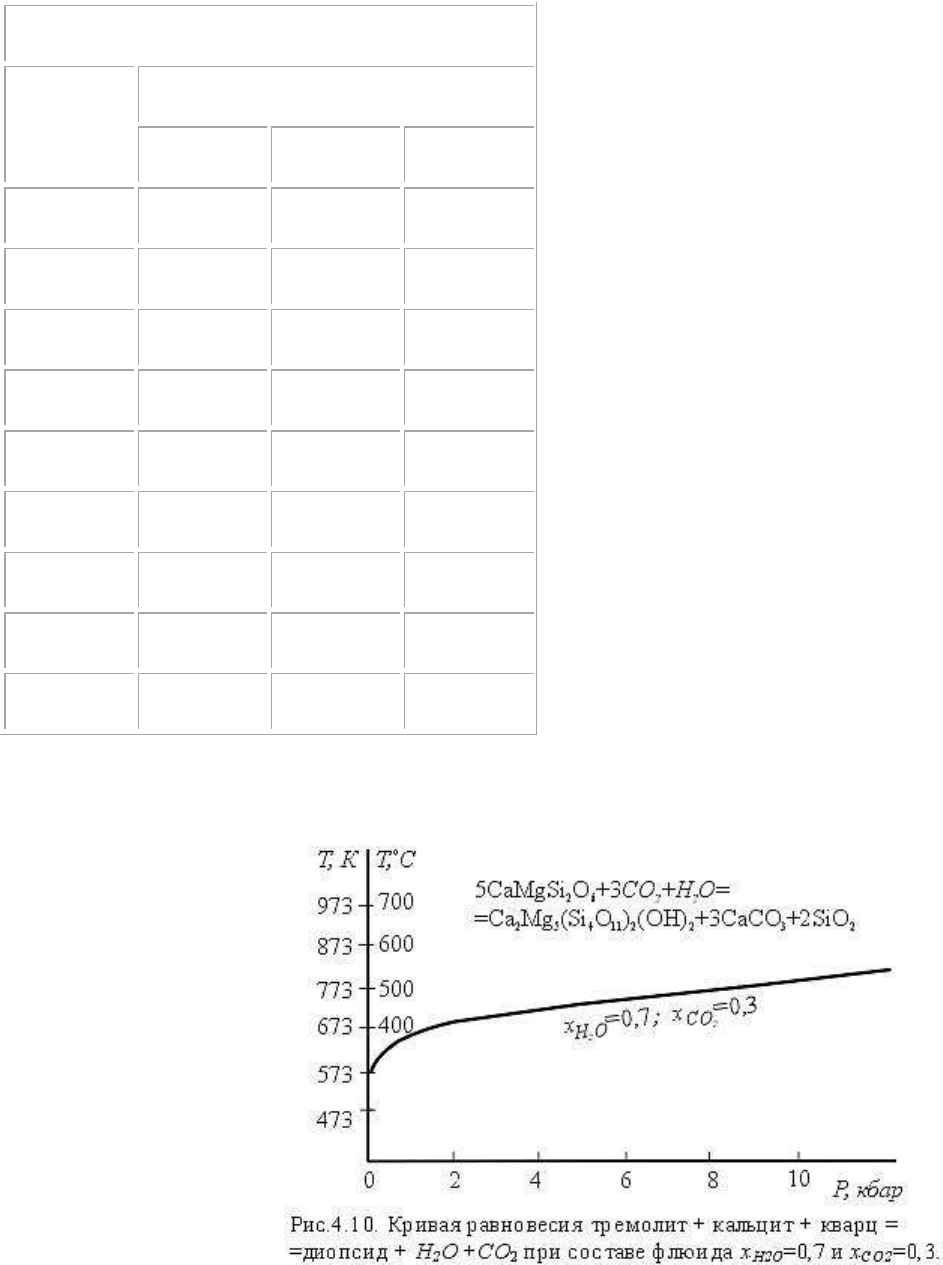
Таким же образом, используя табличные данные по коэффициентам летучести воды и
углекислоты, находим пределы ΔG
R
p
для других температур (табл.4.13) и линейной
интерполяцией определяем равновесные значения р.
Таблица 4.13. Значения (Т), кал/моль (По Хелсеру)
р, бар
Температура,
о
С
300
400
500
10*
5 937
50*
12 969
100
15 665
500
20 354
25 671
1 000
28 210
33 820
2 000
37 172
5 000
42 114
7 000
44 053
10 000
45 861
Получаем следующие координаты: Т=300
о
С , р=33 бар; Т=500
о
С, р=8120 бар. Для
Т=600
о
С давление больше 10000 бар, но точно рассчитать равновесное давление
невозможно из-за
отсутствия данных по
коэффициентам летучести
воды и углекислоты.
Обычным путем
определяем температуру
равновесия при р=1 атм,
она равна 230
о
С.
На рис.4.10 показано
положение рассчитанной
моновариантной кривой.
Использование
компьютеров намного
облегчает и убыстряет
расчеты. Программа
составляется сразу на поиск равновесных значений Т и р.

Диаграммы зависимости равновесий от летучести (парциальных давлений) и
активности компонентов
Диаграммы зависимости фазовый равновесий от парциальных давлений или летучестей и
активностей вполне подвижных компонентов рассчитываются в общем случае подобно
рассмотренным выше реакциям со сложным флюидом. Расчетная формула:
Обычно диаграммы зависимости фазовых равновесий от парциальных давлений
(летучестей) или активностей компонентов представляют одно или несколько изотермо-
изобарических сечений. Схема расчета в таком случае следующая:
1. Рассчитывается значение свободной энергии, соответствующей определенным изотерме
и изобаре. Для стандартных условий она равна ΔG
R
298 1бар
. Для других Т и р
ΔG
R
T,p
= ΔG
R
298
- [ΔS
R
298
(T-298) + ΔaA
g
+ ΔbB
g
- ΔcC
g
] + ΔV
s
p
2. По соотношению -ΔG
R
T,p
= 2.3Δm
j
RTlga
j
+ 2.3Δm
k
RTlga
k
или
находятся равновесные значения активностий или летучести, или парциальных давлений
компонентов, или К
a
реакции.
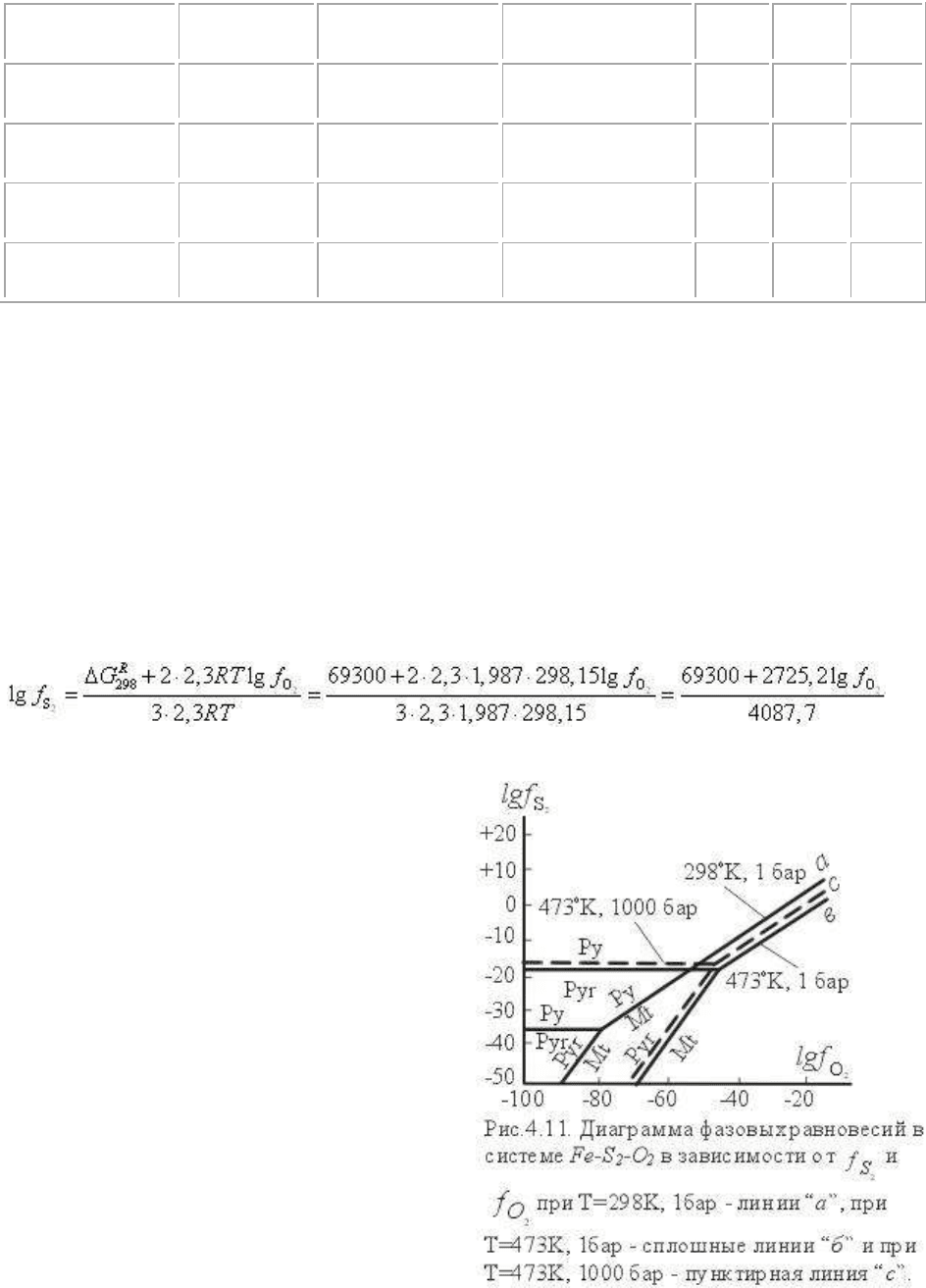
Рассмотрим в качестве примера расчет равновесий магнетит (Mt) - пирротин (Pyr) - пирит
(Py) в зависимости от летучести (парциального давления) кислорода и серы. Качественная
диаграмма этой системы в координатах μ
S2
- μ
O2
приведена выше (см.гл.3). Построим
диаграммы для температуры Т=298К (25
о
С), Т=473К (200
о
С) и р=1 бар, и р=1000 бар.
Исходные термодинамические данные приведены в табл.4.14.
Таблица 4.14 Термодинамические данные к расчету равновесий магнетит-пирит-пирротин
Компоненты
-ΔG
298
S
298
V, см
3
/моль
С
р
=a+bT-cT
-2
ккал/моль
кал/моль
.
град
(кал/моль
.
бар)
a
b
.
10
3
c
.
10
-5
Магнетит
242,70
35,00
44,50 (1,0636)
21,88
48,20
-
Пирит
38,90
12,65
23,94 (0,5722)
17,88
1,32
3,05
Пирротин
24,02
14,42
18,20 (0,4350)
5,19
26,40
-
Н
2
О (газ)
54,634
45,104
-
7,30
2,46
-
О
2
(газ)
0
49,003
-
7,16
1,00
0,40
S
2
(газ)
-18,9
54,51
-
8,72
0,16
0,90
Н
2
S (газ)
8,02
49,16
-
7,81
2,96
0,46
HS
-
-2,88
15,0
-
S
-
-20,50
-3,5
-
Рассчитаем сначала моновариантное равновесие магнетит-пирит.
Уравнение реакции:
Fe
3
O
4
+3S
2
=3FeS
2
+2O
2
.
1. Рассчитывается стандартная свободная энергия реакции ΔG
R
298
= 3ΔG
Py
298
+ 2ΔG
O2
298
-
ΔG
Mt
298
- 3ΔG
S2
298
= 69300 кал/моль, член ΔV
s
(p-p
*
) равен нулю.
2. По уравнению -ΔG
R
298
= 2.3RTlgK
p
= 2.3RT(2lgf
O2
- 3lgf
S2
) получаем зависимость между
lgf
O2
и lgf
S2
, отвечающую моновариантному равновесию магнетит-пирит. Так, из
следует , что при lgf
O2
= 0 lgf
S2
= 14.21; при lgf
O2
= -10 lgf
S2
= 10.29; при lgf
O2
= -20 lgf
S2
=
3.62; при lgf
O2
= -30 lgf
S2
= -3.05 и т.д. На
рис.4.9 в координатах диаграммы lgf
O2
- lgf
S2
проведена соответствующая линия
равновесия Py ↔ Mt.
Аналогично (можно округлить стандартную
температуру до целых градусов -298К)
рассчитываем равновесия магнетит ↔
пирротин (ΔG
R
298
= -142140) и пирротин-
пирит (ΔG
R
298
= -46260); пересечение
моновариантных линий должно дать
нонвариантную точку: Py+Pyr+Mt. Из-за
ограниченной точности ΔG
298
фаз и
компонентов возможно возникновение
"треугольника невязки", который должен
быть устранен введением соответствующих
поправок. Полученная диаграмма показана на
рис.4.11.
3. Рассчитаем ΔG
R
473
для соответствующих
моновариантных реакций по неоднократно использовавшемуся уравнению
ΔG
R
473
= ΔG
R
298
- [ΔS
R
298
(473-298) + ΔaA
g
+ ΔbB
g
- ΔcC
g
]
В результате получим (кал/моль):
для реакции Mt-Py ΔG
R
473
= -80931,
для реакции Mt-Pyr ΔG
R
473
= -137731,
для реакции Pyr-Py ΔG
R
473
= -37867.
4. По уравнению -ΔG
R
298
= 2.3RT(Δm
O2
lgf
O2
- Δm
S2
lgf
S2
) находим, как это было сделано
выше, зависимости между f
S2
и f
O2
, отвечающие каждому моновариантному равновесию
при Т=473К (200
о
С). Пересечение моновариантных линий образует нонвариантную точку
диаграммы; "треугольник невязки", в случае его возникновения, из-за недостаточной
точности данных также устраняется введением соответствующих поправок. Диаграмма
равновесий при Т=473К приведена для сопоставлений на рис.4.11.
Аналогично рассчитываются диаграммы в координатах парциальных давлений летучих
компонентов (например, p
S2
и p
O2
), поскольку существует очевидная связь f
j
= θ
j
p
j
.
Обратим внимание на то, что диаграммы в координатах логарифмов летучести или
активности компонентов, численно выраженные через RT ln f
j
(или RT ln a
j
),
представляют диаграммы эффективных химических потенциалов компонентов, которые
могут быть обозначены как μ
j
-μ
j
o
и μ
k
-μ
k
o
, и которые, очевидно, равны RT ln f
j
и RT ln f
k
.
Диаграммы зависимости минеральных равновесий в координатах μ
j
-μ
j
o
, μ
k
-μ
k
o
,
рассчитываются и строятся подобно диаграммам в координатах логарифмов летучести
или активности компонентов.
При расчете равновесий для давлений, отличающихся от стандартных, учитывается член
ΔG
s
p
= ΔV
s
p. Так, при расчете равновесия магнетит ↔ пирит для давлений 1000 бар
(473К):
1. Рассчитывается ΔG
R
T
ΔG
R
473
= ΔG
R
298
- [ΔS
R
298
(473-298) + ΔaA
g
+ ΔbB
g
- ΔcC
g
] = -80931 кал/моль
2. Рассчитывается G
s
p
= ΔV
s
p = ΔG
s
1000
= 0.653*1000 = 653 кал/моль;
3. Из соотношения -ΔG
R
T,p
= -ΔG
R
473
+ ΔG
R
1000
= 2.3RT(2lgf
O2
- 3lgf
S2
) определяются
значения lgf
O2
и lgf
S2
, отвечающие моновариантному равновесию магнетита и пирита при
Т=473К (200
o
С) и р=1000 бар. Расположение линий равновесия магнетит-пирит, магнетит-
пирротин, пирит-пирротин для Т=473К и р=1000 бар показаны на рис.4.11 пунктиром.
Нетрудно видеть, что влияние давления на эти равновесия крайне незначительно.
Еh-pH диаграммы
Эти диаграммы - одна из разновидностей диаграмм зависимости фазовых равновесий от
химических потенциалов (активностей) компонентов, где в качестве компонентов
выступают ионы водорода и электроны. Любая реакция с участием ионов водорода и
электронов в присутствии воды в общем виде может быть записана следующим образом:
A + B + αj + βk + δH
2
O + εH
+
+ νe
-
(4.74)
где α, β, δ, ε, ν - соответственно Δm
j
, Δm
k
, Δm
H2O
, Δm
H
+
, Δm
e
-
, изменение количества
компонентов j, k, H
2
O, H
+
и e
-
- числа электронов в реакции. Условие равновесия можно
раскрыть следующим образом:
ΔG
R
T,p,μ
= ΔG
A
T,p
+ ΔG
B
T,p
+ Δm
j
μ
j
+ Δm
k
μ
k
+ Δm
H2O
μ
H2O
+ Δm
H+
μ
H+
+ Δm
e-
μ
e-
= 0
(4.75)
В уравнении (4.75) ΔG
A
T,p
и ΔG
B
T,p
- свободные энергии образования из элементов
твердых фаз А и В при данных Т и р (т.е. ΔG
A
T,p
= ΔG
A
T*,p*
+ ΔG
A
ΔT
+ ΔG
A
Δp
), а члены,
заданные через химические потенциалы, отражают результат интегрирования Δmdμ от
стандартных состояний с активностью, равной единице (см. выше). Эти члены можно
представить как
Выполненные здесь преобразования подробнее рассмотрены выше. Наконец, μ
H+
= μ
o
H+
(p,T)
+ 2.3RT ln a
H+
= 2.3RT lg a
H+
поскольку по условиям стандартизации μ
o
H+ (p,T)
= 0 и μ
e
=
μ
o
e (p,T)
+ 2.3RT lga
e
= FE, где F - число Фарадея (заряд одного электрона, равный 23,06
ккал/моль
.
В); Е - восстановительный потенциал (равный с обратным знаком
окислительному потенциалу -Е=Еh), а μ
o
e
= 2.3RT lg a
o
e
по условиям стандартизации,
согласно которым за единичную активность a
o
e
= 1 принимается активность нормального
водородного электрода. Заменяя E на обычный окислительный потенциал Eh, а -lga
H+
на
рН , уравнение (4.75) можно преобразовать:
Это уравнение лежит в основе расчета равновесий в координатах Еh-pH. Ему можно
придать в зависимости от назначения любую удобную форму. Например, разрешая его
относительно Eh, получим:
где, очевидно, значение стандартного окислительного потенциала равно Eh
o
= ΔG
R
T,p
/
Δm
e
F. Для стандартных условий, подставляя значение R=1,987 кал/град, F=23060
кал/моль
.
В и Т=298К вместо (4.79), имеем обычное уравнение:
В качестве примера рассчитаем Eh-pH диаграмму равновесий магнетит-пирротин-пирит
для Т=298К. Если ограничиться этой ассоциацией, то в условиях инертного поведения
железа и вполне подвижного режима серы и кислорода топология диаграмм в координатах
фугитивостей серы и кислорода: три моновариантные двухфазовые линии ограничивают
однофазовые поля стабильности пирротина, пирита и магнетита. При расчете и

построении Eh-pH диаграмм должны быть определены (заданы) конкретные формы
протекания реакций, т.е. формы компонентов, участвующих в реакции, кроме твердых
фаз, ионов H
+
и электронов, и заданы их активности. Кроме того, реакции, отвечающие
уравнениям моновариантных линий, должны быть сбалансированы с учетом валентности
элементов с каждым из компонентов и соединений (для этой цели полезно помечать
валентность элементов в уравнении реакции).
Моновариантное равновесие пирротин-магнетит в зависимости от формы нахождения
серы в растворе может быть представлено различным образом:
3Fe
(+2)
S
(-2)
+ 4H
2
O = Fe
(+2)
Fe
2
(+3)
O
4
+ 3H
2
S
(-2)
+ 2H
(+)
+ 2e
(-)
(a)
(4.81a)
или
3Fe
(+2)
S
(-2)
+ 4H
2
O = Fe
(+2)
Fe
2
(+3)
O
4
+ 3HS
(-1)
+ 5H
(+)
+ 2e
(-)
(b)
(4.81б)
или
3Fe
(+2)
S
(-2)
+ 4H
2
O = Fe
(+2)
Fe
2
(+3)
O
4
+ 3S
(-2)
+ 8H
(+)
+ 2e
(-)
(с)
(4.81в)
При расчете реакции с множеством частиц по разную сторону уравнения реакции уместно
(чтобы не спутать знаки) выражать их в алгебраической форме, как это и сделано в
уравнении (4.74), которое иногда называют "уравнением Пурбо" - по имени
исследователя, активно использовавшего его при расчете реакций.
Примем следующие термодинамические параметры реакции. (см табл. 4.15).
Таблица 4.15. Термодинамические характеристики для расчета реакций пирротин-пирит-
магнетит
фаза или
компонент
ΔG
298
,
кал/моль
Активность
Примечания
Fe
3
O
4
(магнетит)
-243 150
1
FeS
(пирротин)
-24 220
1
При а=1, член 2,3RTlga=0
FeS
2
(пирит)
-38 900
1
H
2
O жид.
-56 688
1
H
2
S р-р.
-6 660
10
-3
; 10
-6
Поскольку уравнение (4.8) зависит от активности
