Жариков В.А. Основы физической геохимии
Подождите немного. Документ загружается.


5. При анализе и расчете систем с вполне подвижными компонентами в ионной форме
важны отчетливые представления о параметрах, выступающих в качестве независимых в
различных случаях при наложенных дополнительных условиях электронейтральности
систем. Рассмотрим это в общем виде на примере двухфазового равновесия жидкость -
пар. Определим соотношения активностей какого-либо компонента, например CO
2
.
Распределение CO
2
между паром и жидкостью определяется равенством химических
потенциалов компонента:
Растворение CO
2
в воде выражается в гидратации и последующей диссоциации угольной
кислоты, протекающих по схеме
CO
2
l
+ H
2
O ↔ H
2
CO
3
H
2
CO
3
↔ H
+
+ HCO
3
-
HCO
3
-
↔ H
+
+ CO
3
2-
CO
2
+ H
2
O ↔ 2H
+
+ CO
3
2-
K
02
K
1
K
2
Условия равновесия каждой из ступеней процесса определятся по закону действующих
масс:
Сопоставляя эти уравнения и заменяя произведение постоянных через K
01
.
K
02
.
a
H2O
,
получим следующую зависимость:
которая выражает соотношения между общей валовой активностью углекислоты и
активностями отдельных ионных форм. Выражение (4.37) может быть представлено в
общем виде для кислотных (A) и основных (B) компонентов:
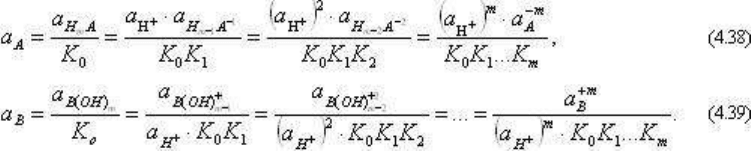
Уравнения (4.37)-(4.39) показывают, что активности отдельных ионных форм зависят от
температуры и давления (константы K
0
K
1
...K
m
), от состава и концентрации раствора
(коэффициенты активности) и, что следует подчеркнуть, от общей кислотности -
активности иона водорода, или pH = -lg a
H
+
раствора. Отсюда следует, что в простых по
составу растворах, строго в растворах одного компонента, где pH определяется
концентрацией этого растворенного компонента, активности различных форм компонента
отличаются на постоянные величины и в равной степени могут быть представлены как
независимые параметры. В общем случае в сложных по составу растворах изменение
концентрации какого-либо компонента влияет не только на коэффициенты активность
других компонентов, но, главное, вызывает изменение pH раствора, а следовательно, и
активности отдельных ионных форм. В этом случае в качестве независимых параметров
выступают валовые активности (точнее, конечно, химические потенциалы) компонентов и
активность (химический потенциал) иона водорода, или рН раствора. Поэтому при
расчетах реакций с участием ионных форм, активности которых определяют течение
реакции, поcледние в свою очередь являются параметрами, зависящими от валовой
концентрации, рН раствора, температуры и давления.
6. Рассмотренные выше величины ΔG
ΔT
, ΔG
Δp
, ΔG
Kp
или ΔG
∑μj
показывают приращения
свободной энергии вследствие изменения T, p, μ
j
...μ
k
. Остается обсудить определение
исходного значения величины свободной энергии реакции, обозначенной в уравнениях
(4.6) и (4.33) как ΔG
T*p*μa*
o
. Свободная энергия любой фазовой реакции или превращения
связана с энтальпией и энтропией известным соотношением
ΔG = ΔH - TΔS
(4.40)
поэтому определение и условия стандартизации исходных значений ΔH и ΔG неразрывно
связаны. Поскольку абсолютные значения H и G установить невозможно, за исходные
величины для расчетов принимаются ΔH и ΔG образования фаз из элементов (иногда из
окислов) в стандартных условиях. В качестве стандартных условий в большинстве
справочников выбраны Т=298,15К (или 293,15К) и p=1 бар, и принято, что в этих
стандартных условиях в соответствующем им агрегатном состоянии энтальпии и
свободные энергии элементов равны нулю. В таком случае в качестве исходной меры
энтальпии выступает теплота образования соединения из элементов, например для
соединения АВ (где А и В - элементы) теплота реакции А+В=АВ равна
ΔH
AB
298
- ΔH
A
298
- ΔH
B
298
+ Q
AB
= 0
и поскольку все реакции образования соединений из элементов экзотермические и Q
AB
величина положительная, энтальпия образования всегда величина отрицательная, т.е.
-ΔH
AB
298
= Q
AB
(4.40)

В соответствии с (4.40) определяется свободная энергия образования соединения из
элементов
Значение ΔG
298
также всегда отрицательное и отличается от ΔH
298
на положительную
величину 298(S
AB
298
-(S
A
298
+ ΔS
B
298
)). Вычислить ΔG
298
можно, если известны энтропии А,
В и АВ при 298,15К. Величины ΔH
298
(или ΔH
0
), ΔG
298
(или ΔG
0
), ΔS
298
(или ΔS
0
)
приведены во всех термодинамических и физико-химических справочниках. Для многих
минералов, особенно переменного состава, они, к сожалению, пока еще не определены.
Другие условия стандартизации элементов, принимаемые некоторыми исследователями
(0К и р=1 атм), используются лишь в специальных целях.
7. Оценивая возможности использования стандартных значений ΔH
298
(получаемых
термохимическими исследованиями), ΔG
298
(рассчитываемых из ΔH
298
при наличии
экспериментально определенных энтропий) для расчетов при высоких Т и р следует
признать невысокую, а в ряде случаев неудовлетворительную точность стандартных ΔH и
ΔG для минералов, особенно сложного состава. Это связано с большими
экспериментальными трудностями определения надежных термохимических констант.
Поэтому следует рекомендовать для получения необходимых ΔH и ΔG, S, особенно для
расчетов при высоких параметрах, использовать данные по хорошо изученным
экспериментальным минеральным равновесиям. Этот косвенный метод получения
необходимых термодинамических констант, несомненно, и правомерен, и перспективен, а
в некоторых сложных случаях оказывается единственно возможным. Поясним его
использование на простом примере. Если имеются Т-р данные по экспериментально
изученному минеральному равновесию A↔B (для простоты рассмотрим равновесие
между твердыми фазами), то для любой точки моновариантной линии изменение
свободной энергии реакции ΔG
R
равно нулю:
Тогда рассчитав для этого уравнения ΔG
p
R
~= ΔV
s
p (что сделать нетрудно) получим
нужное значение ΔG
T
R
(равное ΔG
p
R
). ΔG
T
R
может быть принята за исходное
(стандартное) значение свободной энергии реакции при данной известной нам из
экспериментальных данных температуре. Далее нужно определить ΔS
T
R
, рассчитав ΔG
R
от
стандартных условий 298,15К (величины энтропий фаз и уравнение S=f(T))
термохимически определены намного точнее, чем ΔH
R
298
и ΔG
T
R
). Далее обычным
способом можно вычислить любые T-p координаты моновариантного равновесия,
основываясь на экспериментально полученной ΔG
T
R
- принятой стандартной.
Если энтропии фаз неизвестны (или ненадежны), сопоставляя значение ΔV
p
R
для
различных равновесных температур, можно получить зависимость ΔS
R
от Т. Используя
несколько опорных минеральных равновесий, всегда можно выйти на равновесие с
фазами, для которых значения S=f(T) известны, и по ним рассчитать энтропии других фаз,
их свободные энергии образования из элементов, в том числе и стандартные, если имеется
удовлетворительная зависимость C
p
=f(T).
Выше отмечались трудности расчетов минеральных равновесий с вполне подвижными
компонентами в ионной форме в связи с отсутствием данных по для высоких
параметров. Использование экспериментальных данных по соответствующим
минеральным равновесиям дает возможность получить соотношения:
(4.44)
на основании которых можно оценить по крайней мере в пределах,
необходимых для расчета диаграмм.
3 ПРИМЕРЫ ФИЗИКО-ХИМИЧЕСКИХ РАСЧЕТОВ
Т-х диаграммы плавкости
Рассмотрим расчет диаграмм плавкости на примере простейшей диаграммы бинарной
системы с двумя твердыми фазами и неограниченной смесимостью в жидком
состоянии. Из уравнения (4.5) и (4.6) для этого типа диаграмм следует:
ΔG
R
T,a
= ΔG
R
T*,a*
+ ΔG
ΔT
= ΔG
T
= 0
(4.45)
Для построения Т-х диаграммы плавкости необходимо вычислить координаты равновесий
твердая фаза + расплав (кривые ликвидуса двух фаз) и две твердые фазы + расплав
(положение эвтектики) для которых всегда ΔG
R
. Поэтому расчет диаграммы сводится к
решению нескольких уравнений Шредера.
Действительно, для равновесия твердая фаза А + расплав
Интегрируя (4.46) от x
L
a
= 1 до x
L
a
и соответственно от Т T
A
m
до T при постоянной (в
первом приближении) теплоте плавления, получим
(4.47)
где выражение (4.47) представляет уравнение ликвидуса фазы А, т.е. уравнение
зависимости равновесия A+L от температуры.
Аналогичное выражение будем иметь для равновесия L+B (т.е. кривой ликвидуса фазы В).
Координаты эвтектической точки определяются совместным решением системы из трех
уравнений:
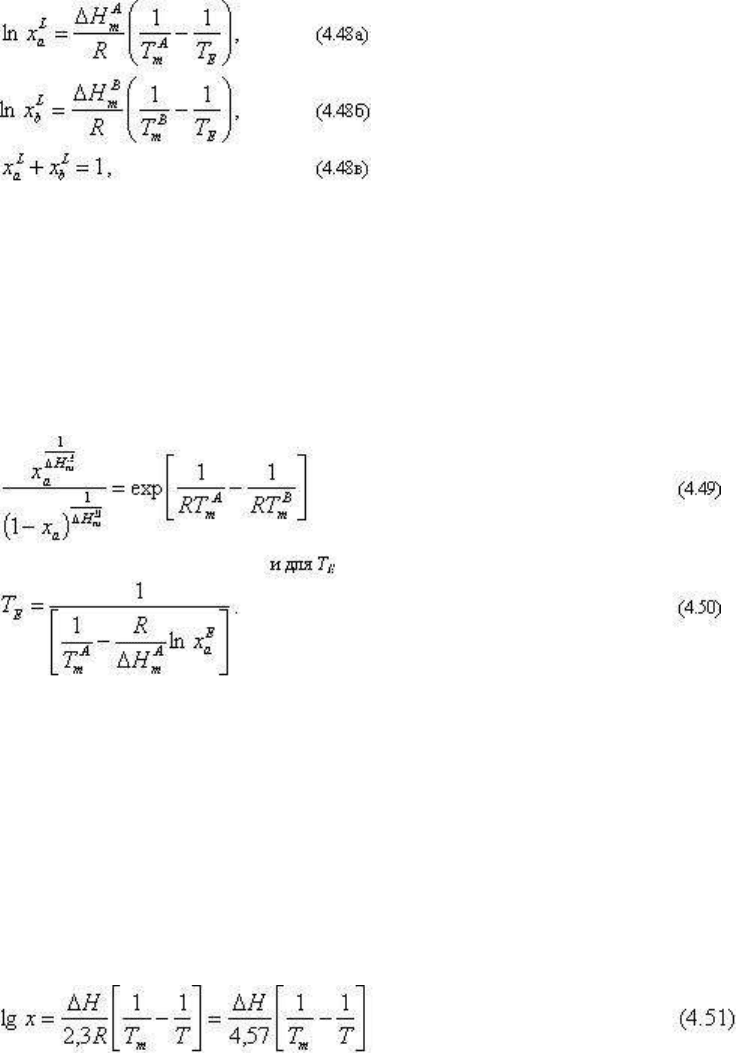
где Т
Е
- температура эвтектической точки, x
a
, x
b
- мольные доли компонентов а и b в
эвтектической точке их можно обозначить как x
a
E
и x
b
E
. Вследствие (4.48с) только две
величины T
Е
и x
a
или x
b
являются неизвестными и определяются из системы из трех
уравнений (4.48). Систему (4.48) нужно решить в отношении x
a
E
и Т
Е
или x
b
E
и Т
Е
.
Уравнения 4.48а и 4.48б - трансцедентные и приведение их к алгебраическому виду
требует громоздких преобразований и подстановок. Опуская их, приведем в качестве
примера одно из решений:
В обычной практике пользуются упрощенным, смешанным аналитически-графическим
методом. При этом: а) рассчитываются кривые ликвидуса А и В в область температур
ниже эвтектической; б) эти кривые строятся на Т-х диаграмме; в) точка пересечения
кривых ликвидуса дает координаты эвтектической точки, которые можно проверить по
одному из уравнений (4.48, 4.49)
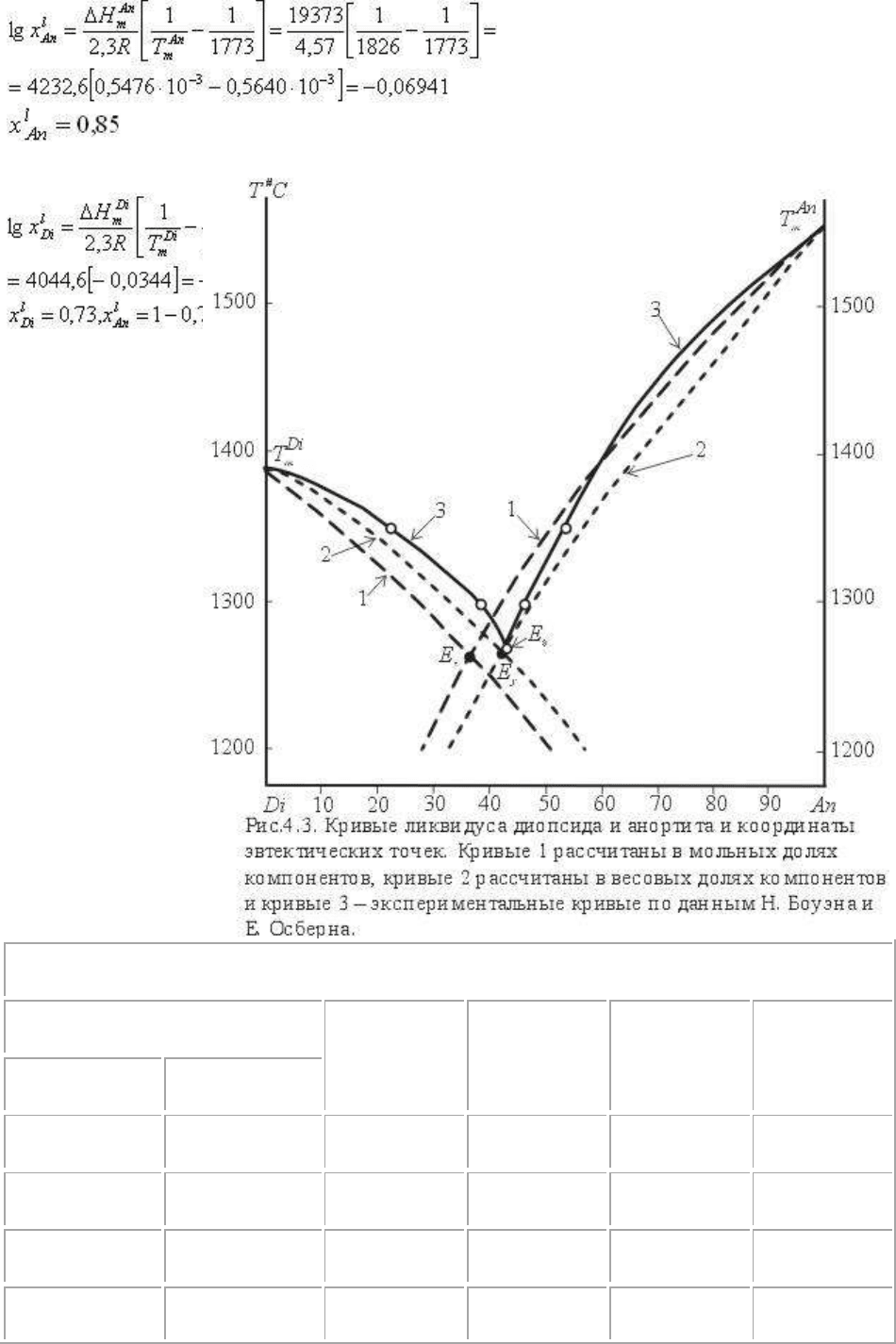
Рассчитаем в качестве примера уже рассматривающуюся диаграмму анортит-диопсид.
Исходные данные: Т
m
анортита 1558
o
С (1826К) ΔН
m
анортита 19343 кал/моль, Тm
диопсида 1390
o
С (1663К), ΔН
m
диопсида 18484 кал/моль. Рассчитываем по уравнению
Шредера:
кривые ликвидуса анортита и диопсида в диапазоне 1873К-1473К, перекрывающим, по
нашим предположениям, области кристаллизации анортита и диопсида, включая
эвтектическую точку. Обратим внимание, что температура в уравнении Шредера
выражена в абсолютной шкале в градусах Кельвина, так же как в подавляющем
большинстве термодинамических формул.
Расчет проведем простейшим образом, приняв идеальность расплава и постоянство теплот
(энтальпий) плавления ΔН
m
диопсида и ΔН
m
анортита (иначе говоря, компоненты в
расплаве не взаимодействуют, а ΔН не зависит от температуры и состава расплава).
Для примера рассчитаем координату Т= 1773К (1500
o
С) на ликвидусе анортита
или для диопсида
при 1573К (1300
o
С)
Таким же путем
вычисляются все
координаты кривых
ликвидуса.
Результаты
расчетов
представлены в
табл. 4.1 и на
рис.4.3.
Таблица 4.1 Координаты линий ликвидуса диопсида и анортита.
Т
x
Di
x
An
y
Di
y
An
o
С
К
1600
1873
0
0
0
0
1553
1826
0
1
0
1,0
1550
1827
0
0,99
0
0,99
1500
1773
0
0,85
0
0,88
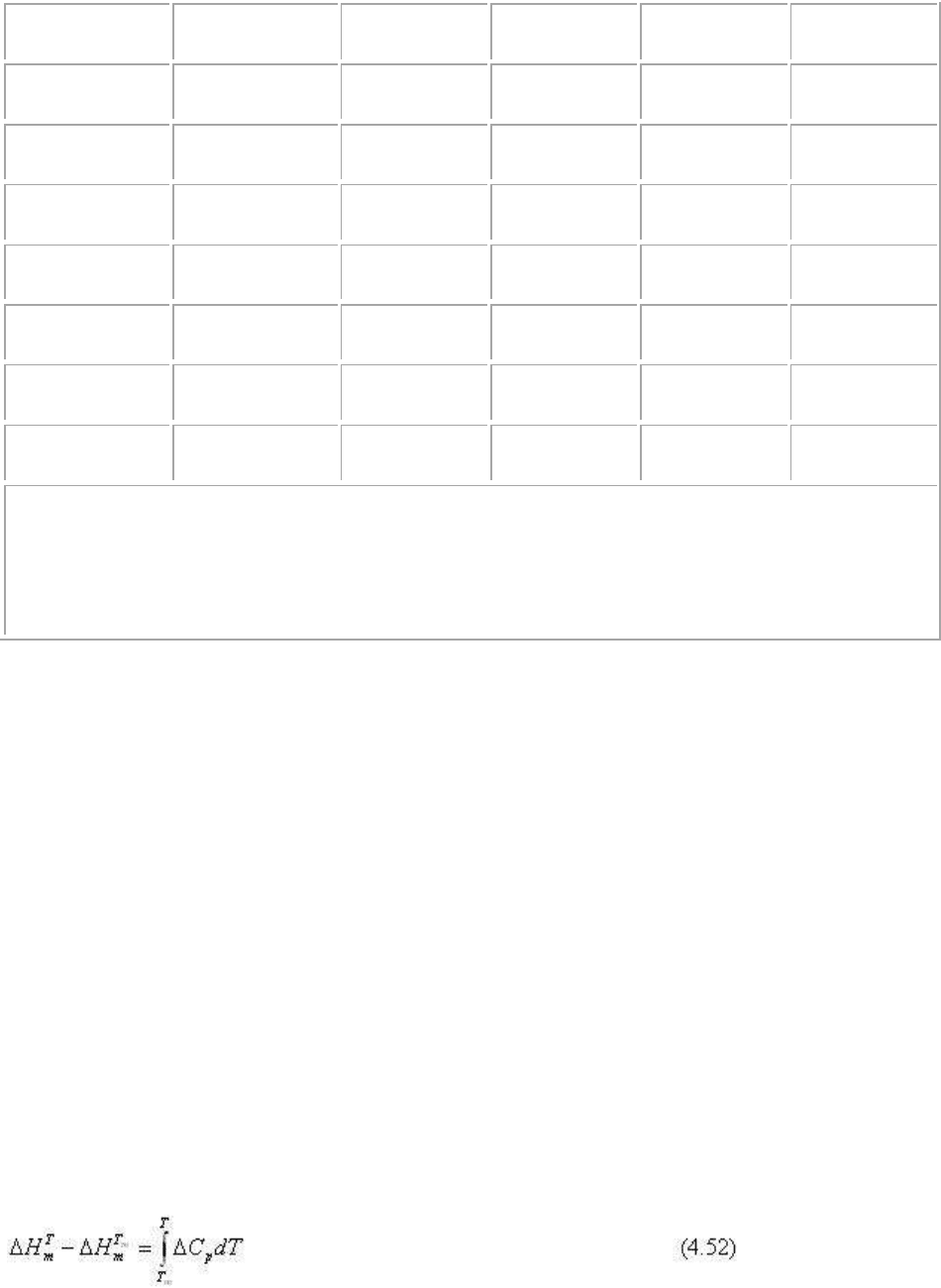
1450
1723
0
0,73
0
0,78
1400
1673
0
0,61
0
0,67
1390
1663
1,0
0,59
1,0
0,65
1350
1623
0,87
0,51
0,83
0,57
1300
1573
0,73
0,42
0,68
0,48
1265
1538
0,64
0,36
0,57
0,43
1250
1523
0,60
0,35
0,54
0,41
1200
1473
0,49
0,28
0,43
0,33
Примечание: х
Di
, x
An
- мольные доли, у
Di
, у
An
- весовые доли. Молекулярный вес расплава
принят на 6% меньше молекулярного веса твердых фаз (возрастание объема при
плавлении 6%). Подчеркнуты температуры плавления анортита (1553
o
С ),
диопсида(1390
o
С) и температура (1265
o
С) и составы эвтектики.
В таблице и на рисунке показаны кривые ликвидуса в координатах Т-х (мольная доля) -
кривые 1, в координатах T-y (весовая доля, или умножив на 100 - весовой процент) -
кривые 2 и экспериментально изученные в координатах Т-y кривые ликвидуса анортита и
диопсида - кривые 3. Пересечение кривых ликвидуса показывает нам положение
эвтектических точек : в координатах Т-х T
e
=1265
o
C, x
Di
=0,64, x
An
=0,36, в координатах Т-у
T
e
=1265
o
C, x
Di
=0,57, x
An
=0,43. Положение эвтектических точек легко проверить по
уравнению (4.50). Расчет по нему показывает Т
E
=1267
o
C (с разницей в пределах
округления при расчетах). Обратим внимание, что х и у координаты эвтектических точек
различаются в силу различия молекулярных весов диопсида и анортита. При малых
различиях в молекулярных весах компонентов координаты Ех и Еу практически
совпадают. Отметим, что положение Е
y
и Е
x
очень близки , разница составляет ~=5
о
С , что
в пределах точности эксперимента и расчетов. Следовательно, принятые при расчетах
упрощения вполне допустимы для системы диопсид-анортит.
При расчете других диаграмм плавкости следует иметь в виду возможные осложнения,
связанные: а) с зависимостью ΔН
m
от температуры и б) с отклонением системы от
идеальности.
Поправки на ΔН
m
= f(T) вносятся сравнительно просто. Помня, что dΔН
m
=ΔC
p
dT
рассчитываем
для интересующего нас интервала температур и подставляем полученные значения ΔН в
решаемые уравнения Шредера.
Значительно сложнее введение поправок на неидеальность расплава. Существует
несколько уравнений, выражающих γ=f(T,p,x), среди которых наиболее популярным
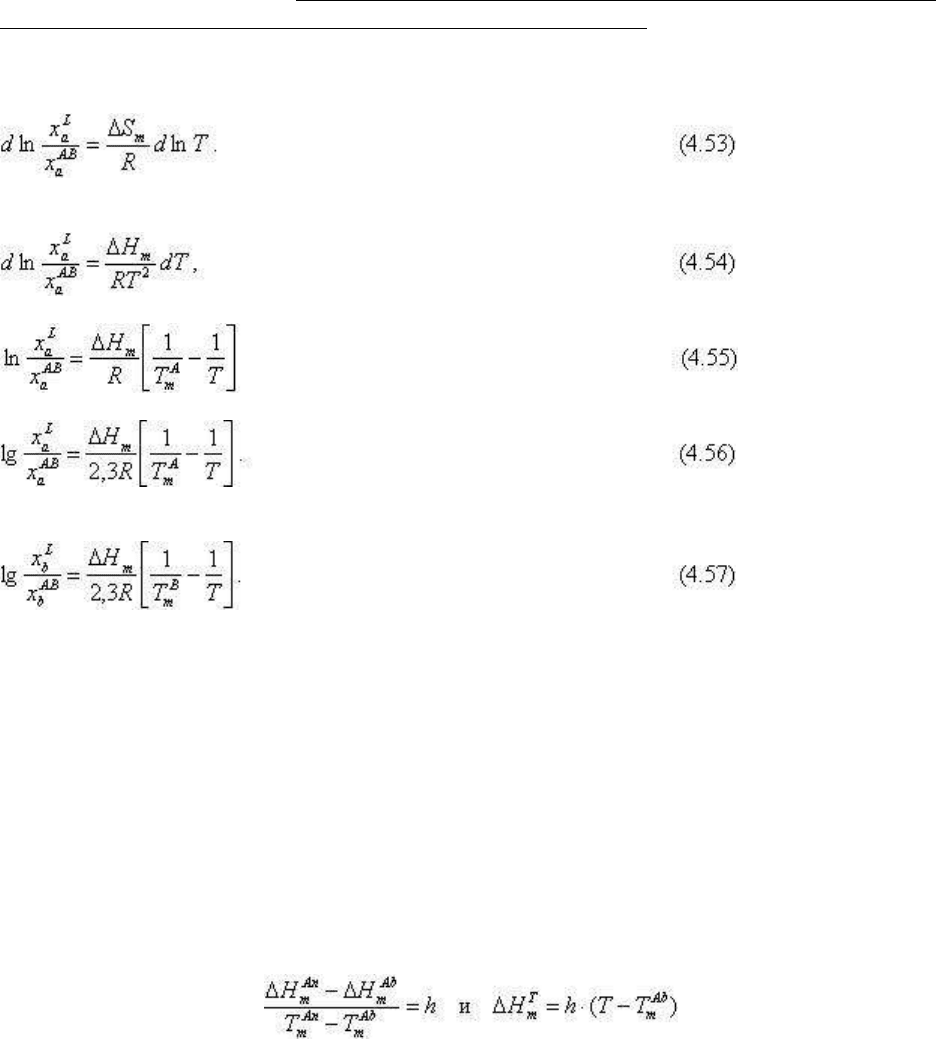
являются уравнения Маргулиса, которые могут быть представлены в виде зависимостей
G
ex
=f (x) и G
ex
=f(T,p,x). Мы не будем рассматривать эти усложнения, поскольку они
потребовали бы более глубокого проникновения в термодинамику растворов, по
сравнению с принятым в книге уровнем изложения. Интересующихся читателей направим
к книгам "Термодинамическое моделирование", 1992; Саксены, 1984; Чатаржи 1991;
Перчука, 1976 и др. Однако несмотря на весьма сложные и многопараметрные схемы
расчетов реальное значение коэффициентов активности приходится проверять
экспериментальными определениями отдельных точек ликвидуса и применять расчетные
методы для интерполяции экспериментальных данных.
Рассмотрим кратко расчет диаграммы плавкости с неограниченной растворимостью в
жидком и твердом состоянии (твердые растворы первого типа).
Равновесие сосуществующих расплава и твердой фазы АВ описывается, как было
показано выше, уравнением Ван-Лаара:
Для численного решения уравнение лучше представить в виде
интегрируя (4.54) от х
а
=1, T
m
A
до x
а
, T, получим
или
Аналогичным образом для компонента b имеем:
Решая уравнения (4.55), (4.56) вместе с очевидными
x
a
L
+ x
b
L
= 1, x
a
AB
+ x
b
AB
= 1
(4.58)
получим приближенные координаты кривых ликвидуса и солидуса.
Рассмотрим в качестве примера систему альбит-анортит. Исходные параметры: альбит
Т
m
Ab
=1391K (1118
о
C), ΔН
m
Ab
=14156 ккал, анортит Т
m
An
=1830K (1557
о
C), ΔН
m
An
=19343
ккал. Поскольку разница в ΔН
m
альбита и анортита существенна, энтальпия плавления для
промежуточных плагиоклазов должна быть вычислена по зависимости ΔН
m
=f(T) и dΔН
m
=
ΔC
p
dT. Точные данные для этой зависимости отсутствуют, поэтому примем в расчетах
линейную зависимость . Расплав плагиоклазов
будем рассматривать как идеальный.
Рассчитаем, в качестве примера, координаты ликвидуса и солидуса для 1673К (1400
о
С).

1. Теплота плавления равна:
2. Уравнение Ван-Лаара для альбитового компонента:
3. Уравнение Ван-Лаара для анортитового компонента:
4. Преобразуем соотношение 3, используя очевидное x
Ab
L
+ x
An
L
= 1 и x
Ab
Pl
+ x
An
Pl
= 1
получим:
5. Сходным путем можно из получить точки на ликвидусе и
солидусе, выраженные в мольных долях анортитовой молекулы. Они будут
соответственно x
l
An
= 0.53, x
Pl
An
= 0.84;
Подобным образом вычисляются остальные необходимые координаты кривых ликвидуса
и солидуса. Результаты расчетов приведены в таблице 4.2 в мольных и весовых долях
альбитового компонента.
Таблица 4.2 Координаты кривых ликвидуса и солидуса твердых растворов альбит-
анортит.
Т
x
L
Ab
x
Pl
Ab
y
L
Ab
y
Pl
Ab
о
С
К
1557
1830
0
1
0
1
1500
1773
0,19
0,04
0,18
0,04
1400
1673
0,47
0,16
0,46
0,15
1300
1573
0,68
0,34
0,67
0,34
1200
1473
0,86
0,63
0,85
0,62
1118
1391
0
1
0
1
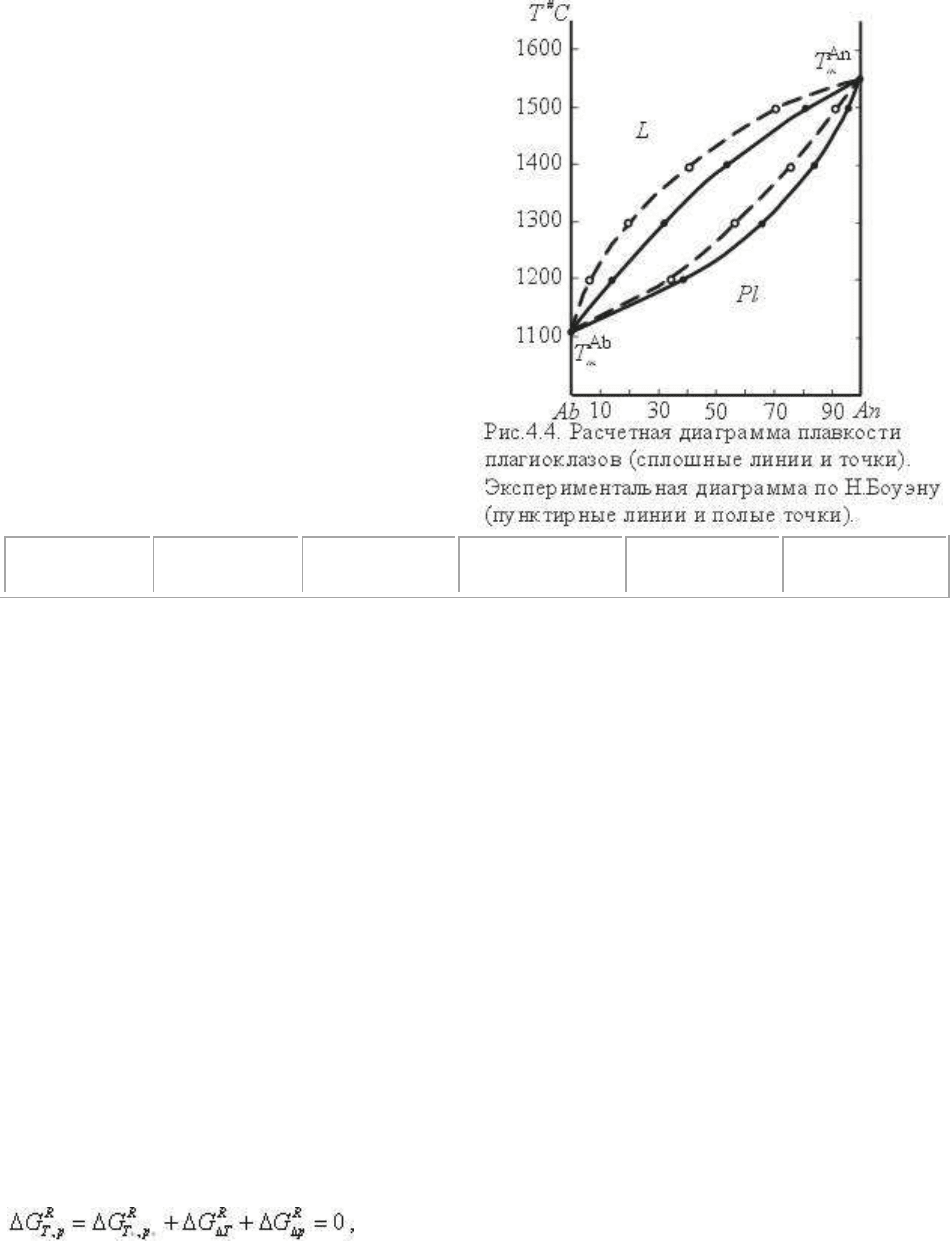
На рис.4.4 сплошными линиями и точками показаны соответствующие кривые. На этом
же рисунке пунктиром (полые точки) нанесена экспериментальная диаграмма Н.Боуэна,
уже приводившаяся выше. Экспериментальная диаграмма выражена в весовых долях, что
вполне сопоставимо с расчетной , поскольку мольные и весовые координаты для
плагиоклазов практически совпадают - разница в 0,01 доли (см. табл. 4.2) по причине
близости молекулярных весов альбита и анортита.
Из рис. 4.4. видно, что экспериментальные кривые расположены на 25-60
о
выше по
температуре или обогащены на 0,05-0,12 долей альбитовым компонентом (по изотерме).
Эти различия связаны с двумя главными причинами: экспериментальная ошибка может
состоять в метастабильном перегреве для начала плавления столь вязких расплавов,
какими являются плагиоклазовые расплавы. Расчетная ошибка, по-видимому, состоит в
том, что не учтены отклонения от идеальности растворов плагиоклазов. Принятая
линейная зависимость ΔН
m
от T вряд ли вносит погрешности, поскольку С
р
для расплавов
практически постоянна.
Т-р диаграммы твердофазовых реакций
Формула для расчета:
