Жариков В.А. Основы физической геохимии
Подождите немного. Документ загружается.

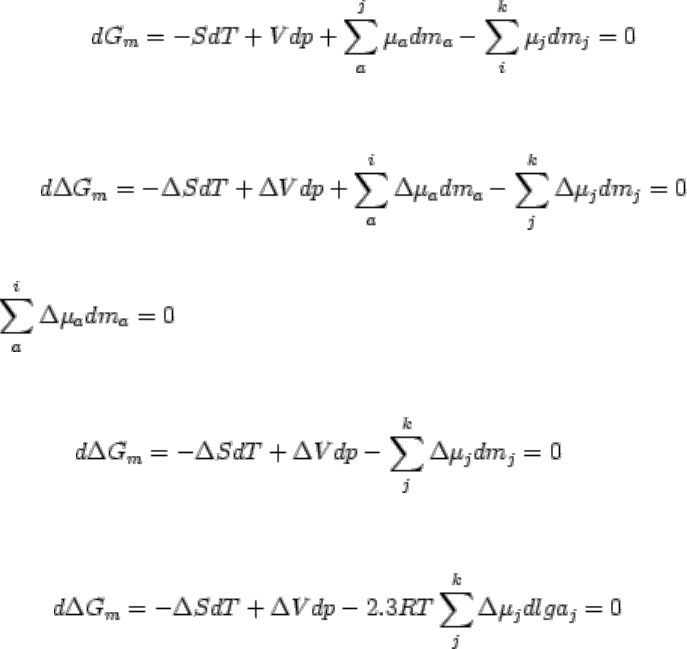
или dG
m
= 0, d
2
G
m
> 0. Если система из одного состояния переходит в какое-либо другое,
то равновесие сохраняется, если изменение термодинамического потенциала и его
дифференциал равны нулю:
ΔG
m
= 0
(4.1)
dΔG
m
= 0
(4.2)
Раскроем последнее выражение. Поскольку
то и
Но член , так как химические потенциалы инертных компонентов в
состоянии равновесия равны (и Δμ = 0), тогда
(4.3)
или, заменяя dμ
j
= RT d ln a
j
= 2.3RT d lg a
j
, получим
(4.4)
Уравнения (4.3) и (4.4) выражают связь изменения свободной энергии при переходе из
одного состояния в другое с изменением экстенсивных и интенсивных параметров
системы. И если система из состояния T*, p*, a
j
*, a
k
* переходит в какое-то новое
состояние T, p, a
j
, a
k
то изменение свободной энергии соответствующего перехода можно
получить интегрированием выражений (4.3) или (4.4):
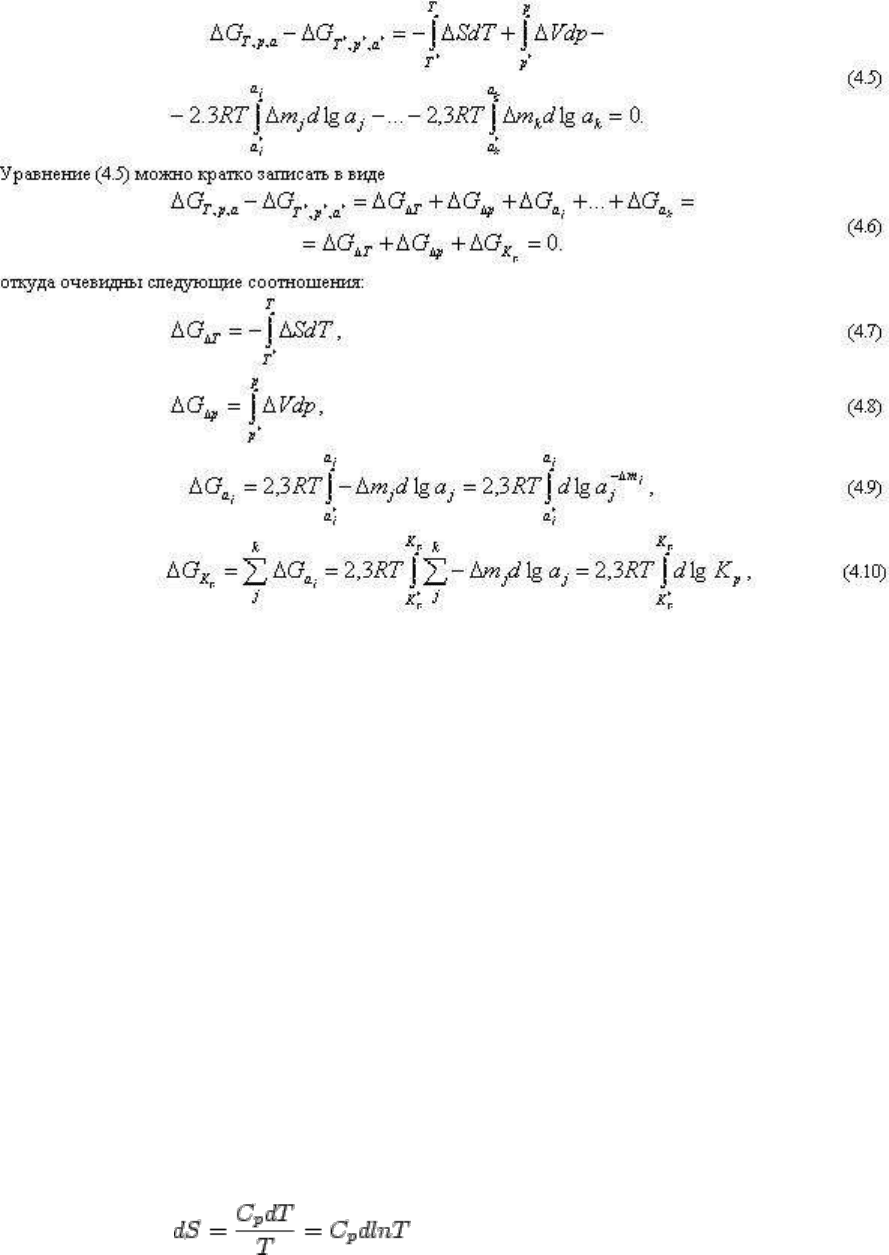
(обратим еще раз внимание на то, что отрицательный знак при Δm
j
относится к
изменению масс вполне подвижных компонентов в твердых фазах и должен быть заменен
на положительный при обычном способе выражений реакции, как это и сделано в
дальнейшем).
Уравнение (4.5) и соответственно вытекающие из него уравнения (4.6-4.10) представляют
основные уравнения для расчета фазовых равновесий. Задача состоит в том, чтобы
корректно вычислить интегралы (4.7)-(4.10), что в общем-то не элементарно и задача эта
составляет главное содержание химической термодинамики. Поскольку в любом полном
курсе химической термодинамики можно почерпнуть подробные сведения, ограничимся
далее кратким схематическим изложением.
1.Интегрирование члена ΔG
ΔT
= - ∫ΔSdT выражающего приращение термодинамического
потенциала в зависимости от температуры, является одной из сложных и в то же время
традиционных задач термодинамики. Сложность состоит в корректном разрешении
подынтегральной функции, поскольку S=f(T), а богатые традиции связаны с тем, что
решение этой задачи всегда было одной из главных проблем классической
термодинамики. Известно, что зависимость энтропии от температуры может быть
выражена через теплоемкость следующим образом:
(4.11)
Интегрирование этого выражения основано на третьем главном законе, или третьем
начале термодинамики, называемом также в обобщенном виде постулатом Нернста -
Планка. Этот постулат сейчас обычно выражается формулировкой Планка: энтропия
любого конденсированного тела при абсолютном нуле равна нулю. Математическое
выражение постулата:
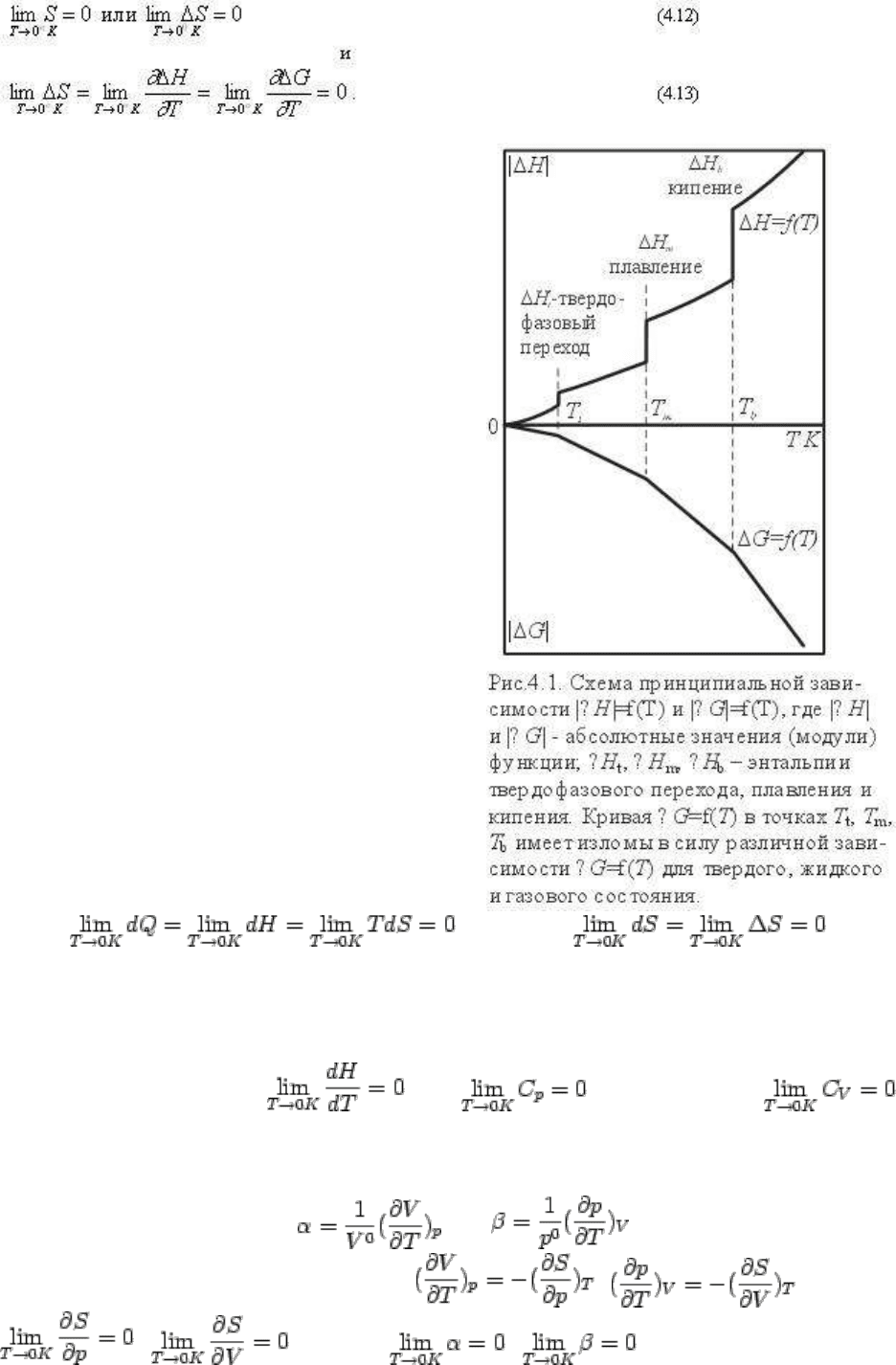
Графически соотношение (4.13) можно
представить как общую горизонтальную
касательную к кривым ΔH=f(T) и ΔG=f(T) в
точке 0К. На рис. 4.1 схематически показаны
типовые зависимости ΔH = H - H
o
и ΔG = G - G
o
от температуры.
а) тепловые эффекты равны нулю при T = 0K:
, поскольку
б) удельные (мольные) теплоемкости равны нулю при Т = 0К:
C
p
= dH / dT, но поскольку , то и , равным образом
в) термические коэффициенты расширения (α) и давления (β) равны нулю при Т=0К.
Согласно определению и ; но из уравнения
термодинамических потенциалов следует и поскольку
и , то также и .
Третье начало и вытекающие из него следствия дают принципиальную возможность
вычисления теплоемкости и энтропии фаз при любой температуре: определенный
интеграл от 0К до Т по уравнению (4.11) равен
и для того,
чтобы
установить S
T
,
необходимо
знать значение
теплоемкости
от 0К до T.
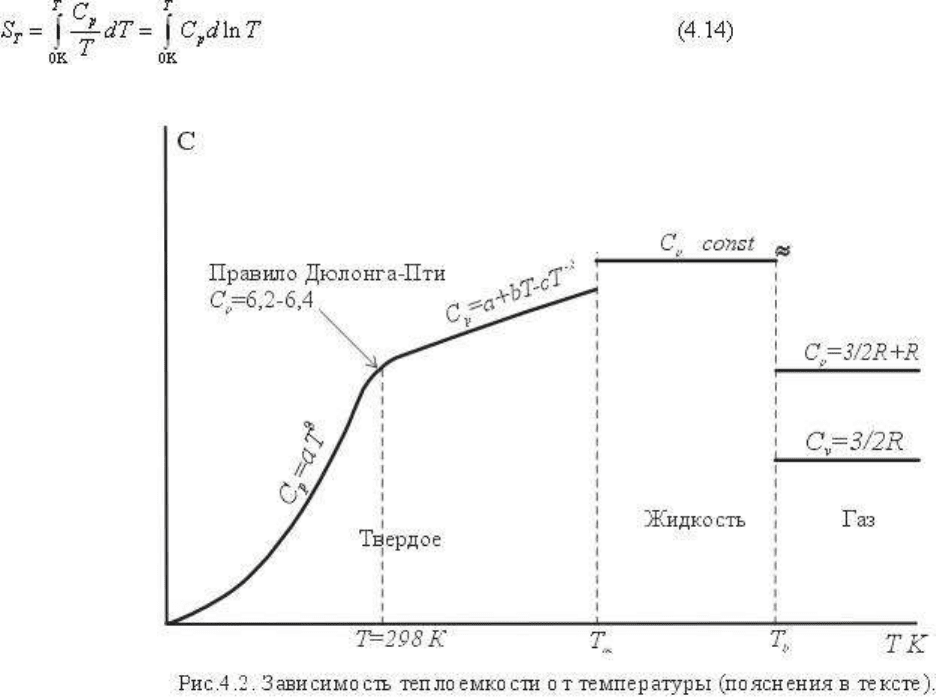
Температура оказывает существенное влияние на величину теплоемкости, причем
различное при разных температурах. Если обобщить многочисленные данные по
определению температурной зависимости теплоемкости разных веществ, то для многих
элементов (твердых при комнатной температуре) эта зависимость может быть
представлена следующей схемой (рис. 4.2). В области низких температур теплоемкость
изменяется по кубическому закону C
p
= aT
3
(уравнения Эйнштейна и Дебая). При
комнатных температурах атомные теплоемкости твердых веществ приблизительно равны
6,2-6,4 кал/г-атом
.
град (правило Дюлонга - Пти). При повышении температуры до
плавления теплоемкость увеличивается по эмпирической зависимости, описываемой
степенным рядом: C
p
= a + bT + cT
2
+ dT
3
... Практически удовлетворительную точность
дает разложение C
p
в трехчленный ряд вида
C
p
= a + bT - cT
-2
(4.15)
гдe a, b и c - индивидуальные константы вещества, определяемые экспериментально для
конкретного интервала температур; они приведены во всех термодинамических
справочниках. В жидком состоянии теплоемкость с приближением может быть принята
постоянной; обычно теплоемкость жидкости немного больше (иногда меньше)
теплоемкости твердого вещества. Для теплоемкости газов установлены следующие
соотношения С
p
-C
V
=R (где R - газовая постоянная) и с хорошим приближением С
p
= 3/2R
+ R для одноатомных газов, С
p
= 5/2R + R для двухатомных газов, причем теплоемкости
не изменяются с температурой.

Рассмотренные зависимости сводят вычисление энтропии к решению уравнения (4.14) в
виде
где ΔH
t
,ΔH
m
,ΔH
b
-теплоты (изменение энтальпии) твердофазового перехода, плавления и
кипения при соответствующих температурах T
t
, T
m
, T
b
, a, a
1
, b
1
, c
1
, a
2
, b
2
, c
2
- константы
уравнений теплоемкости для разных интервалов температур и фаз; C
p
l
и C
p
g
- постоянные
теплоемкости жидкости и газа.
Зная энтропии фаз, участвующих в реакции, нетрудно вычислить и энтропию любой
совокупности фаз, в том числе и находящихся в моновариантной реакции, для любой
температуры, поскольку все члены уравнения (4.16) полностью аддитивны, т. е. для
реакции имеем соответственно ΔS, Δa, Δa
1
, Δb
1
, Δc
1
, Δa
2
, Δb
2
, Δc
2
, и т. д.
Применительно к минеральным равновесиям энтропия рассчитывается не от 0К, а от
температуры 298К или от какой-либо другой температуры T
*
, для которой равновесие
установлено экспериментально. Тогда интеграл уравнения (4.11) имеет вид
Для вычисления ΔS от стандартной температуры (298,15К) множители A
S
, B
S
, C
S
табулированы в справочниках, а коэффициенты уравнения теплоемкости представлены
обычно в виде C
p
= a + bT
.
10
3
-cT
-2.
10
-5
.
Вычисление температурного или энтропийного приращения свободной энергии ΔG
ΔT
(см.
уравнение (4.7)) сводится, таким образом, к решению:

Значения A
g
, B
g
и C
g
от стандартной температуры табулированы в справочниках, причѐм
для того, чтобы иметь дело с величинами одного порядка, в таблицах приведены значения
A
g
, B
g
10
-3
и C
g
10
5
(и, так же, как и в уравнении приращения энтропии A
s
, B
s
.
10
-3
, C
s
.
10
5
).
Уравнение теплоемкости, как указывалось, имеет вид C
p
= a + bT
.
10
3
-cT
-2.
10
-5
и
соответственно коэффициенты уравнения теплоемкости в таблицах представлены как a,
b
.
10
3
и c
.
10
-5
.
2. Интегрирование члена ΔG
Δp
= ∫ΔVdp, выражающего приращение свободной энергии в
зависимости от давления, существенно отличается для фаз, находящихся в различном
агрегатном состоянии. Для твердых фаз их сжимаемостью и тепловым расширением
можно пренебречь и тогда
поскольку произведение ΔV
.
1 очень мало по сравнению с другими величинами,
входящими в выражение свободной энергии. Сжимаемость твердых фаз можно не
учитывать при расчетах до давлений 15-20 кбар. При больших величинах давлений
желательно было бы ввести соответствующие поправки. Эти поправки имеют линейную
зависимость от Т и р: V
p,T
= V
*
(1-xp)(1+αΔT), где х - коэффициент сжимаемости, α -
коэффициент термического расширения, но для высоких параметров они большей частью
неизвестны.
Выражение ∫V
f
dp для флюидной и газовой фаз может быть получено на основании
экспериментальных определений мольных или удельных объемов при высоких
параметрах. Для таких компонентов, как H
2
O, данные имеются для давлений до 100 кбар и
температуры 1000
o
С, для CO
2
до 10 кбар и 1000
o
С. Они детально охарактеризованы и
табулированы в справочниках в виде приращений свободной энергии

данные для H
2
O в диапазоне Т=25-1000
o
С (298-1273К) и р=1-10000бар, для CO
2
Т=25
1000
o
С и р=1-1000 бар. Реже используется чисто "барическое" приращение
В тех случаях, когда экспериментальные определения отсутствуют, пользуются одним из
эмпирических уравнений, описывающих зависимость V от р для газов (например,
уравнением Тэйта: , где B и C константы, зависящие от
температуры). Однако, если для интерполяции данных эти уравнения работают хорошо,
то при экстраполяциях возможны большие ошибки.
3. Расчеты равновесий с участием газовой смеси в условиях, когда летучие ведут себя как
вполне подвижные компоненты, должны производиться с учетом мольной доли и
активности компонентов в газовой смеси. Для газовой смеси, например смеси H
2
O и CO
2
,
справедливы следующие соотношения:
dG
H
2
O
= dG
p
H
2
O
+ dG
a
H
2
O
= V
H2O
dp + Δm
H2O
RT d ln
a
H2O
(4.26)
но для идеального газа , а для воды как реального газа
V
H2O
dp = Δm
H2O
RT dln θ
H2O
p; второй член (4.26) равен Δm
H2O
RT dln γ
H2O
x
H2O
, где θ
H2O
и
γ
H2O
- коэффициенты летучести и активности воды.
где θ
H2O
, θ
CO2
, γ
H2O
, γ
CO2
коэффициенты активности и летучести при p=p
общ
и
соответствующей Т равновесия. Из уравнений (4.26)-(4.30) видно, что для корректного
расчета реакции с газовыми смесями необходимы данные не только по коэффициентам
летучести, определяемые по мольным и удельным объемам индивидуальных газов, но и
по коэффициентам активности, отражающим отклонение поведения газов от идеальности
в смеси газов. Экспериментально определены коэффициенты H
2
O и CO
2
для геологически
важного диапазона Т=400-600
o
С и р=300-5000 бар. Однако для более сложных газовых
смесей и больших давлений данные единичны или пока еще отсутствуют, и значения

коэффициентов активностей приходится опускать, что может приводить к существенным
погрешностям расчетов.
Формулы (4.26)-(4.30) справедливы, для расчета активности любого летучего компонента
в любых сложных растворах. Они показывают, что для успешного выполнения расчетов
кроме общего Т и р необходимо знать индивидуальные γ, θ и x.
4. Наибольшие осложнения возникают при расчете равновесий, в которых участвуют
нелетучие вполне подвижные компоненты, присутствующие в растворе в виде
нейтральных и диссоциированных молекул. Эти сложности связаны с необходимостью
использовать в расчетах данные по энтропиям, объемам и коэффициентам активности для
растворенных молекул и ионов, которые нередко неизвестны, тем более для высоких
параметров.
Расчеты равновесий с участием вполне подвижных компонентов (в.п.к.) по степени их
сложности распадаются на несколько групп: а) расчеты минеральных равновесий в
зависимости от активности (фугитивности или парциальных давлений) в.п.к. для
изотермических и изобарических условий и б) расчеты равновесий в зависимости от
переменных температуры, давления и активностей (фугитивностей, парциальных
давлений) в.п.к. В свою очередь вполне подвижные компоненты могут быть представлены
в нейтральной - молекулярной и диссоциированной - ионной форме. Последний тип
расчетов с ионизированными в.п.к. представляет, как будет показано ниже, наибольшие
сложности. Рассмотрим эти вопросы несколько подробнее.
Физико-химические расчеты равновесий в системе с вполне подвижными компонентами
для изотермо-изобарических условий предполагают кроме ΔG*
p*, T*
определение членов
ΔG
Kp
= ΔG
aj
+ ... + ΔG
ak
в следующем виде:
Для определения ΔG
Kp
необходимо, таким образом, знать концентрации (мольные доли)
вполне подвижных компонентов и коэффициенты их активностей. Первое не вызывает
особых затруднений в том случае, если вполне подвижные компоненты представлены
нейтральными молекулами. Заметно усложняются расчеты в случае ионных форм вполне
подвижных компонентов, поскольку необходимо знать степени или константы
диссоциации соответствующих веществ при данных Т и р.
Введение коэффициентов активности в расчеты нередко невозможно из-за отсутствия
данных, особенно при высоких параметрах. Поэтому поневоле приходится
ограничиваться приближением к идеальным растворам. Известно, что, как правило,
степень отклонения от идеальности уменьшается с уменьшением концентрации и
давления и с увеличением температуры. Соответственно можно как-то оценить
допустимость сделанных приближений.
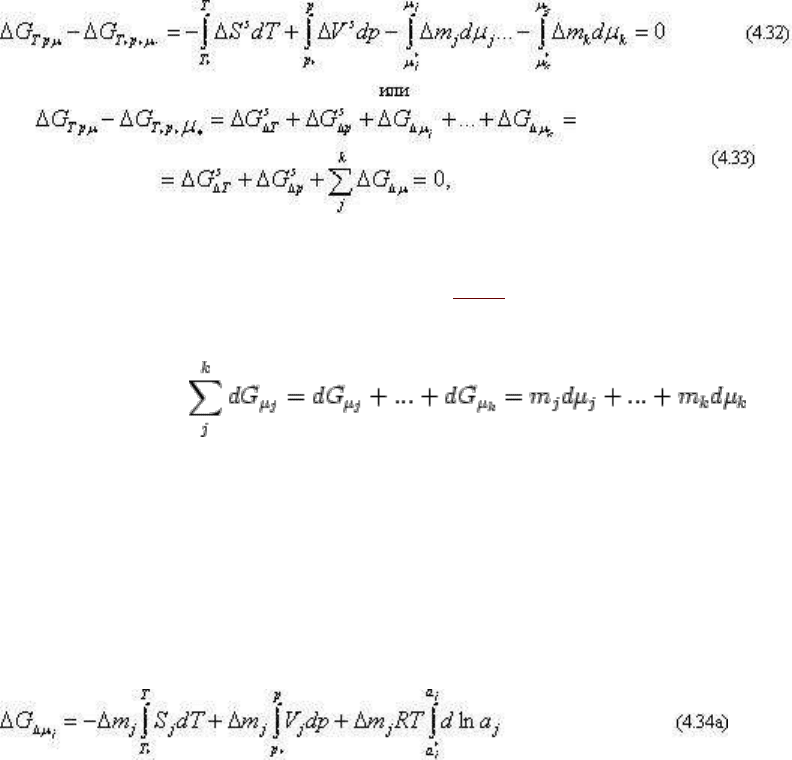
Расчеты равновесий с вполне подвижными компонентами для различных температур и
давлений дополнительно осложняются необходимостью учета энтропий и мольных
объемов вполне подвижных компонентов в той форме, в какой они принимают участие в
реакциях минералообразования, т.е. обычно в виде диссоциированных, реже нейтральных
молекул в растворе. Уравнение приращения термодинамического потенциала в этом
случае иногда удобнее представить в другом виде:
где индекс s, например ΔG
T
s
, ΔG
s
, как обычно, обозначает, что данный член отнесен к
твердым фазам. Как показано выше (см. гл. 2), изменение свободной энергии вполне
подвижных компонентов выражается как
Для каждого вполне подвижного компонента
dΔG
μj
= Δm
j
dμ
j
= Δm
j
(-S
j
dT + V
j
dp + RT d ln a
j
),
(4.34)
откуда также для каждого вполне подвижного компонента
где S
j
, V
j
- энтропия и мольный объем вполне подвижного компонента. Сопоставляя (4.34)
и (4.35) с выражением dμ
j
, нетрудно видеть, что изменение свободной энергии вполне
подвижного компонента слагается, таким образом, из приращения стандартного
химического потенциала dG
o
μj
, связанного с энтропийными и объемными
характеристиками компонента и из приращения эффективного химического потенциала
dG
aj
, вызванного изменением активности компонента, т. е.
dG
μj
= dG
o
μj
+ dG
aj
,
(4.35)
ΔG
μj
= ΔG
o
μj
+ ΔG
aj
,
(4.36)
Определение приращения стандартной свободной энергии вполне подвижных
компонентов, находящихся в растворе, сопряжено со значительными трудностями,
особенно для компонентов в ионной форме. Возникающие осложнения связаны: а) с
принципиальной трудностью определить энтропию и объем отдельного иона в растворе,
поскольку может быть известен только суммарный тепловой и объемный эффект
диссоциации; б) с отсутствием достаточного количества экспериментальных данных по
энтропиям и объемам растворенных и диссоциированных соединений, особенно для
высоких параметров. Вследствие этого вычисления ΔG
o
μj
носят в известной степени
условный и приближенный характер, но, впрочем, такие приемы используются и при
вычислении других термодинамических параметров. В соответствующей справочной
литературе (см., например, Наумов и др., 1971; Карпов и др., 1968, А.Г.Булах, К.Г.Булах,
1978, М.В.Борисов и Ю.В. Шваров, 1992) подробно оговариваются сделанные допущения
и условия стандартизации, принятые для возможности вычисления (с ними нужно
внимательно знакомиться во избежание недоразумений). Поэтому здесь, как бы в качестве
введения, можно ограничиться общей характеристикой исходных посылок.
При вычислении энтропии ионов принимается S
298
H+
= 0 и S
T
H+
= 0 для всех температур
(Наумов и др., 1971) или S
298
H+
= 5.2 кал / моль
.
град и энтропия линейно зависит от
температуры S
T
= a + bT (Карпов и др., 1968). Принятие S
H+
= 0 для всех температур
вводит условную шкалу отсчета, но это вполне приемлемо для расчета моновариантных
реакций, если, естественно, соответствующая поправка введена в значения энтропий всех
других ионов. Так, например расчетное уравнение моновариантной линии C + K
+
= D +
Na
+
вполне сопоставимо с экспериментальными результатами (если, конечно, взяты
надежные данные по зависимости S
K
+
и S
Na
+
от температуры). В тоже время следует иметь
в виду что для реакций типа E + K
+
= F + H
+
условие S
H
+
= 0 приведет к существенным
отличиям от экспериментально изученных равновесий. В этом случае необходимо
определить зависимость S
H
+
= f(T) по экспериментальным данным (см. ниже).
При вычислении мольного объема ионов принимается V
298
H+
=0 (Наумов и др., 1971) или
V
H+
= 4.5см
3
/моль (Карпов и др., 1968). Зависимости мольных объемов большинства
ионов от давления, температуры и концентрации растворов не известны и поэтому пока не
учитываются. Для многих веществ мольные объемы ионов и молекул при Т=298К тоже
еще не определены и обычно оцениваются по приближенным расчетным формулам
(исходя, например, из радиуса ионов и т. д.). Отсутствие надежных термодинамических
данных по энтропиям и мольным объемам ионов для высоких параметров вынуждает
искать обходные пути их определения, основанные на экспериментально изученных
равновесиях с участием вполне подвижных диссоциированных компонентов, и эти пути
кажутся сейчас весьма перспективными.
Наконец, энтропийные характеристики недиссоциированных растворенных молекул (при
отсутствии термодинамических констант) приближенно рассчитываются из энтропий
твердых соединений с учетом (если это возможно) теплоты растворения и концентрации
раствора: поскольку
S
i(T)
= S*
i(T)
- Rlnx
i
то
S
l
i(T)
= S
os
i(T)
+ ΔQ
m
/T - Rlnx
i
Точность таких расчетов зависит прежде всего от представительности ΔQ
m
, и если эта
величина включает и теплоту растворения и теплоту гидратации, и теплоту смешения (в
случае неидеального раствора), то искомая величина представляет собой
термодинамическую константу.
