Жариков В.А. Основы физической геохимии
Подождите немного. Документ загружается.

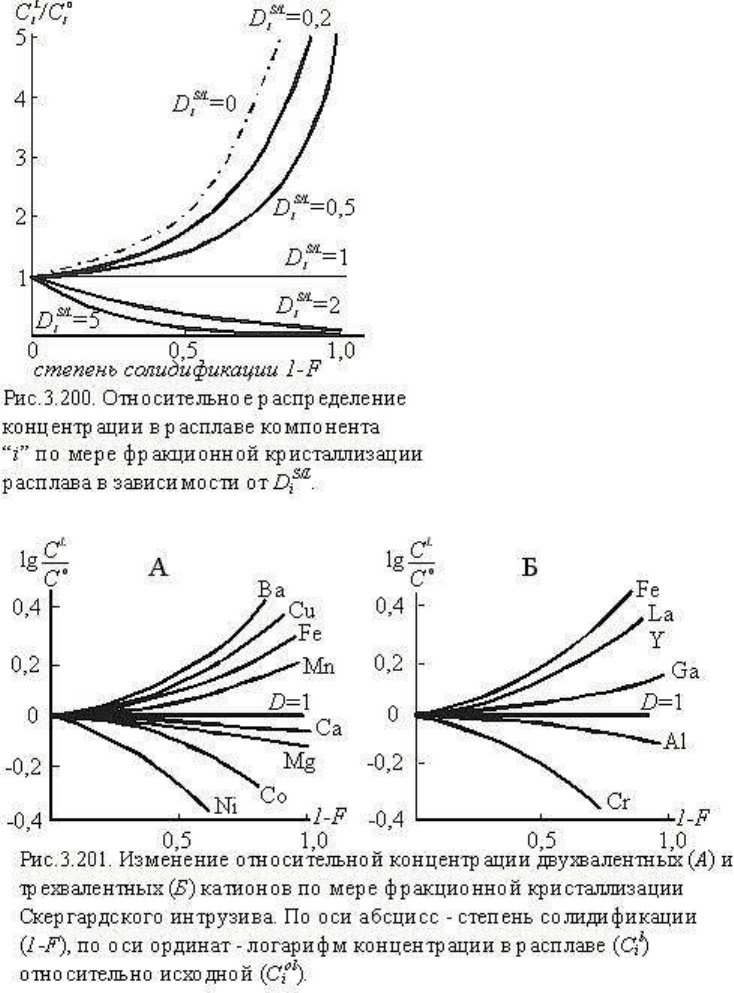
На рис.3.200
приведена
концентрация
компонента i в
зависимости от
величины
коэффициента
D
i
S/L
, D
i
S/L
= 0,2,
0,5, 1, 2, 5, и
степени
солидификации F
расплава.
Нетрудно видеть
крайние значения.
Если D
i
S/L
= 0, то
C
i
l
/ C
i
ol
= 1 / F и
штрихпунктирная
линия (D
i
S/L
= 0) ограничивает область реальных концентраций компонента i в расплаве.
При D
i
S/L
= 1 C
i
l
/ C
i
ol
= 1 и концентрация компонента "i" по мере кристаллизации не
изменяется. Все другие значения D
i
S/L
> 0 имеют реальный смысл, если D
i
S/L
не слишком
велико (например, при D
i
S/L
= 50 при кристаллизации 10% расплава (F=0,9), концентрация
i в расплаве составит уже 0,006 исходный).
Сопоставляя графики равновесной (см. рис.3.199) и фракционной (см. рис.3.201)
кристаллизации, можно видеть значительно более контрастное перераспределение
компонентов при фракционной кристаллизации. Это свойство успешно используется для
различных генетических построений. В качестве наглядного примера приведем (по
П.Хендерсону, 1985) две диаграммы (рис.3.201, А и Б) относительного изменения
концентрации элементов в магме при фракционной кристаллизации известного
Скергардского интрузива. Диаграммы построены для двухвалентных (А) и трехвалентных
(Б) катионов в координатах (1-F) - абсцисса и отношение концентрации, построенной для
большей наглядности в логарифмической шкале lg (C
i
l
/ C
i
ol
). Диаграммы наглядно
показывают относительные обеднение и обогащение остаточных расплавов элементами,
имеющими различные геохимические свойства.
Так же, как и при равновесном плавлении, уравнения и диаграммы изменения
концентраций компонентов могут быть выведены для фракционного плавления.
Соответствующие диаграммы являются как бы зеркальным отражением диаграмм
фракционной кристаллизации и мы их оставим для самостоятельного творчества.
Заметим, что при построении моделей кристаллизации и плавления возможно более
сложное многоэтапное чередование различных процессов: частичное равновесное
плавление, отделение расплавов, их фракционная кристаллизация с отделением
остаточных расплавов и т.д. Сложные модели лучше строить на примере конкретных
магматических комплексов, изучение которых позволит выявить граничные условия
каждого из этапов. Также, при кристаллизации какого - либо компонента i в нескольких
фазах необходимым оказываются введение валовых коэффициентов распределения и
другие усложнения моделей.
Диаграммы фазового соответствия
Как уже отмечалось выше, что при рассмотрении закономерностей распределения между
фазами макрокомпонентов, образующих в твердых фазах минералы - твердые растворы
необходимо использовать уравнения обменнных реакций между сосуществующими
фазами. Термодинамическая теория обменных реакций изложена в первом параграфе
этого раздела. Здесь мы рассмотрим примеры и способы построения диаграмм фазового
соответствия.
Способы изображения сосуществующих составов
В физико -химической петрологии используются главным образом два способа
изображения диаграмм фазового соответствия. В первом случае диаграмма строится в
координатах отношений мольных долей миналов x
b
M
/x
c
M
и x
b
N
/x
c
N
, где b и c - компоненты
твердого раствора, М и N - фазы, или, что то же самое, для бинарного твердого раствора:
x
b
M
/ (1-x
b
M
) и x
b
N
/ (1-x
b
N
). В таких координатах тангенс угла наклона линии, проведенной
через любую фигуративную точку, показывает значение константы распределения К
d
, и
если K
d
=const, соответствующие линии оказываются прямыми, исходящими из начала
координат.

Во втором случае координатами диаграммы служат мольные доли какого-либо
компонента x
b
M
и x
b
N
, а линии K
d
=const представлены семейством кривых (кроме K
d
=1,
которая прямая). Способ изображения выбирается обычно в зависимости от того, какие
данные - K
d
или x
b
- предпочтительно сразу, без пересчета снимать с диаграммы. На рис.
3.202 и 3.203 приведены диаграммы идеального распределения компонентов b и с
(формула (3.86)), разница между которыми состоит только в способе изображения.
Диаграммы фазового соответствия очень наглядны, их чтение не составит никаких
затруднений: очевидно, что если K
d
> 1, то фаза М всегда содержит больше компонента b,
чем фаза N, и тем больше, чем выше K
d
; наоборот, если K
d
< 1, то фаза М содержит тем
меньше компонента b по сравнению с фазой N, чем меньше величина K
d
. Построить
диаграммы фазового соответствия природных (и искусственных) минералов несложно: в
координатах x
b
или x
b
/ (1-x
b
) наносятся соответствующие составы, определение которых
нередко требует кропотливого микрохимического, рентгеноспектрального или
оптического исследования. Интерпретация диаграмм с целью получения количественных
значений факторов минералообразования возможна, как отмечалось, только на основании
экспериментальных и термодинамических данных.
Диаграммы фазового соответствия и проблема миналов
Рассмотрим несколько диаграмм фазового соответствия.
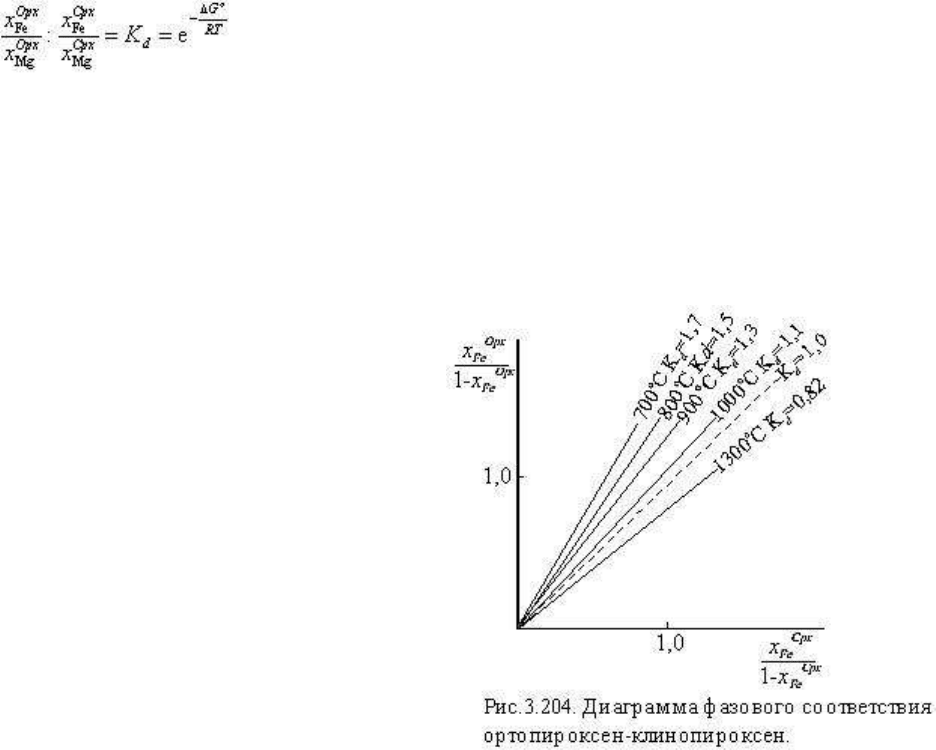
1. Клинопироксен - ортопироксен. Закономерности сосуществующих составов этой
пары минералов изучались многими исследователями (Кретц, Мюллер, Перчук и др.).
Распределение магния и железа между ортопироксеном и клинопироксеном может быть
представлено обменной реакцией
CaMgSi
2
O
6
+ FeSiO
3
= CaFeSi
2
O
6
+ MgSiO
3
или в символах
Cpx
Mg
+ Орx
Fe
= Срx
Fe
+ Opx
Mg
.
Константа равновесия реакции
практически не зависит от состава, и, следовательно, распределение компонентов в этой
паре идеальное:
Изучение природных парагенезисов и экспериментальные исследования и
термодинамические расчеты показали, что К
d
очень мало зависит от давления, поскольку
объемный эффект этой обменной реакции мал, и установили очевидную зависимость К
d
от температуры (
о
С):
К
d
1300
= 0.82
К
d
1000
= 1.1
К
d
900
= 1.3
К
d
700
= 1.7
На рис. 3.204 представлена диаграмма
фазового соответствия ортопироксен -
клинопироксен, отвечающая этим
значениям.
Диаграмма показывает, что в
парагенезисах, образованных при
температуре 1000
о
С и ниже, ортопироксен
всегда содержит больше железистой
молекулы, чем сосуществующий клинопироксен, и чем ниже температура, тем больше
разница в содержании железистой молекулы в пироксенах. При высоких температурах
(около 1100
о
C) происходит инверсия этих соотношений, и при Т=1300
о
С обнаружено уже
обратное распределение: ортопироксен оказывается более магнезиальным. Заметим, что
содержание титана, алюминия в пироксенах осложняет эти соотношения. Явная
зависимость распределения магния и железа между клинопироксеном и ортопироксеном
от температуры эффективно используется для решения главной (обратной) задачи -
определение температуры образования парагенезисов магматических и метаморфических
пород по сосуществующим составам пироксенов. Иначе говоря, пара клинопироксен -
ортопироксен вляется надежным природным геотермометром.
2. Ортопироксен - оливин. Распределение компонентов между ортопироксеном и
оливином многократно обсуждалось в литературе Г.Рамбергом, П.Бартоломе,
А.А.Маракушевым, Д.С.Коржинским и др. Причина такого внимания связана с важной и
дискуссионной проблемой выбора компонентов (миналов) обменных реакций. В
приведенном выше примере обменная реакция была записана как уравнение первого
порядка, что в отношении реакции Орх=Срх очевидно. Между тем в других парагенезисах
обменные реакции могут быть уравнениями второго, третьего и других порядков, что
приведет к другому выражению константы равновесия и зависимостей распределения
компонентов. Покажем это на примере пары оливин - ортопироксен.
Обменная реакция между оливином и ортопироксеном может быть представлена как
реакция первого порядка
Mg
2
SiO
4
+
Fe
2
Si
2
O
6
=
Fe
2
SiO
4
+
Mg
2
Si
2
O
6
Ol
Mg
Орx
Fе
Ol
Fe
Opx
Mg
с константой реакции
или как реакция второго порядка:
Mg
2
SiO
4
+
2FeSiO
3
=
Fe
2
SiO
4
+
2MgSiO
3
Ol
Mg
Орx
Fе
Ol
Fe
Opx
Mg
с другой константой распределения:
где y
Fe
Ol
, y
Fe
Opx
- также мольные доли миналов, обозначенные так для того, чтобы, не
оговариваясь, различать два уравнения.
Для реакции первого порядка в соответствии с приведенным выражением констант при K
d
≠ 1 x
Fe
Ol
не равно x
Fe
Opx
во всем интервале составов, кроме крайних, когда х = 0 и х = 1. В

случае K
d
= 1, х
Ol
= х
Opx
во всем интервале значений х, но такие соотношения не имеет
смысла рассматривать.
Для реакции второго порядка, кроме у=0 и y=1, найдется еще одно - единственное
решение, когда y
Ol
=y
Opx
и это решение зависит от величины K
d
II
. В этом легко убедиться.
Уравнение константы реакции
т.е. отношение мольных долей компонентов равно константе реакции. Преобразуя
y=K
d
II
(1-y) и y+K
d
II
y=K
d
II
, уравнению нетрудно придать и такой вид:
(3.115)
Для реакции любого порядка можно получать общие выражения для определения
действительного значения K
d
*
для разных экстремальных состояний. Пусть константа
обменной реакции высокого порядка запишется как:
В соответствии с уравнениями (3.118) и (3.119) ищем все решения для К*
d
=1 (т.е y
b
M
=
y
b
N
). Прежде всего очевидны решения y=0 и y=1 - не имеющего прикладного смысла
(конечные точки диаграммы). При m=n имеем для всех составов К*
d
=1. Наконец, если m ≠
n, то можно убедиться, что есть решение 0 < y < 1, дающее один экстремальный состав
для каждого значения m и n.
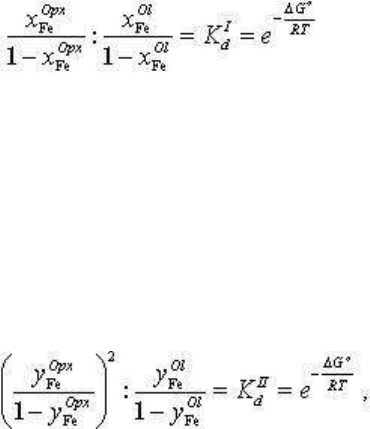
На рис. 3.205 построена диаграмма сосуществующих
составов оливин - ортопироксен, соответствующих
распределению компонентов по реакциям первого и
второго порядка для одинаковых величин констант
распределения. Распределение компонентов по
обменной реакции первого порядка при постоянной
величине К
d
монотонно и однозначно во всем
диапазоне составов: оливин обогащен железистой
молекулой по сравнению с сосуществующим
ортопироксеном.
Распределение компонентов по обменной реакции
второго порядка тоже при постоянной величине К
d
имеет сложную зависимость: в области железистых
составов также x
Fe
Ol
> x
Fe
Opx
, но в области
магнезиальных составов происходит инверсия
распределения, изменяясь на обратные соотношения,
когда x
Fe
Ol
< x
Fe
Opx
. При этом все кривые
распределения проходят через точки x
Fe
Ol
= x
Fe
Opx
,
которые имеют координаты, зависящие, как показано
выше, от K
d
II
: при K
d
II
= 0,08 x
Fe
Ol
= x
Fe
Opx
= 0,07, при
K
d
II
= 0,25 x
Fe
Ol
= x
Fe
Opx
= 0,20 и при K
d
II
=0,66 x
Fe
Ol
=
x
Fe
Opx
= 0,40. Это точки экстремума, где происходит
инверсия железистости сосуществующих оливина и
ортопироксена. Одинаковые составы. оливина и
клинопироксена, являясь экстремальными, служат признаком экстремума в бинарной
системе. Ниже экстремальные составы рассмотрены подробнее, здесь же только отметим,
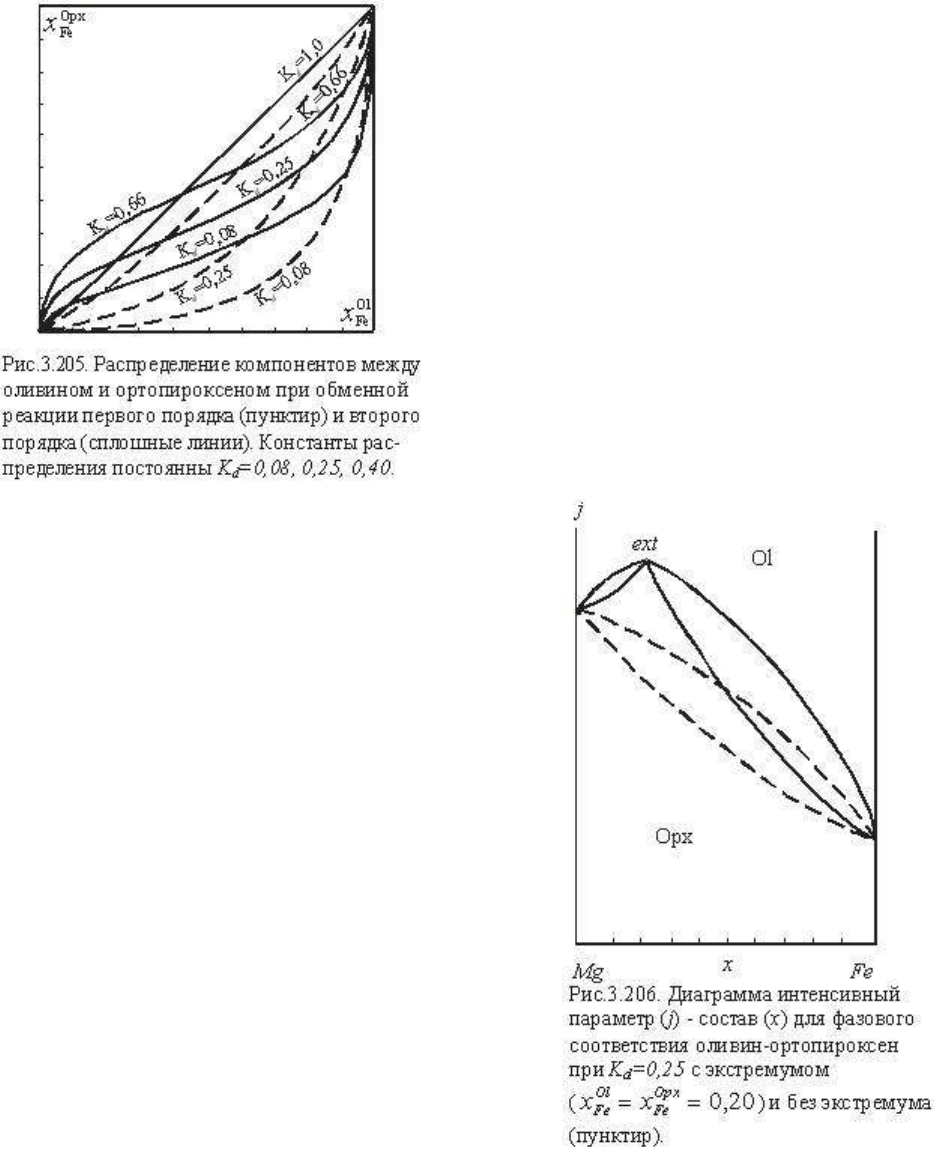
что они особенно хорошо видны на диаграммах в смешанных координатах интенсивный
параметр - состав. На рис. 3.206 представлена j (интенсивный параметр) - х диаграмма
бинарной системы оливин - ортопироксен, где показано распределение Ol=Opx при K
d
II
=0,25 с экстремумом x
Fe
Ol
= x
Fe
Opx
= 0,2 и для сравнения пунктиром показано

распределение K
d
=0,25 без экстремума, соответствующее обменной реакции первого
порядка.
Если обратиться к материалам по сосуществующим составам оливина и ортопироксена в
природных парагенезисах, то эти данные, несомненно, устанавливают экстремальные
состояния с экстремумами х
Fe
~= 0,07; 0,20; 0,26; 0,4, которые зависят от температуры
образования парагенезиса. Объяснение этих экстремумов может быть двояким. Первое:
природные оливины и ортопироксены являются идеальными (или близкими к ним)
твердыми растворами, и существование экстремумов объясняется тем, что обменная
реакция представляет реакцию второго порядка, имеющую экстремальный состав в
зависимости от K*
d
, которая в свою очередь зависит от температуры. Второе возможное
объяснение: обменная реакция оливин - ортопироксен относится к реакции первого
порядка, но оливин и ортопироксен представляют неидеальные твердые растворы, и
распределение компонентов между ними зависит от температуры, т.е. в соотношении
(3.116):
член, характеризующий отклонение растворов от идеальности , непрерывно
изменяется в зависимости от состава и температуры, вызывая изменение распределения
Кd с экстремальным состоянием.
Изложенная альтернатива имеет отношение, не только к оливинам и ортопироксенам, но и
представляет общую проблему фазового соответствия - проблему миналов, на
aктуальность которой в свое время обратил внимание Д.С.Коржинский (1973). Нужны
специальные углубленные термохимические и кристаллохимические исследования, чтобы
разобраться в этих соотношениях, поскольку среди природных минералов встречаются и
простые твердые растворы, способные на <ионный обмен>, например щелочные полевые
шпаты, и сложные твердые растворы, где возможно замещение только всего минала
(конечного члена изоморфного ряда), как, например, в плагиоклазах. Проблема миналов
еще ждет своего решения. Успехи в этом направлении откроют прямой путь к пониманию
механизма обменных реакций, протекающих в недрах Земли.
3. Гранат - ортопироксен. Обменная реакция распределения железистого и
магнезиального миналов между гранатом и ортопироксеном может быть записана как:
Mg
3
Al
2
Si
3
O
12
+ 3FeSiO
3
= Fe
3
Al
2
Si
3
O
12
+ 3MgSiO
3
с константой распределения
или в виде реакции первого порядка
MgAl
2/3
SiO
4
+ FeSiO
3
= FeAl
2/3
SiO
4
+ MgSiO
3
с константой
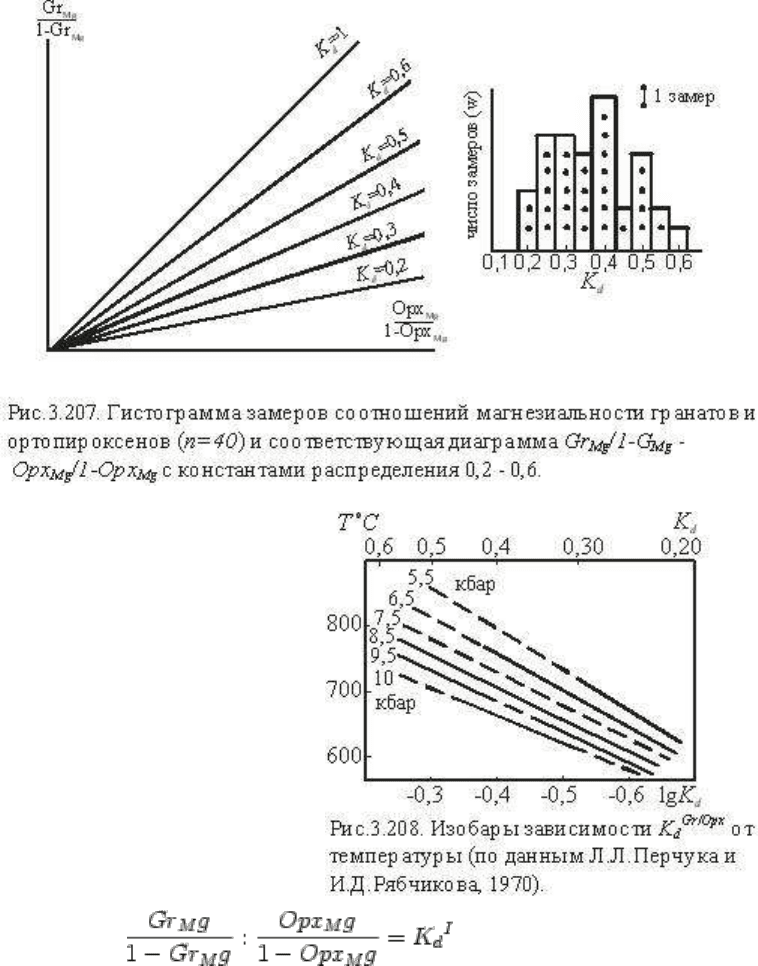

На рис.3.207 представлена диаграмма , где нанесены линии K
d
,
отвечающие наиболее часто встречающимся соотношением магнезиальности граната и
ортопироксена, а данные замеров показаны в виде гистограммы (n=40). Все значения Kd
располагаются в пределах Kd=0,2-0,6, не обнаруживая экстремальных соотношений.
Поэтому с допустимым приближением мы принимаем обменную реакцию первого
порядка и рассматриваем ее зависимость от температуры и давления. Эту зависимость
можно ожидать существенной вследствие заметного различия в энтропиях и объемах
эквикатионных единиц граната и ортопироксена. Опуская соответствующие вычисления,
основанные на экспериментальных данных (вычисления см. в гл. 4) приведем типовую
диаграмму lgK
d
-T, на которой нанесены изобары обменного равновесия для участка 5,5-10
кбар (рис.3.208). Диаграмма показывает принципиальную зависимость K
d
Gr/Opx
от
температуры и давления. Хотя диаграмма построена с известным приближением
(наиболее обоснованные изобары проведены сплошными линиями), она однозначно
указывает, что во всем охарактеризованном диапазоне Т и р ортопироксен всегда более
магнезиален, чем гранат, но с возрастанием Т и р эта разница уменьшается. Можно видеть
также, что при высоких температурах (800
о
С) давление оказывает более существенное
значение на перераспределение магния.
Вследствие влияния на K
d
Gr/Opx
и температуры и давления сосуществующие составы
граната и ортопироксена могут служить и как геотермометры, и как геобарометры.
Однако достоверное использование этого распределения как геотермометра требует
уверенного определения независимым способом давления и, напротив, - использование
как геобарометра хорошего независимого определения температуры. Это непростая
задача и для целей геотермобарометрии проще и надежнее использовать минеральные
парагенезисы, которые являются ярко выраженными геотермометрами (влияние давления
мало) и геобарометрами (незначительно зависящими от температуры).
Диаграммы фазового соответствия в системах с вполне подвижными компонентами
