Жариков В.А. Основы физической геохимии
Подождите немного. Документ загружается.


HS
-
р-р.
2 880
10
-3
; 10
-6
растворимых частиц серы, для расчета примем два
опорных значения 10
-3
и 10
-6
S
-2
р-р.
20 500
10
-3
; 10
-6
Расчетные уравнения:
Реакция пирротин-магнетит:
а) Реакция по форме а при lg a
H2S
= -3.0:
Если примем lg a
H2S
= -6, то это уравнение будет различаться вторым членом (-6) *
0.059*(-3) / (-2) = -0.531 и окончательно:
Eh
6
(a)
= 0.256 - 0.059pH
б) Для реакции по форме b при lg a
HS-
= -3.0:
Если примем lg a
HS-
= -6, то это уравнение будет различаться вторым членом (-6) *
0.059*(-3) / (-2) = -0.531 и окончательно:
Eh
6
(b)
= 0.875 - 0.148pH
с) Реакция в форме с выглядит:
Из приведенных
уравнений видно,
что каждой форме
моновариантной
реакции на Еh-pH
диаграмме будет
отвечать прямая
линия с
отрицательным
наклоном, тангенс
угла которого равен
(при одинаковом
масштабе) величине
коэффициента при
pH с ординатой Eh
o
+ (0.059 Δm
j
/ Δm
e
)
lg a
j
, поскольку при
постоянной lg a
j
второй член
уравнения
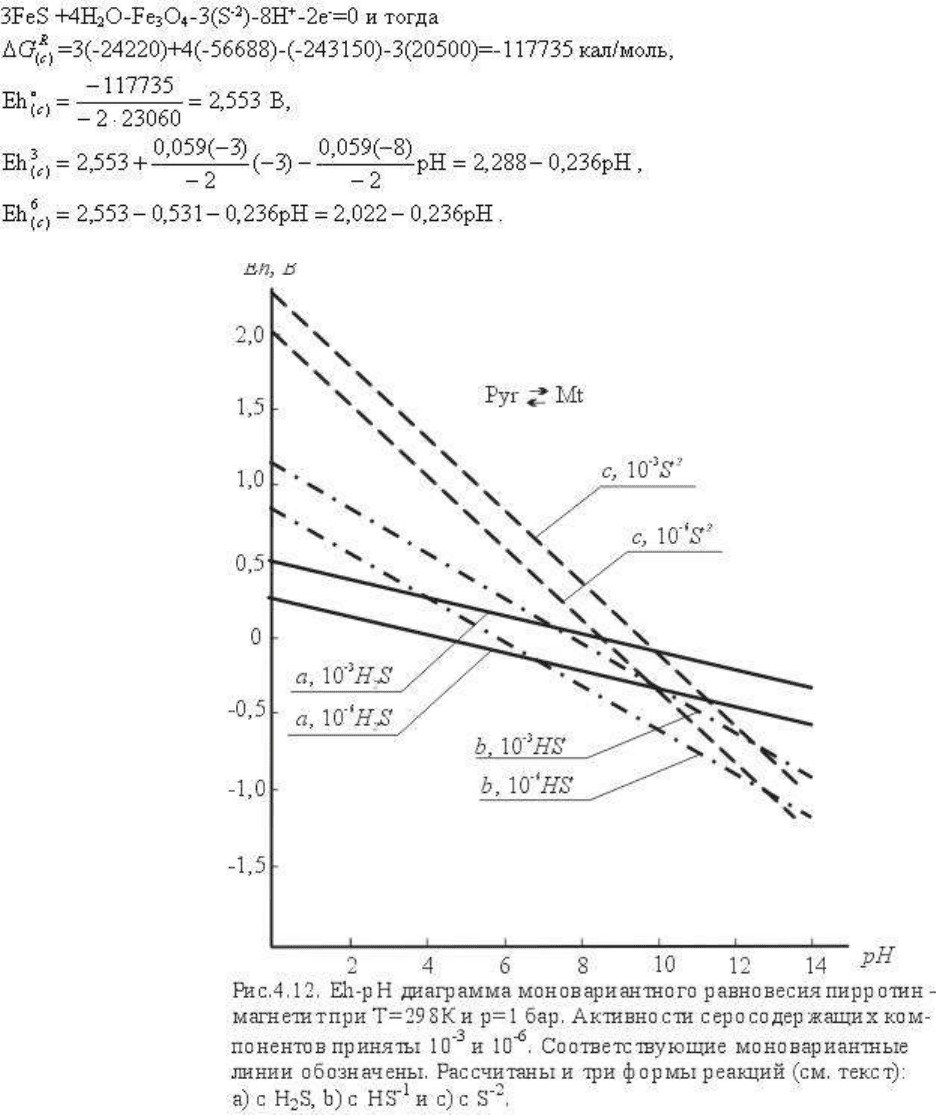
постоянный. Эти линии показаны на рис.4.12 соответственно сплошными линиями (а),
штрих-пунктиром (b) и мелким пунктиром (с). Линии при lga
(S)
= -3 и lga
(S)
= -6 проходят
параллельно, отличаясь, естественно, значениями pH (или Eh). Если принять lga
(S)
постоянной, то в зависимости от pH окисление пирротина в магнетит будет происходить
по разным схемам: например, при lga
(S)
= -6 по схеме а до pH ~= 7, по схеме b от pH=7 до
pH ~= 13 и по схеме с при рН ≥ 13. Увеличение lga
(S)
до -3, естественно, расширяет поле
устойчивости пирротина, но это увеличение незначительно.
Реакция пирит-магнетит:
а) Уравнение реакции по форме а:

б) Уравнение реакции по форме b с частицей (HS
-
) и концентрацией ее 10
-3
и 10
-6
:
в) Для реакции по форме с имеем:
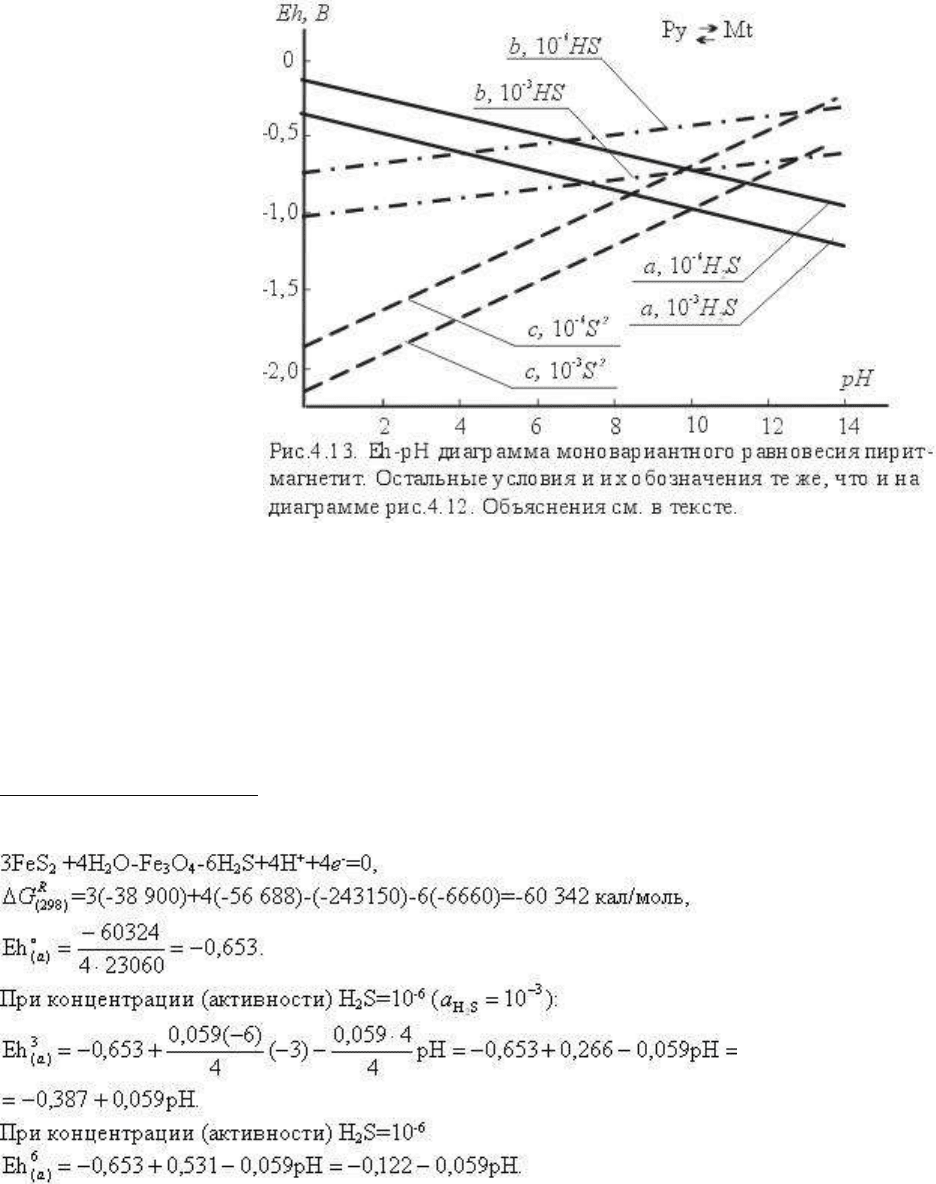
На рис.4.13 нанесены моновариантные линии равновесия пирит-магнетит для всех форм
реакции (а- сплошные линии, b - штрих-пунктир, с - пунктир) и для различной активности
содержащих серу частиц lga
(S)
= -3, lga
(S)
= -6. Отметим, что эта реакция значительно
меньше зависит от кислотности раствора, чем реакция Py=Mt.
Равновесие пирротин-пирит.
Моновариантное равновесие пирротин-пирит также может быть представлено в
различных формах:
FeS + H
2
S = FeS
2
+ 2H
+
+ 2e
-
(а);
FeS + HS
-
= FeS
2
+ H
+
+ 2e
-
(b);
FeS + S
-2
= FeS
2
+ 2e
-
(c).

a) Рассчитаем первую реакцию (a):
б) Уравнение реакции по форме b:
с) Реакция пирротин-пирит в форме с не зависит от pH:
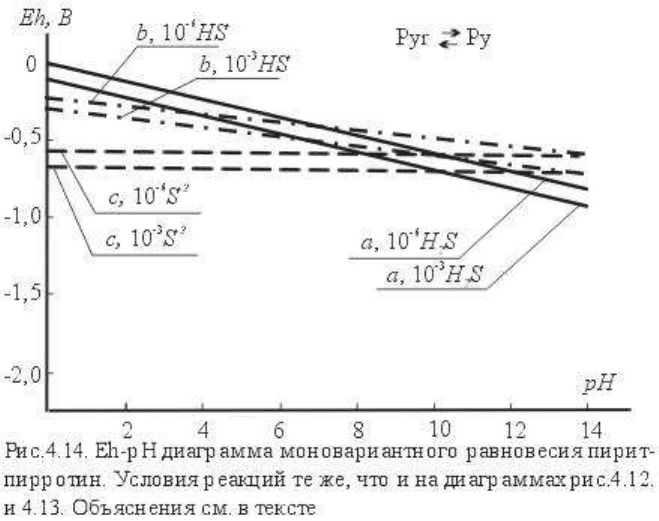
На рис. 4.14 построены равновесные линии пирит-пирротин. Равновесие по форме с не
зависит от pH, его ординаты Eh=-0,675 В (при lga
(S)
= -3) и Eh=-0,586 В (lga
(S)
= -6). Другие
моновариантные линии имеют слабый отрицательный наклон.
Для того чтобы построить не отдельные моновариантные линии, а полную Eh-pH
диаграмму равновесий пирит- пирротин- магнетит в присутствии воды и различных форм
серы, следует увязать между собой отдельные моновариантные линии, ограничивающие
поля устойчивости минералов в зависимости от главных параметров рассматриваемой
системы. Из вышеизложенного очевидно, что при постоянных Т=298К, р=1 бар главными
параметрами кроме Eh и pH являются общая активность серы и активность частиц H
2
S,
HS
-
и S
-2
, которые зависят от pH раствора. Пренебрегая весьма малыми концентрациями
других частиц и ориентируясь на рассчитанные равновесия, можно убедиться что в
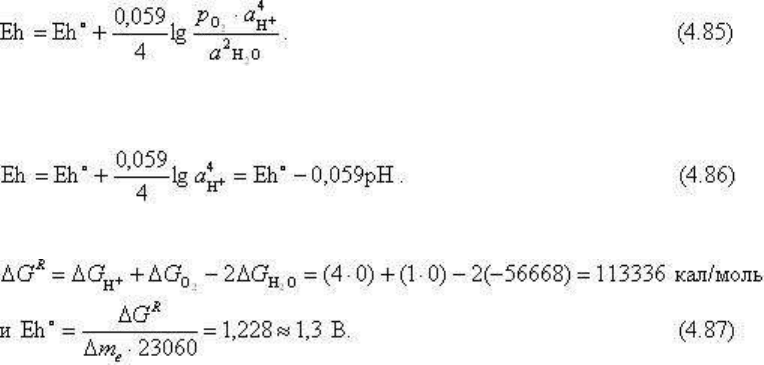
области кислых растворов (до pH ~= 7) стабильна недиссоциированная форма H
2
S, в
диапазоне pH = 7-13 преобладающей является частица HS
-
, и наконец в сильно щелочной
области pH > 13 превалирует ион серы S
-2
(границы между областями обозначены мелким
пунктиром на рис.4.15).
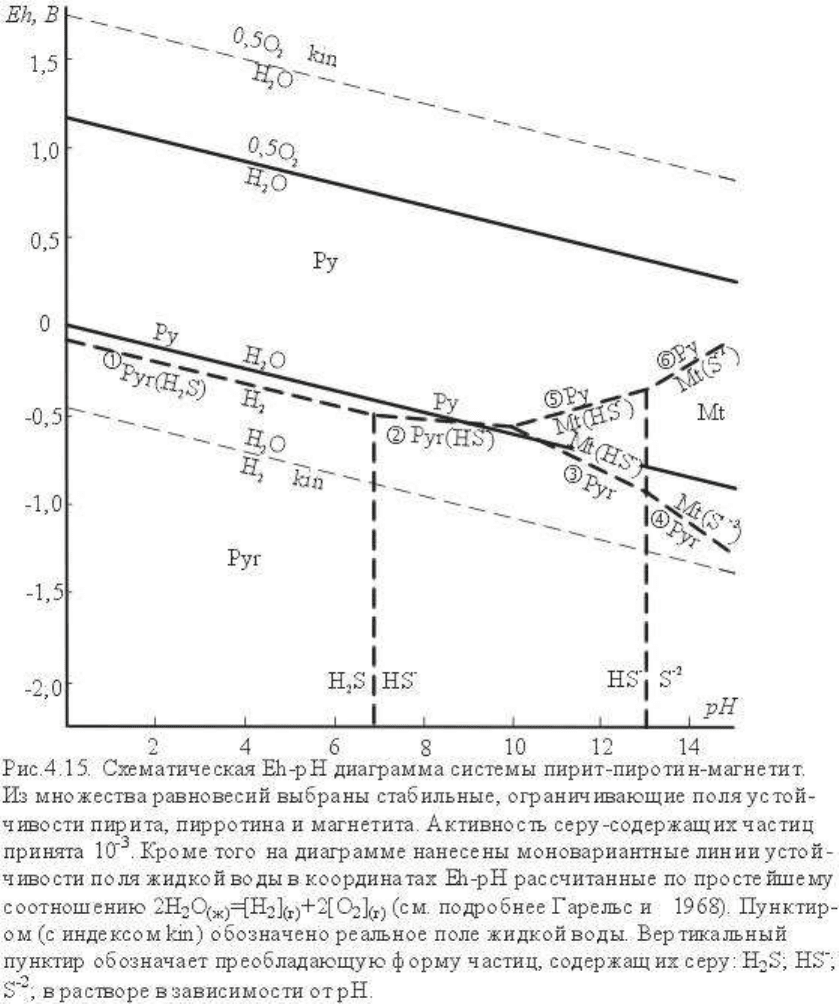
На рис.4.15 приведена итоговая диаграмма системы пирит-пирротин-магнетит (при
активности сера-содержащих частиц 10-3), где показаны стабильные части
моновариантных линий: 1. Py=Pyr (pH=0-7,5) 2. Py=Pyr+HS
-
(pH=7,5-9,2). При
координатах pH ~= 10, Eh ~= -0,5 - нонвариантная точка Py+Pyr+Mt. Далее поле
пирротина и магнетита разделяют линии 3. Pyr=Mt+HS
-
(pH=10,0-13,0) и 4. Pyr=Mt+S
-2
(pH>13,0). Поле магнетита-пирита разграничено стабильной линией 5. Py=Mt+HS
-
и
линией 6. Py ↔ Mt+S
-2
. Представленная диаграмма схематизирована, небольшие
"треугольники невязки" опущены.
При рассмотрении фазовых равновесий в присутствии жидкой воды следует определить
поле устойчивости H
2
O в координатах Eh-pH.
Реакция устойчивости воды:
2Н
2
О
(жид)
= 2Н
2(газ)
+ О
2(газ)
(4.83)
или, выражая еѐ применительно к Eh-pH диаграммам,
2Н
2
О
(жид)
= О
2(газ)
+ 4H
+
+ 4e
-
(4.84)
тогда
принимая а
H2O
=1, верхний предел устойчивости воды будет при p
О2
= 1 бар и уравнение
(4.85) выразится как:
Обычным способом определим Eh
o
:
Верхний предел устойчивости воды (Н
2
О
(жид)
→ О
2 (газ)
) определится как
Eh = 1,23 - 0,059
.
pH
(4.88)
На рис.4.15 моновариантные линии устойчивости воды нанесены сплошными линиями.
Можно видеть , что в присутствии воды в поле стабильности попадает очень маленькая
часть поля Pyr (около нонвариантной точки) и только части полей Mt и Py. Для того чтобы
большая часть пучка разместилась в поле устойчивости жидкой воды необходимо на

несколько порядков уменьшить концентрацию фазы или увеличить температуру. На
диаграмму нанесены линии термодинамического равновесия воды. Как известно, при этом
ΔG
R
= 0 и естественно реакция не осуществляется. Реально реакция протекает при
отклонениях Еh от линий равновесия на 0,5 и более вольт. Соответствующие линии (+0,5
В и - 0,5 В) показаны пунктиром (с символом kin). В этих условиях диаграмма полностью
реальна.
При расчете Eh-pH диаграмм для температур, отличающихся от стандартной, сначала
рассчитывается
ΔG
R
T
= ΔG
R
298
- [ΔS
R
298
(T-298) + ΔaA
g
+ ΔbB
g
- ΔcC
g
]
Затем определяется Eh
o
T
= ΔG
R
T
/ Δm
e
F и далее рассмотренным выше путем определяют
зависимость фазовых равновесий (меняя или оставляя формы и активности компонентов):
В тех случаях, когда необходимо рассчитать Еh-pH диаграммы для давлений, отличных от
1 бар, новый стандартный окислительный потенциал равен Eh
o
298
, плюс его приращения
по температуре и давлению:
В этом уравнении член ΔG
R
Δp
включает приращение свободной энергии по давлению для
всех фаз, принимающих участие в реакции. Для реакций рассмотренного выше типа
нередко удобнее представить этот член только как ΔG
s
Δp
(для твердых фаз), а
соответствующие члены для воды, сероводорода, углекислоты и др. выразить через
активности этих компонентов, как это и было сделано выше. Во многих случаях это
просто необходимо.
Из вышеизложенного следует, что диаграммы Еh-pH приобретают существенную
геохимическую значимость при учете конкретных форм протекания реакций, при
реальных значениях активностей компонентов в растворах, при учете зависимости
растворимости этих компонентов от pH и т.д. Формальный и упрощенный расчет по
какой-либо одной схеме ограничивает их возможности вследствие налагаемой исходным
уравнением однозначной обратной зависимости между Eh и pH.
Еh-pH диаграммы очень широко используются в геохимии, особенно для
низкотемпературных процессов. Подробное обсуждение их можно найти в книге
Р.Гаррелса и Ч.Крайста (1968).
О расчетах других типов диаграмм
Мы рассмотрели примеры расчетов наиболее употребительных и типовых диаграмм. Эти
диаграммы широко используются в минералогии, петрологии и геохимии. Конкретные
задачи исследования могут вызвать необходимость построения диаграмм и в других
координатах, нежели рассмотренные выше, например: T-lgp
i
, p-Eh или T-lga
j
-pH
диаграмм, или других возможных разновидностей по набору k
m
+2 интенсивных
параметров. Однако принципы расчета и стандартизации возможных исходных условий
этих диаграмм подобны разобранным примерам. Различия заключаются в использовании
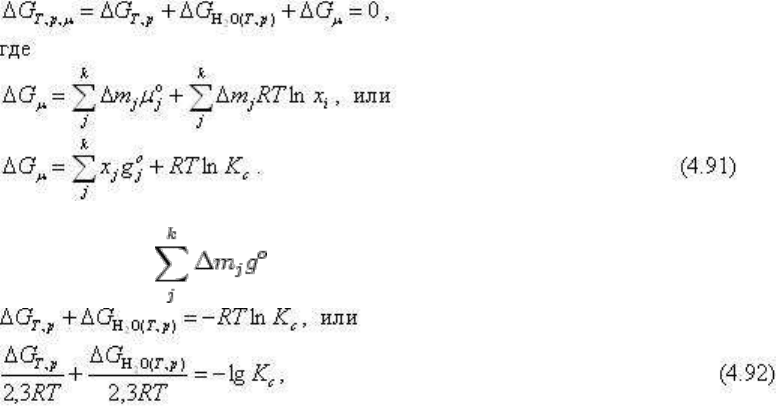
и раскрытии тех или других членов общего уравнения свободной энергии реакций.
Нередко это требует дополнительных, не всегда простых вычислений.
Наиболее сложными являются построения диаграмм гетерогенных равновесий с участием
вполне подвижных компонентов, представленных ионизированными частицами. По мере
усложнения возникают различные типы задач.
Простейшая задача отвечает условиям сильно разбавленных растворов, когда вполне
подвижные ионы ведут себя как идеальные компоненты.
Или, включая в член ΔG
T,p
, поскольку g
о
зависит только от Т и р, получим:
где К
с
- константа равновесия, выраженная алгебраическим произведение концентраций
вполне подвижных компонентов. В соответствии с К
с
записывается и ΔG
R
.
Рассмотрим в качестве примера моновариантное равновесие калиевого полевого шпата с
мусковитом:
1.5KAlSi
3
O
8
+ H
+
=
0.5KAl
3
Si
3
O
10
(OH)
2
+
3SiO
2
+ K
+
(4.93)
Kfs
Mu
Q
