Жариков В.А. Основы физической геохимии
Подождите немного. Документ загружается.

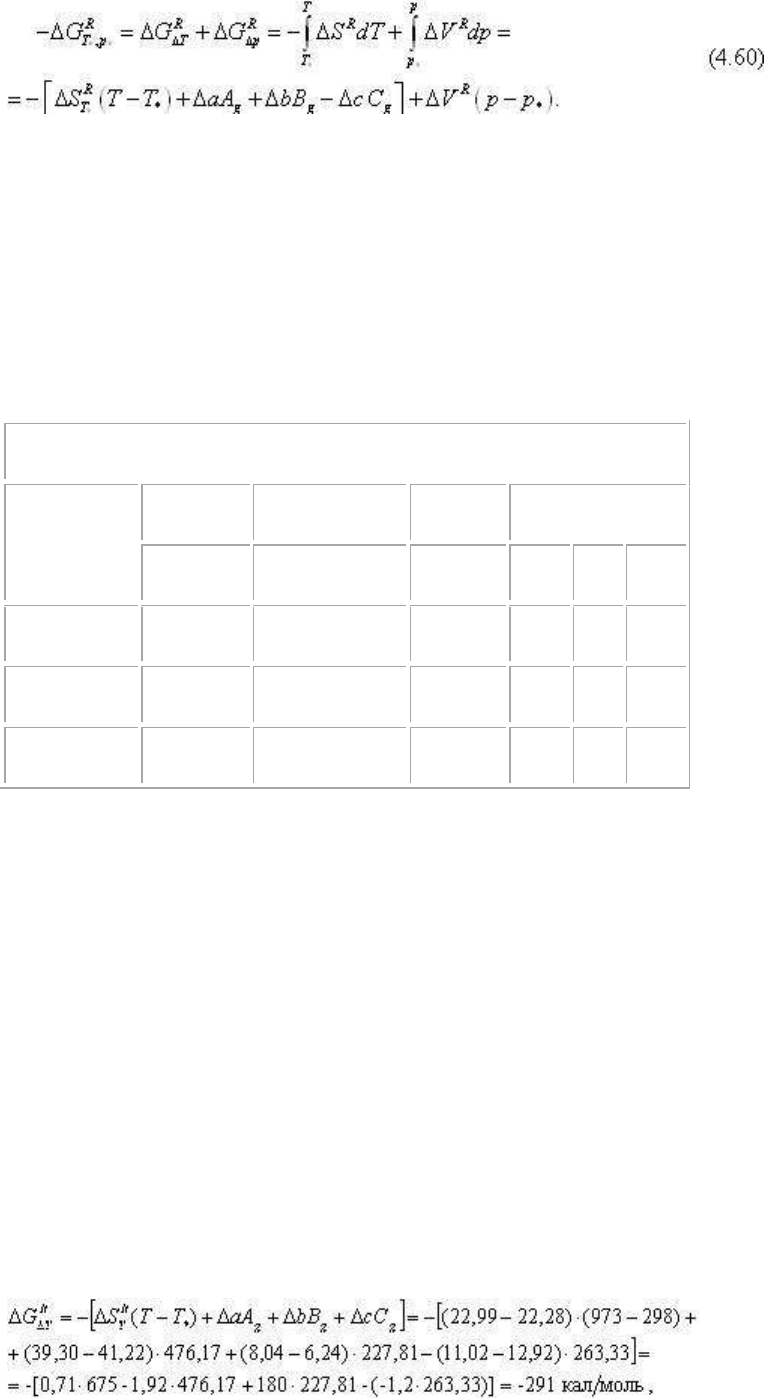
поскольку ΔG
R
T,p
= 0, то рассчитываем:
Последовательность расчета:
1) находится или принимается ΔG
R
T,p
; 2) вычисляется ΔG
R
ΔT
; 3) в соответствии с -ΔG
R
T,p
-
ΔG
R
ΔT
=ΔG
R
Δp
определяется значение р, равновесное данному Т. В качестве примера
рассмотрим расчет моновариантного равновесия андалузит-силлиманит по стандартным
данным и расчет всех трех моновариантных линий андалузит- силлиманит, андалузит-
кианит и кианит-силлиманит, исходя из экспериментально определенной нонвариантной
точки Т=622
о
С = 895К, р=5600 кг/см
2
=5675 бар. Термодинамические константы
минералов приведены в табл. 4.3.
Таблица 4.3. Термодинамические константы минералов.
Минерал
ΔG
298
S
298,
V,
C
p
= a + bT - cT
-2
ккал/моль
кал/моль*град
см
3
/моль
a
b10
3
c10
-5
Кианит
-585,91
22,03
44,11
41,05
6,98
12,46
Андалузит
-584,70
22,28
51,54
41,22
6,24
12,22
Силлиманит
-583,75
22,99
49,91
39,30
8,04
11,02
Здесь и в дальнейшем использованы наиболее доступные читателю справочники Г.Б.
Наумова, Б. Н. Рыженко и И. Л. Ходаковского (1971), А.Г. Булаха и К.Г. Булаха (1979). В
некоторых случаях также использовались уже упоминавшийся справочник И.К. Карпова и
др. (1978) и известный справочник Р. Роби, Б. Хеменгуса и Док. Фишера (1979).
А. Расчет равновесия андалузит=силлиманит от стандартных условий:
-ΔG
R
T298,p=1бар
-ΔG
R
ΔT
=ΔG
R
Δp
, где ΔG
R
= ΔG
Sil
-ΔG
Andl
1. Определяем значение:
-ΔG
R
T298,p=1бар
= -(-583,75+584,70)=-950кал/моль.
2. Вычисляем ΔG
R
ΔT
для температуры 700
о
С=973К (во всех термодинамических формулах
абсолютная шкала температур):

где A
g
, B
g
и C
g
- табулированные значения соответствующих интегралов (см. уравнения
(4.20) и (4.21)) для интервала температуры 973-298; Δa, Δb, Δc- разность в уравнении
реакции коэффициентов уравнения теплоемкости фаз.
3. Находим равновесное значение р:
где η = 41.84 см
3
бар/кал - множитель размерности для перевода калорий в бары. Обратный
множитель 1/η = 0.0239 кал/см
3
бар.
В тех случаях, когда расчеты производятся в технических единицах, множитель
размерности η = 41.293 см
3
атм/кал и обратный 1/η = 0.0242 кал/см
3
атм. Соответственно
вычисленное р =16694 атм. Аналогичным путем найдены и другие координаты
моновариантной линии Andl-Sil, они показаны в табл. 4.4.
Таблица 4.4 Координаты моновариантных линий
Рассчитаны от Т=298oК,
р= 1 бар
Рассчитаны из экспериментальной нонвариантной точки
Т=895oК, р= 5675 бар
Andl=Sil
Andl=Sil
Andl=Ky
Ky=Sil
T, K
(T,oC)
p,бар
T, K
(T,oC)
p,бар
T, K
(T,oC)
p,бар
T, K
(T,oC)
p,бар
673
(400)
19 221
-
-
673
(400)
5465
-
-
773
(500)
18 358
-
-
773
(500)
5575
-
-
873
(600)
17 607
895
(622)
5675
895
(622)
5675
895
(622)
5675
5876
16 916
973
(700)
5108
-
-
973
(700)
-
6096
16 225
1073
(800)
4472
-
-
1073
(800)
1173
(900)
15 516
1173
(900)
3796
-
-
1173
(900)
6284
Б. Расчет равновесий из экспериментально определенной нонвариантной точки
T
*
=622
o
С=895К и p
*
=5600 атм=5675 бар.
1. Определяем значение ΔG
R
T*
для моновариантной реакции андалузит-силлиманит в
нонвариантной точке.
Из ΔG
R
T*,p*
= ΔG
R
T*
+ ΔG
R
p*
= 0 следует:
2. Рассчитываем значение ΔS
R
для нонвариантной температуры (895К) от стандартной
ΔG
R
298
по уравнению (4.19):
3. Рассчитываем координаты любой точки моновариантной линии от исходной
нонвариантной точки, основываясь на ΔG
R
895
и ΔS
R
895
. Например, для T=700
o
С=973К:
ΔG
R
973
= ΔG
R
895
- [ΔS
R
895
(973-985) + ΔaA
g
+ ΔbB
g
+ ΔcC
g
] = 221-[0,28 (973 - 895) + (-
1,92)
.
3,104 +1,80
.
3,042- (-1,20)
.
0,39] = 199,17 кал/моль ~= 199 кал/моль (округляя до целых
величин).
Тогда равновесное давление определится как
Для температуры 800
o
С=1073К получим
ΔG
R
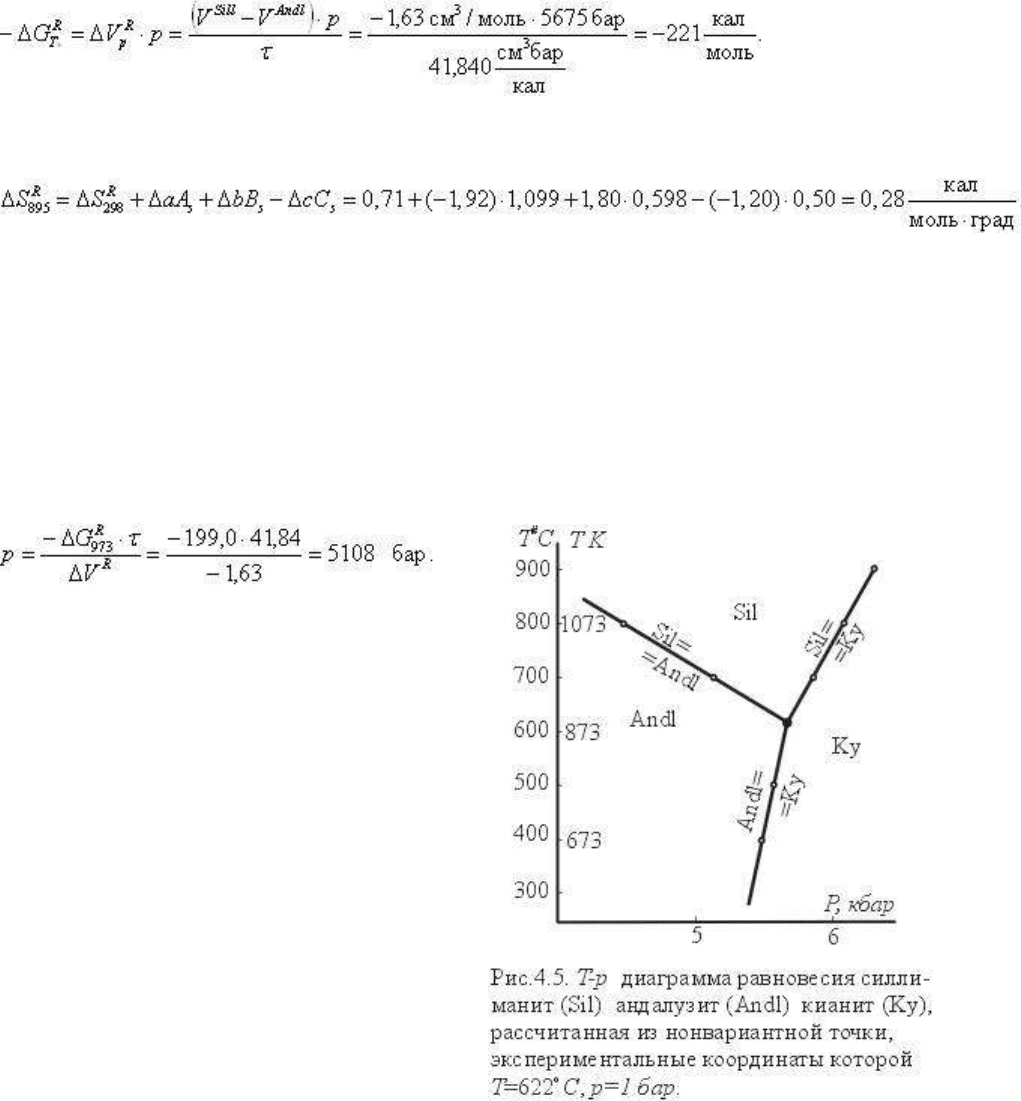
1073
= 173.0 кал/моль и p = 4472 бар и т. д.
Аналогичным путем рассчитываются из
нонвариантной точки и другие
моновариантные линии кианит- силлиманит,
кианит-андалузит (координаты их см. в табл.
4.4 и на рис. 4.5). Для того чтобы избежать
вычисления нетабулированных значений A
g
,
B
g
и C
g
(в приведенном расчете они вычислены
для ΔT=973-895К), можно воспользоваться
следующим приемом.
При Т:
ΔG
R
T
= ΔG
R
298
- [ΔS
R
298
(T-298) + ΔaA
g
T
+ ΔbB
g
T
+ ΔcC
g
T
]
при T
*
:
ΔG
R
T*
= ΔG
R
298
- [ΔS
R
298
(T
*
-298) + ΔaA
g
T
*
+ ΔbB
g
T
*
+ ΔcC
g
T
*
]
ΔG
R
T
= ΔG
R
T*
- [ΔS
R
298
(T-T
*
) + Δa(A
g
T
- A
g
T
*
) +
Δb(B
g
T
- B
g
T
*
) + Δc(C
g
T
- C
g
T
*
)]
(4.61)
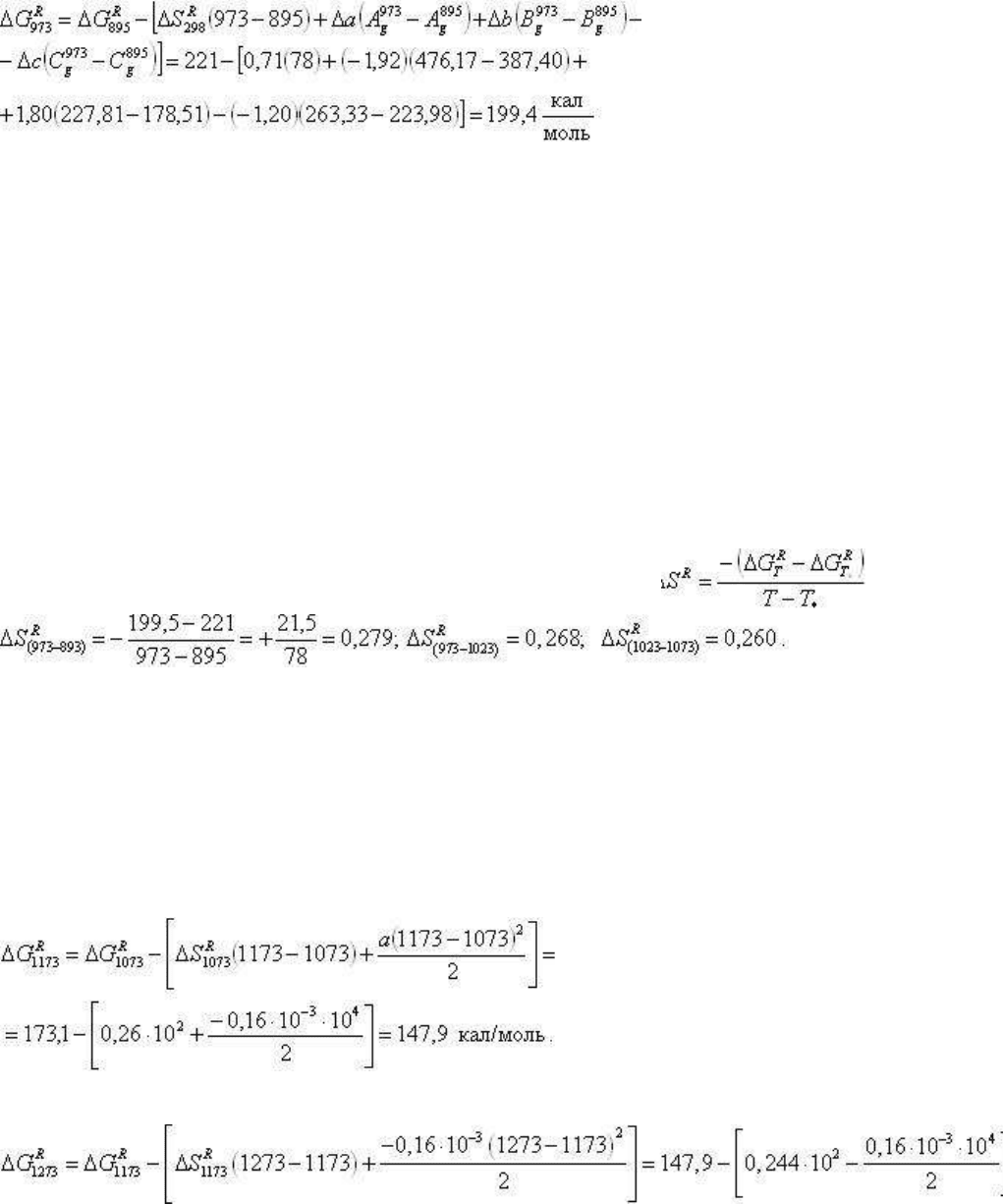
где коэффициенты A
g
T
, A
g
T
*
, B
g
T
, B
g
T
*
, C
g
T
, C
g
T
*
- табулированные значения для
интервалов Т - 298 и Т
*
- 298. Например, та же реакция Andl-Sil для Т=973К рассчитается
как
и далее обычным путем следует определение равновесного давления.
Обратим внимание на невысокую точность в расчете твердофазовых реакций даже на
экспериментальной основе. Например, ошибка в ΔG
R
на 1 кал (199 или 200 кал/моль) при
Т=973К дает расхождение в определении равновесного давления в 25 бар.
В. Наконец, покажем схему расчета моновариантных реакций с приблизительным
определением энтропии реакции по экспериментальным кривым. Пусть, например,
моновариантная реакция андалузит=силлиманит экспериментально изучена от
нонвариантной точки до 800
o
С. Требуется рассчитать ее до 1000
o
С.
1. Для температур 622
o
С (895К), 700
o
С (973К), 750
o
С (1023К) и 800
o
С (1073К) определяем
значения ΔG
R
T
; -ΔG
R
T
= ΔVp / η; они соответственно равны (вычисляя уже с точностью до
десятых) ΔG
R
895
= 221.0; ΔG
R
973
= 199.2; ΔG
R
1023
= 186.1; ΔG
R
1073
= 173.1.
2. Известно, что с приближением тогда
Эти значения хорошо укладываются в линейную зависимость вида
ΔS
R
T
= ΔG
R
T*
+ aΔT = 0.276+(-0.16
.
10
-3
)ΔT,
которая может быть использована для расчета моновариантной линии до 1000
o
C.
3. Рассчитываем ΔG
R
1173
и ΔG
R
1273
по упрощенной формуле:
Соответственно:
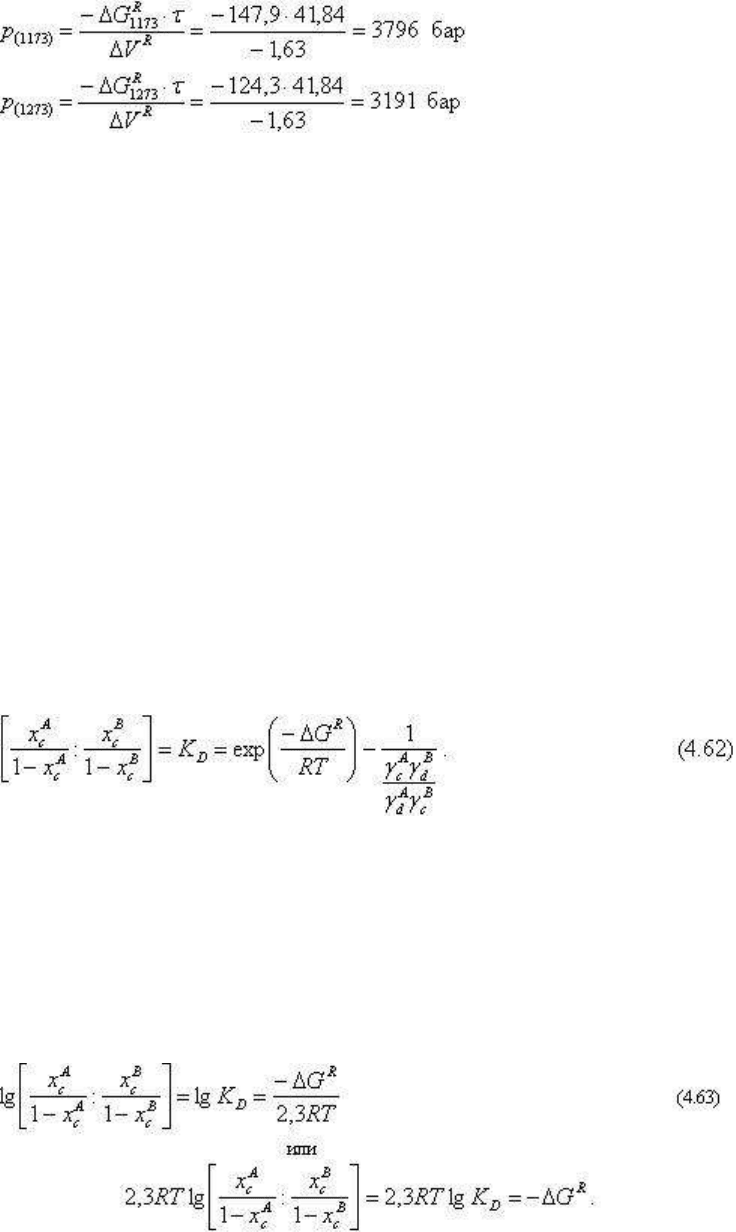
4. Определяем равновесные давления:
Если энтропия одной из фаз известна, то по соотношению ΔS
R
= ΔG
R
T*
+ aT легко
получить S и S=f(T) для другой фазы.
На рис. 4.5 показаны нонвариантная точка и три рассчитанные из нее кривые равновесия.
Моновариантная линия Andl-Sil, рассчитанная от стандартных данных, расположится при
существенно больших давлениях (см. табл. 4.4) и на диаграмме не нанесена. Это
показывает, что расчет твердофазовых реакций от стандартных условий практически
нецелесообразен, так как приводит обычно к нереальным координатам Т и р. Заметим, что
в связи с малыми ΔH и ΔS твердофазовых реакций незначительные, граничащие с
точностью определения, изменения ΔH, ΔG, S, V, a, b и с минералов вызывают
существенное изменение в положении кривых, считаемых даже из экспериментальных
точек. В этом смысле данные, представленные в табл. 4.3, и положения линий на рис. 4.5
мало удовлетворительны с петрологических позиций и для этих целей лучше
использовать несколько иные константы (см. Жариков и др., 1972). Рассмотренные
расчеты имеют учебное назначение и для них были использованы цифры, приведенные в
наиболее распространенном справочнике (Наумов и др., 1970).
Обменные реакции фазового соответствия
Как было показано выше:
И если твердые растворы близки к идеальным, то уравнение (4.62) решается сравнительно
просто. Если же обменная реакция происходит между неидеальными растворами, то
термодинамическое уравнение реакции нередко оказывается столь сложным, что поневоле
приходится ограничиваться графическими приближениями или эмпирическими
зависимостями. Решение таких задач представляет собой серьезное исследование и мы
отсылаем интересующихся к специальной литературе.
Для идеальных растворов уравнение (4.62) лучше выразить в логарифмической форме:
Из уравнения смещенного равновесия, как было показано выше, следуют соотношения
выражающие зависимость К
D
от температуры и давления. Из этих уравнений можно
рассчитать численные значения констант распределения для интересующих нас
температур и давлений.
Несмотря на очевидную несложность расчета обменных реакций главным препятствием
служит отсутствие надежных экспериментальных данных по термодинамическим
свойствам конечных членов - миналов твердых растворов, и, особенно, степени
отклонения твердых растворов от идеальности.
В качестве примера рассмотрим расчет обменного равновесия оливин-ортопироксен в
зависимости от Т и р. Примем, для простоты, в качестве исходной обменную реакцию
первого порядка.
MgSi
0.5
O
2
+
FeSiO
3
=
FeSi
0.5
O
2
+
MgSiO
3
Fo
Fa
Fe
En
Растворы Орх и Ol примем идеальными, исходные данные Р.Роби, В.Хемингуэя и
Дж.Брюса (1979), Акимото и др. (1970) и в ряде случаев линейную экстраполяцию G=f(T).
Для идеального
раствора
Составим табличку (табл.4.5) термодинамических параметров ΔG фаз в зависимости от
температуры и рассчитаем K
D
Ol/Opx
в соответствии с приведенными формулами.
Таблица 4.5 Термодинамические параметры обменного равновесия оливин-ортопироксен
T, K
(T,
o
C)
-ΔG
T
,
кал
-ΔG
R
,
lg K
D
K
D
FeSi
0.5
O
2
Fa
MgSi
0.5
O
2
Fo
FeSiO
3
Fs
MgSiO
3
En
900
141 240
216 379
231 280
307 715
1296
0,32
2,09
(627)
1000
(727)
137 408
211 520
224 598
300 035
1325
0,29
1,95
1100
(827)
133 552
206 626
218 532
292 967
1361
0,27
1,86
1200
(927)
129 696
201 747
212 480
285 920
1389
0,25
1,78
1300
(1027)
125 860
196 890
206 449
278 900
1421
0,24
1,74
1400
(1127)
122 051
191 188
200 418
271 043
1488
0,23
1,70
V, см
3
/моль
23,19(0,5)
21,86(0,5)
33,10
31,47
V, кал/бар
0,554
0,522
0,791
0,752
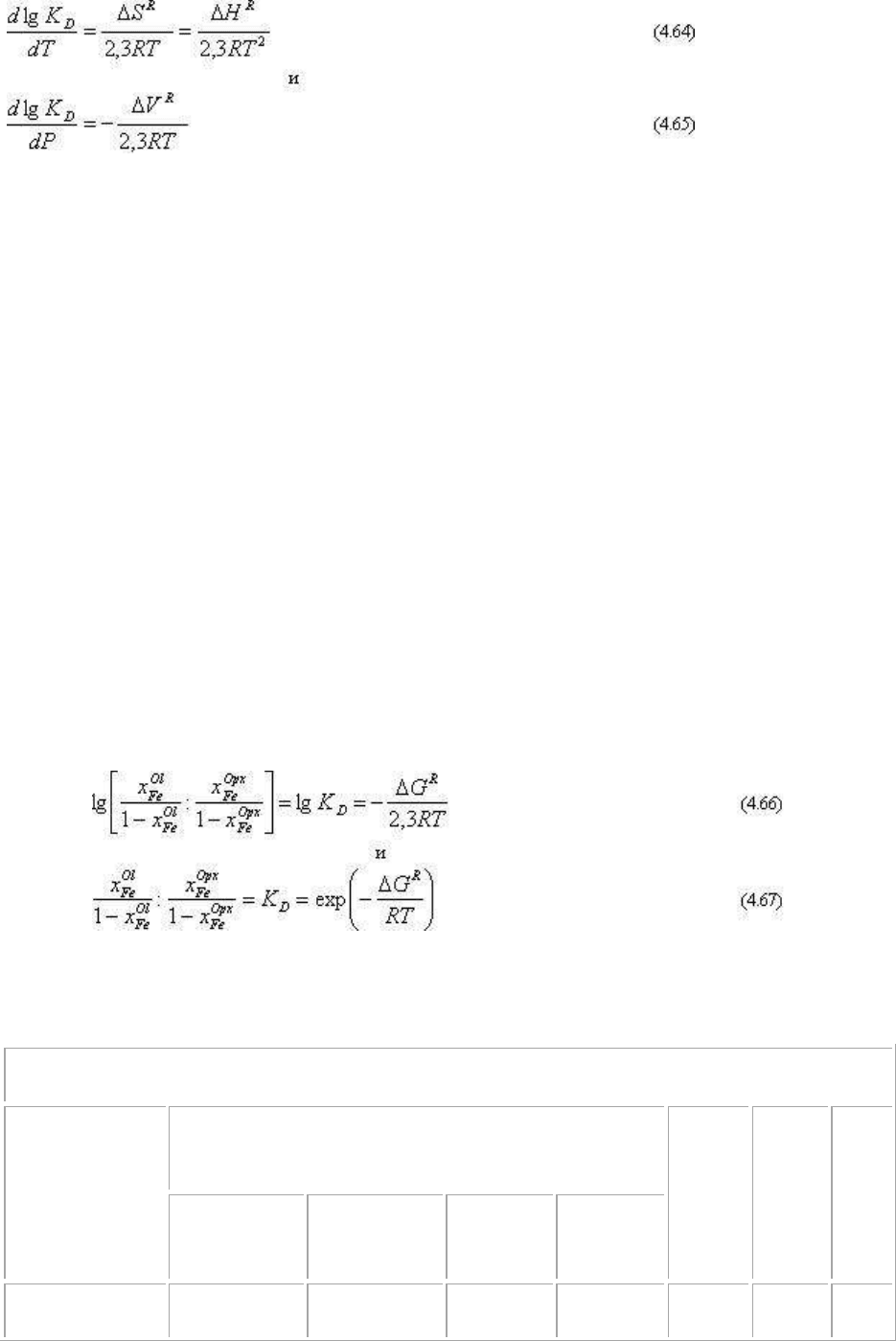
Как можно видеть, для обменной
реакции оливин - ортопироксен в
диапазоне 900-1400К устанавливается
однозначное распределение
железистости: оливин всегда более
железистый, чем сосуществующий
ортопироксен, и с увеличением
температуры константа распределения и
соответственно разность в железистости
оливина и пироксена уменьшаются. Для
иллюстрации расчета на рис.4.6
приведена диаграмма .
Объемный эффект обменной реакции незначителен ΔV=23,19+31,47-21,86-33,10=-0,3
см
3
/моль или -0,0072 кал/бар
.
моль, поэтому давление оказывает слабое влияние на
железистость сосуществующих фаз (сдвигая равновесие в сторону повышения
железистости оливина). Оценить это влияние можно интегрируя уравнение (4.65).
Например для Т=1000К и в пределах давлений от 1 бара до 5000 бар

Сравнивая с K
D
1бар, 1000K
= 1.9498 (неокругленное значение, в табл.4.4 K
D
1бар, 1000K
= 1.95),
можно видеть, что повышение К
D
до давления 5000 бар (по сравнению с давлением в 1
бар) составляет всего 0,035, т.е. величину, которой можно пренебречь. Влияние давления
оказывается более существенным для давлений 30-40 кбар, но в этом случае нужно
учитывать зависимость V от р и Т.
Т-р диаграммы реакций гидратации (дегидратации)
К реакциям гидратации (дегидратации) относятся реакции вида А+Н
2
О=В;
А+В+Н
2
О=С+D и т.д. Расчетная формула:
А. Последовательность расчета от стандартных условий: 1) определяются ΔG
R
298
и ΔS
R
298
;
2) рассчитывается ΔG
R
ΔT
(по формулам 4.20, 4.21); 3) по соотношению -ΔG
R
T
= -
(ΔG
R
298
+ΔG
R
ΔT
) = ΔG
p
H
2
O
приблизительно находим диапазон p
H2O
; 4) по соотношению -
ΔG
R
T
-ΔV
S
p = ΔG
p
H
2
O
точно определяется величина p
H2O
, равновесная данной Т.
В качестве примера рассмотрим реакцию дегидратации мусковита: мусковит (Mu) =
калиевый полевой шпат (Kfs) + корунд (Cor) + H
2
O. Термодинамические данные
приведены в табл.4.6.
Таблица 4.6. Термодинамические данные к расчету реакции дегидратации мусковита
Фаза
-ΔG
298
S
298
,
V,
C
p
= a + bT - cT
-2
ккал/моль
кал/моль
.
град
см
3
/моль
(кал/бар)
a
b
.
10
3
c
.
10
-5
Корунд
378,200
12,17
25,57
(0,6113)
27,43
3,06
8,47
Калиевый полевой шпат
892,830
52,50
108,69
(2,5977)
63,83
12,90
17,05
Мусковит
1330,400
69,00
140,55
(3,3591)
97,56
26,38
25,44
Вода
54,634
45,104
---
7,30
2,46
---

Таблица 4.7. Значения (G
T,P
-G
P=1
) воды, кал/моль (по PVT данным Бернема, 1969)
p,
бар
T
o
C
(T K)
200
250
300
350
400
450
500
550
600
650
700
750
800
850
900
950
100
0
(47
3)
(52
3)
(57
3)
(62
3)
(67
3)
(72
3)
(77
3)
(82
3)
(87
3)
(92
3)
(97
3)
(102
3)
(107
3)
(112
3)
(117
3)
(122
3)
(127
3)
100
253
9
369
7
479
8
546
2
597
1
646
6
695
1
742
7
789
9
837
5
884
2
930
6
977
3
200
258
9
375
1
486
0
590
4
667
8
729
7
788
5
845
9
901
7
957
5
101
25
106
66
112
14
500
273
5
390
7
503
0
610
1
711
4
803
7
887
4
963
1
103
47
110
48
117
27
123
89
130
49
137
08
143
12
148
71
155
26
100
0
297
0
415
7
529
6
639
5
744
9
845
1
941
2
103
18
111
83
120
20
128
24
136
03
143
71
151
21
158
61
165
90
173
11
200
0
342
6
463
4
580
0
693
1
802
3
907
9
101
06
110
95
120
58
130
03
139
20
148
12
156
93
165
53
173
98
182
25
190
42

250
0
364
5
486
5
604
1
718
3
829
2
936
3
104
08
114
17
124
01
133
71
143
18
152
45
161
62
170
55
179
31
187
91
196
39
300
0
386
3
509
1
627
5
742
9
854
9
963
3
106
94
117
20
127
23
137
15
146
83
156
33
165
75
174
93
183
95
192
79
201
53
350
0
407
7
531
1
650
5
766
9
879
8
989
5
109
68
120
09
130
27
140
34
150
21
159
91
169
51
178
91
188
13
197
99
206
08
400
0
428
7
552
8
673
0
790
1
904
1
101
49
112
33
122
85
133
17
143
39
155
40
163
24
173
02
182
58
191
97
201
17
210
22
450
0
449
6
574
3
695
2
813
1
927
9
103
95
114
90
125
53
135
96
146
30
156
44
166
42
176
33
186
04
195
58
204
91
214
06
500
0
470
1
595
5
716
9
835
6
951
2
106
37
117
41
128
14
138
67
149
11
159
37
169
47
179
50
189
33
198
99
208
43
217
68
550
0
490
5
616
4
738
4
857
8
974
1
108
73
119
86
130
67
141
30
151
84
162
20
172
40
182
55
192
49
202
26
211
80
221
12
600
0
510
6
637
0
759
7
879
7
996
7
111
06
122
26
133
17
143
87
154
50
164
93
175
25
185
49
195
54
205
41
215
04
224
44
650
0
530
6
657
5
780
7
901
2
101
89
113
35
124
62
135
60
146
38
157
10
167
63
178
02
188
35
198
49
208
45
218
18
227
66
700
0
550
3
677
8
801
5
922
5
104
08
115
61
126
95
137
99
148
85
159
64
170
25
180
72
191
14
201
36
211
41
221
21
230
79
750
0
569
9
697
8
822
1
943
6
106
25
117
84
129
24
140
34
151
27
162
13
172
82
183
36
193
85
204
16
214
29
224
19
233
84
800
0
589
4
717
7
842
4
954
5
108
38
120
03
131
49
142
66
153
65
164
58
175
33
185
94
196
51
206
89
217
09
227
07
236
82
850
0
608
7
737
5
862
6
985
3
110
50
122
21
133
72
144
95
156
00
166
99
177
80
188
47
199
11
209
55
219
83
229
89
239
74
900
0
627
8
757
1
882
7
100
57
112
60
124
35
135
92
147
20
158
31
169
35
180
22
190
96
201
65
212
16
222
51
232
64
242
59
950
0
646
8
776
5
902
5
102
61
114
68
126
47
138
09
149
43
160
58
171
67
182
61
193
40
204
15
214
71
225
13
235
34
245
38
100
665
795
922
104
116
128
140
151
162
173
184
195
206
217
227
237
248
