Шендрик А.Н. Химия белка. Структура, свойства, методы исследования
Подождите немного. Документ загружается.

232
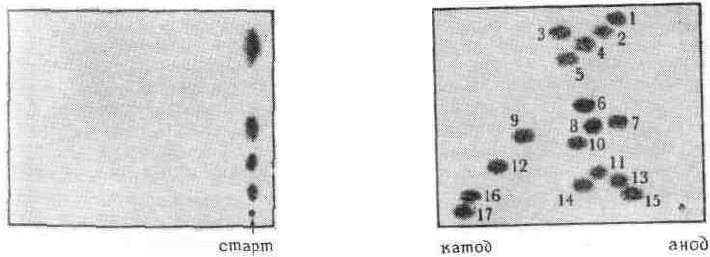
Анализируемый образец наносят у края или по центру листа. После подачи на-
пряжения компоненты смеси движутся в направлении соответствующих элек-
тродов.
Низковольтный электрофорез малоэффективен для небольших молекул
(например, аминокислот и нуклеотидов), поскольку из-за малого заряда они об-
ладают низкой подвижностью. Они медленно разделяются и для них имеет ме-
сто значительное размывание зон за счет диффузии. При высоковольтном элек-
трофорезе скорость разделения увеличивается за счет значительного градиента
потенциала (200 В/см) Высокое напряжение обусловливает большую силу тока,
бумага нагревается, поэтому здесь необходимо охлаждение. Для охлаждения
бумагу погружают в большой объем несмешивающейся и не проводящей ток
жидкости или прижимают ее к охлаждающей поверхности. После окончания
электрофореза бумагу высушивают, и вещества определяют так же, как и при
низковольтном электрофорезе.
Высоковольтный электрофорез на бумаге имеет большую ценность для
разделения аминокислот и пептидов. Поскольку полное разделение смесей не
всегда возможно при использовании одного высоковольтного электрофореза,
его часто используют в сочетании с хроматографией. Этот метод известен под
названием двухмерного разделения. Образец вначале подвергают электрофоре-
зу, а затем хроматографируют под прямым углом или наоборот (см. рис. 4.5).
АБ
Рис. 4.5
Сочетание электрофореза с хроматографией для разделения сложных смесей.
А - только хроматография; Б - хроматография с последующим ЭФ
233
Помимо бумаги, в качестве твердой пористой основы для проведения
электрофореза можно использовать крахмал, ацетат целлюлозы, агарозу, поли-
акриламидный гель (ПААГ).
4.5.3.3 Электрофорез на полосках ацетата целлюлозы
Многие биологические макромолекулы адсорбируются на целлюлозе, на-
ходящейся в бумаге за счет гидроксильных групп целлюлозы. Адсорбция пре-
пятствует движению несущих на себе заряд макромолекул в направлении сило-
вых линий электрического поля и поэтому вызывает вытягивание пятен или по-
лос, что ухудшает разделение. Этого можно избежать, если вместо бумаги ис-
пользовать мембрану из ацетата целлюлозы, так как в ней большинство гидро-
ксильных групп замещены ацетатными, которые не проявляют столь выражен-
ных адсорбирующих свойств. Помимо того что разделение при этом улучшает-
ся, оно также ускоряется, и возможно использовать более низкое напряжение.
При меньших размерах пятен вещество в них находится в большей концентра-
ции, поэтому его легче анализировать. Низкая адсорбция ацетатом целлюлозы
приводит к меньшему фону при окрашивании, что увеличивает чувствитель-
ность метода.
По простоте обращения и степени разделения ацетат целлюлозы не имеет
себе равных. Однако при необходимости получить особо высокое разделение,
предпочтение следует отдавать методу гель-электрофореза. Полоски ацетата
целлюлозы широко применяют в клинических лабораториях для количествен-
ного анализа белков крови
.
4.5.3.4 Электрофорез в полиакриламидном геле
Электрофорез в полиакриламидном геле является чрезвычайно полезным
методом в биохимических исследованиях и применяется для разделения, очи-
стки, оценки чистоты и молекулярной массы белков.
234
Полиакриламидный гель получают сополимеризацией акриламида с N,N-
метилен-бис-акриламидом:
nC H
2
=C HCONH
2
CH
2
=C H CONH
CH
2
CONHCH
2
=C H
+ m
CH
2
CH CH
2
CH CH
2
CH CH
2
CH CH
2
CH CH
2
CH
CO
NH
CH
2
NH
CO
CH
CO
NH
CH
2
CONH
2
CONH
2
NH
CO
CH
2
CHCH
2
CH
2
CH CHCH
2
CONH
2
CH
CONH
2
CH
2
CH CH
2
CONH
2
CONH
2
Реакция полимеризации протекает по радикально-цепному механизму.
Степень сшивки регулируют количеством бис-акриламида. Чем больше его
концентрация, тем меньше размер пор.
Гель полиакриламидной матрицы в виде однородного тонкого слоя мож-
но сформировать между двумя пластмассовыми пластинками или же в стеклян-
ной трубочке. ПААГ характеризуется развитой пористостью, и частицы, двига-
ясь через тонкий слой в электрическом поле распределяются в соответствии с
отношением Q/r (см. выше).
Электрофорез в ПААГ относится к простым и удобным в подготовке, вы-
сокочувствительным методам. При его проведении не происходит повреждений
нестойких белковых молекул, что часто присуще другим методам. Он позволя-
ет с хорошей эффективностью разделять на индивидуальные компоненты
сложные смеси.
4.5.3.5 Диск-электрофорез
Этот вид электрофореза является разновидностью гель-электрофореза. Он
выполняется в градиентах рН среды, концентрации геля и величины напряже
235
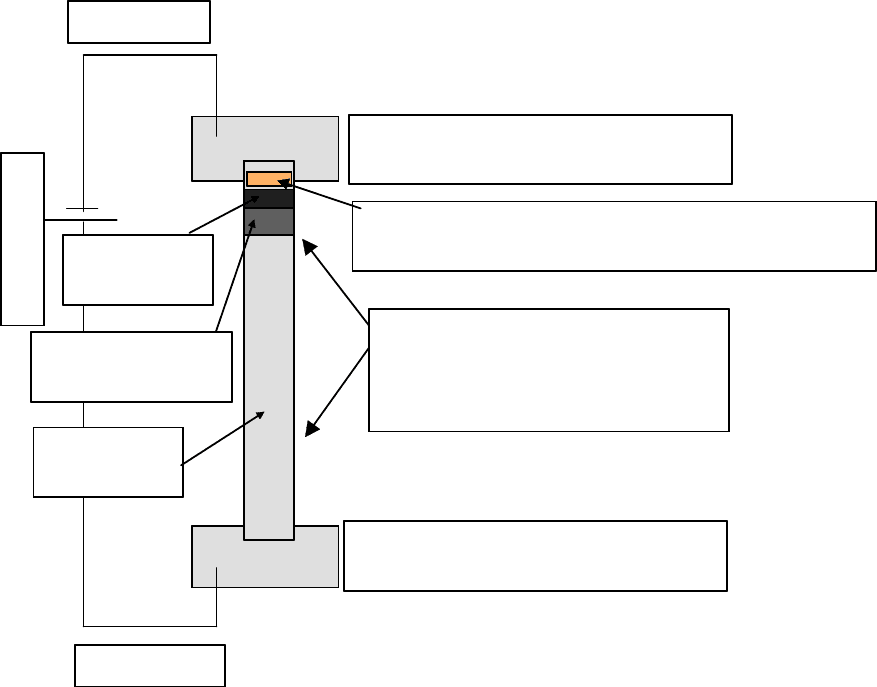
ния. Принципиальная схема диск-электрофореза и прибора для его проведения
приведены на рис. 4.6; 4.7).
Источник тока
Электрод (-)
Электрод (+)
Верхний резервуар
с токопроводящим буфером, рН = 8.3
Нижний резервуар
с токопроводящим буфером, рН = 8.3
Стеклянная трубка с ПААГ
предварительно полимеризованным
в присутствии токопроводящего
буфера
Анализируемая смесь в небольшом к-ве
растворителя наносится на верхнюю часть трубки
Стартовый
гель, рН = 6.7
Концентрирующий
гель, рН = 6.7
Разделяющий
гель, рН=8.9
Рис. 4.6
Принципиальная схема диск-электрофореза в стеклянной трубке
Гель находится в вертикальной колонке из стекла и разделен на три об-
ласти. Верхняя область -это область образца или стартовый гель, средняя - про-
кладка или концентрирующий гель, нижняя - разделяющий гель. Стартовый и
концентрирующий гели имеют больший размер пор, чем разделяющий и гото-
вятся в буферном растворе с низкой ионной силой и меньшим значением рН.
236
Меньшая ионная сила обеспечивает большее электриче-
ское сопротивление, поэтому градиент электрического
потенциала в верхней части колонки больше.
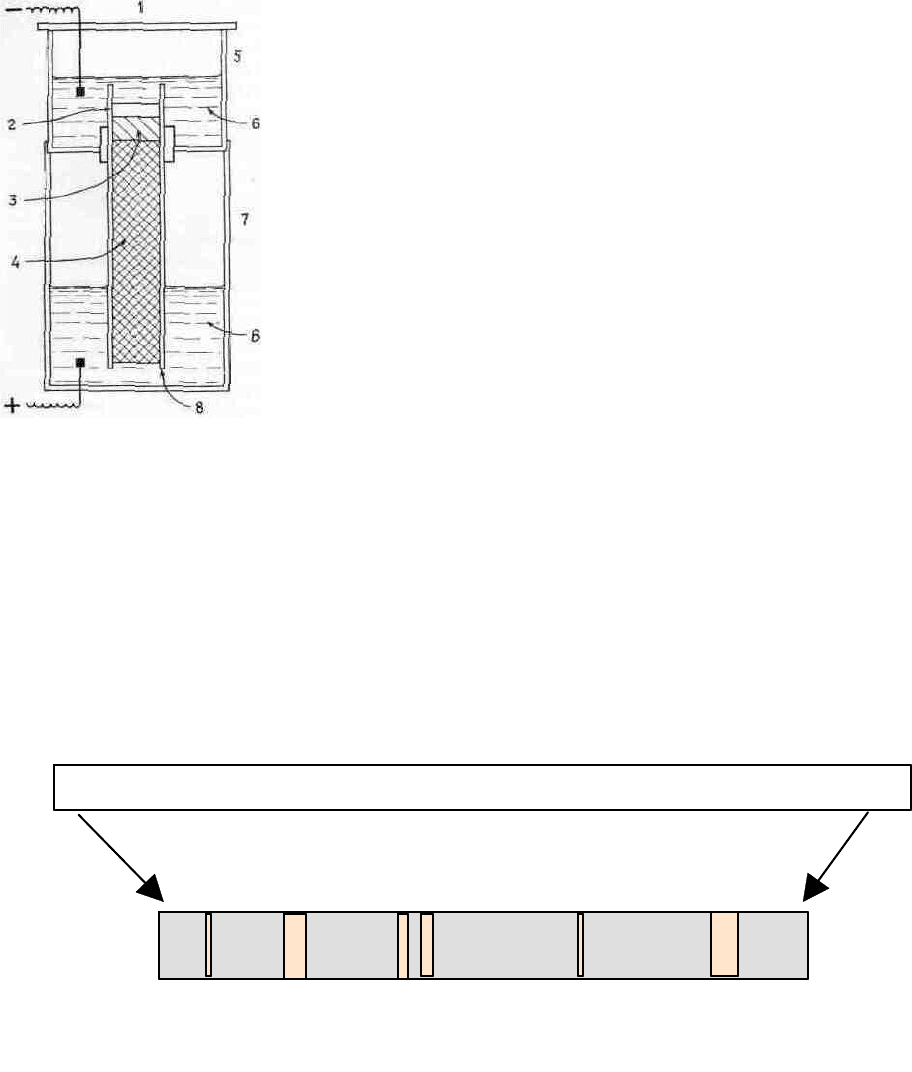
Рис 4.7
Принципиальная схема прибора для диск-электрофореза.
1 - крышка; 2 - анализируемый образец; 3 - стартовый гель (гель-
прокладка); разделяющий гель; 5 - верхний сосуд; 6 - буфер; 7 -
нижний сосуд; 8 - стеклянная трубка.
Большие
поры и градиент потенциала вверху колонки
позволяют быстро продвигаться образцу через ее верхние слои. В результате на
границе между прокладкой и разделяющим слоем происходит концентрирова-
ние образца. В нижнем геле из-за большей ионной силы, большей величины рН
и меньшего размера пор создается эффект молекулярного сита. Проходя через
него молекулы одного вида образуют более узкие и лучше разрешенные зоны,
чем при обычном гель-электрофорезе (см рисунок).
После электрофореза и прокрашивания геля проявляются зоны для отдельных
компонентов, различающихся подвижностью - Q/r (зоны 1-6)
1 2 3 4 5 6
Стеклянная трубочка с гелем после проведения электрофореза и прокрашивания
4.5.3.6 ДСН-электрофорез
Очень полезным вариантом методики электрофореза в ПААГ является
предварительная обработка образца белка (или смеси белков) додецилсульфа-
том натрия (CH
3
(CH
2
)
10
OSO
3
-
Na
+
) (ДСН) перед нанесением образца на гель.
Такой метод называют ДСН-электрофорезом в ПААГ. ДСН является поверхно
237
стно-активным ионным соединением, в котором гидрофобная часть (алкильный
радикал) заряжена отрицательно. Адсорбируясь на поверхности белка, ДСН
приводит к его денатурации. Адсорбция молекул ДСН на поверхности пептид-
ной цепи сообщает ей общий отрицательный заряд. При этом, количество ад-
сорбировавшегося на белке ДСН пропорционально размерам его пептидной це-
пи. Это приводит к тому, что разные по размеру пептидные цепи приобретают
практически одинаковую подвижность Q/r. При прохождении через ПААГ, ко-
торый выполняет в этом случае роль молекулярного сита, денатурированные и
покрытые слоем ДСН молекулы белка меньшего размера "просеиваются" в по-
ры геля (молекулярного сита) движутся медленнее, а более крупные быстрее.
Путем сравнения с электрофоретической подвижностью обработанных ДСН
эталонных белков (с известной ММ) методом ДСН-электрофореза в ПААГ
можно определить ММ неизвестного белка так же как методом гель-
фильтрации.
4.5.3.7 Метод изоэлектрофокусировки
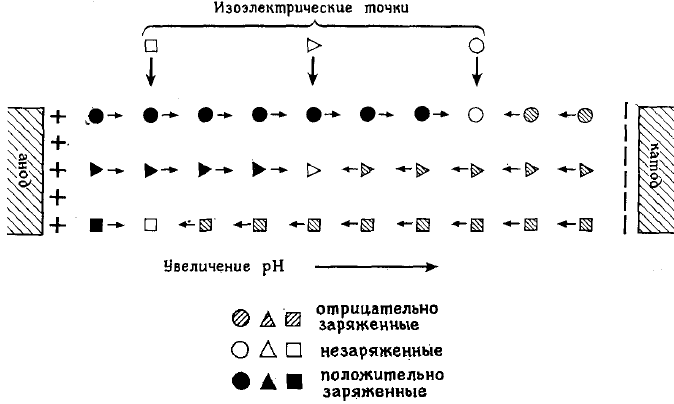
Для выделения белков и анализа их смесей разработан весьма эффектив-
ный метод электрофореза, названный изоэлектрофокусировкой (ИЭФ). Он ос-
нован на различиях в изоэлектрических точках белков. Напомним, что в изо-
электрической точке молекула белка имеет суммарный нулевой заряд. Метод
ИЭФ позволяет различать белки, для которых величины рI отличаются всего на
0.01-0.0025 единиц рН. В качестве геля в ИФ используют ПААГ или агарозные
гели.
Вначале гель погружают в раствор со смесью низкомолекулярных солей
и амфолитов. В качестве соли используют, например, сульфат натрия. При про-
пускании через гель тока (в приложенном извне электрическом поле) у катода
накапливается щелочь (гидроксид натрия), а у анода кислота (серная). Амфолит
- это амфотерное вещество. У катода, оно в щелочной среде приобретает отри-
цательный заряд и движется к аноду. У анода, в кислой среде, амфолит заряжен

238
положительно и начинает двигаться к катоду. Через некоторое время амфолит
переместится от электродов и окажется в той части колонки, где величина рН
равна его изоэлектрическому значению. Если в систему ввести несколько ам-
фолитов с разными величинами ИЭТ, то они распределятся по колонке, форми-
руя в ней градиент рН. Этот градиент рН поддерживается в течении всего вре-
мени проведения эксперимента. В качестве амфолитов используются вещества,
содержащие в своих молекулах одновременно кислотные и основные группы.
Основными являются чаще всего аминогруппы (первичные, вторичные, тре-
тичные), гуанидиновые группы. Кислотными - карбоксильная, сульфо- и фос-
фогруппы. Обобщенная формула амфолита:
NH
2
CNH
NH
(CH
2
)a N
(CH
2
)e
(CH
2
)b N
COOH
(CH
2
)c
(CH
2
)f
N
SO
3
H
(CH
2
)d
(CH
2
)g
PO
3
H
2
NH(CH
2
)hNH
2
Молекулярная масса амфолита должна быть небольшой. Обычно она изменяет-
ся от 300-600 до 1000. Это позволяет легко отделять их от макромолекул по
окончанию эксперимента. В настоящее время различные амфолиты произво-
дятся серийно. Торговые названия - «амфолины», «сервалиты» и др. Они раз-
личаются по интервалам градиента рН, например 3-5, 7-10, 3.5-10, 4-4.5 и т.д.
Максимальный интервал рН 2-11.
После подготовки колонки и создания в ней градиента рН на гель наносят
образец смеси белков и проводят электрофорез. При прохождении через зоны с
различными величинами рН белки «титруются» и изменяют свой суммарный
заряд. Миграция и титрование продолжаются до тех пор пока каждый компо-
нент не достигнет такого значения рН, при котором белок оттитрован до изо-
электрического состояния. В этой зоне белок утрачивает электрофоретическую
подвижность (Q=0) и больше не перемещается вдоль трубки с гелем. Результа
239
том есть то, что первоначальная белковая смесь распределяется по трубке с ге-
лем на весьма узкие зоны по значениям рI. Ширина зон при ИЭФ существенно
меньше, чем при обычном электрофорезе.
По сути говоря изоэлектрофокусировка есть скорее самостоятельный метод
исследования, чем разновидность электрофореза. Электрофореза, в чистом
виде при ИЭФ нет. Остановимся очень кратко на сути электрофокусировки.
Рассмотрим поведение белка с ИЭТ рН=6 в трубке со стабилизированной
средой в градиенте рН от 3 до 10 при прохождении через нее постоянного
тока (см. рис. 4.8).
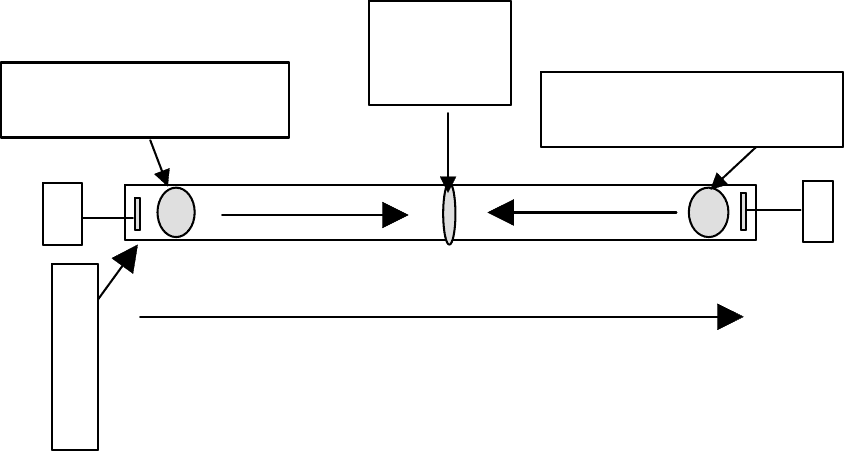
pH=3 ph=6=pI pH=10
Градиент рН
+
-
+ -
-
Молекула белка
заряжена положительно
Молекула белка
заряжена отрицательно
Суммарный
заряд
равен "0"
Колонка с гелем
+
Рис. 4.8
Принципиальная схема изоэлектрофокусировки белка
Молекулы белка в области рН > pI будут нести на себе положительный
заряд и двигаться в электрическом поле по направлению к катоду. Молекулы
этого же белка в области рН < pI имеют отрицательный заряд и будут двигаться
в противоположном направлении, т.е. в сторону анода. В точке рН = рІ молеку-
лы белка электронейтральны и электрическое поле на них не действует. В этой
240
точке поле пытается как бы спрессовать молекулы белка с двух сторон, т.е.
сфокусировать их в очень узкую полоску.
Таким образом, основное различие между изоэлектрической фокусировкой и
электрофорезом состоит в том, что при ЭФ молекулы белка просто переме-
щаются в одном направлении вдоль колонки под действием электрического
поля со скоростями пропорциональными их электрофоретической подвиж-
ности. При этом, движение заряженной молекулы через колонку будет про-
должаться до тех пор, пока она не достигнет соответствующего электрода.
При ИЭФ картина иная. Заряженная молекула белка движется в направлении
своей ИЭТ и постоянно уменьшает свой суммарный заряд. ИЭТ есть, таким
образом, предельная точка движения молекулы вдоль колонки. Достигнув
этой точки молекула останавливается и не может сместится даже под дейст-
вием сил диффузии ни в одну ни в другую сторону от ИЭТ. Это ясно из при-
веденного рисунка. По этой собственно причине электрическое поле как бы
«разносит» белковую смесь по соответствующим ИЭТ, т.е. фокусирует бел-
ки в этих точках, сжимая их в очень узкие зоны.
Схема миграции белков в процессе ИЭФ и устройства для проведения ИЭФ
приедены на рис. 4.9; 4.10 соответственно.
Рис. 4.9
Схема процесса миграции белков с различными величинами рІ в электрическом поле
241
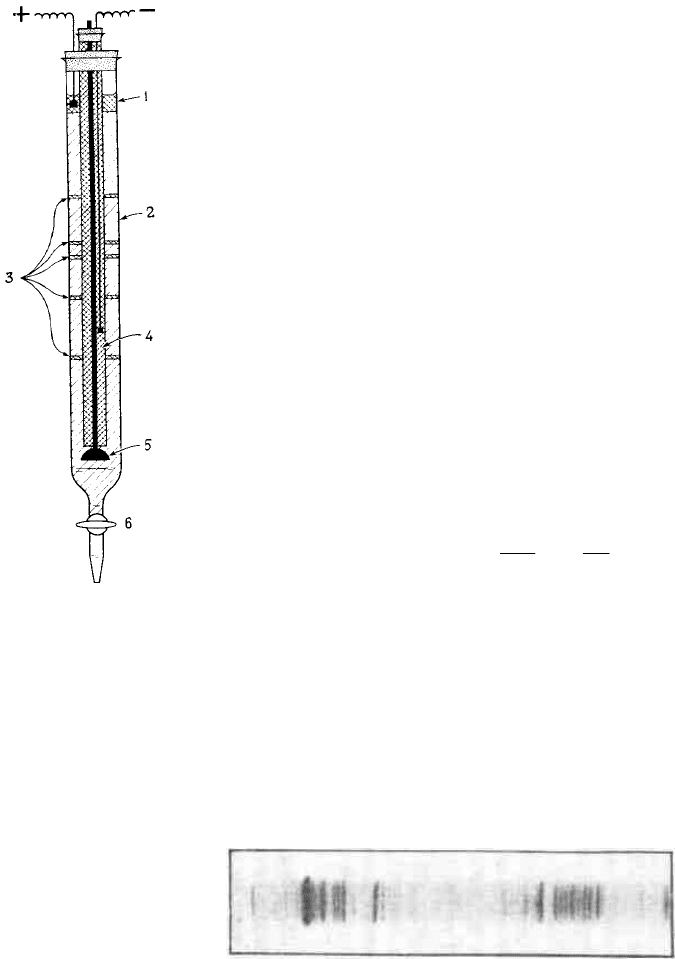
Рис. 4.10
Схема установки для проведения изоэлектрофокусировки белков
1. фосфорная кислота;
2. амфолит + сахароза, создающие градиент рН и плотности среды
3. зоны расположения белков с различными величинами рІ после завер-
шения процесса ИЭФ
4. заполненная триэтаноламином катодная трубка
5. запорный клапан
6. сливной кран
Основные закономерности процесса ИЭФ описываются урав-
нением Свенссона:
ci
qk
D
dc
dx
µ
=
где с- концентрация; µ- подвижность; i- сила тока; k- проводимость; q-
поперечное сечение колонки; D- коэффициент диффузии; x- координата вдоль
оси колонки в направлении от анода к катоду.
Ниже, на рисунке, в качестве примера приведена фотография результата
анализа методом ИЭФ сложной белковой смеси после окрашивания геля.
4.5.3.8 Двухмерный электрофорез
Так же как для бумажной и тонкослойной хроматографий, для электро-
фореза в ПААГ применим подход двухмерного разделения смесей. Проводят
эксперимент обычно так. Вначале проводят разделение смеси методом ИЭФ.
Затем в перпендикулярном направлении проводят ДСН-электрофорез. Разре-
шающая способность этого комбинированного метода чрезвычайно высока.
Удается разделять смеси, содержащие 1000 и более белков. О’Фаррелл, автор
этого метода, считает, что таким образом можно разделить смесь, включающую
